Особенности строения сольвата трис(2-метокси-5-хлорфенил)висмута с бензолом
Автор: Шарутин В.В., Шарутина О.К.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 4 т.16, 2024 года.
Бесплатный доступ
По данным рентгеноструктурного анализа, атомы висмута в двух молекулах трифенилвисмута (1) [C36H30Bi2, M 880,56; сингония триклинная, группа симметрии P1 ; параметры ячейки: a = 5,787(3), b = 14,203(7), c = 19,667(14) Å; a = 72,61(3), β = 81,68(4), g = 78,34(2) град.; V = 1504,5(16) Å3; размер кристалла 0,46×0,16×0,15 мм; интервалы индексов отражений -7 ≤ h ≤ 7, -18 ≤ k ≤ 18, -25 ≤ l ≤ 25; всего отражений 32105; независимых отражений 6933; Rint 0,0437; GOOF 1,093; R1 = 0,0290, wR2 = 0,0609; остаточная электронная плотность 0,48/-1,87 e/Å3] имеют искаженную тригональную координацию с неподеленной электронной парой на атоме металла. Длины связей Bi-C изменяются в интервале 2,246(5)-2,260(5) Å, углы CBiC 92,56(16)-95,24(15)°. В сольвате трис(2-метокси-5-хлорфенил)висмута с бензолом (2) [C24H21O3Cl3Bi, M 672,74; сингония моноклинная, группа симметрии P21/n; параметры ячейки: a = 8,920(5), b = 21,362(7), c = 13,649(5) Å; a = 90,00, β = 107,33(2), g = 90,00 град.; V = 2482,8(17) Å3; размер кристалла 0,5 × 0,11 × 0,09 мм; интервалы индексов отражений -11 ≤ h ≤ 11, -28 ≤ k ≤ 28, -17 ≤ l ≤ 17; всего отражений 40401; независимых отражений 5924; Rint 0,0334; GOOF 1,150; R1 = 0,0269, wR2 = 0,0623; остаточная электронная плотность 0,48/-2,02 e/Å3] атом висмута имеет аналогичную координацию. Длины связей Bi-C (2,253(3)-2,267(3) Å) длиннее связей в 1 из-за присутствия внутримолекулярных контактов Bi∙∙∙O (3,09, 3,08, 3,05 Å). Несмотря на увеличение объема 2-метокси-5-хлорфенильных лигандов, значения углов CBiC (90,26(12)-92,96(12)°) заметно меньше. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2333440 (1), 2044008 (2); deposit@ccdc.cam.ac.uk; https://www.ccdc.cam.ac.uk).
Сольват, трис(2-метокси-5-хлорфенил)висмут, бензол, строение, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147246064
IDR: 147246064 | УДК: 546.865+547.47+548.312.5 | DOI: 10.14529/chem240403
Текст научной статьи Особенности строения сольвата трис(2-метокси-5-хлорфенил)висмута с бензолом
Аннотация. По данным рентгеноструктурного анализа, атомы висмута в двух молекулах трифенилвисмута (1) [C36H30Bi2, M 880,56; сингония триклинная, группа симметрии P1; параметры ячейки: a = 5,787(3), b = 14,203(7), c = 19,667(14) A; a = 72,61(3), в = 81,68(4), Y = 78,34(2) град.; V = 1504,5(16) Å3; размер кристалла 0,46×0,16×0,15 мм; интервалы индексов отражений –7 ≤ h ≤ 7, –18 ≤ k ≤ 18, –25 ≤ l ≤ 25; всего отражений 32105; независимых отражений 6933; Rint 0,0437; GOOF 1,093; R1 = 0,0290, wR2 = 0,0609; остаточная электронная плотность 0,48/–1,87 e/Å3] имеют искаженную тригональную координацию с неподеленной электронной парой на атоме металла. Длины связей Bi-C изменяются в интервале 2,246(5)-2,260(5) A, углы CBiC 92,56(16)-95,24(15)°. В сольвате трис(2-метокси-5-хлорфенил)висмута с бензолом (2) [C24H21O3Cl3Bi, M 672,74; сингония моноклинная, группа симметрии P21/n; параметры ячейки: a = 8,920(5), b = 21,362(7), c = 13,649(5) Å; a = 90,00, в = 107,33(2), Y = 90,00 град.; V = 2482,8(17) A3; размер кристалла 0,5 х 0,11 х 0,09 мм; интервалы индексов отражений –11 ≤ h ≤ 11, –28 ≤ k ≤ 28, –17 ≤ l ≤ 17; всего отражений 40401; независимых отражений 5924; Rint 0,0334; GOOF 1,150; R1 = 0,0269, wR2 = 0,0623; остаточная электронная плотность 0,48/-2,02 e/A3] атом висмута имеет аналогичную координацию. Длины связей Bi-C (2,253(3)–2,267(3) Å) длиннее связей в 1 из-за присутствия внутримолекулярных контактов Bi∙∙∙O (3,09, 3,08, 3,05 Å). Несмотря на увеличение объема 2-метокси-5-хлорфенильных лигандов, значения углов CBiC (90,26(12)-92,96(12)°) заметно меньше. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2333440 (1), 2044008 (2); ; .
Наиболее изученными арильными производными трехвалентного висмута являются соединения с фенильными и, в меньшей степени, толильными лигандами. Наличие вакантных d -орбиталей у атомов висмута позволяет образовывать дополнительные координационные связи металла с лигандами, содержащими потенциальные координирующие центры, что приводит к увеличению координационного числа атома Bi. Сравнение структуры трифенилвисмута ( 1 ) с арильными соединениями висмута, содержащих потенциальные координирующие центры в арильных лигандах, может позволить выявить влияние природы заместителей при атоме висмута на геометрические параметры указанных молекул. С целью дальнейшего исследования арильных соединений висмута(III) [1, 2] были получены трис (5-бром-2-метоксифенил)висмут [3], трис (5-хлор-2-метоксифенил)висмут [4] и его сольват с бензолом ( 2 ), строение которого изучено в настоящей работе.
Экспериментальная часть
Синтез 1 и 2 осуществляли по методикам, приведенным в монографии [5] и работе [4] соответственно. Кристаллы 2 выделяли при перекристаллизации целевого продукта из смеси бензол-октан.
Рентгеноструктурный анализ (РСА) кристаллов соединения 1 и 2 проводили на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo K„-излучение, 1 = 0,71073 Å, графитовый монохроматор) при 293 К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus [6]. Все расчеты по определению и уточнению структур выполнены с помощью программ SHELXL/PC [7] и OLEX2 [8]. Структура определена прямым методом и уточнена методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника. Кристаллографические данные и результаты уточнения структуры приведены в табл. 1, геометрические характеристики координационного полиэдра атома висмута – в табл. 2. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2333440 (1), 2044008 (2); или .
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структур 1 и 2
|
Параметр |
1 |
2 |
|
Формула |
C 36 H 30 Bi 2 |
C 24 H 21 O 3 Cl 3 Bi |
|
М |
880,56 |
672,74 |
|
Сингония |
триклинная |
моноклинная |
|
Пр. группа |
P 1 |
P 2 1 / n |
Окончание табл. 1
|
Параметр |
1 |
2 |
|
a , Å |
5,787(3) |
8,920(5) |
|
b, Å |
14,203(7) |
21,362(7) |
|
c, Å |
19,667(14) |
13,649(5) |
|
а , град. |
72,61(3) |
90,00 |
|
β, град. |
81,68(4) |
107,33(2) |
|
Y , град. |
78,34(2) |
90,00 |
|
V , Å3 |
1504,5(16) |
2482,8(17) |
|
Z |
2 |
4 |
|
р (выч.), г/см 3 |
1,944 |
1,800 |
|
ц , мм-1 |
11,703 |
7,446 |
|
F (000) |
824,0 |
1292,0 |
|
Размер кристалла, мм |
0,46 × 0,16 × 0,15 |
0,5 × 0,11 × 0,09 |
|
Область сбора данных по 2 0 , град |
5,88–55,16 |
6,12–55,82 |
|
Интервалы индексов отражений |
–7 ≤ h ≤ 7, –18 ≤ k ≤ 18, –25 ≤ l ≤ 25 |
–11 ≤ h ≤ 11, –28 ≤ k ≤ 28, –17 ≤ l ≤ 17 |
|
Измерено отражений |
32105 |
40401 |
|
Независимых отражений |
6933 |
5924 |
|
R int |
0,0437 |
0,0334 |
|
Переменных уточнения |
343 |
283 |
|
GOOF |
1,093 |
1,150 |
|
R -факторы по F2 > 2 c (F2) |
R 1 = 0,0290, wR 2 = 0,0609 |
R 1 = 0,0269, wR 2 = 0,0623 |
|
R-факторы по всем отражениям |
R 1 = 0,0455, wR 2 = 0,0654 |
R 1 = 0,0330, wR 2 = 0,0654 |
|
Остаточная электронная плотность (max/min), e/A3 |
0,48/–1,87 |
0,48/–2,02 |
Таблица 2
|
Связь |
d , Å |
Угол |
го , град. |
|
1 |
|||
|
Bi(1)–С(1) |
2,246(5) |
С(1)Bi(1)С(11) |
92,67(16) |
|
Bi(1)–С(11) |
2,253(5) |
C(1)Bi(1)С(21) |
94,80(16) |
|
Bi(1)–C(21) |
2,254(4) |
C(11)Bi(1)С(21) |
95,03(15) |
|
Bi(2)–С(31) |
2,250(5) |
C(31)Bi(2)C(41) |
92,56(16) |
|
Bi(2)–С(41) |
2,260(5) |
C(51)Bi(2)C(31) |
94,68(16) |
|
Bi(2)–C(51) |
2,249(4) |
C(51)Bi(2)C(41) |
95,24(15) |
|
2 |
|||
|
Bi(1)–С(1) |
2,267(3) |
C(11)Bi(1)C(1) |
92,96(12) |
|
Bi(1)–С(11) |
2,261(3) |
C(21)Bi(1)C(1) |
90,26(12) |
|
Bi(1)–C(21) |
2,253(3) |
C(21)Bi(1)C(11) |
92,96(12) |
|
O(3)∙∙∙Bi(1) |
3,049(7) |
O(3)Bi(1)C(11) |
141,82(13) |
|
O(2)∙∙∙Bi(1) |
3,079(8) |
O(2)Bi(1)C(1) |
141,47(12) |
|
O(1)∙∙∙Bi(1) |
3,090(7) |
O(1)Bi(1)C(21) |
139,08(12) |
|
Преобразования симметрии: 1–x, –y, 1–z |
|||
Длины связей и валентные углы в молекулах соединений 1 и 2
Обсуждение результатов
Согласно теории отталкивания электронных пар валентных орбиталей (ОЭПВО) и правилам, разработанным Гиллеспи [9], четыре электронные пары, расположенные на валентных орбиталях центрального атома, должны располагаться в вершинах правильного тетраэдра. Искажение тетраэдрической конфигурации обусловлено наличием неподеленных электронных пар, которые занимают бóльший объем, чем связывающие электронные пары, что приводит к уменьшению углов между связями по сравнению с теоретическим значением 109 ° 28 ' . Другой причиной отклонения углов от этого значения является наличие внутримолекулярных невалентных взаимодействий центрального атома с лигандами.
Строение арильных соединений висмута общей формулы Ar 3 Bi, содержащих потенциальные координирующие центры в арильных лигандах, описано в работах [1 - 4, 10 - 16]. Сравнение геометрических характеристик указанных соединений с геометрическими параметрами простейших триарильных производных висмута [17 - 20] помогает выявить общие закономерности в строении триарильных соединений висмута. С этой целью в настоящей работе определено строение трифенилвисмута ( 1 ) и сольвата трис (2-метокси-5-хлорфенил)висмута с бензолом ( 2 ), полученного при перекристаллизации продукта из смеси бензол-октан. Отметим, что соединение 2 изоструктурно аналогичному соединению сурьмы [21, 22]. Строение координационного узла атома металла схоже с ранее описанными структурами триарилвисмута.
Молекулы 1 , 2 имеют конфигурацию искаженного тетраэдра с тремя атомами углерода трех арильных лигандов и неподеленной электронной парой в его вершинах (рис. 1, 2). Среднее значение длины связи Bi - C в 2 (2,260(3) Å, интервал 2,253(3) - 2,267(3) Å) несколько превышает таковое в 1 (2,252 Å, интервалы 2,246(5)–2,254(4) Å и 2,249(4) - 2,260(5) Å в двух кристаллографически независимых типах молекул), при этом сумма ковалентных радиусов атомов-партнеров связи равна 2,31 Å [23]. Удлинение связей в 2 объясняется, вероятно, присутствием внутримолекулярных контактов Bi∙∙∙O - СН 3 (3,09, 3,08, 3,05 Å). Отметим, что наблюдаемое расстояние значительно меньше суммы ван-дер-ваальсовых радиусов атомов висмута и кислорода, которая равна 3,9 Å [24]. Более заметное увеличение расстояний Bi - C имеет место в молекуле тримезитилвисмута (2,291 Å [20]), что обусловлено большим объемом лигандов.
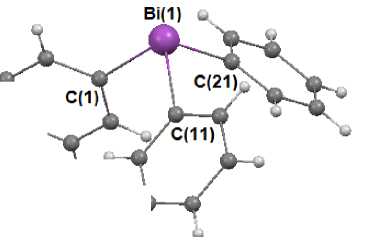
Рис. 1. Строение трифенилвисмута (1) (приведена молекула одного из двух кристаллографически независимых типов)
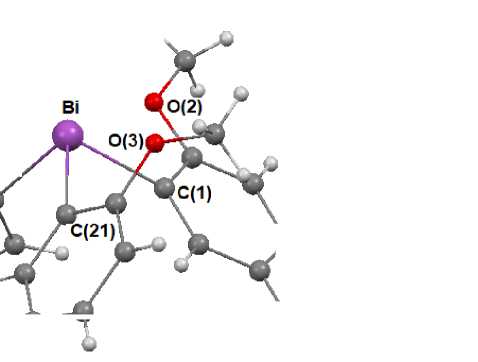
Рис. 2. Строение сольвата трис (2-метокси-5хлорфенил)висмута с бензолом (2) (сольватная молекула бензола не показана)
Несмотря на увеличение объема 2-метокси-5-хлорфенильных лигандов по сравнению с фенильными, значения углов CBiC (90,26(12)-92,96(12) ° ) в 2 несколько меньше, чем в 1 (92,67(16) - 95,03(15) и 92,56(16)-95,24(15) ° ), что может быть обусловлено направлением дополнительных взаимодействий Bi-"O - CH3 (рис. 3).
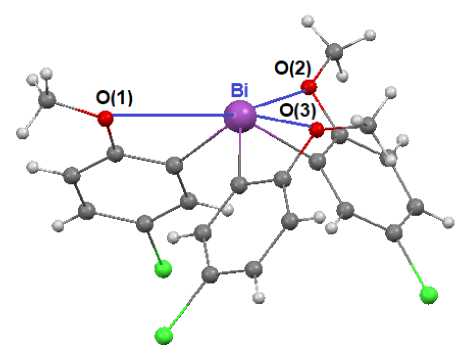
Рис. 3. Направление контактов Bi—O-CH3 в молекуле трис (2-метокси-5хлорфенил)висмута
Максимальное значение валентных углов (среднее 102,71 ° ) имеет место в молекуле тримезитилвисмута с большим объемом радикалов [20] и молекуле трис(2,6-диметоксифенил)висмута (среднее 99,41 ° ), имеющей метоксигруппы в орто- положениях [15]. Отметим, что в молекуле трис (5-бром-2-метоксифенил)висмута среднее значение валентных углов (92,05 ° [25]) совпадает с найденным в 2 .
В молекуле 2 двугранные углы между плоскостями арильных колец [C(1) - C(6)] - [C(11) - C(16)], [C(1) - C(6)] - [C(21) - C(26)], [C(11) - C(16)] - [C(21) - C(26)] составляют 79,63 ° , 75,80 ° , 89,21 ° , в молекуле 1 подобные углы принимают значения 65,95 ° , 69,53 ° , 72,48 ° .
В кристалле 2 молекулы трис (5-хлор-2-метоксифенил)висмута образуют цепи (короткие контакты Cl(1) --- C(11) 3,401 А и Cl(1) --- C(12) 3,371 А, расположенные вдоль кристаллографической оси b . В пространстве между цепями находятся молекулы сольватного бензола, кратчайшее расстояние Н(3) --- С(9) составляет 2,90 А (рис. 4).
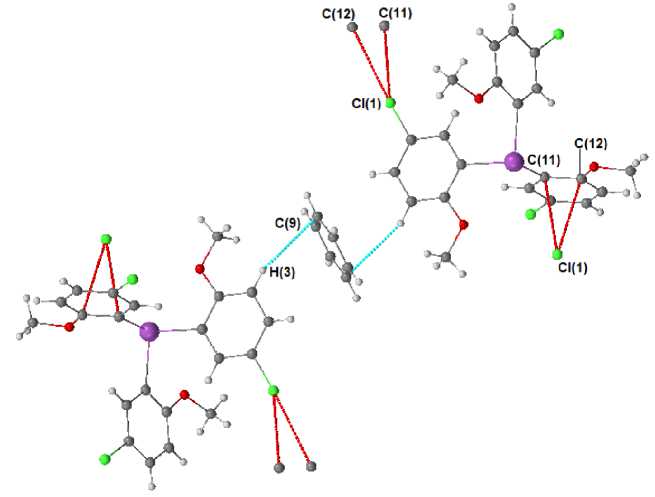
Рис. 4. Межмолекулярные контакты в кристалле 2
Молекулы сольватного бензола располагаются на середине четырех ребер и в центрах двух граней элементарной кристаллической ячейки (рис. 5).
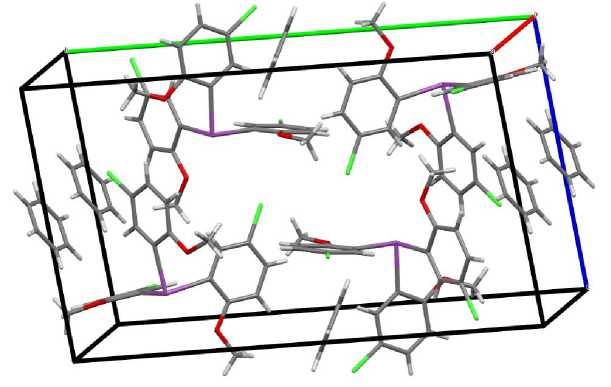
Рис. 5. Упаковка молекул 2 в элементарной кристаллической ячейке (проекция вдоль кристаллографической оси а )
Выводы
Таким образом, удлинение связей Bi - C в производных Ar3Bi по сравнению с Ph3Bi обусловлено, в первую очередь, увеличением объема арильного лиганда, а также наличием в лигандах групп, способных к формированию дополнительных взаимодействий с центральным атомом. Присутствие потенциальных координирующих центров в арильных лигандах, как правило, приводит к уменьшению валентных углов CBiC, в то время как большой объем арильного заместителя способствует увеличению углов.
Список литературы Особенности строения сольвата трис(2-метокси-5-хлорфенил)висмута с бензолом
- Kamepalli S., Carmalt C.J., Culp R.D. et al. // Inorg. Chem. 1996. V. 35, No. 21. P. 6179. DOI: 10.1021/ic960516c
- Шарутин В.В., Поддельский А.И., Шарутина О.К. // Коорд. химия. 2021. Т. 47, № 12. С. 719. DOI: 10.31857/S0132344X21120021
- Шарутин В.В., Сенчурин В.С., Шарутина О.К., Казаков М.В. // Бутлеровские сообщения. 2011. Т. 27, № 14. С. 43. EDN: NJRIHT
- Шарутин В.В., Шарутина О.К., Ефремов А.Н. // Коорд. химия. 2021. Т. 47, № 9. С. 568. EDN: RURAHX
- Кочешков К.А., Сколдинов А.П., Землянский Н.Н. Методы элементоорганической химии. Сурьма, висмут. М.: Наука, 1976. 483 с.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339. DOI: 10.1107/S0021889808042726
- Гиллеспи Р., Харгиттаи И. Модель отталкивания электронных пар валентной оболочки и строение молекул. М.: Мир, 1992. 296 с.
- Шарутин В.В., Сенчурин В.С., Шарутина О.К., Чагарова О.В. // Журн. неорган. химии. 2012. Т. 57, № 8. С. 1149. EDN: OZLDRJ
- Plajer A.J., Colebatch A.L., Rizzuto F.J. et al. // Angew. Chem., Int. Ed. 2018. V. 57. P. 6648. DOI: 10.1002/anie.201802350
- Vranova I., Jambor R., Ruzicka A. et al. // Organometallics. 2015. V. 34. P. 534. DOI: 10.1021/om5011879
- Hebert M., Petiot P., Benoit E. et al. // J. Org. Chem. 2016. V. 81. P. 5401. DOI: 10.1021/acs.joc.6b00767
- Ohshita J., Yamaji K., Ooyama Y. et al. // Organometallics. 2019. V. 38. P. 1516. DOI: 10.1021/acs.organomet.8b00945
- Ogawa T., Ikegami T., Hikasa T. et al. // J. Chem. Soc., Perkin Trans.1. 1994. P.3479. DOI: 10.1039/P19940003479
- Шарутин В.В., Шарутина О.К., Сенчурин В.С. // Бутлеровские сообщения. 2013. Т. 34, № 4. С. 55. EDN: RAVMKT
- Jones P.G., Blaschette A., Henschel D., Henschel A. // Z. Kristallogr. Crystalline Materials. 1995. V. 210, No. 5. P. 377. DOI: 10.1524/zkri.1995.210.5.377
- Stavila V., Thurston J.H., Prieto-Centurión D., Whitmire K.H. // Organometallics. 2007. V. 26, No. 27. P. 6864. DOI: 10.1021/om7009667
- Шарутин В.В., Шарутина О.К. // Бутлеровские сообщения. 2013. Т. 36, № 10. С. 111. EDN: RURAHX
- Соболев A.H., Ромм И.П., Бельский В.К., Гурьянова E.H. // Kooрд. химия. 1980. Т. 6, № 6. С. 945.
- Шарутин В.В., Шарутина О.К. II Журн. общ. химии. 2020. Т. 90, № 10. С. 1577. DOI: 10.31857/S0044460X20100133
- Шарутин В.В., Шарутина О.К. II Журн. неорган. химии. 2021. Т. 66, № 3. С. 358. DOI: 10.31857/S0044457X21030156
- Cordero B., Gómez V., Platero-Prats A.E. et al. // Dalton Trans. 2008. V. 21. P. 2832. DOI: 10.1039/B801115J
- Mantina M., Chamberlin A.C., Valero R. et al. // J. Phys. Chem. A. 2009. V. 113, No. 19. P. 5806. DOI: 10.1021/jp8111556
- Sharutin V.V., Sharutina O.K., Ermakova V.A. et al. // Russ. J. Inorg. Chem. 2017. V. 62, No. 8. P. 1043. DOI: 10.1134/S0036023617080174


