Особенности структурно-геометрической перестройки левого желудочка у больных с метаболическим синдромом и артериальной гипертензией
Автор: Полозова Э.И., Мамкина Н.Н.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 4, 2017 года.
Бесплатный доступ
Цель работы - изучение особенностей ремоделирования сердца у больных метаболическим синдромом и артериальной гипертензией без метаболических нарушений. Материалы и методы. Обследовано 60 больных артериальной гипертензией без метаболических нарушений (группа сравнения) и 60 пациентов с метаболическим синдромом (основная группа). Пациентам анализируемых групп проведена оценка данных эхокардиографического исследования, на основании которых выделены типы ремоделирования левого желудочка. Результаты. В работе показано, что для пациентов с метаболическим синдромом характерна большая частота развития гипертрофии левого желудочка по сравнению с больными артериальной гипертонией без метаболических нарушений. В структуре геометрических типов левого желудочка у больных с метаболическим синдромом преобладает концентрическая гипертрофия левого желудочка; у больных артериальной гипертензией без метаболических нарушений эксцентрическая гипертрофия левого желудочка является наиболее распространенным вариантом ремоделирования сердца. Диастолическая дисфункция левого желудочка наблюдается при всех изученных типах ремоделирования сердца среди пациентов с артериальной гипертензией и метаболическим синдромом, наиболее часто - при эксцентрической и концентрической гипертрофии левого желудочка. Эксцентрический тип гипертрофии левого желудочка характеризуется большей частотой формирования диастолической дисфункции левого желудочка II типа. Выводы. Пациенты с метаболическим синдромом характеризуются более значимыми и частыми нарушениями диастолической функции левого желудочка и более высокой частотой формирования прогностически неблагоприятных вариантов ремоделирования сердца, чем больные артериальной гипертензией без метаболических нарушений.
Метаболический синдром, артериальная гипертензия, ремоделирование сердца, левый желудочек, гипертрофия, диастолическая дисфункция
Короткий адрес: https://sciup.org/14113316
IDR: 14113316 | УДК: 616.12-008.331 | DOI: 0.23648/UMBJ.2017.28.8737
Текст научной статьи Особенности структурно-геометрической перестройки левого желудочка у больных с метаболическим синдромом и артериальной гипертензией
Введение. В настоящее время несомненна высокая актуальность проблемы метаболического синдрома (МС), что обусловлено его большой распространенностью, многообразием клинических проявлений, негативным влиянием на сердечно-сосудистый риск, а также прогрессивными темпами роста заболевания во всем мире [1]. По данным Kuopio Ischaemic Heart Disease Risk Factors Study, среди больных с МС риск развития ишемической болезни сердца (ИБС) в 2,9–4,2 раза выше, смертность от ИБС – в 2,6–3,0 раза и от всех причин – в 1,9–2,1 раза больше по сравнению с пациентами без МС [2].
МС является приоритетной социально значимой проблемой медицины. На сего- дняшний день клиницисты рассматривают метаболический синдром как поликомпо-нентную патологию. Интерес к проблеме МС и значительно возросшее в последнее время количество публикаций о нем можно объяснить накоплением новых сведений о закономерностях его развития и ростом внимания практикующих врачей различных специальностей к данной патологии. Эксперты ВОЗ охарактеризовали МС как «пандемию XXI века» [3].
МС характеризуется увеличением массы висцерального жира, снижением чувствительности периферических тканей к инсулину и гиперинсулинемией, которые вызывают развитие нарушений углеводного, липидного, пуринового обмена и артериальной гипертензии (АГ). При изучении проблемы МС большое значение придается рассмотрению вопросов, касающихся ремоделирования сердца, под которым понимают процесс комплексного нарушения структуры и функции сердца в ответ на повреждающую перегрузку или утрату части жизнеспособного миокарда и который включает в себя прогрессирующее увеличение массы миокарда, дилатацию полостей, а также изменение геометрических характеристик желудочков [4–8].
Цель исследования. Изучить особенности ремоделирования сердца у больных метаболическим синдромом и артериальной гипертензией без метаболических нарушений, находившихся на стационарном лечении в терапевтическом отделении ГБУЗ РМ «Республиканская клиническая больница № 5» г. Саранска в период 2013–2016 гг.
Материалы и методы. Обследовано 120 пациентов, которые были разделены на две группы: основную группу составили 60 больных с МС, группу сравнения – 60 пациентов с АГ без метаболических нарушений. Среди пациентов основной группы женщин было 44 чел. (73 %), мужчин – 16 чел. (27 %); в группе сравнения – 32 (53 %) и 28 чел. (47 %) соответственно. Возраст пациентов основной группы варьировал от 40 до 70 лет (средний – 60,83±2,15 года), группы сравнения – от 40 до 68 лет (средний возраст – 54,60±4,53 года). Показатели артериального давления пациентов соответствовали 2 и 3 степеням АГ (в основной группе – 7 и 93 %; в группе сравнения – 15 и 85 % соответственно). Длительность АГ в исследуемых группах составляла от 12 до 37 лет. Критерием включения было наличие АГ у пациентов, у которых ИБС в варианте стенокардии напряжения явилась следствием длительного течения АГ, а не предшествовала или развивалась параллельно АГ. Из исследования исключались пациенты, имевшие в анамнезе инфаркт миокарда и хроническую сердечную недостаточность III–IV функциональных классов. На момент проведения исследования все пациенты продолжали принимать гипотензивные препараты: в основной группе – 90 % пациентов; в группе сравнения – 75 % больных.
Сахарный диабет (СД) 2 типа имели 77 % пациентов основной группы. Течение СД 2 типа оценивалось как средней степени тяжести у 73 %, легкое – у 27 % пациентов данной группы.
Пациенты основной группы в 87 % случаев (52 чел.) имели трехкомпонентный МС, в 13 % (8 чел.) – четырехкомпонентный. При структурном анализе было установлено, что из всех вариантов МС наиболее часто встречалось сочетание абдоминального ожирения, АГ и клинически манифестированного нарушения углеводного обмена (СД 2 типа) – в 67 % случаев (40 чел.).
В ходе исследования проводилось измерение физических параметров, таких как рост и вес, используемых для вычисления индекса массы тела (ИМТ) – показателя, позволяющего оценить степень ожирения и риска сердечно-сосудистых заболеваний [9]:
ИМТ = масса тела/рост2 (кг/м2).
Инструментальное обследование включало регистрацию электрокардиограммы в 12 общепринятых отведениях на аппарате FUKUDA DENSHI CARDIMAX FX-326U (Япония). Каждому больному проводилось эхокардиографическое исследование (ЭХОКГ) на аппарате AU 4 Idea фирмы ESAOTE BIO-MEDICA (Италия).
Оценивались следующие эхокардиографические показатели: толщина задней стенки левого желудочка (ТЗС ЛЖ), толщина межжелудочковой перегородки (ТМЖП), конечный диастолический размер ЛЖ (КДР ЛЖ), конечный систолический размер ЛЖ, размер левого предсердия, фракция выброса.
По результатам измерений рассчитывались показатели, необходимые для выделения типов ремоделирования ЛЖ.
Индекс относительной толщины стенок ЛЖ (ИОТС) вычислялся по формуле
ИОТС=(ТМЖП+ТЗСЛЖ)/КДР ЛЖ.
Значения ИОТС в норме не должны были превышать 0,42.
Масса миокарда ЛЖ (ММЛЖ) рассчитывалась по формуле R.B. Devereux [10]
ММЛЖ=1,04X((ТМЖП+КДР ЛЖ+ТЗС ЛЖ)3-
-КДР ЛЖ3)-13,6.
Индекс ММЛЖ определялся как отношение ММЛЖ к площади поверхности тела (ППТ):
ИММЛЖ=ММЛЖ/ППТ.
За верхнюю границу нормы ИММЛЖ принимались такие его значения, как 95 г/м2 для женщин и 115 г/м2 для мужчин [11].
Для расчета ППТ использовалась формула ППТ=0,007184X р0,725+m0,425, где р – рост (м), m – масса тела (кг).
На основании значений ИММЛЖ и ИОТС выделялись следующие типы ремоделирования ЛЖ: нормальная геометрия (НГ) (ИММЛЖ в пределах нормы, ИОТС<0,42), концентрическое ремоделирование (ИММЛЖ в пределах нормы, ИОТС>0,42), концентрическая гипертрофия (КГ) ЛЖ (ГЛЖ) (ИММЛЖ больше нормальных значений, ИОТС>0,42) и эксцентрическая ГЛЖ (ЭГ) (ИММЛЖ больше нормальных значений, ИОТС<0,42) [11, 12].
Для оценки диастолической функции ЛЖ (ДФЛЖ) проводилось исследование трансмитрального кровотока и движения фиброзного кольца митрального клапана в режиме импульсно-волнового доплера из верхушечной четырехкамерной позиции. Определялись максимальная скорость потока в фазу раннего наполнения (пик Е), максимальная скорость потока в фазу предсердной систолы (пик А), их соотношение (Е/А) и время изоволюмомет-рического расслабления ЛЖ (IVRT).
По результатам исследования трансмитрального кровотока выделялись три типа нарушений ДФЛЖ: I тип диастолической дис- функции ЛЖ (ДДЛЖ) (гипертрофический); II тип ДДЛЖ (псевдонормальный); III тип ДДЛЖ (рестриктивный) [13].
Полученные результаты обрабатывались методом вариационной статистики на персональном компьютере с использованием программы Excel путем расчета средних арифметических величин (M) и ошибок средних (m). Для оценки достоверности различий двух величин использовался параметрический критерий Стьюдента (t), различия считали достоверными при вероятности ошибки менее 5 % (p<0,05). Вычисления производились на CPU 1600 MHz Intel Pentium-IV.
Результаты и обсуждение. При изучении особенностей структурно-геометрической перестройки миокарда ЛЖ в группах больных с МС и АГ без метаболических нарушений по данным электрокардиографии было установлено, что ГЛЖ имела место у 50 % больных АГ и 70 % пациентов с МС. При оценке данных ЭХО-КС было выявлено, что гипертрофия миокарда ЛЖ имела место в 100 % случаев в основной группе и в 70 % случаев в группе сравнения.
Нарушения ДФЛЖ были обнаружены у 50 больных группы сравнения (83 %) и 60 больных основной группы (100 %). Структура нарушений ДФЛЖ была следующей: в группе сравнения 10 чел. (16,7 %) имели II тип диастолической дисфункции, 40 чел. (66,7 %) – I тип диастолической дисфункции; в основной группе 46 чел. (76,7 %) – I тип диастолической дисфункции, 14 чел. (23,3 %) – II тип ДДЛЖ. Рестриктивный тип диастоли-сфункции в обследованных группах не встречался (рис. 1).
Основная группа
Группа сравнения
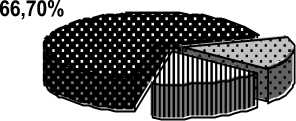
16,70
16,70%
76,70%
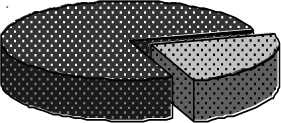
23,30%
И I тип ДДЛЖ □ II тип ДДЛЖш Пациенты без ДДЛЖ
В I тип ДДЛЖ □ II тип ДДЛЖ
Рис. 1. Структура нарушений диастолической функции левого желудочка в исследуемых группах, в % от общего числа обследованных больных
Таким образом, ДДЛЖ наблюдалась у всех пациентов с наличием ГЛЖ как в основной группе, так и в группе сравнения. Для пациентов основной группы характерен больший процент развития II типа ДДЛЖ.
Пациенты основной группы имели достоверно большие показатели ТЗС ЛЖ и ТМЖП, превышавшие на 8,4 и 25,7 % данные группы сравнения соответственно. Относительная толщина стенок ЛЖ в основной группе была на 5,9 % больше, чем в группе сравнения (р<0,05). ММЛЖ в группе пациентов с АГ без метаболических нарушений составляла 223,990±2,530 г, что достоверно ниже показателя основной группы - 333,940± ±15,940 г (р<0,001). ИММЛЖ в основной группе пациентов на 32,6 % превышал показатель группы сравнения (р<0,001) (табл. 1).
Анализируемые группы достоверно различались также по показателям КДР ЛЖ, размера левого предсердия (РЛП), которые на
11 % (р<0,001) и 14,7 % (р<0,001) соответственно были выше в основной группе больных. В обеих исследуемых группах пациенты имели нормальные значения фракции выброса (ФВ), при этом в группе больных с артериальной гипертонией ФВ на 8,1 % была больше, чем в группе больных МС.
Обнаружены существенные расхождения в характере ремоделирования ЛЖ. У больных АГ без метаболических нарушений концентрическая ГЛЖ имела место в 20 % случаев, эксцентрическая ГЛЖ - в 46,7 %, концентрическое ремоделирование - в 6,7 %, нормальная геометрия ЛЖ - в 26,6 %. В основной группе наиболее часто выявлялась концентрическая ГЛЖ - в 56,7 % случаев, эксцентрическая ГЛЖ была обнаружена у 33,3 % больных, концентрическое ремоделирование ЛЖ - у 10 % пациентов, больных с нормальным типом геометрии ЛЖ в данной группе выявлено не было (рис. 2).
Таблица 1
|
Показатель |
АГ, n=60 |
МС, n=60 |
|
ТЗС ЛЖ, см |
1,070±0,001 |
1,160±0,020 (р<0,005) |
|
ТМЖП, см |
1,058±0,003 |
1,330±0,030 (р<0,001) |
|
КДР ЛЖ, см |
4,800±0,023 |
5,330±0,100 (р<0,001) |
|
КСР, см |
3,150±0,008 |
3,470±0,130 (р>0,05) |
|
ИОТС |
0,444±0,002 |
0,470±0,010 (р<0,05) |
|
ММЛЖ, г |
223,990±2,532 |
3 3 3,940±15,940 (р<0,001) |
|
ИММЛЖ, г/м2 |
121,990±1,462 |
161,810±6,780 (р<0,001) |
|
ФВ, % |
64,790±0,121 |
60,270±2,120 (р>0,05) |
|
РЛП, см |
3,680±0,013 |
4,220±0,080 (р<0,001) |
Примечание. Достоверность различий p рассчитана по отношению к данным группы больных АГ; различия достоверны при р<0,05.
Эхокардиографические показатели больных в исследуемых группах
На следующем этапе были проанализированы эхокардиографические показатели больных исследуемых групп с разными ти- пами ремоделирования левого желудочка (табл. 2).
Основная группа
Группа сравнения
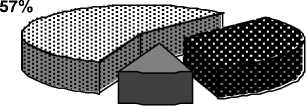
10%
Концентрическая ГЛЖ
Эксцентрическая ГЛЖ
Концентрическое ремоделирование ЛЖ
47%
7%
26%
20%
Концентрическая ГЛЖ
Эксцентрическая ГЛЖ
Концентрическое ремоделирование ЛЖ
Нормальная геометрия ЛЖ у пациентов исследуемых групп
Эхокардиографические показатели пациентов с различными типами ремоделирования сердца в исследуемых группах
Таблица 2
|
Показатель |
АГ |
МС |
|||
|
НГ, n=16 |
ЭГ, n=28 |
КГ, n=12 |
ЭГ, n=20 |
КГ, n=34 |
|
|
ТЗС ЛЖ, см |
0,890±0,012 |
1,070±0,004 (р<0,001) |
1,180±0,003 (р<0,001) (р 1 <0,001) |
1,11±0,05 (р 2 >0,05) |
1,220±0,02 (р з >0,05) (р 4 >0,05) |
|
ТМЖП, см |
0,860±0,011 |
1,060±0,007 (р<0,001) |
1,180±0,054 (р<0,001) (р 1 <0,05) |
1,24±0,05 (р 2 <0,01) |
1,400±0,04 (р з <0,05) (р 4 <0,01) |
|
КДР ЛЖ, см |
4,680±0,009 |
4,980±0,056 (р<0,001) |
4,880±0,043 (р<0,005) (р 1 >0,05) |
5,65±0,12 (р 2 <0,001) |
5,320±0,11 (р з >0,05) (р 4 <0,01) |
|
КСР ЛЖ, см |
2,940±0,062 |
3,290±0,007 (р<0,001) |
3,170±0,029 (р<0,005) (р 1 <0,005) |
3,77±0,26 (р 2 >0,05) |
3,46±0,14 (р з >0,05) (р 4 >0,05) |
|
ИОТС |
0,370±0,001 |
0,420±0,005 (р<0,001) |
0,480±0,006 (р<0,001) (р 1 <0,001) |
0,42±0,01 (р 2 >0,05) |
0,49±0,01 (р з <0,001) (р 4 >0,05) |
|
ММЛЖ, г |
156,140±0,534 |
258,110±5,193 (р<0,001) |
261,520±12,676 (р<0,001) (р 1 >0,05) |
335,95±25,49 (р 2 <0,01) |
356,28±19,67 (р з >0,05) (р 4 <0,005) |
|
ИММЛЖ, г/м2 |
80,770±1,561 |
141,110±2,911 (р<0,001) |
143,540±11,743 (р<0,001) (р 1 >0,05) |
164,97±11,75 (р 2 >0,05) |
170,94±7,45 (р з >0,05) (р 4 >0,05) |
|
ФВ, % |
69,500±0,905 |
61,210±0,042 (р<0,001) |
63,170±0,429 (р<0,001) (р 1 <0,005) |
57,3±4,8 (р 2 >0,05) |
60,71±2,46 (р з >0,05) (р 4 >0,05) |
|
РЛП, см |
3,350±0,017 |
3,730±0,003 (р<0,001) |
3,730±0,074 (р<0,001) (р 1 >0,05) |
4,36±0,14 (р 2 <0,005) |
4,14±0,11 (р з >0,05) (р 4 <0,01) |
Примечание. Достоверность различий р рассчитана по отношению к данным пациентов с АГ, имеющих НГ ЛЖ; р1 - при сравнении групп больных АГ с ЭГ и КГ ЛЖ; р2 - при сравнении групп больных с АГ и МС, имеющих ЭГ ЛЖ; рз - при сравнении групп больных с МС, имеющих ЭГ и КГ ЛЖ; р4- при сравнении групп больных с АГ и МС, имеющих КГ ЛЖ; различия достоверны при р<0,05.
Вследствие малого количества больных с концентрическим ремоделированием миокарда каких-либо исследований в данной группе не проводилось. Как показано в табл. 2, три группы пациентов с АГ без метаболических нарушений достоверно различались по структурно-геометрическим показателям сердца между собой, а также имели отличия по сравнению с данными основной группы.
В группе сравнения ТЗС ЛЖ и ТМЖП были наибольшими у пациентов с КГ ЛЖ. ИОТС ЛЖ в группе больных с КГ составлял 0,480±0,006, что на 14,3 % (p<0,001) и 29,7 % (p<0,001) соответственно превышало показатели пациентов, имеющих ЭГ и НГ. В основной группе значения ТЗС ЛЖ и ТМЖП превышали аналогичные показатели пациентов группы сравнения: ТЗС ЛЖ при ЭГ - на 3,7 % (p>0,05), при КГ - на 3,4 % (p>0,05); ТМЖП при ЭГ - на 16,9 % (p<0,01), при КГ - на 18,7 % (p<0,01) соответственно. ИОТС в основной группе среди пациентов с КГ на 2,1 % (p>0,05) был выше, чем в группе сравнения.
ММЛЖ имела наибольшие значения среди больных с КГ ЛЖ в обеих группах. В группе сравнения ММЛЖ у больных с КГ была на 67,5 % выше, чем у пациентов с НГ (p<0,001). У пациентов с ЭГ показатель на 65,3 % превышал данные больных с НГ (p<0,001), достоверно не отличаясь от показателя пациентов с КГ. В основной группе показатель ММЛЖ среди пациентов с ЭГ на 30,2 % был выше, чем в группе сравнения (p<0,01). У пациентов с КГ данный показатель на 36,2 % превышал аналогичный в группе сравнения (p<0,005). Достоверных различий ММЛЖ в основной группе среди пациентов с ЭГ и КГ не отмечалось.
ИММЛЖ среди пациентов основной группы имел более высокие показатели, составив у больных с ЭГ 164,97±11,75 г/м2 и с КГ - 170,94±7,45 г/м2, что на 16,9 % (p>0,05) и 19,1 % (p>0,05) соответственно выше данных группы сравнения. У больных АГ без метаболических нарушений ИММЛЖ в группе с КГ на 77,7 % (p<0,001) превышал показатель пациентов с НГ, достоверно не отличаясь от данных больных с ЭГ. В группе пациентов с ЭГ ИММЛЖ на 74,7 % (p<0,001) был выше, чем среди пациентов с НГ.
При сравнении показателей КДР ЛЖ и КСР ЛЖ как в основной группе, так и в группе сравнения наибольшие значения были выявлены у больных с ЭГ. Достоверных различий в основной группе среди пациентов с ЭГ и КГ не отмечалось. Значения КДР ЛЖ среди пациентов с ЭГ и КГ в основной группе на 13,5 % (p<0,001) и 9 % (p<0,01) соответственно превышали показатели пациентов из группы сравнения, но достоверных различий показателей КСР выявлено не было.
РЛП в группе сравнения среди пациентов с ЭГ и КГ на 11,3 % был выше, чем у больных с НГ (p<0,001). В основной группе у больных с ЭГ РЛП составил 4,36±0,14 см, что на 5,32 % большее, чем у больных с КГ (p>0,05). Сравнение показателей РЛП в основной группе и у пациентов с АГ без метаболических нарушений, имеющих ЭГ и КГ, выявило достоверно более высокие значения среди больных с МС: при ЭГ - на 16,9 % (p<0,005), при КГ - на 11 % (p<0,01).
ФВ ЛЖ была достоверно больше у больных с НГ в группе сравнения, на 13,5 % (p<0,001) и 10 % (p<0,001) соответственно превышая показатели больных с ЭГ и КГ. В основной группе больных с ЭГ и КГ показатель ФВ был недостоверно ниже, чем в группе сравнения, составив 57,3±4,8 % (p>0,05) и 60,71±2,46 % (p>0,05) соответственно.
Таким образом, проведенное исследование выявило достоверно более высокую распространенность у пациентов с МС прогностически неблагоприятных вариантов ремоделирования ЛЖ (ЭГ и КГ) и нарушений диастолической функции ЛЖ, ассоциирующихся с большей частотой модифицируемых и немодифицируемых факторов риска. Оба типа ремоделирования ЛЖ определяют высокий риск сердечно-сосудистых событий у большинства больных МС. Неблагоприятный прогноз у больных с МС обусловливает необходимость раннего назначения медикаментозной терапии.
Выводы:
-
1. Для пациентов с МС характерна большая частота развития ГЛЖ по сравнению с больными артериальной гипертонией без метаболических нарушений.
-
2. В структуре геометрических типов ЛЖ у больных МС преобладает концентри-
- ческая ГЛЖ; у больных АГ без метаболических нарушений наиболее распространенным вариантом ремоделирования сердца является эксцентрическая ГЛЖ.
-
3. Диастолическая дисфункция левого желудочка наблюдается при всех изученных
типах ремоделирования сердца среди пациентов с АГ и МС, наиболее часто – при эксцентрической и концентрической ГЛЖ. Эксцентрический тип ГЛЖ характеризуется большей частотой формирования диастолической дисфункции ЛЖ II типа.
Список литературы Особенности структурно-геометрической перестройки левого желудочка у больных с метаболическим синдромом и артериальной гипертензией
- Калашникова М.Ф. Метаболический синдром: современный взгляд на концепцию, методы профилактики и лечения. Эффективная фармакотерапия. Эндокринология. 2013; 6: 52-63.
- Рекомендации экспертов Всероссийского научного общества кардиологов по диагностике и лечению метаболического синдрома. Второй пересмотр. Практическая медицина. 2010; 5: 81-101.
- Крячкова А.А., Савельева С.А., Галлямов М.Г., Шестакова М.В., Кутырина И.М. Роль ожирения в поражении почек при метаболическом синдроме. Нефрология и диализ. 2010; 1: 34-35.
- Машина Т.В. Клинико-гемодинамические особенности артериальной гипертонии и ремоделирования сердца у больных сахарным диабетом 2 типа: автореф. дис. … канд. мед. наук. Ульяновск; 2006. 22.
- Сапожникова И.Е., Тарловская Е.И., Тарловский А.К. Ремоделирование сердца у пациентов с сахарным диабетом 2 типа и гипертонической болезнью. Вятский медицинский вестник. 2005; 3-4: 24-29.
- Романова Т.А., Полупанов А.Г. Артериальная гипертензия и метаболический синдром. Бишкек; 2008. 169.
- Andreadis E.A., Tsourous G.I., Tzavara C.K. Metabolic syndrome and incident cardiovascular morbidity and mortality in a Mediterrnean hypertensive population. Amer. J. Hypertens. 2007; 20 (5): 558-564.
- Thomas G.N., Schooling C.M., McGhee S.M. Metabolic syndrome ncreased all-cause and vascular mortality: the Hong Kong Cardiovascular Risk Factor Study. Clin. Endocrinol (Oxf). 2007; 66 (5): 666-671.
- Федоткина Л.К., Гончарова Л.Н., Фазлова И.Х. Диагностика и лечение впервые выявленной артериальной гипертензии. Саранск: Изд-во Мордов. ун-та; 2004. 68.
- Devereux R.B. Methods of recognition and assessment of left ventricular hypertrophy. Mediography. 1995; 17: 12-16.
- Васюк Ю.А., ред. Рекомендации по количественной оценке структуры и функции камер сердца. Российский кардиологический журнал. Прил. 1. 2012; 3 (95): 13-16.
- Ganau A., Devereux R.B., Roman M.J. Patterns of left ventricular hypertrophy and geometric remodeling in essential hypertension. J. Am. Coll. Cardiol. 1992; 19: 1550-1558.
- Шиллер Н.Б., Осипов М.А. Клиническая эхокардиография. М.: Практика; 2005. 344.


