Особенности термолиза малеатов Cu и La
Автор: Полозов Максим Александрович, Найферт Сергей Александрович, Полозова Валерия Владимировна, Жеребцов Дмитрий Анатольевич, Сактхидхаран Четтичи Палаям, Мерзлов Сергей Владимирович, Авдин Вячеслав Викторович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 2 т.11, 2019 года.
Бесплатный доступ
Соли карбоновых кислот широко используются в органическом синтезе при получении катализаторов и нанокомпозитов металлов в углеродной матрице путем термолиза малеатов, акрилатов или ацетилендикарбоксилатов этих металлов, однако исследования процесса термодеструкции подобных соединений отрывочны. Исследованы процессы многостадийного разложения малеатов Cu и La в инертной атмосфере методом синхронного термического анализа с анализом состава выделяющихся газов. Предложены механизмы реакций, соответствующие определенным в ходе термического ступеням потери массы, газообразным продуктам и конечному твердому продукту разложения. Показано образование нанодисперсных оксидов меди и оксокарбоната лантана, включенных в пористую углеродную матрицу. Результаты термического анализа позволили выделить общие для малеатов особенности их термолиза. Во-первых, разложение малеат-иона или малеиновой кислоты всегда сопровождается образованием наряду с водой и углекислым газом двух продуктов, содержащих двойную или тройную связь С-С: акриловой кислоты и ацетилена приблизительно в равных количествах. Во-вторых, наличие кратных связей как в молекулах исходных веществ, так и в молекулах газообразных продуктов термолиза приводит к их полимеризации и далее к образованию углеродистого остатка. Количество этого остатка наиболее высоко в случае разложения малеата лантана и наиболее низко в случае малеата меди. В-третьих, протекание термолиза малеатов металлов в матрице, состоящей из углеродистого полимера, приводит к формированию частиц металлов (Cu) или оксидов/карбонатов металлов в виде нанодисперсных кристаллов, равномерно распределенных в этой матрице. С помощью электронной микроскопии определена морфология и размер частиц продуктов термолиза малеатов La и Cu. Продуктами термолиза являются композиты из сферических частиц La2O2(CO3) (диаметром 2-5 мкм) и Cu2O, CuO, Cu (диаметром 10-500 нм), равномерно распределенные в углеродной матрице. Применение при анализе механизма термолиза одновременно данных о величине потери массы на каждом этапе, тепловых эффектах, а также о составе газообразных продуктов и о фазовом составе конечных твердых продуктов термолиза позволило предложить непротиворечивую исходную формулу малеатов Cu и La.
Термический анализ, малеаты, рентгенофазовый анализ, термолиз
Короткий адрес: https://sciup.org/147233124
IDR: 147233124 | УДК: 547.599.3 | DOI: 10.14529/chem190204
Текст научной статьи Особенности термолиза малеатов Cu и La
Соли карбоновых кислот широко используются в органическом синтезе, текстильной промышленности, при получении катализаторов и в других областях [1–5]. Ряд работ был посвящен получению нанокомпозитов металлов (Zn, Co, Ni, Mn, Fe, Cu, Nd, Ce) в углеродной матрице путем термолиза малеатов, акрилатов или ацетилендикарбоксилатов этих металлов [6–10], однако исследования процесса термодеструкции подобных соединений отрывочны. В результате термолиза солей карбоновых кислот возможно получить различные продукты органического, нефтехимического и неорганического синтеза (кетоны, альдегиды, фенолы). Кроме того катализаторы, полученные термолизом карбоксильных кислотных солей, применяемые для металлокомплексного катализа [11–16]. Известно, что термическая устойчивость ароматических карбоксильных кислотных солей и состав их продуктов определены природой катиона и аниона, но особенности теплового преобразования алифатических карбоксильных кислотных солей изучены только для нескольких комплексов [17–21].
В данной работе проведено комплексное исследование механизма термолиза малеатов Cu и La с привлечением результатов анализа продуктов разложения в газовой фазе и рентгенофазового анализа твердых продуктов.
Было выполнено всестороннее исследование тепловых реакций разложения солей алифатических карбоксильных кислот. Для изучаемых комплексов впервые были определены диапазоны температур разложения (температура начала и конца).
Экспериментальная часть
Термический анализ (ТГ-ДСК)малеатов был проведен в среде аргона в платиновом тигле ёмкостью 50 мкл при скорости нагрева 10 К/мин с помощью синхронного термоанализатора Netzsch 449C Jupiter, совмещенного с квадрупольным масс-спектрометром QMS 403C Aëolos (МС) для анализа газообразных продуктов разложения. Рентгенофазовый анализ (РФА) исходных веществ и твердых продуктов их термолиза проводился с помощью рентгеновского порошкового дифрактометра Rigaku Ultima IV на излучении CuKα.
В качестве объектов исследования были использованы малеиновая кислота квалификации «чда», а также малеаты, полученные при ее реакции с Cu 2 (OH) 2 CO 3 и La 2 O 3 (также квалификации «чда») в концентрированном водном растворе в течение суток при 70 °С. Соотношение металла и кислоты было выбрано из расчета образования средних солей. Выделившиеся при медленном охлаждении растворов крупные прозрачные кристаллы малеатов были отделены от раствора и непрореагировавших соединений металлов.
Морфологию и состав твердых продуктов разложения исследовали с помощью растрового электронного микроскопа Jeol JSM–7001F, сопряженного с энергодисперсионным спектрометром EDSOxford INCAX–max 80.
Обсуждение результатов
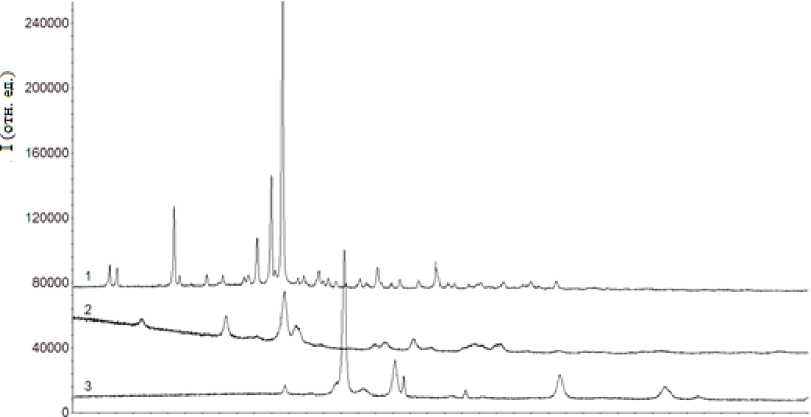
В литературных источниках нами не обнаружено описание структуры и состава малеатов Cu(II) и La. Для интерпретации процессов, протекающих при их разложении, были проведены расчеты ожидаемых потерь массы для нескольких вариантов их исходного состава: кислых и средних солей, содержащих от 1 до 4 молекул кристаллизационной воды. Благодаря сопоставлению с экспериментальными термолитическими данными и составом газообразных и твердых продуктов термолиза (рис. 1) удалось оценить их начальный состав и предложить механизмы термического разложения.
10 0 20 0 300 <0 0 50 0 60 0 70 0 80 0
26 Л
Рис. 1. Рентгенограммы малеата Cu (1) и твердых продуктов термолиза малеатов La (2) и Cu (3)
На термограмме малеата меди (рис. 2) в интервале 65–357 °С поданным ДСК, ТГ и масс-спектрометрического анализа состава выделяющихся газов можно выделить 5 этапов разложения.
Первый этап протекает в интервале 65–106 °С и сопровождается потерей массы 14,49 масс. %, поглощением тепла и выделением в атмосферу единственного газообразного продукта – воды. Интерпретация этого этапа хорошо согласуется с расчетным изменением массы для реакции потери четырех молекул кристаллизационной воды кислым малеатом состава
Cu(C 4 H 3 O 4 ) 2 (С 4 Н 4 О 4 )·4H 2 O, особенно если предполагать возможную незначительную потерю кристаллизационной воды образцом, использованным для анализа:
Cu(C 4 H 3 O 4 ) 2 (С 4 Н 4 О 4 ) ·4H 2 O = Cu(C 4 H 3 O 4 ) 2 (С 4 Н 4 О 4 ) + 4H 2 O (–14,96 %).
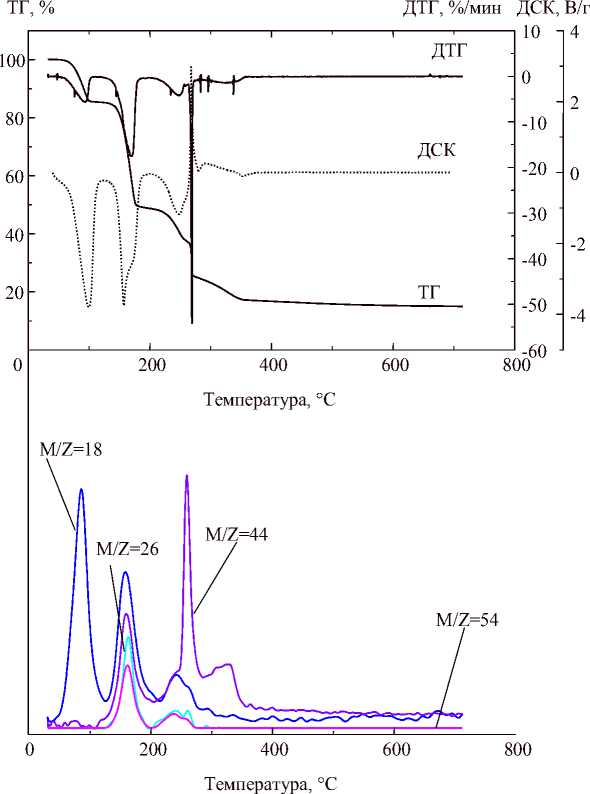
Рис. 2. Результаты синхронного термического анализа малеата меди
Предложенная формула малеата меди включает в себя одну дополнительную молекулу малеиновой кислоты. Такой состав малеата следует из необычно высокой общей потери 85,04 масс. % образцом при нагревании до 720 °С. Поскольку основным твердым продуктом термолиза по данным РФА является Cu2O, то данная формула хорошо объясняет не только потерю массы при отделении кристаллизационной воды, но и наблюдаемую общую потерю массы (летучие продукты указаны упрощенно):
2Cu(C 4 H 3 O 4 ) 2 (С 4 Н 4 О 4 ) ·4H 2 O = Cu 2 O + 11H 2 + 24CO + 7H 2 O (–85,15 %). (2)
Разница в 0,11 масс. % между расчетной и экспериментальной общей потерей массы объясняется присутствием в твердом продукте термолиза небольшого количества аморфного углерода (около 0,4 % всего углерода, содержавшегося в Cu(C 4 H 3 O 4 ) 2 (С 4 Н 4 О 4 )·4H 2 O), различимого с помощью растрового электронного микроскопа как рыхлая масса, связывающая частицы оксидов меди (рис. 3, а).
Второй этап протекает в интервале 106–183 °С и сопровождается потерей массы 36,13 масс. %, поглощением тепла и выделением в атмосферу четырех газообразных продуктов:
воды, ацетилена, углекислого газа и акриловой кислоты. Крутой фронт и острая вершина пика ДСК может соответствовать одновременно протекающему плавлению при 144,2 °С с разложением основной части малеата меди до некоторого промежуточного продукта.
Третий этап протекает в интервале 183–259 °С и сопровождается значительно меньшей и более медленной потерей массы 11,66 масс. %, поглощением тепла и выделением в атмосферу тех же трех газообразных продуктов – воды, ацетилена, углекислого газа и акриловой кислоты, приблизительно с таким же соотношением их между собой. Таким образом, на третьем этапе можно предполагать дальнейшее разложение малеат-иона, входящего в состав промежуточного продукта разложения, вероятно, карбонат-малеата меди Cu 2 (C 4 H 3 O 4 ) 2 (CO 3 ), если учесть результаты разложения на четвертом и пятом этапе. Основными твердыми продуктами третьего этапа разложения являются, по-видимому, Cu 2 O и оксокарбонат меди Cu 2 O(CO 3 ). Таким образом, второй и третий этапы можно описать следующими последовательными уравнениями:
2Cu(C 4 H 3 O 4 ) 2 (С 4 Н 4 О 4 ) = Cu 2 (C 4 H 3 O 4 ) 2 (CO 3 ) + 2HC≡CH
+ 2Н2C=CН–COOH + 3CO2 + 2CO + H2O (–49,09 %)(3)
4Cu 2 (C 4 H 3 O 4 ) 2 (CO 3 ) = 4Cu 2 O(CO 3 ) + 3HC≡CH
+ 3Н2C=CН–COOH + 2CO2 + 15CO + 3H2O (–51,32 %)(4)
4Cu 2 (C 4 H 3 O 4 ) 2 (CO 3 ) = 4Cu 2 O + 3HC≡CH
+ 3Н2C=CН–COOH + 10CO2 + 11CO + 3H2O (–65,70 %)(5)
Особенностью анализа состава выделяющихся газов является влияние на его результаты присутствующих в используемом газе-носителе (аргоне) примесей кислорода и азота (около 1 %). Это приводит к тому, что выделяющийся в небольших количествах СО с молекулярной массой 28 а. е. м. оказывается неразличим на фоне более высокого содержания N 2 (28 а. е. м) и не указан на термограммах. Аналогично неразличим при анализе оказывается и водород, поскольку он успевает в горячей печи в присутствии платиновых деталей измерительной ячейки окислиться до воды.
Четвертый этап протекает в узком интервале 259–274 °С и сопровождается резкой потерей массы 12,44 масс. %, быстрым выделением тепла и выделением в атмосферу только углекислого газа. Выделение тепла в ходе этого этапа может быть объяснено спонтанным разложением ацетиленида меди Cu 2 C 2 , который может образоваться из других соединений меди в присутствии ацетилена [22]. Малеат La не имеет на кривой ДСК резкого экзотермического пика, что согласуется с тем, что ацетиленид La разлагается водой и не образуется в условиях, при которых атмосфера содержит воду или органические кислоты. Резкий разогрев образца при разложении ацетиленида меди (уравнение 6), по-видимому, привел к разложению части оксокарбоната меди и выделению углекислого газа (уравнение 7):
Cu 2 C 2 = 2Cu + 2C (6)
Cu 2 O(CO 3 ) = 2CuO + CO 2 (–21,67 %) (7)
Пятый этап протекает в интервале 274–357 °С и сопровождается потерей массы 8,1 масс. %, поглощением тепла и выделением в атмосферу единственного газообразного продукта – углекислого газа. Этот этап можно интерпретировать как разложение остатков оксокарбоната меди с образованием оксида меди (уравнение 7). В пользу такого объяснения служат данные термолиза гидроксокарбоната меди, который испытывает при 250–350 °С превращение из карбоната в оксид CuO [23].
По данным РФА, конечными продуктами термического разложения малеата меди являются Cu 2 O, CuO и Cu в соотношении 75:20:5 по массе. Присутствие меди объясняется тем, что при высоких температурах CuO и Cu 2 O восстанавливаются под действием углерода до Cu. Это подтверждается уменьшением массы образца при 357–720 °С на 2,22 % и выделением углекислого газа.

б)
a)

в)
Рис. 3. Морфология твердых продуктов термолиза малеатов Cu (а, б), La (в, г)

г)
Согласно данным электронной микроскопии, продуктом термолиза является композит, представляющий собой частицы Cu 2 O, CuO и Cu (рис. 3, а, б), связанные небольшим количеством углерода. Диаметр сравнительно крупных сферических частиц, составляющих основную массу образца, что позволяет отнести их к Cu 2 O, равен 500 нм. Размер частиц, составляющих рыхлую массу между сферами, не превышает 50 нм. Поскольку эти наиболее мелкие частицы имели возможность для более полного восстановления, можно предположить, что это металлическая медь. CuO, вероятно, присутствует внутри крупных сфер Cu 2 O.
На кривых ТГ-ДСК-МС малеата лантана (рис. 4) в интервале 40–820 °С можно выделить 3 этапа разложения. Особенностью подготовки образца малеата лантана для термического анализа была предварительная сушка его в глубоком вакууме, которая привела к обезвоживанию, что выразилось в превращении прозрачных кристаллов в тонкий белый порошок. Следствием этого стало отсутствие на термограмме этапа обезвоживания кристаллогидрата и соответствующих пиков выделения воды на масс-спектре.
Общая потеря массы при 820 °С составила 50,62 масс. %, а твердый остаток, согласно РФА, представляет собой La 2 O 2 (CO 3 ) с некоторым количеством углерода. Это позволяет предложить формулу безводного малеата лантана и упрощенную суммарную реакцию разложения:
2La(C 4 H 3 O 4 ) 3 = La 2 O 2 (CO 3 ) + 2HC≡CH + 19CO + 7H 2 (–61,80 %)
Разница в расчетной и измеренной потере массы может быть отнесена к формированию 11,18 масс. % углерода (около 37 % всего углерода, содержавшегося в La(C 4 H 3 O 4 ) 3 ). Наличие заметного количества углерода в продукте термолиза выявляется на результатах сканирующей электронной микроскопии (рис. 3, б) и данных рентгенофлуоресцентной спектроскопии.
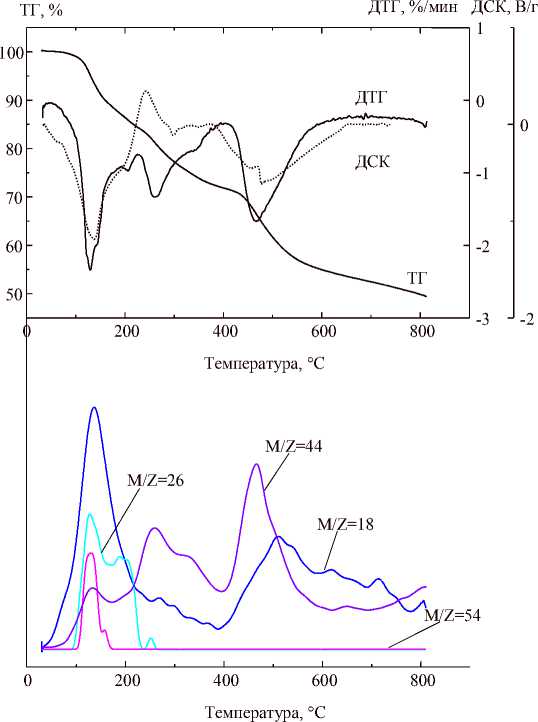
Рис. 4. Результаты синхронного термического анализа La(C 4 H 3 O 4 ) 3 и анализа состава выделяющихся газов
Первый этап термолиза протекает в интервале 40–227 °С и сопровождается потерей массы 15,70 масс. %, поглощением тепла и выделением в атмосферу четырех газообразных продуктов: воды, ацетилена, углекислого газа и акриловой кислоты. Объяснить такую потерю массы можно, предполагая образование карбонат-малеата лантана La 2 (C 4 H 3 O 4 ) 4 (CO 3 ):
16La(C 4 H 3 O 4 ) 3 = 8La 2 (C 4 H 3 O 4 ) 4 (CO 3 ) + 15C + 6HC≡CH
+ 6Н 2 C=CН–COOH + 11CO 2 + 6H 2 O (–15,24 %) (9)
Второй этап протекает в интервале 227–402 °С и сопровождается потерей массы 12,52 масс. %, поглощением тепла и выделением в атмосферу преимущественно углекислого газа и воды, предположительно по реакции:
La 2 (C 4 H 3 O 4 ) 4 (CO 3 ) = La 2 (C 4 H 3 O 4 ) 2 (CO 3 ) 2 + 7С + 1CO 2 + 3H 2 O (–12,29 %) (10)
Таким образом, за первые два этапа экспериментально найденная потеря массы составила 28,22 масс. %, при этом расчет по уравнениям (9) и (10) дает близкое значение 25,66 масс. %.
Третий этап протекает в интервале 402–820 °С и сопровождается потерей массы 22,4 масс. %, поглощением тепла и выделением в атмосферу двух газообразных продуктов – воды и углекислого газа:
La 2 (C 4 H 3 O 4 ) 2 (CO 3 ) 2 = La 2 O 2 (CO 3 ) + 5С + 3CO 2 + 3H 2 O (–30,21 %) (11)
Таким образом, за три этапа измеренная потеря массы составила 50,62 масс. %, при этом расчет по уравнениям (9)–(11) дает близкое значение 48,12 масс. %.
Согласно данным исследования с помощью растрового электронного микроскопа и рентгенофлуоресцентного анализатора, продуктом термолиза является композит, представляющий собой равномерно распределенные в углеродной матрице микросферы (2000–5000 нм) La 2 O 2 (CO 3 ), сложенные из игольчатых кристаллов толщиной около 100 нм (рис. 3, в, г).
Выводы
Результаты термического анализа позволили выделить общие для малеатов особенности их термолиза. Во-первых, разложение малеат-иона или малеиновой кислоты всегда сопровождается образованием приблизительно в равных количествах акриловой кислоты и ацетилена. Во-вторых, наличие кратных связей как в молекулах исходных веществ, так и в молекулах газообразных продуктов термолиза, приводит к их полимеризации и далее к образованию углеродистого остатка. Количество этого остатка наиболее высоко в случае разложения малеата лантана и наиболее низко в случае малеата меди. В-третьих, протекание термолиза малеатов металлов в матрице, состоящей из углеродистого полимера, приводит к формированию частиц металлов (Cu) или оксидов/карбонатов металлов в виде нанодисперсных кристаллов, равномерно распределенных в этой матрице.
Применение при анализе механизма термолиза одновременно данных о величине потери массы на каждом этапе, тепловых эффектах, а также о составе газообразных продуктов и о фазовом составе конечных твердых продуктов термолиза позволило даже в случае малеатов металлов неизвестного состава предложить непротиворечивую исходную формулу малеатов и формулы промежуточных продуктов.
Работа выполнена при поддержке Правительства РФ (Постановление № 211 от 16.03.2013 г.), соглашение № 02.A03.21.0011 и Министерства образования и науки РФ в рамках ГЗ № 4.5749.2017/7.8. Рентгенофазовый и термический анализ, а также электронномикроскопические исследования проведены в научно-образовательном центре «Нанотехнологии» ЮУрГУ.
Список литературы Особенности термолиза малеатов Cu и La
- Hlestkin R.N., HlestkinaV.L. Termicheskoe prevrashchenie kadmievykh i tsinkovykh soley aromaticheskikh i alifaticheskikh karbonovykh kislot [Thermal Transformation of Cadmium and Zinc Salts of Aromatic and Aliphatic Carboxylic Acids]. Chemistry Industry, 1980, vol. 5, 271 p.
- Lebedev N.N. Himiya i tekhnologiya osnovnogo organicheskogo i neftekhimicheskogo sinteza [Chemistry and Technology of Basic Organic and Petrochemical Synthesis]. Moscow, Chemistry, 1984, 592 p.
- Rubinshtejn A.M., Yakerson V.I. [Ketonization of Acetic Acid on Alkali Metal Carbonates and Decomposition of Their Oxalates and Acetates]. J. Kinetics and Catalysis, 1961, vol. 2, no. 1, pp. 118-126.
- Hlestkin R.N., Prosochkina T.R. Termodestruktsiya soley karbonovykh kislot[Thermal Degradation of Carboxylic Acid Salts]. Moscow, Chemistry, 2006, 222 p.
- Hlestkin R.N., Hlestkina V.L., Usanov N.G., Gareev V.M. Termoliz soley karbonovykh kislot [Thermolysis of Salts of Carboxylic Acids]. Chem. Ind., 1982, vol. 7, 391 p.
- Pomogailo A.D., Dzhardimalieva G.I., Rozenberg A.S., Shershnev V.A. [Reactivity of Metal-Containing Monomers. Preparation and Magnetic Broperties of Metal-Containing Nanocomposites]. Russ. Chem. Bul., 2011, vol. 60, no. 7, pp. 1476-1487.
- DOI: 10.1007/s11172-011-0220-x
- Yudanova L.I., Logvinenko V.A., Korol'kov I.V., Ishchenko A.V., Rudina N.A. [Peculiar Properties of Thermal Decomposition in Systems of Acid Maleates Zn(II), Co (II), Ni (II) With Formation of Metal Nanoparticles]. J. Phys. Chem., 2018, vol. 92, no. 11, pp. 1753-1759.
- DOI: 10.1134/s003602441811047x
- Yudanova L.I., Logvinenko V.A., Sheludyakova L.A., Yudanov N.F., Semyannikov P.P., Kozhemyachenko S.I., Korol'kov I.V., Rudina N.A., Ishchenko A.V. [Salts of Maleic Acid Mn (II), Fe (II), Co (II), Ni (II) - Precursors for the Synthesis of Metal-Polymer Composites]. J. Inorg. Chem., 2014, vol. 59, no. 10, pp. 1420-1426.
- DOI: 10.1134/S0036023614100222
- Yudanova L.I., Logvinenko V.A., Yudanov N.F., Rudina N.A., Ishchenko A.V., Semyannikov P.P., SHeludyakova L.A., Alferova N.I. [Thermolysis of Cu (II)Salts of Maleic Acid. Synthesis of Metal-Polymer Composites]. Russ. J. Coord. Chem., 2013, vol. 39, no. 5, pp. 309-314.
- DOI: 10.1134/S1070328413050102
- Pomogajlo A.D,. Rozenberg A.S., Dzhardimalieva G.I. [Thermolysis of Metallopolymers and Their Precursors as a Method of Obtaining Nanocomposites]. Russ. Chem. Rev., 2011, vol. 80, pp. 272-307.
- DOI: 10.1070/RC2011v080n03ABEH004079
- Gauptman Z., Greffe Yu., Remans X. Organicheskaya khimiya [Organic Chemistry]. Moscow: Mir, 1979, 832 p.
- Mishchenko G.L., Vatsuro K.V. Sinteticheskie metody organicheskoy khimii [Synthetic Methods of Organic Chemistry]. Moscow: Chemistry, 1982, 440 p.
- Rayd K. Kurs fizicheskoy organicheskoy khimii [A Course in Physical Organic Chemistry]. Moscow: Mir, 1972, 576 p.
- Serguchev Yu.A., Beletskaya I.P. [Oxidative Decarboxylation of Carboxylic Acids]. Russ. Chem. Rev., 1980, vol. 49, no. 12, pp. 2257-2285.
- DOI: 10.1070/RC1980v049n12ABEH002532
- Chichibabin A.B. Osnovnye nachala organicheskoy khimii [Basic Principles of Organic Chemistry]. Moscow: Chemisry, 1963, 912 p.
- Yakerson V.I., Rubinshteyn A.M. [Kinetics and Mechanism of Thermal Decomposition of Lithium, Sodium, Barium Acetates]. J. Kinetics and Catalysis, 1961, vol. 2, no. 2, pp. 172-178.
- Yakerson V.I. [Mechanism of Thermal Decomposition of Carboxylic Acid Salts]. Proceedings of the USSR academy of sciences, 1966, vol. 7, pp. 1003-1011.
- Yakerson V.I., Rubinshteyn A.M. [Mechanism of Methane Decomposition of Sodium Acetate]. Proceedings of the USSR academy of sciences, 1966, vol. 7, pp. 1278-1281.
- Petrov A.A., Bal'yan Kh.V., Trotsenvo A.T. Organicheskaya khimiya [Organic Chemistry]. Moscow: Vysshaya Shkola Publishers, 1985, 490 p.
- Reutov O.A., Kurts A.L., Butin K.P. Organicheskaya khimiya [Organic Chemistry]. Moscow: Moscow State University, 1999, 624 p.
- Smit V., Bochkov A. Organicheskiy sintez: nauka i iskusstvo [Organic Synthesis: Science and Art]. Moscow: Mir, 2001, 624 p.
- Knunyanc I.L. Chemical encyclopedia. Moscow: Soviet encyclopedia, 1988, vol. 1, 631 p.
- Dobrydnev S.V., Kapaev G.I., Zamuruev O.V., Beskov V.S. [Peculiar Properties of Thermolysis of Hydroxycarbonate Hydrate of Nickel (II), Copper (II), Zinc (II)]. Russian Chemical Bulletin, 2009, vol. 52, no. 6, pp. 25-28.


