Особенности взаимодействия и фазообразования в системе TiO2 (анатаз) - Cr2O3
Бесплатный доступ
Рентгеновский и электронномикроскопический анализ применен для исследования взаимодействия и фазообразования в системе ТiO2 (анатаз) -Сr2O3. Показано, что Сr2Оэ существенно понижает температуру фазового перехода анатаза в рутил. Установлено, что твердый раствор Сг2O3 в ТiO2 образуется только при переходе анатазной модификации в рутильную.
Короткий адрес: https://sciup.org/147158496
IDR: 147158496 | УДК: 540.145
Текст краткого сообщения Особенности взаимодействия и фазообразования в системе TiO2 (анатаз) - Cr2O3
Известно, что фазовый переход анатазной в рутильную модификацию оксида титана (TV) в начинается с 600 °C и заканчивается при 900 °C [1]. Однако этот температурный интервал может существенно меняться в зависимости от способа приготовления оксида титана (TV). Установлено [2-4], что введение в состав гидратированного оксида титана (IV) небольших количеств некоторых соединений, значительно снижает температуру перекристаллизации фазового перехода. Скорость превращения анатаза в рутил определяется диффузионной подвижностью ионов в кристаллической решетке анатаза, при этом атомы добавок влияют на процесс полиморфного превращения в такой степени, в какой они изменяют условия диффузии. Если добавки стимулируют образование кислородных вакансий, они являются рутилирующими, появление ионов в междоузлии приводит к стабилизации анатаза, а значит к увеличению температуры фазового перехода [5]. Однако, литературные данные о влиянии добавок, таких как Сг2О3, вводимых непосредственно к анатазной модификации, на изменение температуры фазового перехода практически отсутствуют.
В системе TiO2-Cr2O3 помимо фаз Магнели существует твердый раствор Сг2О3 в ТЮ2 с содержанием ТЮ2 более 90 мас.%. Оксид хрома образует в рутиле твердые растворы до содержания 6,5-7,4 мас.% Сг2О3 [6].Однако, кинетика массопереноса в системе TiO2-Cr2O3> как и механизм растворения неизоморфных оксидов в различных степенях окисления катионов, таких как Сг2О3 и ТЮ2 изучен недостаточно, что затрудняет построение конкретной физико- химической модели взаимодействия в подобных системах. Отметим что, исследования по образованию твердых растворов в системе TiO2-Cr2O3 проводились только с использованием оксида титана(1У) рутильной модификации [7, 8]. Поэтому представляет интерес изучение образования твердых растворов в системе ТЮ2 (анатаз) - Сг2О3.
Цель данной работы - изучение влияния Сг2О3 на фазовый переход анатаза в рутил.
' Экспериментальная часть
Исходные механические смеси готовили путем тщательного смешения оксидов титана(1У) и хрома(Ш) квалификации «х.ч.» в агатовой ступке до получения порошков однородного цвета. Оксид титана (IV) анатазной модификации получали прокаливанием гидролизного диоксида титана (ГДТ) при 600 °C в течении 2-х часов. В свою очередь ГДТ получали по способу, детально описанному в [1], путем термического гидролиза растворов сульфатных соединений Ti (IV). Гидролиз проводили в присутствии анатазных зародышей, которые согласно [1] являются центрами образования первичных частиц ГДТ в процессе его гидролиза. Полученные смеси прокаливали в фарфоровых тиглях в интервале 850-1000 °C в течении 1 часа, которые исследовали рентгенографически. Количественный и качественный фазовый анализ образцов проводили на дифрак-трометре ДРОН-ЗМ с Ка-излучением кобальта. Параметры решетки рассчитывали методом наименьших квадратов. Точность определения межплоскостных расстояний не превышала 2-Ю-3 А. Электронно-микроскопические исследования образцов до и после прокаливания проводили на электронном микроскопе ПЭМ-100 по стандартным методикам.
Смеси оксидов, с содержанием Cr2O31, 2, 3,4, 5, 6, 7, 8,9 и 10 мас.% прокаливали в интервале температур 850-1000 °C в течении 1-2 часов. Кинетику твердофазного взаимодействия исследовали в изотермических условиях при 850, 900, 1000 °C на образце состава 95 мас.% ТЮ2 и
5 мас.% Сг20з. Колебания температуры в печи в зоне реакции не превышали 10 °C. Количественный фазовый рентгеновский анализ проводили методом внутреннего эталона. Ошибка при определении степени превращения продуктов твердофазных реакций не превышала 5 %. Количественный фотоколориметрический анализ хрома (VI) и хрома (Ш) проводили по методикам подробно описанным в [9].
. Обсуждение результатов
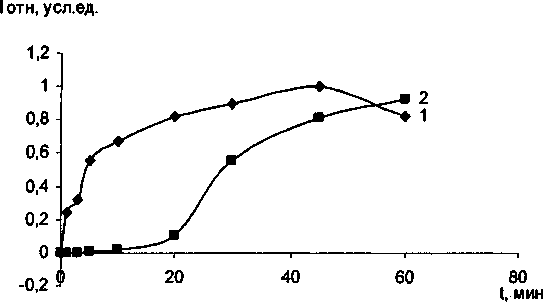
В ходе эксперимента установлено, что Сг20з не образует твердых растворов с ТЮ2 анатазной модификации до тех пор, пока не произойдет полиморфное превращение анатаза в рутил. Рентгеноструктурный и электронномикроскопический анализы показали, что с увеличением температуры и времени выдержки постепенно растут кристаллики анатаза, и при появлении рутильной фазы начинается интенсивное растворение оксида хрома в рутиле. Полученные экспериментальные данные представлены в таблице и на рис. 1, 2. Отметим, что механизм взаимодействия ТЮ2 анатазной и рутильной модификации с оксидом хрома (Ш) существенно различны. При совместном прокаливании анатаза с Сг2О3 на воздухе наблюдается интенсивное окисление последнего с образованием соединений с Сг6+. При прокаливании исходной смеси в атмосфере аргона окисления оксида хрома (Ш) не происходит. При этом количество Сг6+ определяется временем и температурой изотермической выдержки. Наиболее интенсивное окисление происходит при 850 °C в течении 50-60 минут (рис. 3). Дальнейшее увеличение температуры и времени выдержки существенно снижают содержание Сг6+. Следует отметить, что при взаимодействии ТЮ2 рутильной модификации с Сг2О3> окисление значительно меньше, чем при взаимодействии анатаза с оксидом хрома (Ш). Подобное окисление оксида хрома (III) ранее наблюдали при совместном прокаливании Сг20з с у-А120з и связывали с наличием ОН-групп на поверхности оксида алюминия [10]. Отметим, что анатаз на своей поверхности содержит значительное количество воды [11]. В присутствии Сг20з временной интервал фазового перехода существенно снижается, для образцов прокаленных при 1000 °C на 5 мин, при 900 °C на 20 мин, прокаленных при 850 °C - более чем на 30 мин. Данный факт свидетельствует о том, что оксид хрома является рутилирующей добавкой, стимулирующей образование кислородных вакансий.
Окисление оксида хрома (VI) в системе TiO2 (анатаз) - Сг2О3
|
Образец |
Сг 6+/Сгобщ, % . |
||||||||
|
т, мин |
1 |
3 |
5 |
10 |
15 |
20 |
30 |
45 |
60 |
|
850 °C |
0,09 |
0,14 |
0,31 |
0,43 |
0,94 |
1,22 |
1,75 |
2,0 |
2,5 |
|
900 °C |
0,12 |
0,34 |
1,82 |
2,0 |
1,34 |
1,21 |
1,18 |
1,21 |
1,0 |
|
1000 °C |
0,09 |
0,22 |
0,31 |
2,0 |
1,91 |
1,35 |
1,26 |
1,18 |
1,И |
Электронно-микроскопические исследования показали, что в исходных механических смесях частицы ТЮ2 и Сг2О3 определяются своей морфологией и микродифракцией. После нагревания частицы Сг2О3 по морфологическим признакам и микродифракцией электронов не обнаруживаются. Это позволяет считать, что образуется твердый раствор на основе рутила. Отсутствие заметного смещения дифракционных колец после прохождения твердофазной реакции может быть . связанно с тем, что дифракция электронов характеризуется очень малым углом.
Таким образом, полученные экспериментальные данные позволяют предположить следующую модель массопереноса в дисперсной системе ТЮ2 - Сг20з.При нагревании до температуры фазового перехода анатаза в рутил происходит интенсивное окисление Сг20з с образованием метастабильных соединений с Сг6+, которые, по-видимому, в дальнейшем играют значительную роль в образовании твердого раствора оксида хрома (III) в рутиле. Массоперенос при взаимодействии оксидов облегчается за счет образующийся жидкой фазы метастабильных соединений с Сг64".
Белая Е.А., Викторов В.В.
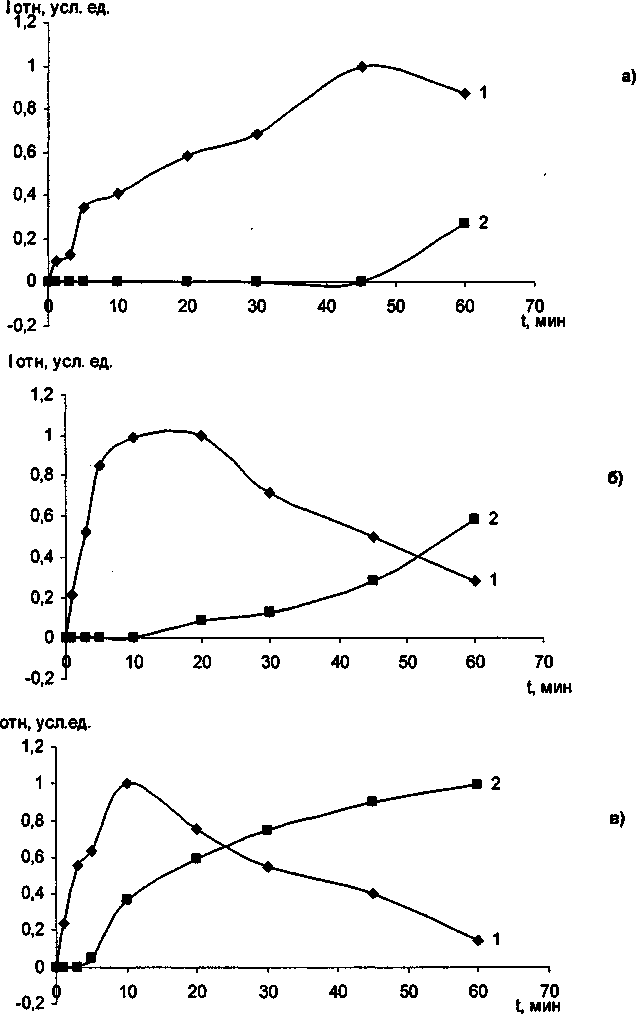
Рис. 1. Фазовый переход анатаза в рутил без добавок Сг2О3 при различных температурах изотермической выдержки: а) 850 °C; б) 900 'С; в) 1000 *С.
. 1 - интегральной интенсивности анатаза;
2- интегральной интенсивности рутила
I отн, усл.ед.
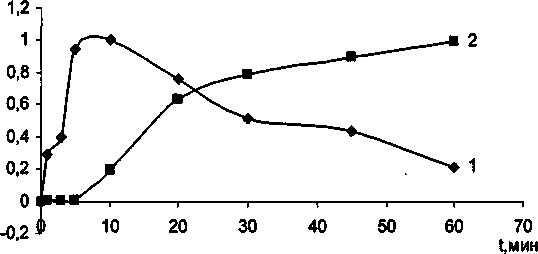
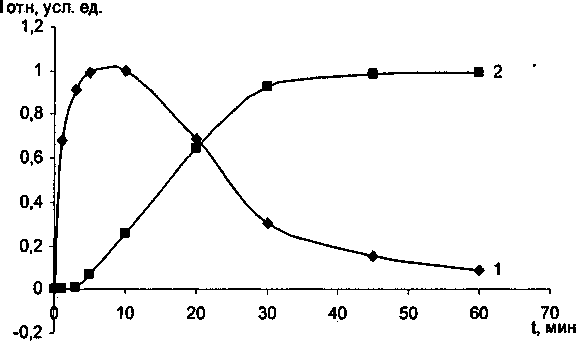
Рис. 2. Фазовый переход анатаза в рутил с добавками Сг20з при разных температурах изотермической выдержки: а) 850 °C; 6) 900 °C; в) 1000 °C.
1 - интегральной интенсивности анатаза; 2 - интегральной интенсивности рутила
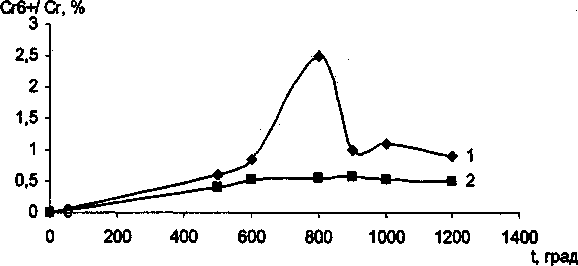
Рис. 3. Содержание Сг**7 Сг общ в образцах прокаленных при изотермической выдержке в течение 1 часа, %: 1 - анатаз; 2 - рутил
Выводы
-
1. Исследован фазовый переход анатаза в рутил в присутствии Сг20з. Установлено, что добавки оксида хрома (Ш) существенно снижают температуру перекристаллизации и временной интервал фазового перехода.
-
2. Взаимодействие анатазной и рутильной модификации ТЮ2 с Сг2О3 различно. При взаимодействии Сг20з с анатазом наблюдается интенсивное окисление Сг3* с образованием метаста-бильных соединений с Сг6*. Максимальное количество этих соединений наблюдается при 850 °C при изотермическом прокаливании в течении 50-60 минут. Окисление оксида хрома (Ш) в присутствии рутила незначительно и отличается более чем на три порядка.
-
3. Твердый раствор Сг20з в ТЮ2 образуется только на основе рутильной модификации. При этом при образовании твердого раствора резко снижается содержание метастабильных соединений с Сг6*.
Работа выполнена при финансовой поддержке Правительства Челябинской области, проект №29/М06/А.
Список литературы Особенности взаимодействия и фазообразования в системе TiO2 (анатаз) - Cr2O3
- Беленький Е.Ф., Рискин И.В. Химия и технология пигментов. -Л.: Химия, 1974. -656 с.
- Лучинский Г.П. Химия титана. -М.: Химия, 1971. -470 с.
- Хазин Л.Г. Двуокись титана. -Л.: Химия, 1970. -176 с.
- Горощенко Я.Г. Химия титана. -Киев: Наукова думка, 1970. -415 с.
- Shanon R.D., Rask G.A. Kinetiks of the anataz-rutile transformation//J. Amer. Ceram. Soc. -1965. -V. 48. -№ 8. -P. 391-397.
- Бережной А.С. Многокомпонентные системы окислов. -Киев: Наукова думка, 1970. -С. 141-143.
- Camara O.R. Electrochemical response of titanium and chromium mixed oxides on titanium substrates//J. ofElectroanalytical Chemistry.-1990.-V. 248.-№ i._p. 155-172.
- Metiko-Hukovi M., Ceraj-Ceri M. Investigations of chromium doped ceramic rutile electrodes//Materials Research Bulletin.-1988.-V. 23.-№ 11.-P. 1535-1544.
- Золотое Ю.А. Основы аналитической химии. -М.: Высшая школа, 1999. -351 с.
- Ковель Н.С., Викторов В.В., Евдокимов И.В., Фотиев А.А. Особенности образования твердых растворов (Crx Al1-x)2O3 при совместном прокаливании гидроксидов A1 и Сr//Изв. АН СССР. Неорганические материалы. -1989. -Т. 25. -№ 7. -С. 1160-1164.
- Моррисон С. Химическая физика поверхности твердого тела. -М.: Мир, 1980. -488 с.


