Особенности взаимодействия электронодонорных молекул с поверхностью кристаллических оксидов α-АL2О3, СR2О3 И АL/СR2О3. Модельные квантовохимические расчеты
Автор: Перминов В.Н., Литинский А.О.
Журнал: Математическая физика и компьютерное моделирование @mpcm-jvolsu
Рубрика: Химическая физика
Статья в выпуске: 8, 2004 года.
Бесплатный доступ
В рамках модели молекулярного кластера с замыканием нескомпенсированных валентностей атомами водорода и полуэмпирической расчетной схемы MNDO-PM/3 в валентном базисе с включением 3d-орбиталей атома хрома рассчитаны электронно-энергетические и ИК-спектроскопические характеристики поверхностных центров кристаллов α-Аl2О3, Сr2О3 и Аl/Сr2О3 с неполнокоординированными атомами Аl* и Сr* на поверхности, а также хемосорбционных комплексов молекул NH3, H2O, СН3ОН с этими центрами. Получены энергетические барьеры, отвечающие переходу недиссоциативной формы адсорбции этих молекул в диссоциативную. Обсуждены электронные и геометрические характеристики соответствующих переходных состояний, закономерности изменения теплот адсорбции, а также процесса поверхностной диссоциации (переноса протона с одного центра на другой) и характеристических колебательных частот в изучаемых рядах.
Короткий адрес: https://sciup.org/14968536
IDR: 14968536 | УДК: 541.183:541.5
Текст научной статьи Особенности взаимодействия электронодонорных молекул с поверхностью кристаллических оксидов α-АL2О3, СR2О3 И АL/СR2О3. Модельные квантовохимические расчеты
В рамках модели молекулярного кластера с замыканием нескомпенсированных валентностей атомами водорода и полуэмпирической расчетной схемы MNDO-PM/3 в валентном базисе с включением ЗсЛорбиталей атома хрома рассчитаны электронноэнергетические и ИК-спектроскопические характеристики поверхностных центров кристаллов а-А12О3, Сг2О3 и А1/Сг2О3 с неполнокоординированными атомами АГ и Сг' на поверхности, а также хемосорбционных комплексов молекул NH3, Н2О, СН3ОН с этими центрами. Получены энергетические барьеры, отвечающие переходу недиссоциативной формы адсорбции этих молекул в диссоциативную. Обсуждены электронные и геометрические характеристики соответствующих переходных состояний, закономерности изменения теплот адсорбции, а также процесса поверхностной диссоциации (переноса протона с одного центра на другой) и характеристических колебательных частот в изучаемых рядах.
Выяснение особенностей взаимодействия газофазных молекул различного типа с активными центрами поверхности оксидных кристаллов представляет существенный интерес для теории хемосорбции и гетерогенного катализа [1—3]. В этой связи представляется важным построение соответствующих моделей поверхностных центров твердых тел и хемосорбционных комплексов с дальнейшим их квантово-химическим расчетом. Ранее модели поверхностных центров оксидов непереходных элементов рассматривались в [2—4].
х
Рис. 1. Квазимолекулярные модели поверхностных центров кристаллов а-А12О3, Сг2О3, А1/Сг2О3, содержащих неполнокоординированные (электроноакцепторные) атомы металлов (АГ; Сг*) и атомы кислорода О’ или О’Н-группы на соседних центрах
В данной работе построены квазимолекулярные модели поверхности кристаллов оксидов а-А1,О, (корунд), Сг2О3 и смешанного оксида А1/Сг2О3 [5], в которых атомы металлов нахо- дятся в октаэдрических узлах кристаллической решетки (рис. 1). В них концевые атомы кислорода замыкались атомами водорода, которые, с одной стороны, моделируют влияние остатка кристалла, а с другой — их количество подбиралось таким образом, чтобы полное число валентных электронов кластера соответствовало количеству полностью заполненных орбита-лей атомов кислорода (полностью заполненные валентные зоны) [2—6]. В кластерах, содержащих атомы хрома сверх заполненной кислородной зоны, частично заполненными оказываются 3 J-орбитали атома хрома. Длины связей и валентные углы в рассматриваемых моделях были выбраны в соответствии с их средними значениями в данных кристаллических структурах [7— 8]. Расчеты выполнялись по методу MNDO-PM/З в валентном базисе с включением З^-орбиталей атомов хрома по программе [9—10].
Спектры одноэлектронных состояний для структур, моделирующих поверхности а-А12О3 и А1/Сг2О3, содержащие неполнокоординированные поверхностные атомы алюминия (структуры I—III; VII—IX), имеют следующие особенности: энергетические уровни группируются в зоны: а) отвечающие занятым состояниям, преимущественный вклад в которые вносят орбитали атомов кислорода (валентные зоны); б) соответствующие вакантным состояниям, преимущественный вклад в которые вносят орбитали атомов алюминия в «объеме кристалла» (зона проводимости); в) состоящие из локальных акцепторных уровней, лежащих в запрещенной зоне, преимущественный вклад в которые вносят орбитали неполнокоординированных атомов алюминия поверхности. Положение уровней последних характеризует способность соответствующих поверхностных центров к образованию хемосорбционных комплексов с электронодонорными молекулами газовой фазы. Для структур, моделирующих поверхность Сг2О3, спектр-одноэлект-ронных состояний, содержит полностью занятые состояния, соответствующие орбиталям атомов кислорода (валентная зона), две группы уровней, одна из которых занята электронами и лежит в запрещенной зоне, другая свободная, преимущественный вклад в которые вносят 3^-орбитали не полностью координированных атомов хрома на поверхности (d — зона, расщепленная на две подзоны).
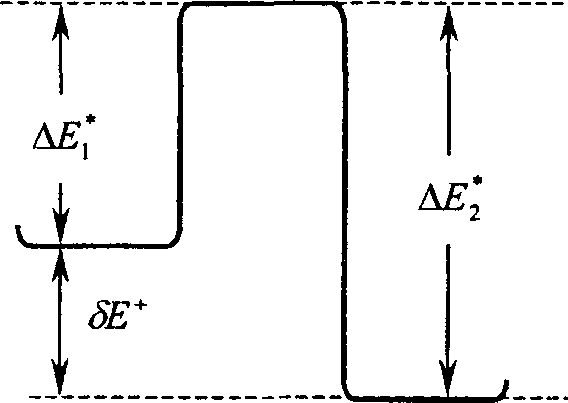
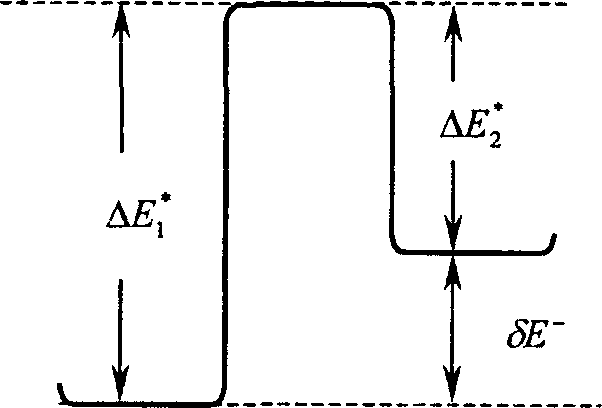
Нами рассчитаны хемосорбционные комплексы молекул NH3, Н2О и СН3ОН с М*-повер-хностными центрами вышеперечисленных структур (недиссоциативная форма адсорбции) с оптимизацией геометрии адсорбированных молекул. Через соответствующие переходные состояния эти формы адсорбции способны переходить в диссоциативные формы в результате переноса протона от молекулы на М*-центре к поверхностной группе соседнего центра. Результаты расчетов геометрических параметров и электронно-энергетических характеристик обеих форм адсорбции и структур переходных состояний, а также соответствующие схемы элементарных процессов приведены на рисунке 2 и в таблицах 1 и 2.
Е f Е t
(а) (с)
(Ь) Координата реакции
(а)
(с)
(Ь) Координата реакции
(А)
(В)
Рис. 2. Энергетические диаграммы элементарных актов процессов перехода недиссоциативной формы адсорбции (а) в диссоциативную (Ь) электронодонорных молекул NH3, Н2О, СН3ОН через переходное состояние (с) на поверхности изучаемых оксидов (А — экзотермический, Б — эндотермический процесс)
Следует отметить, что модели поверхности оксида алюминия I—III, оксида хрома IV—VI и смешанных оксидов VII—IX являются изоэлектронными в пределах каждой группы и отличаются типом состояния поверхностного атома металла. В пределах структур I—III недиссоциативная адсорбция NH3, Н2О, СН3ОН приводит к большему переносу электронной плотности с молекулы на поверхность для структуры II, по сравнению со структурой I, что свидетельствует о том, что соответствующий АГ-центр является более электроноакцепторным. Тепловой эффект процесса перехода недиссоциативной формы адсорбции в диссоциативную оказывается больше в случае структуры I.
Таблица 1
Длины связей в недиссоциативно адсорбированных комплексах, частоты валентных колебаний связей О-Н, N-H, М*-О, M*-N, перенос электронной плотности А$ с адсорбированной молекулы на поверхность, теплоты адсорбции AQ, частоты деформационных колебаний v5 и симметричных v колебаний аммиака, адсорбированного на поверхности, теплота реакции 8Е+ или 5Е~ (см. рис. 2), электронная плотность А^* на атоме водорода, ориентированного на соседний поверхностный центр
|
Структура |
Молекула адсорбата |
м* |
R(M’-O) R(M*- М),А |
R(C-O), A |
RIN-HI RIO-HI, A |
v(M*-oi v(M*-N), cm'1 |
v$, cm 1 |
v(N-H) v(O’-H), cm"1 |
v5, cm'1 |
V? |
M |
AS ккал моль |
5E1 ккал моль |
|
I |
МНз |
А1 |
2,07 |
1,08 |
129 |
3622 |
2495 |
1765 |
0,26 |
0,21 |
58,9 |
34,1 |
|
|
Н2О |
А1 |
1,96 |
1,07 |
275 |
2150 |
1665 |
0,09 |
0,35 |
35,2 |
58,5 |
|||
|
СН3ОН |
А1 |
1,95 |
1,39 |
1,06 |
310 |
2230 |
0,06 |
0,36 |
24,9 |
58,4 |
|||
|
И |
МНз |
А1 |
2,15 |
1,03 |
147 |
3645 |
3185 |
1755 |
0,26 |
0,15 |
20,0 |
-и,з |
|
|
Н2О |
А1 |
1,94 |
1,00 |
350 |
3390 |
1780 |
0,14 |
0,33 |
16,2 |
4,1 |
|||
|
СН3ОН |
AJ |
1,90 |
1,38 |
1,00 |
450 |
3230 |
0,10 |
0,32 |
5,2 |
9,2 |
|||
|
III |
МН3 |
А1 |
2,03 |
1,03 |
253 |
3636 |
3119 |
1758 |
0,28 |
0,13 |
33,9 |
-22,4 |
|
|
Н2О |
А1 |
1,93 |
1,00 |
405 |
3430 |
1770 |
0,15 |
0,32 |
17,8 |
0,7 |
|||
|
СНзОН |
А1 |
1,89 |
1,38 |
0,99 |
460 |
3290 |
0,13 |
0,32 |
2.5 |
4,7 |
|||
|
IV |
МНз |
Сг |
1,97 |
1,01 |
663 |
3480 |
3270 |
1770 |
0,63 |
0,00 |
51,8 |
-15,4 |
|
|
Н2О |
Сг |
2,02 |
0,99 |
550 |
3490 |
1700 |
0,39 |
0,28 |
35,3 |
19,0 |
|||
|
СНзОН |
Сг |
2,07 |
1,42 |
0,98 |
430 |
3590 |
0,95 |
0,25 |
24,1 |
4,3 |
|||
|
V |
МНз |
Сг |
1,93 |
1,01 |
738 |
3560 |
3365 |
1760 |
0,68 |
-0,05 |
30,2 |
-28,5 |
|
|
Н2О |
Сг |
1,99 |
0,95 |
570 |
3770 |
1630 |
0,36 |
0,28 |
10,0 |
-7,8 |
|||
|
СНзОН |
Сг |
2,04 |
1,43 |
0,97 |
540 |
3710 |
0,23 |
0,28 |
-26,3 |
2,3 |
|||
|
VI |
МНз |
Сг |
1,99 |
1,02 |
828 |
3640 |
3300 |
1720 |
0,64 |
0,2 |
43,6 |
-35,9 |
|
|
Н2О |
Ст |
2,02 |
0,99 |
530 |
3405 |
1680 |
0,39 |
0,29 |
11,1 |
5,6 |
|||
|
СНзОН |
Сг |
2,11 |
1,41 |
0,97 |
320 |
3640 |
0,34 |
0,26 |
38,3 |
2,3 |
|||
|
VII |
МНз |
А1 |
2,22 |
1,02 |
157 |
3650 |
3265 |
1750 |
0,25 |
0,11 |
10,0 |
-21,3 |
|
|
Н2О |
А1 |
1,99 |
0,98 |
250 |
3480 |
1730 |
0,15 |
0,31 |
10,3 |
-6,5 |
|||
|
СНзОН |
А1 |
2,08 |
1,39 |
0,98 |
170 |
3505 |
0,10 |
0,31 |
9,2 |
-3,4 |
|||
|
VIII |
МНз |
А1 |
2,08 |
1,03 |
197 |
3650 |
3170 |
1770 |
0,28 |
0,15 |
23,0 |
-0,6 |
|
|
Н2О |
А1 |
1,97 |
0,99 |
280 |
3400 |
1750 |
0,14 |
0,33 |
18,4 |
8,0 |
|||
|
СНзОН |
А1 |
2,13 |
1,39 |
0,90 |
260 |
3360 |
0,14 |
0,35 |
1,0 |
19,9 |
|||
|
IX |
МНз |
А1 |
2,11 |
1,02 |
296 |
3660 |
3330 |
1755 |
0,28 |
0,10 |
14,4 |
-35,0 |
|
|
Н2О |
А1 |
1,96 |
0,98 |
320 |
3640 |
1770 |
0,16 |
0,29 |
9,3 |
-16,0 |
|||
|
СНзОН |
А1 |
2,45 |
1,39 |
0,96 |
356 |
3605 |
0,14 |
0,26 |
-1,0 |
-15,0 |
|||
|
X |
МНз |
Сг |
2,02 |
1,02 |
680 |
3550 |
3310 |
1780 |
0,62 |
0,05 |
37,4 |
-26, |
|
|
Н2О |
Сг |
2,02 |
0,99 |
555 |
3420 |
1660 |
0,37 |
0,28 |
18,3 |
-0,2 |
|||
|
СНзОН |
Сг |
2,02 |
1,42 |
0,99 |
470 |
3355 |
0,34 |
0,29 |
4,5 |
10,8 |
Что касается барьеров перехода недиссоциативной формы адсорбции в диссоциативную, то в тех случаях, когда переходное состояние (седловая точка на поверхности потенциальной энергии) было найдено, в соответствии с данными таблицы 2, величины ДЕ*, для всех электронодонорных молекул уменьшаются в рядах (IV—VI) и (VII—VIII). В такой же последовательности уменьшаются тепловые эффекты соответствующих превращений, что находится в согласии с принципом Белла-Эванса-Поляни [11]. Что касается структур II и III, то для случая адсорбции аммиака ДЕ’ДП) < АЕ’/Ш), в то время как для воды ДЕуП) > АЕ’ДШ). Следует отметить, что для всех найденных структур переходных состояний электронная плотность Д$*н на атоме водорода заметно меньше величины Адн, по сравнению со структурами, отвечающими диссоциативной и недиссоциативной формам адсорбции, причем \qH для всех типов центров убывает в ряду МН3-»Н2О->СН3ОН. В такой же последовательности изменяются величины переноса заряда ^q (молекула -» М*) в комплексах, отвечающих недиссоциированной форме адсорбции. Кроме того, изданных таблицы 2 видно, что в случае экзотермической реакции седловая точка находится во входном канале реакции, а в случае эндотермической реакции — в выходном [12]. Однако в некоторых случаях такая закономерность нарушается. Это характерно для комплексов, где активным центром является атом хрома.
Таблица 2
Длины связей R(O-H), R(N-H) и R(O’-H), энергии активации ДЕ*,и АЕ*2 прямого и обратного процессов, электронная плотность А^ на атоме водорода, ориентированного на соседний центр, в структурах, соответствующих переходным состояниям
|
Структура |
Молекула адсорбата |
R(O-H) R(N-H), А |
R(O’-H), А |
А5,‘ ккал моль |
ае2* ккал моль |
Их |
|
II |
МН3 |
1,42 |
1,29 |
18,7 |
6,0 |
0,30 |
|
н2о |
1,24 |
1,27 |
5,9 |
10,0 |
0,35 |
|
|
СН3ОН |
1,26 |
1,33 |
6,0 |
15,2 |
0,36 |
|
|
III |
NH3 |
1,45 |
1,26 |
27,5 |
5,1 |
0,30 |
|
Н2О |
1,25 |
1,21 |
3,7 |
4,4 |
0,35 |
|
|
IV |
NH3 |
1,54 |
1,16 |
40,2 |
24,8 |
0,29 |
|
Н2О |
1,23 |
1,23 |
21,4 |
40,4 |
0,36 |
|
|
СН3ОН |
1,32 |
1,26 |
11,2 |
15,6 |
0,38 |
|
|
V |
Н2О |
1,14 |
1,23 |
13,7 |
5,9 |
0,33 |
|
СН3ОН |
1,26 |
1,23 |
8,0 |
10,3 |
0,34 |
|
|
VI |
Н2О |
1,19 |
1,18 |
8,0 |
13,6 |
0,32 |
|
СНзОН |
1,18 |
1,23 |
3,9 |
6,2 |
0,33 |
|
|
VII |
NH3 |
1,56 |
1,29 |
29,3 |
8,0 |
0,35 |
|
Н2О |
1,44 |
1,37 |
22,0 |
15,5 |
0,41 |
|
|
СН3ОН |
1,43 |
1,41 |
18,5 |
13,8 |
0,43 |
|
|
VIII |
NH3 |
1,53 |
1,36 |
21,6 |
8,9 |
0,35 |
|
Н2О |
1,46 |
1,53 |
10,0 |
18,0 |
0,43 |
|
|
СНзОН |
1,40 |
1,57 |
2,3 |
22,2 |
0,44 |
|
|
X |
NH3 |
1,39 |
1,26 |
14,2 |
9,1 |
0,26 |
Частота деформационных колебаний v6 адсорбированной молекулы аммиака монотонно убывает в структурах (I—III) и (IV—VI), а частота валентных симметричных колебаний vs соответственно возрастает. В смешанных оксидах (VII—IX) максимальная частота v6 и vs наблюдается в структуре VIII. Частота асимметричных валентных колебаний v^N-H) является характеристической и отвечает колебаниям связи N-H, ориентированной в сторону атома кислорода на соседнем центре. Она заметно ниже частоты симметричных колебаний vs и коррелирует с длиной связи R(N-H). Частоты v5 и vs адсорбированной молекулы аммиака в целом значительно ниже соответствующих частот изолированной молекулы (v5 = 1760 см-1, v = 3660 см-1). Следует отметить, что в структуре I частота v^N-H) существенно меньше, чем в структурах II и III, а длина связи R(N-H) несколько больше. Это можно объяснить образованием водородной связи атома водорода молекулы аммиака с атомом кислорода на соседнем центре. По-видимому, по этой же причине частота колебаний v(Al-NH3) в структуре I оказывается существенно меньше по сравнению с аналогичными частотами в структурах II и III. Частота v(M*-NH3) возрастает в 2 + 2,5 раза при переходе от структур (I—III) и (VII—IX), где активным центром является атом алюминия, к структурам (IV—VI), где активный центр — атом хрома. Отметим, что полученные результаты качественно согласуются с экспериментальными данными [13]. При этом перенос заряда \q с NH3 на поверхность увеличивается более чем в 2 раза, а частоты симметричных и деформационных колебаний адсорбированной молекулы аммиака уменьшаются. Длина связи R(M*-N), соответственно, уменьшается на 0,1 -^ 0,2 А. Отметим также, что в смешанных оксидах длина связи A1-N в среднем больше на 0,5 А, по сравнению с длиной связи A1-N в случае А12О3. Частота колебаний связи v(Al-NH3) монотонно возрастает в ряду (I—III).
Что касается молекулы спирта, то частота колебаний v(AT-O) и частота валентных характеристических колебаний v(O-H) значительно ниже для структуры I, по сравнению с II и III, а длины связей R(AT-O) и R(O-H) несколько больше. Это можно объяснить, как и для случая с аммиаком, образованием водородной связи атома водорода молекулы спирта с кислородом на соседнем центре.
В структурах (IV—VI), где поверхностным центром является атом хрома, частота колебаний v(O-H) заметно выше, по сравнению с (I—III). В ряду IV—VI частота колебаний v(Cr'-O) на 100-г 150 см-1 меньше в структуре VI, по сравнению с IV и V, а длина связи R(Cr'-O) на 0,05 А, соответственно, больше. В смешанных оксидах частота колебаний связи v(Al’-O) значительно меньше, чем в структурах (I—III) и (IV—VI), а длина связи R(Al’-O) в среднем заметно больше. Следует отметить, что частота валентных колебаний связи v(O-H) = 3890 см-1 в изолированной молекуле спирта в целом значительно больше соответствующей частоты в адсорбированной молекуле.
Расчет показал, что при адсорбции молекулы воды на поверхности А12О3 (I—III), длина связи R(M*-O) в среднем на 0,03 А меньше, чем при адсорбции на смешанном оксиде Сг/А12О3 (VII—IX), а частота колебаний связи v(M*-O), соответственно, больше на » 50 см-1. В структуре I для недиссоциированной адсорбции молекулы воды, как и в случае адсорбции молекулы аммиака и спирта, наблюдается значительное уменьшение частоты валентных колебаний v(O-H) связи, ориентированной к соседнему центру, что можно объяснить образованием водородной связи атома Н с атомом О на соседнем центре. Для недиссоциативно адсорбированной молекулы воды в структуре (IV—VI), где активным поверхностным центром является атом хрома, частота деформационных колебаний v5 молекулы Н2О уменьшается примерно на 100 см-1, длина связи увеличивается « на 0,02 -^ 0,04 А, а перенос заряда с молекулы Н2О на поверхность возрастает в2т 3 раза, и частота колебаний связи v(M’-O) возрастает приблизительно в 1,5 -^ 2 раза, по сравнению со структурами (I—III) и (VII—IX), где поверхностный центр — атом алюминия.
Отметим также, что при переходе от АГ к Сг'-центру перенос заряда Д^ с адсорбированной молекулы спирта возрастает примерно в 3 раза, частота v(C-O) уменьшается, а длина связи R(C-O) увеличивается. Таким образом, упрочнение связи адсорбата с поверхностью сопровождается ослаблением химических связей в молекуле адсорбата. Аналогичная картина имеет место в случае адсорбции воды на АГ и Cr'-центрах поверхности Сг/А12О3 в структурах IX и X. Расчет теплоты AQ комплексообразования для структур IX и X показал, что в смешанном оксиде Сг/А12О3 энергетически выгодной является хемосорбция на Cr’-центре для всех исследованных в данной работе молекул.
Подчеркнем также, что приведенные в данной работе расчеты подтверждают общепринятый вывод о том, что при хемосорбции химические связи ослабевают как в адсорбированной молекуле, так и между атомами поверхностного слоя (компенсационный механизм Хофмана [15]), что облегчает соответствующие элементарные процессы с участием поверхностных центров.
Список литературы Особенности взаимодействия электронодонорных молекул с поверхностью кристаллических оксидов α-АL2О3, СR2О3 И АL/СR2О3. Модельные квантовохимические расчеты
- Моррисон С. Химическая физика поверхности твердого тела. М.: Мир, 1980. 488 с.
- Дункен X., Лыгин В.И. Квантовая химия адсорбции на поверхности твердых тел. М.: Мир, 1980. 228 с.
- Михейкин И.Д. Квантовохимические расчеты хемосорбции и поверхностных реакций: Дис.... д-ра хим. наук. М.: ИХФ АН СССР, 1982. 276 с.
- Литинский А.О. Квазимолекулярные модели хемосорбции и поверхностных структур: Дис.... д-ра хим. наук. М.: Изд-во МГУ, 1987. 251 с.
- Knözinger H., Ratnasamy Р.//Catal. Rev. Eng. Sci. 1978. V. 17. № 1. P. 31-70.
- Эварестов Р.А. Квантовохимические методы в теории твердого тела. Л.: Изд-во ЛГУ, 1982.279с.
- Кребс Г. Основы кристаллохимии неорганических соединений. М.: Мир, 1971. 234 с.
- Пенкаля Т. Очерки кристаллохимии. Л.: Химия, 1974. 496 с.
- Dewar M.J.S, Thiel W.//1. Amer. Chem. Soc. 1977. V. 99. № 15. P. 4899.
- Stewart J.J.P.//J. Comput. Chem. 1989. V. 10. № 2. P. 209.
- Дьюар М. Теория молекулярных орбиталей в органической химии. М.: Мир, 1972. 590 с.
- Минкин В.И., Симкин Б.Я., Миняев P.M. Теория строения молекул. Ростов н/Д: Феникс, 1997. 560 с.
- Давыдов А.А. ИК-спектроскопия в химии поверхности окислов. Новосибирск: Наука. Сиб. отд-ние, 1984. 245 с.
- Литтл Л. Инфракрасные спектры адсорбированных молекул. М.: Мир, 1969. 514 с.
- Хофман Р. Строение твердых тел и поверхностей. М.: Мир, 1990. 215 с.


