Остеоинтегративные характеристики и биологическая совместимость имплантатов из циркониевой керамики при восполнении диафизарных дефектов
Автор: Волокитина Е.А., Саушкин М.В., Антропова И.П., Кутепов С.М., Бриллиант С.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.31, 2025 года.
Бесплатный доступ
Введение. Разработка новых керамических материалов, обладающих высокими остеоинтегративными характеристиками, и экспериментальное обоснование их применения является актуальной проблемой для современной травматологии. Цель работы — определение остеоинтегративных характеристик и биологической совместимости имплантатов из новой циркониевой керамики при восполнении диафизарных дефектов костной ткани в эксперименте. Материалы и методы. Исследование выполнено на 18 самцах кроликов породы Шиншилла. Животным моделировали диафизарный дефект с интрамедуллярной имплантацией стержня из нового керамического пористого (ПК), непористого (НПК) материала и титанового сплава (ТС). В зависимости от вида стержня животные были разделены на три группы (по шесть в каждой). Гематологические показатели животных определяли за сутки до операции, и через восемь недель после операции перед выведением животных из эксперимента. Рентгенографию задних конечностей, забор тканей для гистологического и морфометрического исследования выполняли после выведения животных из эксперимента. Статистическую обработку данных проводили с использованием программы Statistica 10. Для сравнения исследуемых групп использовали критерий Краскела – Уоллиса с последующим межгрупповым анализом. Для оценки изменений в динамике в отдельных группах использовали критерий Вилкоксона. Результаты представлены как медиана и интерквартильный размах. Результаты. Через восемь недель после операции уровень лейкоцитов, моноцитов и гранулоцитов был существенно ниже в группе ПК по сравнению с группами НПК и ТС (p = 0,025; p = 0,022; p = 0,005 соответственно). Толщина костной трабекулы в области имплантации в группе ПК была существенно выше по сравнению с группами ТС и НПК (86,2 [55,8; 109,9], 56,0 [47,2; 75,9] и 33,1 [19,0; 84,5] соответственно, в обоих случаях p < 0,001). Обсуждение. Нами изучена биологическая совместимость и остеоинтегративные характеристики имплантатов из нового керамического материала в двух вариантах, — непористый и пористый (с размером пор 10–50 мкм), проведено сравнение с имплантами из титанового сплава. Ранее доказано, что легированные керамические материалы привлекательны для регенерации тканей благодаря функциональным свойствам, биологической активности и терапевтическим эффектам, обеспечиваемым вводимыми ионами. Результаты наших гистологических и морфометрических исследований подтвердили лучшую биологическую совместимость и остеоинтеграцию имплантатов из пористой циркониевой керамики (ПК), содержащей ионы иттрия, иттербия, гадолиния, в сравнении с имплантатами из НПК и ТС. Заключение. Установлена биологическая совместимость нового керамического материала при восполнении диафизарных дефектов костной ткани в эксперименте с животными. Имплантаты с размерами пор 10–50 мкм обладают хорошими остеоинтегративными характеристиками, что определяет возможность и необходимость проведения клинических испытаний.
Диафизарные дефекты костной ткани, имплантат, циркониевая керамика, биологическая совместимость, остеоинтеграция, эксперимент
Короткий адрес: https://sciup.org/142244812
IDR: 142244812 | УДК: [616.718.5/.6-007.24-089.227.84:004.9]-089.168 | DOI: 10.18019/1028-4427-2025-31-3-350-360
Текст научной статьи Остеоинтегративные характеристики и биологическая совместимость имплантатов из циркониевой керамики при восполнении диафизарных дефектов
В 2020 г., в мирное время, в России зарегистрировано более 11 млн. переломов, полученных при несчастных случаях, костная травма верхних конечностей в структуре травм, отравлений и других последствий воздействия внешних причин составила 34,6 %, нижних конечностей — 33,2 %, злокачественные новообразования костной ткани — 4,2 % от всех онкологических заболеваний [1]. Частота повреждений конечностей в ходе военных конфликтов последнего десятилетия превышает 60–70 % и не имеет тенденции к снижению, при этом повреждения нижних конечностей с нарушением целостности кости и опорной функции встречаются в два разе чаще, чем верхних [2]. Наличие костного дефекта является причиной длительного, порою неэффективного лечения и приводит к стойкой инвалидизации пострадавших [3]. Для восполнения диафизарных дефектов применяют различные методики ауто-и аллопластики в комбинации в закрытым интрамедуллярным остеосинтезом титановым стержнем и чрескостным дистракционным остеосинтезом, а также комбинации технологий костной пластики по Илизарову и Masquelet [4].
Травматолог-ортопед должен располагать достаточным количеством имплантов/аугментов различного дизайна, а также разнообразным арсеналом костно-пластического и остеозамещающего материала для лечения пострадавших с патологическим ортопедическим симптомокомплексом и критическими дефектами костной ткани, сформировавшимися в результате высокоэнергетической и огнестрельной травмы. Аутокость, аллотрансплантаты и деминерализованный матрикс в качестве остеозамещающего материала не применимы при обширных дефектах, имеются риски воспаления донорского ложа, иммунной реакции реципиентов и отторжения чужеродного импланта [5]. Требуются специальные биоинертные прочные материалы и конструкции из керамики и титана с высокими остеоинтегратив-ными характеристиками, которые позволят воссоздать не только форму утраченного костного фрагмента, но и восстановить опорную функцию конечности в целом [6, 7].
Применение искусственных остеозамещающих биоматериалов имеет преимущества благодаря совместимости с аутологичной костью, удобству моделирования и возможностью их использования в больших объемах [8]. Биокерамика нашла широкое применение в оперативной травматологии и ортопедии [6]. В России и за рубежом успешно применяются различные виды керамики на основе фосфата кальция, как наиболее близкие по составу и строению к костной ткани человека [9], а также циркониевая керамика в силу своей инертности к тканям организма и хороших механических характеристик [10]. Кроме того, показано положительное влияние циркония на остеобласты [11]. Активно проводятся исследования, посвященные модификации химической структуры остеозамещающих материалов для оптимизации их биоинтеграционных и физических характеристик [12]. В частности, введение в циркониевую керамику редкоземельных элементов оказывают значительное влияние на коррозионную стойкость композитов [13], на ингибирование экспрессии генов, специфичных для остеокластов [14].
В связи с тем, что разработка новых керамических материалов, обладающих высокими остеоинте-гративными характеристиками, и экспериментальное обоснование их применения при восполнении диафизарных дефектов является актуальной проблемой современной травматологии, в ООО «Микроакустика» разработан новый керамический материал, — циркониевая керамика, стабилизированная иттрием, иттербием и гадолинием Zr9Y5Yb5Gd (ТУ-20.12.19.001-20883295-2020). Керамический материал обладает коррозионной и эрозионной стойкостью, износостойкостью, устойчив к окислению и высокотемпературной стерилизации.
Цель работы — определение остеоинтегративных характеристик и биологической совместимости имплантатов из новой циркониевой керамики при восполнении диафизарных дефектов костной ткани в эксперименте.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы для тестирования
Исследовали новый керамический материал, – циркониевую керамику, стабилизированную иттрием, иттербием и гадолинием. Образцы изготавливали методом холодного прессования с последующим спеканием в атмосферной печи. После спекания производили окончательную механообработку. Образцы керамического материала подготовлены двух типов: непористой и пористой (размер пор 10–50 мкм) структур. Стержни для синтеза перелома (интрамедуллярной имплантации) длиной 50 мм с круглым сечением диаметром 5 мм изготавливали из пористого и непористого материала. Стержни аналогичного размера изготовлены из медицинского сплава на основе титана.
Экспериментальные животные
Исследование выполнено на 18 самцах кроликов породы Шиншилла массой 3–3,5 кг. Животные находились в идентичных условиях кормления и содержания (виварий Уральского государственного медицинского университета). Все животные имели ветеринарный сертификат качества и состояния здоровья. Протокол использования и ухода за животными соответствовал «Методическим рекомендациям по содержанию лабораторных животных в вивариях научно-исследовательских институтов и учебных заведений» РД-АПК 3.10.07.02-09 и «Директиве 2010/63/EU Европейского Парламента и Совета Европейского Союза по охране животных». Исследование одобрено локальным этическим комитетом Уральского государственного медицинского университета, протокол от 20.05.2020 № 5.
Моделирование диафизарного дефекта с интрамедуллярной имплантацией стержня
Всем животным проводили билатеральное моделирование диафизарного дефекта бедренных костей с билатеральным интрамедуллярным остеосинтезом стержнями. В соответствии с дизайном исследования животные разделены на три группы (по шесть в каждой). В правую и левую бедренные кости в первой группе имплантировали стержни из непористой керамики (НПК), во второй — из пористой керамики (ПК), в третьей группе — из титанового сплава (ТС).
Под внутривенным наркозом костномозговой канал бедренной кости в межмыщелковой области ретроградно рассверливали, устанавливали в канал стержень из остеозамещающего материала. Далее по наружной поверхности бедра выполняли линейный разрез кожи и фасции, между мышцами послойно осуществляли доступ к диафизу бедренной кости, на границе средней и нижней трети которого путем двойной циркулярной остеотомии формировали костный дефект диафиза в виде цилиндра длиной 10 мм, который был перекрыт стержнем из остеозамещающего материала, ретроградно установленным в костно-мозговом канале на первом этапе хирургического вмешательства. Рану послойно ушивали. Выведение животных из эксперимента, рентгенографию задних конечностей и забор тканей проводили через восемь недель после операции.
Гематологические исследования
Образцы крови отбирали из краевой вены уха кроликов в стандартные пробирки для лабораторных исследований за сутки до операции, и через восемь недель после операции перед выведением животных из эксперимента. Гематологические показатели определяли на автоматическом гематологическом анализаторе Cell-70 (Biocode-Hygel, France). Исследование выполняли в соответствии с протоколом, рекомендованным производителем прибора.
Гистологические исследования периимплантной костной ткани
Каждый образец бедренных костей лабораторных животных, очищенных от мягких тканей, фиксировали путем погружения в 10 % забуференный формальдегид при комнатной температуре в течение минимум семи дней. После фиксации образцы декальцинировали в течение 48 часов в растворе соляной (11,5 ± 0,5 %) и муравьиной (5,8 ± 0,3 %) кислот, который заменяли каждые 24 часа. Декальцинированные образцы с частично растворенными и извлеченными керамическими образцами, а также с извлеченными титановыми имплантатами разрезали с формированием двух пластин толщиной от 2 до 4 мм на уровне диафиза. Полученные пластины обезвоживали в этаноле восходящей крепости и заливали в парафин с формированием блоков. Изготавливали срезы парафиновых блоков толщиной от 3 до 4 мкм, материал окрашивали гематоксилином и эозином. Гистологическое и морфометрическое исследование осуществляли при помощи микроскопа Olympus CX-41, камеры Levenhuk M1000 PLUS. Измерения проводили в программе Phenix Phmias 3.0.6731. Гистоморфологическое определение толщины костной трабекулы выполняли в периимплантной области (10 измерений на образец, 60 измерений на исследуемую группу). Протяженность поверхности костных трабекул (ППКТ), формируемых в области имплантата, суммарную протяженность поверхности остеобластов (ППОБ) и суммарную протяженность поверхности остеокластов (ППОК), расположенных на поверхности этих трабекул, измеряли в микрометрах (мкм) на цифровых изображениях гистологических препаратов, отснятых при общем увеличении 400× (окуляр — 10×, объектив — 40×). Измерения выполняли не менее чем в 20 полях зрения от одного случая. Далее рассчитывали относительные показатели, — процентную долю протяженности каждого из обозначенных типов клеток. За 100 % принимали протяженность трабекулы. Вычисление проводили по формулам:
%ППОБ = ППОБ (мкм) × 100 % / ППКТ (мкм);
%ППОК = ППОК (мкм) × 100 % / ППКТ (мкм).
Статистическую обработку данных проводили методами вариационной статистики с использованием программы Statistica 10. Для сравнения исследуемых групп использовали критерий Краскела – Уоллиса с последующим межгрупповым анализом. Для оценки изменений в динамике (до операции и через восемь недель после операции) в отдельных группах использовали критерий Вилкоксона для сравнения двух связанных (зависимых) выборок. Уровень р < 0,05 принимали статистически значимым. Данные представлены как медиана [интерквартильный размах].
РЕЗУЛЬТАТЫ
Спустя восемь недель после имплантации исследуемых материалов проведена рентгенография таза и обеих задних конечностей исследуемых животных (рис. 1). По данным рентгенографии область диафизарного дефекта перекрыта керамическим имплантатом, установленным интрамедуллярно с плотным прилеганием к костной ткани на отдельных участках. Линии остеотомии не прослеживаются, кортикальные пластинки в области ранее сформированного костного дефекта замкнуты. Целостность бедренной кости восстановлена.
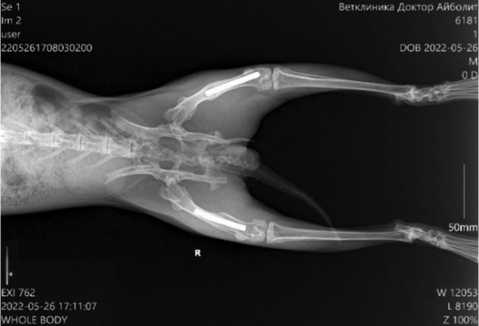
Рис. 1. Рентгенография таза и обеих задних конечностей кролика в прямой проекции с имплантированными керамическими стержнями (пористая керамика) через восемь недель после операции
Результаты определения гематологических параметров кроликов до операции и через восемь недель после операции представлены в табл. 1. До операции между группами не выявлено существенных различий ни по одному из определяемых показателей.
Таблица 1
Гематологические показатели кроликов до и после операции
|
Показатель |
Срок |
Гематологические показатели в группах исследования |
|||
|
Титан (ТС) |
Непористая керамика (НПК) |
Пористая керамика (ПК) |
p 1 |
||
|
Лейкоциты, ×109/л |
1 |
9,4 [8,0; 11,1] |
9,9 [8,0; 10,7] |
9,4 [8,0; 12,4] |
0,932 |
|
2 |
11,8 [10,2; 13,00] |
11,7 [11,1; 12,4] |
7,6 [6,9; 8,1] |
0,021 |
|
|
p 2 |
0,138 |
0,028 |
0,028 |
||
|
Лимфоциты, ×109/л |
1 |
5,3 [4,8; 5,6] |
5,7 [5,1; 7,1] |
4,9 [4,1; 6,5] |
0,301 |
|
2 |
6,8 [6,3; 8,3] |
6,60[5,9; 6,8] |
4,6 [4,5; 7,2] |
0,103 |
|
|
p 2 |
0,043 |
0,686 |
0,675 |
||
|
Моноциты, ×109/л |
1 |
0,3 [0,2; 0,3] |
0,3 [0,2; 0,3] |
0,3 [0,2; 0,4] |
0,888 |
|
2 |
0,4 [0,2; 0,5] |
0,3 [0,3; 0,3] |
0,2 [0,2; 0,2] |
0,043 |
|
|
p 2 |
0,361 |
0,068 |
0,285 |
||
|
Гранулоциты, ×109/л |
1 |
3,8 [3,0; 5,4] |
4,0 [2,8; 3,5] |
4,7 [3,9; 5,4] |
0,243 |
|
2 |
4,2 [4,0; 4,7] |
5,2 [4,2; 5,4] |
2,7 [2,4; 3,4] |
0,005 |
|
|
p 2 |
0,686 |
0,028 |
0,028 |
||
|
Эритроциты, ×1012/л |
1 |
6,68 [6,39; 6,93] |
6,90 [6,69; 7,17] |
6,67 [6,42; 6,78] |
0,368 |
|
2 |
6,83 [6,75; 7,69] |
6,82 [6,55; 7,05] |
6,94 [6,52; 7,74] |
0,816 |
|
|
p 2 |
0,345 |
0,463 |
0,345 |
||
|
Гемоглобин, г/л |
1 |
144 [142; 148] |
147 [144; 150] |
145 [140; 148] |
0,526 |
|
2 |
150 [141; 152] |
146 [134; 149] |
148 [147; 152] |
0,684 |
|
|
p 2 |
0,686 |
0,295 |
0,281 |
||
|
Гематокрит, % |
1 |
41,8 [40,5; 41,9] |
42,4 [41,3; 42,8] |
41,3 [40,9; 42,8] |
0,613 |
|
2 |
43,7 [43,2; 44,0] |
42,5 [41,0; 43,6] |
42,9 [41,6; 43,1] |
0,459 |
|
|
p 2 |
0,225 |
0,917 |
0,116 |
||
|
Средний объем эритроцита, фл |
1 |
63,2 [62,7; 63,6] |
63,2 [61,9; 66,4] |
63,3 [62,5; 63,8] |
0,927 |
|
2 |
63,1 [62,4; 64,0] |
62,1 [61,0; 62,6] |
63,2 [61,2; 64,0] |
0,479 |
|
|
p 2 |
0,178 |
0,116 |
0,463 |
||
|
Тромбоциты, ×109/L |
1 |
372 [341; 429] |
491 [473; 575] |
429 [392; 508] |
0,150 |
|
2 |
647 [433; 700] |
636 [473; 836] |
496 [393; 593] |
0,264 |
|
|
p 2 |
0,043 |
0,046 |
0,249 |
||
|
Средний объем тромбоцита, фл |
1 |
5,2 [4,8; 5,5] |
5,5 [5,1; 6,0] |
5,5 [5,2; 5,8] |
0,498 |
|
2 |
5,1 [5,1; 5,4] |
5,3 [4,9; 6,0] |
5,2 [5,0; 5,9] |
0,963 |
|
|
p 2 |
0,500 |
0,465 |
0,753 |
||
|
Тромбокрит, % |
1 |
0,19 [0,18; 0,24] |
0,27 [0,23; 0,35] |
0,24 [0,22; 0,25] |
0,095 |
|
2 |
0,32 [0,23; 0,36] |
0,32 [0,28; 0,50] |
0,29 [0,21; 0,30] |
0,610 |
|
|
p 2 |
0,043 |
0,028 |
0,249 |
||
Примечание : 1 — до операции; 2 — восемь недель после операции; p 1 — тест Краскела – Уоллеса; p 2 — тест Вилкоксона.
Через восемь недель после операции уровень лейкоцитов, моноцитов и гранулоцитов был существенно ниже в группе ПК. При этом отмечено, что если в группе НПК спустя два месяца после хирургического вмешательства уровень лейкоцитов и гранулоцитов демонстрировал существенное повышение относительно исходного уровня, то в группе ПК наблюдалось значительное снижение данных показателей. По уровню лимфоцитов существенных различий между группами не выявлено, хотя тенденция к более низким значениям в группе ПК присутствует и для этого показателя. По количеству эритроцитов, уровню гемоглобина, объему эритроцитов существенных различий между изучаемыми группами не обнаружено. В тромбоцитарном звене крови значимых различий между группами также не выявлено. Вместе с тем, в группах ТС и НПК наблюдали существенное повышение относительно исходного уровня количества тромбоцитов и тромбокрита, что, по-видимому, связано с сохранением умеренного реактивного тромбоцитоза. В группе ПК количество тромбоцитов не отличался от дооперационного уровня.
Гистоморфометрическая оценка остеоинтегративных характеристик имплантатов
Исследования остеоинтеграции в группе ТС показало, что вокруг имплантата формировался непрерывный тяж трабекулярной кости, представленный как пластинчатой, так и ретикулофиброзной костной тканью (рис. 2, а). На внутренней, обращенной к имплантату стороне трабекул, визуализировали активные и покоящиеся остеобласты (рис. 2, в). В некоторых небольших по протяженности участках обнаруживали рыхлую волокнистую соединительную ткань с умеренно расширенными, заполненными эритроцитами микрососудами (рис. 2, б). Визуализировали частицы имплантационного материала от 1 до 7 мкм и единичные участки с повышенным скоплением клеток моноцитарно-макрофагального дифферона с признаками фагоцитоза (рис. 2, в). Обнаруживали локальные воспалительные инфильтраты. На поверхности костной ткани выявлены немногочисленные резорбционные полости с остеокластами, в отдельных полостях отмечали активный остеогенез и остеобласты с аморфным костным веществом вокруг них. Между костным слоем вокруг имплантата и компактной пластинкой значительное место занимал гемопоэтический жировой костный мозг. Микроциркуляторное русло в области костного мозга представлено преимущественно расширенными тонкостенными капиллярами синусоидного типа с признаками эритростаза. В компактной пластинке отмечены умеренные реактивные изменения. Для нее характерно утолщение линий склеивания, расширение гаверсовых каналов остеонов (рис. 2,а). В большинстве гаверсовых и фолькмановых каналов обнаружены кровеносные микрососуды с расширенными просветами, окруженные слоем рыхлой волокнистой соединительной ткани (рис. 2, г). На эндостальной и периостальной поверхностях пластинки определяли небольшие по объему наслоения частично компактизированного губчатого костного вещества. В межтрабекулярных промежутках обнаруживали васкуляризированную рыхлую соединительную ткань (рис. 2, а). Остеокластическая резорбция — слабая. Имеются признаки реактивной репаративной перестройки материнской кости на фоне вялотекущего хронического асептического воспаления вследствие слабо выраженного металлоза в периимплантационной зоне. Относительная протяженность поверхности остеобластов — 57,47 %, относительная протяженность поверхности остеокластов — 4,5 %. В целом, отмечена остеоинтеграция имплантата, применяемый материал не вызвал выраженного негативного влияния на ткани компактной пластинки и костного мозга.
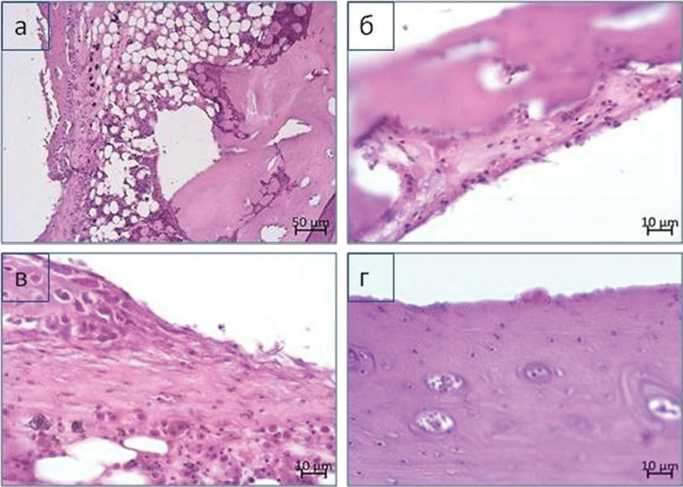
Рис. 2. Особенности гистологического строения тканей в области имплантации ТС:
а — формирование костной «муфты» трабекулярного строения вокруг имплантата;
б — волокнистая соединительная ткань на поверхности трабекулярной кости со стороны, прилегающей к имплантату, на поверхности костных трабекул видны остеокласты;
в — участок рыхлой волокнистой соединительной ткани в межтрабекулярной зоне с признаками имбибиции имплантационного материала и локального очага воспаления;
г — компактная пластинка с расширенными гаверсовыми каналами и расширенными полнокровными микрососудами. Парафиновый срез. Окраска гематоксилином и эозином. Ув. 100 (а), ув. 400 (б–г)
В группе НПК гистоморфологическое исследование обнаружило на границе с имплантатом по его периметру формирование фиброзной ткани со слоем костных трабекул снаружи (рис. 3, а). В соединительной ткани отмечена скудная клеточность, представленная немногочисленными клетками фибробластического дифферона и скоплениями клеток воспалительного характера (лейкоцитов, лимфоцитов, плазмоцитов, клеток моноцитарно-макрофагального дифферона). Ближе к компактной пластинке отмечали фиброзирующийся костный мозг с очагами инфильтратов воспалительного характера. Микрососуды были малочисленны, большей частью с фиброзированными стенками и облитерированными просветами (рис. 3, а). Отмечали имбибицию частиц имплантационного материала в ткани периимплантационной области (рис. 3, б). Костные трабекулы пластинчатого строения на поверхности соединительнотканного футляра — с признаками хронического воспаления (рис. 3, в). Гаверсовы каналы компактной пластинки неравномерно расширены, в большей части — запустевшие либо заполненные фиброзной тканью (рис. 3, г). Выраженной остеокластической резорбции не наблюдали, гистологическая картина, вероятно, связана с нарушением микроциркуляции кости и состоянием хронического воспалительного процесса. Согласно результатам морфометрического исследования относительная протяженность поверхности остеобластов — 57,2 %, относительная протяженность поверхности остеокластов — 1,7 %.
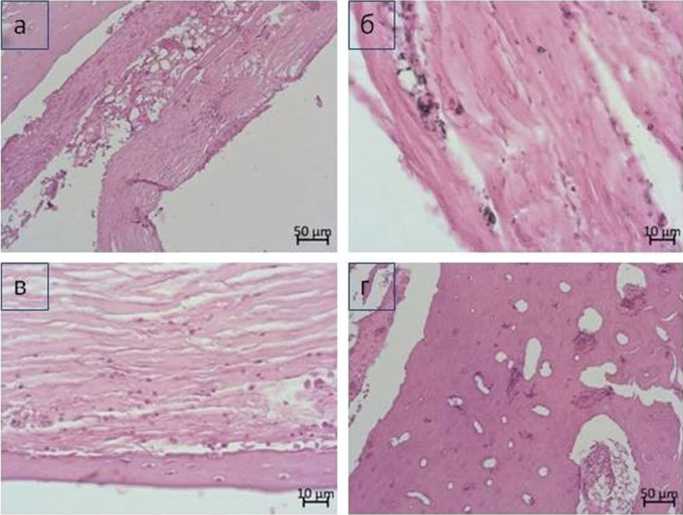
Рис. 3. Особенности гистологического строения тканей в области имплантации стержня из НПК: а — формирование фиброзного футляра с тонким трабекулярным слоем снаружи вокруг имплантата, костный мозг фиброзирован с очагами воспалительного инфильтрата;
б — фиброзная, плохо васкуляризированная ткань, прилегающая к имплантату, видны интегрированные в соединительную ткань частицы имплантационного материала;
в — костная трабекула пластинчатого строения на поверхности соединительнотканного футляра с признаками хронического воспаления;
г — компактная пластинка с неравномерно расширенными, запустевшими, фиброзированными гаверсовыми каналами.
Парафиновый срез. Окраска гематоксилином и эозином. Ув. 100 (а, г), ув. 400 (б, в)
В группе ПК по результатам гистоморфологических исследований остеоинтеграции имплантата обнаружили, что вокруг имплантата формировался слой трабекулярной костной ткани, костные трабекулы представлены ретикулофиброзной костной тканью, но ближе к компактной пластинке костная ткань имела пластинчатое строение, выявлена имбибция частиц материала в ткани периимплантационной области (рис. 4, а, б). Между компактной пластинкой и образованной на поверхности имплантата костной тканью визуализировали желатинозный костный мозг с жировыми включениями и участками гемопоэза, либо гемопоэтический жировой костный мозг. Сосуды костного мозга имели тонкие стенки, были расширены и заполнены клетками крови и плазмой, неравномерно распределенными в русле сосуда. На поверхности костных трабекул, состоящих из пластинчатой костной ткани, чаще визуализировали однорядно расположенные функционально активные остеобласты (рис. 4, в). На поверхности и в наружных участках ретикулофиброзных костных трабекул отмечали активный процесс остеогенеза. Остеокласты встречались редко, чаще были не прикреплены к поверхности трабекул. Однако обнаруживали резорбционные лакуны, заполненные рыхлой волокнистой соединительной тканью с очагами остеогенеза либо костными клетками с новообразованным аморфным костным веществом в перицеллюлярном пространстве. Для компактной пластинки было характерно расширение просветов некоторых гаверсовых каналов. Со стороны периоста отмечали очаги остеокластической резорбции (рис. 4, г). Морфометрия показала, что относительная протяженность поверхности остеобластов составляла 62,3 %, относительная протяженность поверхности остеокластов — 2,9 %. Таким образом, при использовании новой пористой керамики на основе циркония отмечена хорошая остеоинтеграция имплантата, применяемый материал не вызывал выраженного негативного влияния на ткани компактной пластинки и костного мозга.
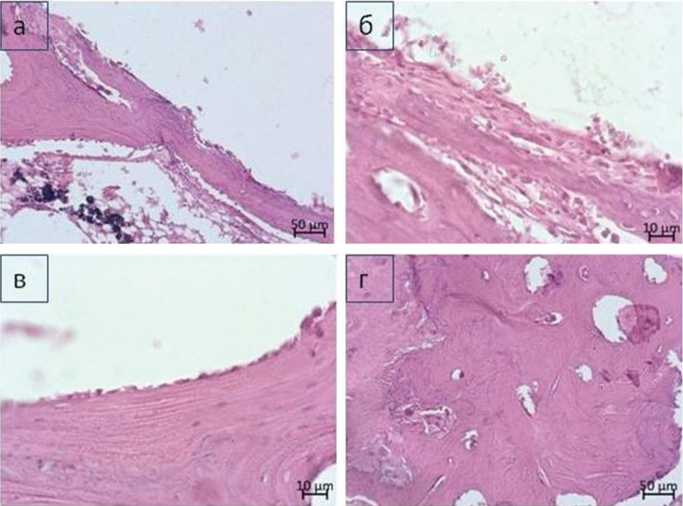
Рис. 4. Особенности гистологического строения тканей в области имплантации стержня из ПК: а — формирование костной «муфты» трабекулярного строения вокруг имплантата, пространство между новообразованными костными трабекулами и компактной пластинкой материнской кости заполняет гемопоэтический жировой костный мозг с небольшими участками рыхлой волокнистой соединительной ткани, на поверхности костных трабекул и в межтрабекулярных промежутках, обнаружены скопления частиц имплантационного материала; б — трабекулы ретикулофиброзной костной ткани на поверхности имплантата; в — слой кубовидных активных остеобластов на поверхности костной трабекулы, прилегающей к имплантату; г — компактная пластинка с расширенными гаверсовыми каналами, усиленными линиями склеивания и резорбцией со стороны периоста. Парафиновый срез. Окраска гематоксилином и эозином. Ув. 100 (а, г), ув. 400 (б, в)
Результаты гистоморфологических исследований по определению толщины костной трабекулы в области имплантации в группах ТС, НПК и ПК представлены на рис. 5. Данный показатель при имплантации пористого керамического стержня был существенно выше не только по сравнению с имплантатом из сплава титана ( p < 0,001), но и по сравнению с непористым керамическим имплантатом ( p < 0,001): 86,2 [55,8; 109,9] мкм, 56,0 [47,2; 75,9] мкм и 33,1 [19,0; 84,5] мкм соответственно.
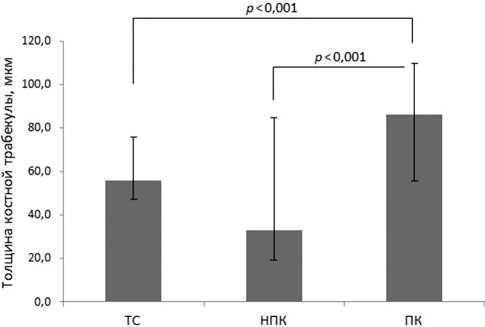
Рис. 5. Толщина костной трабекулы в области имплантации кроликам стержня из сплава титана (ТС), непористого нового керамического материала (НПК) и пористого нового керамического материала (ПК)
ОБСУЖДЕНИЕ
В связи увеличением продолжительности жизни людей и старением населения создание новых материалов и технологий для функционального замещения части органа или системы является одним из ключевых направлений стратегии научно-технологического развития Российской Федерации (Указ Президента РФ № 642). Требуются специальные прочные материалы и конструкции с высокими остеоинтегративными характеристиками, которые позволят воссоздать не только форму утраченного костного фрагмента, но и восстановить опорную функцию конечности в целом [15]. Керамические материалы в качестве остеозамещающих занимают особое место благодаря уникальному сочетанию свойств. Высокая прочность, износостойкость, низкий коэффициент трения позволяют использовать такой материал при высоких нагрузках, а совместимость с тканями человека снижает риск воспаления и побочных реакций [16]. Кроме того, состав керамического материала может быть адаптирован для улучшения конкретных свойств [17]. Для повышения биологической и физической эффективности многофункциональных биоматериалов используют ионы металлов [18], в частности проводят исследования по легированию керамики редкоземельными элементами [19]. Такие легированные керамические материалы привлекательны для регенерации тканей благодаря функциональным свойствам, биологической активности и терапевтическим эффектам, обеспечиваемым вводимыми ионами [20].
В нашем экспериментальном исследовании проведено изучение биологической совместимости и остеоинтеграции имплантатов из нового керамического материала на основе оксида циркония, содержащего ионы иттрия, иттербия, гадолиния. Ранее было доказано, что введение в состав керамики циркония существенно улучшает механические свойства материалов [21]. В то же время присутствие в композитах циркония не оказывает цитотоксического воздействия на пре-остеобласты [22], улучшает реакцию остеобластов in vitro [11], не оказывает отрицательного влияния на динамику гематологических показателей [23]. Хорошие результаты получены в клинических исследованиях по применению имплантатов из оксида циркония [24]. Введение иттрия в керамику на основе диоксида циркония позволяет получить исключительные механические свойства, такой материал демонстрирует цитосовместимость, не вызывает цитотоксических эффектов или аллергических реакций в окружающих тканях [25]. Включение в керамический материал иттербия и гадолиния способствует пролиферации и дифференцировке мезенхимальных стволовых клеток костного мозга, стимулирует отложение новообразованной кости и коллагена, увеличивает долговечность керамики [26, 27].
Мы провели изучение реакции организма экспериментального животного на имплантацию нового керамического материала на основе оксида циркония, содержащего ионы иттрия, иттербия, гадолиния. Определяли основные гематологические показатели в эксперименте по восполнению диафизарных дефектов костной ткани. Наше исследование показало сходную реакцию организма животных на новый материал и сплав титана.
Известно, что, изменяя характер поверхности и пористость имплантата, можно существенно изменить его функциональные свойства, например, меньшие размеры пор могут привести к усилению молекулярного транспорта и удалению отходов клеточного метаболизма. Наоборот, большие размеры пор способствуют движению клеток [28, 29]. В нашем исследовании имплантаты из нового керамического материала представлены в двух вариантах — непористого и пористого (с размером пор 10–50 мкм). Определено, что в случае использования непористых керамических образцов и имплантатов из сплава титана параметры лейкоцитарного, эритроцитарного и тромбоцитарного звеньев крови в послеоперационном периоде не имеют значимых различий. Тогда как при использовании пористой керамики уровень лейкоцитов, количество гранулоцитов и моноцитов было ниже, чем в двух других группах, что может свидетельствовать о менее выраженном воспалительном процессе в ответ на имплантацию искусственного остеозамещающего материала.
Результаты проведенных ранее исследований доказывают, что в контакте с поверхностями циркониевой керамики активно формируется новообразованная кость; периимплантно обнаруживают секретирующие остеобласты в большом количестве [30]. Сравнительные исследования установили, что в отношении индексов остеоинтеграции имплантаты из диоксида циркония и имплантаты на основе титана демонстрируют сходные результаты [31, 32]. Результаты наших гистоморфологических исследований показали, что при использовании стержней, изготовленных из пористой циркониевой керамики, происходит лучшая интеграция имплантатов по сравнению с титановыми имплантатами и с имплантатами из непористой циркониевой керамики. Стержни из титана и непористой керамики показывали умеренную либо незначительную остеоинтеграцию, помимо этого была отмечена картина хронического воспаления, что свидетельствовало о худшей приживаемости данных имплантатов.
ЗАКЛЮЧЕНИЕ
Разработка новой биокерамики на основе оксида циркония, содержащего ионы иттрия, иттербия, гадолиния для возмещения костных и костно-суставных дефектов критических размеров базируется на физико-химической устойчивости, высокой механической прочности материала, возможности проявления не только остеокондуктивных, но и остеоиндуктивных свойств. Установлена биологическая совместимость нового керамического материала при восполнении диафизарных дефектов костной ткани в эксперименте с животными. Имплантаты с размерами пор 10–50 мкм обладают хорошими остеоинтегративными характеристиками, что определяет возможность и необходимость проведения (при разрешении Росздравнадзора) клинических испытаний.


