Острое повреждение почек у пациентов с тромбоэмболией легочной артерии
Автор: Филимонова Валентина Вячеславовна, Мензоров Максим Витальевич, Большакова Анна Юрьевна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 2, 2021 года.
Бесплатный доступ
Цель исследования. Оценить наличие, степень выраженности и варианты острого повреждения почек (ОПП) у пациентов с тромбоэмболией легочной артерии (ТЭЛА); уточнить связь между ОПП и расчетным риском смерти, госпитальной летальностью. Материалы и методы. Обследовано 111 пациентов (мужчин - 61 (55 %), женщин - 50 (45 %), средний возраст - 66,8±11,7 года) с ТЭЛА, госпитализированных в отделение кардиологии ГУЗ «Центральная городская клиническая больница г. Ульяновска». Результаты. Острое повреждение почек диагностировано у 36 (34 %) пациентов с ТЭЛА, причем у 24 (67 %) из них выявлена 1 стадия, у 7 (19 %) - 2 стадия и у 5 (14 %) - 3 стадия. У 20 (56 %) пациентов диагностирован догоспитальный вариант осложнения, госпитальное ОПП выявлялось в 16 (44 %) случаях. ОПП при ХБП имело место у 24 (67 %) обследованных, ОПП de novo -у 12 (33 %). В период госпитализации умерло 26 (23 %) пациентов. Относительный риск смерти в стационаре у пациентов с ОПП составил 5,2 (95 % ДИ: 2,02-13,39; р
Острое повреждение почек, тромбоэмболия легочной артерии, госпитальная летальность, расчетный риск смерти
Короткий адрес: https://sciup.org/14121210
IDR: 14121210 | УДК: 616.61-008.64-07-08 | DOI: 10.34014/2227-1848-2021-2-36-45
Текст научной статьи Острое повреждение почек у пациентов с тромбоэмболией легочной артерии
Введение. Проблема острого повреждения почек (ОПП) крайне актуальна во всем мире [1–3]. У пациентов блоков интенсивной терапии ОПП диагностируется в 70 % случаев и является одним из самых распространенных осложнений [4, 5]. Одним из факторов неблагоприятного прогноза тромбоэмболии легочной артерии (ТЭЛА) является нарушение функционального состояния почек [6–8]. Что касается ОПП при ТЭЛА, то оно врачами часто игнорируется [9]. Исследования по представленной тематике единичны, в основе своей ретроспективные, в них редко используются современные критерии KDIGO (2012) [10–12].
Распространенность ОПП и его прогностическое значение при ТЭЛА изучены недостаточно, а имеющиеся данные ограничены несколькими, в большинстве своем ретро-
спективными исследованиями, в которых частота указанного осложнения варьирует от 5 до 30 % [13]. Публикации в Российской Федерации по указанной тематике отсутствуют.
Цель исследования. Оценить наличие, степень выраженности и варианты острого повреждения почек у пациентов с ТЭЛА; исследовать связь между острым повреждением почек и расчетным риском смерти, госпитальной летальностью.
Материалы и методы. Работа представляет собой открытое проспективное когортное наблюдательное исследование, выполненное методом сплошной выборки. Все обследуемые дали информированное согласие на участие в исследовании, включение в которое осуществлялось с января 2017 г. по апрель 2020 г. Всего включено 111 пациентов с ТЭЛА: мужчин – 61 (55 %), женщин – 50 (45 %). Средний
возраст составил 66,8±11,7 года. Факторами, предрасполагающими к развитию ТЭЛА, чаще всего были хроническая сердечная недостаточность в анамнезе – у 67 (60 %) чел., известная фибрилляция предсердий – у 36 (32 %), варикозная болезнь поверхностных вен ниж-
них конечностей – у 34 (31 %), онкологические заболевания – у 16 (14 %) и иммобилизация в предшествующие 12 мес. – у 13 (12 %) пациентов. Исходная клиническая характеристика пациентов представлена в табл. 1, а результаты их обследования – в табл. 2.
Таблица 1
Table 1
Общая характеристика, анамнез и клинические признаки у пациентов с ТЭЛА в зависимости от наличия острого повреждения почек
Overall characteristics, history, risk factors, and clinical signs in patients with PATE depending on acute kidney injury
|
Характеристики Characteristics |
Всего Total (n=111) |
Группа с ОПП Patients with AKI (n=36) |
Группа без ОПП Patients without AKI (n=75) |
p |
|
Базовые характеристики Overall characteristics |
||||
|
Возраст, лет (Me (Q1–Q3)) Age, years (Me (Q1–Q3)) |
66 (60–75) |
68 (61,5–74,5) |
65 (59–75) |
0,327 |
|
Пол: мужчины, n (%) женщины, n (%) Sex: males, n (%) females, n (%) |
61 (55) 50 (45) |
20 (56) 16 (44) |
41 (55) 34 (45) |
0,930 0,452 |
|
Койко-день (Me (Q1–Q3)) Bed-day (Me (Q1–Q3)) |
12 (9–15) |
9,5 (1–15,5) |
13 (10–15) |
0,011 |
|
Койко-день у выживших (Me (Q1–Q3)) Bed-day for survivors (Me (Q1–Q3)) |
13 (11–16) |
14,5 (10,5–17) |
13 (12–15) |
0,551 |
|
Анамнез History |
||||
|
ПИКС, n (%) PC, n (%) |
29 (26) |
14 (39) |
15 (20) |
0,034 |
|
Инсульт / ТИА в прошлом, n (%) Stroke / TIA, n (%) |
19 (17) |
7 (19) |
12 (16) |
0,652 |
|
Известная АГ, n (%) Diagnosed AH, n (%) |
78 (70) |
29 (81) |
49 (65) |
0,100 |
|
Известная ХСН, n (%) Diagnosed CHF, n (%) |
67 (60) |
19 (53) |
48 (64) |
0,258 |
|
Известный СД, n (%) Diagnosed DM, n (%) |
22 (20) |
10 (28) |
12 (16) |
0,145 |
|
Известная ХОБЛ, n (%) Diagnosed COPD, n (%) |
12 (11) |
4 (11) |
8 (11) |
0,943 |
|
Известная ХБП, n (%) Diagnosed CKD, n (%) |
51 (46) |
24 (67) |
27 (36) |
0,002 |
|
Ожирение, n (%) Obesity, n (%) |
39 (38) |
16 (47) |
23 (33) |
0,160 |
|
Характеристики Characteristics |
Всего Total (n=111) |
Группа с ОПП Patients with AKI (n=36) |
Группа без ОПП Patients without AKI (n=75) |
p |
|
Клинические характеристики Clinical characteristics |
||||
|
Бессимптомное течение, n (%) Asymptomatic disease course, n (%) |
7 (6) |
3 (8) |
4 (5) |
0,543 |
|
Одышка, n (%) Dyspnea, n (%) |
104 (94) |
33 (92) |
71 (95) |
0,542 |
|
Кровохарканье, n (%) Hemoptysis, n (%) |
8 (7) |
1 (3) |
7 (9) |
0,211 |
|
Боль в грудной клетке, n (%) Chest pain, n (%) |
62 (56) |
19 (53) |
43 (57) |
0,651 |
|
Синкоп, n (%) Syncope, n (%) |
32 (29) |
13 (36) |
19 (25) |
0,241 |
|
Кашель, n (%) Cough, n (%) |
31 (28) |
8 (22) |
23 (31) |
0,353 |
|
Боль, асимметрия в ногах или другие внешние причины, заставляющие подозревать ТГВ, n (%) Pain, leg asymmetry, or other external causes indicating deep venous thrombosis, n (%) |
22 (20) |
4 (11) |
18 (25) |
0,110 |
Примечание. ПИКС – постинфарктный кардиосклероз, ТИА – транзиторная ишемическая атака, АГ – артериальная гипертензия, ХСН – хроническая сердечная недостаточность, СД – сахарный диабет, ХОБЛ – хроническая обструктивная болезнь легких, ХБП – хроническая болезнь почек, ТГВ – тромбоз глубоких вен.
Note . PC – post infarction cardiosclerosis, TIA – transient ischemic attack, AH – arterial hypertension, CHF – chronic heart failure, DM – diabetes mellitus, COPD – chronic obstructive pulmonary disease, CKD – chronic kidney disease.
Диагностику ТЭЛА осуществляли согласно «Рекомендациям Европейского общества кардиологов» (ESC) (2014) [14]. При анализе данных учитывали «Рекомендации ESC» (2019) [15]. ОПП диагностировали по «Рекомендациям KDIGO» (2012) [16]. Исходным считали уровень креатинина в момент госпитализации, до проведения компьютерной томографии.
Статистическую обработку данных проводили с использованием программы Statistica for Windows 10.0. Выбор вида распределения количественных данных осуществляли по критерию Шапиро–Уилка. В случае приближенно нормального распределения данные представлены в виде M±SD, где M – среднее арифметическое, SD – стандартное отклонение. В противном случае данные представлены в виде Me (Q1–Q3), где Me – медиана, Q1–Q3 – интерквартильный размах. Качест-
венные переменные описаны абсолютными (n) и относительными (%) значениями. Достоверность различий между двумя группами несвязанных переменных при нормальном распределении определяли по критерию t Стьюдента, в противном случае использовали Mann–Whitney U-test. Для сравнения двух групп по качественному признаку использовали χ 2 Пирсона. Для прогнозирования вероятности развития события выполняли логистический регрессионный анализ. Различие считали достоверным при р<0,05.
Результаты. Обследуемые с острой дисфункцией почек чаще имели в анамнезе инфаркт миокарда и ХБП (табл. 1), у них выявлялся более низкий уровень диастолического артериального давления, сатурации, фракции выброса левого желудочка (ФВ) и более высокий – систолического давления в легочной артерии (ЛА) и индекса тяжести (PESI) (табл. 2).
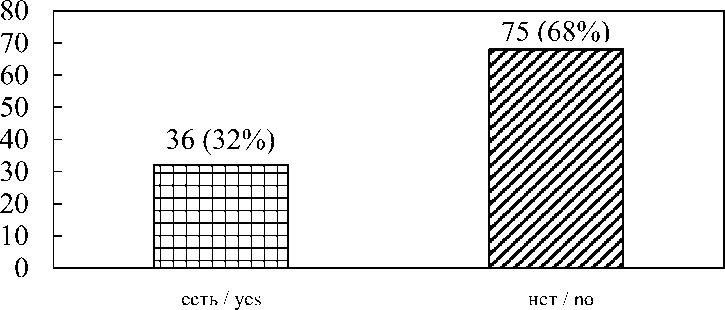
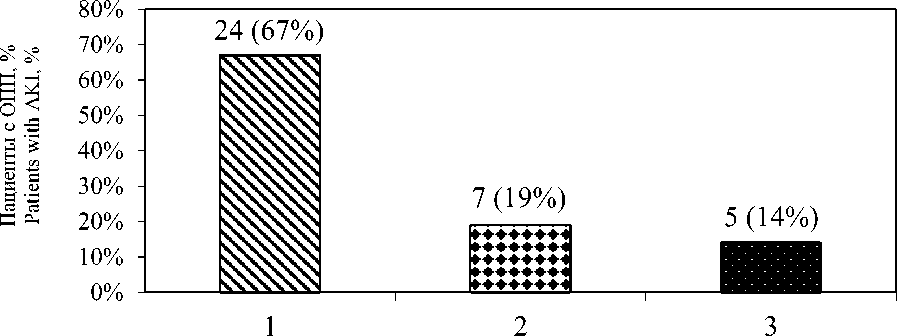
ОПП диагностировано у 36 (34 %) пациентов с ТЭЛА (рис. 1), причем у 24 (67 %) из них выявлена 1 стадия, у 7 (19%) – 2 стадия и у 5 (14 %) – 3 стадия (рис. 2). У 20 (56 %) обследуемых обнаружен догоспитальный вариант осложнения, госпитальное ОПП выявля-
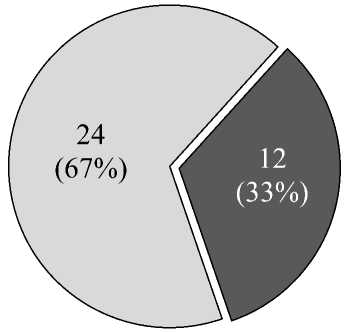
лось реже – в 16 (44 %) случаях (рис. 3) и чаще было ранним (в первые 48 ч) – у 10 (62 %) пациентов. У 24 (67 %) исследуемых острая дисфункция почек развивалась на фоне предшествующей ХБП, у 12 (33 %) – de novo (рис. 3).
Таблица 2
Table 2
Результаты объективного осмотра, лабораторных, инструментальных методов исследования и оценки индексов тяжести у пациентов с ТЭЛА в зависимости от наличия острого повреждения почек
Results of physical examination, laboratory and instrumental methods of diagnosis and assessment of severity indices in patients with PATE depending on acute kidney injury
|
Характеристики Characteristics |
Всего Total (n=111) |
Группа с ОПП Patients with AKI (n=36) |
Группа без ОПП Patients without AKI (n=75) |
p |
|
Объективные данные Objective data |
||||
|
Систолическое АД, мм рт. ст. (Me (Q1–Q3)) Systolic BP, mmHg (Me (Q1–Q3)) |
120 (100–135) |
110 (90–130) |
120 (110–140) |
0,091 |
|
Диастолическое АД, мм рт. ст. (Me (Q1–Q3)) Diastolic BP, mmHg (Me (Q1–Q3)) |
80 (70–80) |
70 (60–80) |
80 (70–80) |
0,014 |
|
ЧСС, уд./мин (Me (Q1–Q3)) HR, bpm (Me (Q1–Q3)) |
92 (78–108) |
91 (79–100) |
94 (78–110) |
0,569 |
|
ЧД, в мин (Me (Q1–Q3)) BR, min (Me (Q1–Q3)) |
19 (18–20) |
19 (18–22) |
19 (18–20) |
0,374 |
|
Сатурация, % (Me (Q1–Q3)) Saturation, % (Me (Q1–Q3)) |
92 (90–95) |
91 (89–92) |
93,5 (90–96) |
0,013 |
|
Цианоз, n (%) Cyanosis, n (%) |
52 (47) |
11 (31) |
41 (55) |
0,017 |
|
Увеличение шейных вен, n (%) Cervical vein enlargement, n (%) |
14 (13) |
4 (11) |
10 (13) |
0,741 |
|
Влажные хрипы, n (%) Bubbling rale, n (%) |
22 (20) |
10 (28) |
12 (16) |
0,145 |
|
Отеки нижних конечностей, n (%) Lower limb edema, n (%) |
42 (38) |
16 (44) |
26 (35) |
0,320 |
|
Лабораторные данные Laboratory data |
||||
|
Гематокрит, % (Me (Q1–Q3)) Hematocrit, % (Me (Q1–Q3)) |
39,5 (35,5–44,4) |
41,3 (34,6–48,8) |
38,95 (35,9–43,6) |
0,289 |
|
Лейкоциты, ×109/л (Me (Q1–Q3)) Leukocytes, ×109/л (Me (Q1–Q3)) |
9,6 (7,3–12,4) |
10,0 (7,9–13,2) |
9,4 (7,0–12,0) |
0,236 |
|
Тромбоциты, ×109/л (Me (Q1–Q3)) Thrombocytes, ×109/л (Me (Q1–Q3)) |
214,5 (175–265) |
206 (187–275) |
219 (175–261) |
0,911 |
|
Тропонин повышен, n (%) Elevated troponin level, n (%) |
26 (43) |
9 (47) |
17 (41) |
0,614 |
|
Характеристики Characteristics |
Всего Total (n=111) |
Группа с ОПП Patients with AKI (n=36) |
Группа без ОПП Patients without AKI (n=75) |
p |
|
Инструментальные данные Instrumental data |
||||
|
ФВ, % (Me (Q1–Q3)) EF, % (Me (Q1–Q3)) |
57 (49,0-63,2) |
52 (44–55) |
60,9 (50,4–64,2) |
0,001 |
|
Размер ПЖ, мм (Me (Q1–Q3)) RV dimensions, mm (Me (Q1–Q3)) |
34 (30,1–39,0) |
34,2 (26–38) |
34 (31–40) |
0,224 |
|
Размер ПП, мм (Me (Q1–Q3)) RA dimensions, mm (Me (Q1–Q3)) |
43 (37–51) |
46 (38–54) |
42 (36–49) |
0,505 |
|
Нарушение сократимости ПЖ, n (%) Impairment of RV contractility, n (%) |
50 (55) |
13 (56) |
37 (54) |
0,860 |
|
Систолическое давление в ЛА, мм рт. ст. (Me (Q1–Q3)) Systolic pressure in the PA, mm Hg (Me (Q1–Q3)) |
53 (35–68) |
68 (38–81) |
49,5 (35–60) |
0,002 |
|
Любой венозный тромбоз по данным УЗДГ, n (%) Any venous thrombosis according to USDG, n (%) |
55 (67) |
11 (61) |
44 (69) |
0,542 |
|
Шкалы Scales |
||||
|
Индекс тяжести ТЭЛА (PESI) PATE severity index (PESI) |
99 (75–139) |
120 (87,5–158) |
90 (70–126) |
0,004 |
|
Упрощенный индекс тяжести ТЭЛА (sPESI) Simplified PATE severity index (sPESI) |
1 (0–1) |
1 (0,5–1,0) |
1 (0–1) |
0,025 |
Примечание. АД – артериальное давление, ЧСС – частота сердечных сокращений, ЧД – частота дыхания, ПЖ – правый желудочек, ПП – правое предсердие, ФВ – фракция выброса левого желудочка, ЛА – легочная артерия, УЗДГ – ультразвуковая доплерография.
Note. BP – blood pressure, HR – heart rate, BR – breathing rate, RV – right ventricle, EF – ejection fraction, RA – right atrium, PA – pulmonary artery, LVEF – left ventricular ejection fraction, USDG – ultrasound dop-plerography.
Острое повреждение почек
Acute kidney injury.
Рис. 1. Частота острого повреждения почек у пациентов с ТЭЛА
Fig. 1. Frequency of acute kidney injury in patients with PATE
Стадия острого повреждения почек Pha se of acute kidney injury
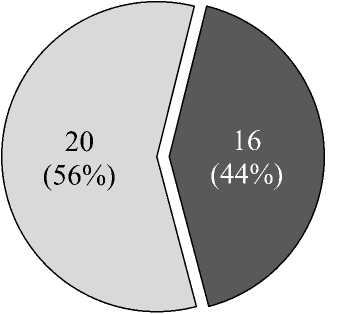
Рис. 2. Тяжесть острого повреждения почек у пациентов с ТЭЛА
Fig. 2. Severity of acute kidney injury in patients with PATE
-
□ Госпитальное ОПП / Hospital AKI
-
□ Догоспитальное ОПП / Prehospital AKI
-
□ ОПП при ХБП / AKI to chronic kidney disease
Рис. 3. Варианты острого повреждения почек у пациентов с ТЭЛА
Fig. 3. Types of acute kidney injury in patients with PATE
В период госпитализации умерло 26 (23 %) пациентов, в случае отсутствия ОПП госпитальная летальность составила 13 %, а при его
наличии – 44 % (рис. 4). ОПП было ассоциировано с увеличением риска смерти в стационаре (ОШ 5,2 (95 % ДИ: 2,02–13,39; р<0,001).
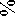
50%
40%
30%
20%
10%
0%
Х2=12,48; р<0,001
10 (13%)

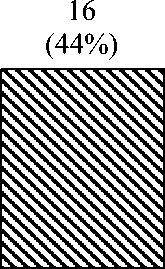
нет no
есть yes
Острое повреждение почек Acute kidney injury
Рис. 4. Острое повреждение почек и госпитальная летальность у пациентов с ТЭЛА
Fig. 4. Acute kidney injury and hospital mortality in patients with PATE
Расчетный риск 30-дневной смерти по шкале PESI у пациентов с ОПП был выше, чем у пациентов без ОПП (120,0 (87,5–158) и 90 (87,5–158,0) соответственно, p=0,004).
Обсуждение. По данным ретроспективного исследования C.H. Chang et al., выполненного в 2017 г. и включавшего 7588 пациентов с ТЭЛА азиатской популяции, частота ОПП составила всего 5 % [10]. Это объяснить тем, что осложнение регистрировалось по наличию в базе данных кода МКБ-10 «острая почечная недостаточность – N17». В проспективном исследовании A. Trimaille еt al., включавшем 678 пациентов европейской популяции, был продемонстрирован другой результат: ОПП выявлялось у 19 % пациентов с ТЭЛА, при этом в качестве основного критерия использовалось повышение уровня креатинина на 25 % от исходного, что могло привести к занижению реальной частоты осложнения [12]. По данным международного регистра RIETE, который декларировался как «первое исследование, в котором ОПП диагностировалось в соответствии с «Рекомендациями KDIGO» (2012)» и включал 21 131 пациента с ТЭЛА, частота острой почечной дисфункции достигала 29,5 %, при этом 21 % пациентов имели ОПП 1 стадии, 7 % – 2 стадии и 2 % – 3 стадии [11], что в целом сопоставимо с нашими данными. Следует, однако, подчеркнуть,
что за исходный в этой работе принимался креатинин, соответствующий скорости клубочковой фильтрации 75 мл/мин/1,73 м2 по формуле MDRD, что могло привести к завышению частоты осложнения за счет ранее не выявленной ХБП [11]. Нами за исходный принимался креатинин сыворотки крови при поступлении, в последующем он оценивался в динамике, что является оптимальным и позволяет минимизировать ошибки диагностики [1].
Необходимо отметить, что публикации, в которых проводился бы анализ вариантов ОПП у пациентов с ТЭЛА, отсутствуют, а в части исследований отсутствовала даже стратификация тяжести [10, 12]. В нашей работе такая оценка выполнена впервые, при этом наиболее частыми вариантами оказались догоспитальное ОПП и ОПП при ХБП.
Согласно имеющимся литературным данным, большинством исследователей установлена связь между дисфункцией почек и госпитальной летальностью [10–12], хотя в некоторых публикациях подобное влияние отрицается [17]. Наша работа, основанная на диагностике ОПП согласно «Рекомендациям KDIGO» (2012), подтвердила влияние ОПП на летальность у пациентов российской популяции. Также в представленной работе установлено, что расчетный риск ранней смерти по шкале PESI у пациентов с ОПП выше, чем у
пациентов без ОПП, что позволяет рассматривать острую дисфункцию почек как кофактор стратификации риска смерти.
Заключение. У пациентов с ТЭЛА наблюдается высокая частота острого повреждения почек: оно диагностируется у каждого 3-го пациента. В большинстве случаев (2/3) имеют место 1 и 2 стадии заболевания. У 67 %
пациентов острое повреждение почек развивается на фоне предшествующей хронической болезни почек. Преобладают пациенты с догоспитальным острым повреждением почек (58 %). Острое повреждение почек у пациентов с ТЭЛА ассоциировано с увеличением госпитальной летальности и расчетного риска 30-дневной смертности.
Список литературы Острое повреждение почек у пациентов с тромбоэмболией легочной артерии
- Мензоров М.В., Шутов А.М., Макеева Е.Р., Серов В.А., Михайлова Е.В., Парфёнова Е.А. Сложности диагностики острого повреждения почек у больных инфарктом миокарда с подъемом сегмента ST. Терапевтический архив. 2014; 4 (86): 25-29.
- Мензоров М.В., Шутов А.М., Макеева Е.Р., Страхов А.А. Острое повреждение почек у больных с острой декомпенсацией хронической сердечной недостаточности. Клиницист. 2013; 2: 29-33.
- Lewington A.J., Cerda J., Mehta R.L. Raising awareness of acute kidney injury: a global perspective of a silent killer. Kidney Int. 2013; 84 (3): 457-467.
- Chertow G.M., Burdick E., HonourM. Acute kidney injury, mortality, length of stay, and costs in hospitalized patients. J. Am. Soc. Nephrol. 2005; 16: 3365-3370.
- Yang C.H., Chang C.H., Chen T.H. Combination of urinary biomarkers improves early detection of acute kidney injury in patients with heart failure. Circ. J. 2016; 80: 1017-1023.
- AbbottK.C., CruessD.F., AgodoaL.Y., SawyersE.S., TveitD.P. Early renal insufficiency and late venous thromboembolism after renal transplantation in the United States. Am. J. Kidney Dis. 2004; 43: 120-130.
- TveitD.P., Hypolite I.O., Hshieh P., Cruess D., Agodoa L.Y., Welch P.G. Chronic dialysis patients have high risk for pulmonary embolism. Am. J. Kidney Dis. 2002; 39: 1011-1017.
- AndersonF.A.Jr., Spencer F.A. Risk factors for venous thromboembolism. Circulation. 2003; 107: 9-16.
- Boettger B., Wehling M., Bauersachs R.M. Initial anticoagulation therapy in patients with venous thromboembolism and impaired renal function: results of an observational study. J. Public Health. 2014; 22: 89-99.
- Chang C.H., Fu CM, Fan P.C., Chen S.W., Chang S.W., Mao C.T., Tian Y.C., Chen Y.C., Chu P.H., Chen T.H. Acute kidney injury in patients with pulmonary embolism: A population-based cohort study. Medicine (Baltimore). 2017; 96 (9): e5822.
- Martin Murgier, Laurent Bertoletti, Michael Darmon, FabriceZeni, Reina Valle, Jorge Del Toro, Pilar Llamas, Lucia Mazzolai, Aurora Villalobos, ManuelMonreal, RIETE Investigators. Frequency and Prognostic Impact of Acute Kidney Injury in Patients with Acute Pulmonary Embolism. Data from the RIETE Registry. Int. J. Cardiol. 2019; 291: 121-126.
- Trimaille A., Marchandot B., Girardey M., Muller C., Lim H.S., Trinh A., Ohlmann P., Moulin B., Jesel L., Morel O. Assessment of Renal Dysfunction Improves the Simplified Pulmonary Embolism Severity Index (sPESI) for Risk Stratification in Patients with Acute Pulmonary Embolism. J. Clin. Med. 2019; 8 (2): 160-174.
- KostrubiecM., PruszеzykP., BochowiczA. Biomarker-based risk assessment model in acute pulmonary embolism. Eur. Heart J. 2005; 26: 2166-2172.
- ESC Guideline on the diagnosis and management of acute Pulmonary Embolism. European Heart Journal. 2014; 35: 3033-3080.
- ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society. European Heart Journal. 2020; 41: 543-603.
- KDIGO Clinical Practice Guideline for Acute Kidney Injury. Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. Kidney inter. Suppl. 2012; 2 (6): 1-138.
- Wilke T., Wehling M., Amann S., Bauersachs R.M., Bottger B. Renal impairment in patients with throm-boembolic event: prevalence and clinical implications. A systematic review of the literature. Dtsch. Med. Wochenschr. 2015; 140 (17): 166-174.


