Отдаленные клинические результаты трансплантации аутологичных мононуклеарных клеток костного мозга больным при остром инфаркте миокарда
Автор: Рябов Вячеслав Валерьевич, Киргизова Марина Александровна, Суслова Татьяна Евгеньевна, Попонина Юлия Сергеевна, Марков Валентин Алексеевич, Карпов Ростислав Сергеевич
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.29, 2014 года.
Бесплатный доступ
Цель: изучение отдаленных клинических результатов трансплантации аутологичных мононуклеарных клеток костного мозга у больных острым инфарктом миокарда (ОИМ). В открытое рандомизированное исследование включено 62 пациента, поступивших с первичным ОИМ в 2003-2006 гг. Критерии включения: первичный ОИМ с подъемом сегмента ST, время реперфузии инфарктсвязанной коронарной артерии (ИСКА) не ранее 4 ч от начала ОИМ. Пациенты рандомизированы на две группы: 1-я группа - проведено стентирование ИСКА и клеточная кар-диомиопластика на 20±10-е сутки (n=28), 2-я группа - стентирование ИСКА на 20±10-е сутки (n=34). В среднем на 14±6,8-е сутки ОИМ производился забор крови для определения HGF, VGF, FGF, IGF, IL-1, TNFα, TGF методом твердофазного иммуноферментного анализа. Через 8,23±0,72 лет после ОИМ оценили клиническое течение ишемической болезни сердца (ИБС), провели физикальный осмотр, определили сывороточный уровень BNP, выполнили эхокардиографию. Получена информация о жизненном статусе 58 больных (93%). В 1-й группе отдаленная как общая, так и сердечно-сосудистая летальность были выше по сравнению со 2-й - 10 (36%) против 4 (12), p=0,01; 8 (29%) против 2 (6%), p=0,03 соответственно. ХСН II и более ФК и ХСН IIA и ПБ чаще выявлялись во 2-й группе - 6 (31%) против 10 (21%), р=0,058 и (29%) против 3 (9%), р=0,05 соответственно. Во 2-й группе было достоверно больше пациентов с нестабильной стенокардией - 12 (37,5%) против 5 (19%) в основной группе, p=0,035. По толерантности к физической нагрузке (ТФН) и по уровню BNP различий между группами не выявлено. Большая частота повторных ОИМ наблюдалась у пациентов с более высоким уровнем FGF при ОИМ (21,8±4,9 против 15,9±7,2; p=0,02), среди умерших пациентов при ОИМ наблюдался достоверно более высокий уровень FGF (17,2 против 16,3, p=0,0013). ХСН II ФК и более и ХСН II А ст. и более наблюдалась у пациентов с более низким уровнем HGF (706,7 против 4239,7; p=0,017 и 758,1 против 3998,5; p=0,025 соответственно). Выявлены положительные корреляционные связи между уровнями TNFα и КДИ - R 0,62, TNFα и КСИ - R 0,60, TNFα и стадией ХСН - R 0,47, p
Аутологичные мононуклеарные клетки костного мозга, острый инфаркт миокарда
Короткий адрес: https://sciup.org/14919960
IDR: 14919960 | УДК: 616.127-005.8:
Текст научной статьи Отдаленные клинические результаты трансплантации аутологичных мононуклеарных клеток костного мозга больным при остром инфаркте миокарда
Актуальность
Согласно современным представлениям, цитокиновая система принимает активное участие в реализации иммунного ответа при тромботических коронарных событиях. Как известно, при длительности окклюзии ИСКА более 3 ч в зоне ишемии погибает более 80% кардиомиоцитов, поэтому успешная реканализация не является залогом полного восстановления жизнеспособности миокарда. Важным этапом регенерации зоны инфаркта миокарда является не только реваскуляризация очага некроза, но и активация клеточной и внутриклеточной форм регенерации кардиомиоцитов. Основополагающую роль в индукции и регуляции данных процессов играют цитокины, различные факторы роста. Поиск и разработка новых способов регенеративной и иммуномодулирующей терапии с использованием стволовых клеток, а также факторов роста с целью стимуляции не только кардиомиогенеза, но и ангиногенеза по-прежнему являются актуальным направлением.
Согласно данным международных регистров, таких как MEDLINE, EMBASE, CENTRAL, CINAHL, ClinicalTrials.gov, к настоящему времени в мире насчитывается более 30 плацебо-контролируемых исследований, посвященных изучению эффективности и безопасности трансплантации АМККМ у больных при ОИМ [5, 9]. Признано, что первые краткосрочные результаты рандомизированных исследований в отношении эффективности были чрезмерно оптимистичны [9, 11, 15]. Необходимо отметить, что выявленное улучшение функциональных показателей сердца, либо их отсутствие, является недостаточным для клиницистов, поскольку не воспроизводит положительных результатов экспериментальных работ, кроме того, отсутствуют данные по отдаленным клиническим исходам болезни.
Таким образом, несмотря на большое количество исследований, существует необходимость в накоплении данных по отдаленным клиническим результатам после клеточной кардиомиопластики. Актуален вопрос в отношении влияния различных уровней циркулирующих в крови цитокинов, факторов роста, определенных при ОИМ, на отдаленные результаты трансплантации АМККМ, клиническое течение ИБС.
Цель исследования: изучить отдаленные клинические результаты после трансплантации АМККМ больным при ОИМ.
Материал и методы
В открытое рандомизированное исследование, зарегистрированное на сайте Clinicaltrials.gov. под названием “ESTABOMA”, включено 62 пациента с первичным ОИМ с подъемом сегмента ST в 2003–2006 гг. Протокол исследования одобрен локальным этическим комитетом. Все пациенты подписали информированное согласие. Диагноз ОИМ устанавливали на основе критериев ВОЗ. Критерии включения: первичный ОИМ с подъемом сегмента ST, время достижения реперфузии ИСКА не ранее 4 ч от начала ОИМ.
Пациенты рандомизированы на две группы: 1-я группа (основная) – проведено стентирование ИСКА и клеточная кардиомиопластика на 20±10-е сутки (n=28), 2-я группа (контрольная) – стентирование ИСКА на 20±10-е сутки (n=34). По клинико-анамнестическим характеристикам, определяющим ближайший и отдаленный прогноз заболевания, группы были сопоставимы (табл. 1).
Все пациенты получали лечение ОИМ согласно национальным рекомендациям, проводилась тромболитическая терапия, чрескожное коронарное вмешательство, кроме того, назначалась стандартная медикаментозная терапия. В 1-й группе проводили стентирование ИСКА и клеточную кардиомиопластику в среднем на 20±10-й день ОИМ. Во 2-й группе проводилась аналогичная терапия ОИМ, исключая трансплантацию АМККМ.
Из аспирата костного мозга, полученного пункцией передне-верхней ости крыла подвздошной кости, выделяли 100 мл АМККМ. Введение АМККМ осуществляли интракоронарно двумя способами: методом пассивного пассажа в течение 5 мин и суперселективно через центральный просвет баллонного катетера после создания окклюзии ИСКА в течение 3 мин. Описание протокола исследования представлено на сайте Clinicaltrials.gov и в ранее опубликованных статьях [4, 6, 7, 10].
В среднем на 14±6,8-е сутки ОИМ производился забор крови для определения следующих факторов роста и цитокинов: гепацитарный фактор роста (HGF), васку-лоэндотелиальный фактор роста (VEGF), фактор роста фибробластов (FGF), инсулиноподобный фактор роста 1 (IGF1), интерлейкин-1 (IL-1), фактор некроза опухоли – α (TNFα), трансформирующий фактор роста (TGF). Исследование выполняли с использованием набора реагентов Bio Vendor HGF, VEGF, FGF, IGF 1 и набора реаген-
Таблица 1
Клинико-анамнестические показатели больных при поступлении, М±SD, n (%)
|
Показатели |
1-я группа М±SD, n, % |
2-я группа М±SD, n, % |
р |
|
Количество больных |
28 |
34 |
|
|
Средний возраст |
55,3±8,2 |
52,8±8,5 |
0,29 |
|
Мужчины/женщины |
25 (89)/3 (11) |
27 (79)/7 (21) |
0,26/0,07 |
|
Курение |
23 (82) |
26 (76) |
0,61 |
|
Ожирение |
9 (32) |
12 (35) |
0,37 |
|
Артериальная гипертензия |
21 (75) |
30 (88) |
0,18 |
|
Предынфарктная стенокардия |
14 (50) |
18 (53) |
0,81 |
|
Передний инфаркт миокарда |
23 (82) |
24 (71) |
0,35 |
|
Распределение больных в зависимости от ИСКА ПНА/ПКА/ОА |
22 (79)/4 (14)/2 (7) |
24 (71)/7 (21)/3 (8) |
0,20 |
|
Количество больных в зависимости от степени поражения коронарного русла: |
3 (11)/18 (64)/6 (21) |
13 (38)/15 (44)/6 (18) |
0,21 |
|
1-/2-/3-сосудистое поражение Время реканализации ИСКА, ч |
5,7±2,5 |
6,5±3,4 |
0,55 |
|
QRS индекс, % поражения левого желудочка |
32,2±16,3 |
24,5±12,6 |
0,06 |
|
Количество введенных АМККМ Признаки острой сердечной недостаточности по T. Killip: I /II /III /IV |
93±43x10 6 , из них 5,4x10 6 CD34+ и 1x10 6 CD34+CD38- 11 (39)/11 (39)/4 (14)/2 (7) |
15 (44)/14 (42)/5 (15)/- |
0,40 |
|
Полная реваскуляризация |
12 (43) |
17 (50) |
0,57 |
Таблица 2
Сывороточные уровни факторов роста и цитокинов, М, Ме (25, 75)
Через 8,23±0,72 лет оценили клиническое течение ИБС. Конечными точками определены следующие события: смерть, повторный инфаркт миокарда (ПИМ), НС, ХСН II и более ФК, ХСН II А и более ст., острые нарушения мозгового кровообращения (ОНМК). Кроме того, оценили количество госпитализации по поводу сердечно-сосудистых заболеваний (ССЗ): плановых, а также в порядке скорой медицинской помощи с диагнозом НС, ПИМ.
Проведен физикальный осмотр, ТФН оценили с помощью теста 6-минутной ходьбы (ТШХ), сывороточный уровень BNP определили с помощью панели Triage BNP Test на анализаторе “Triage Meter”, Biosite, USA. Оценили приверженность пациентов к стандартной медикаментозной терапии с помощью теста Мориски–Грина. Выполнена эхокардиография на ультразвуковой системе “VIVID 7, GE Vingmed Ultrasound, Norway”.
Для изучения долгосрочной безопасности клеточной кардиомиопластики АМККМ у больных ОИМ оценивали частоту развития онкологических заболеваний, новых документированных нарушений ритма сердца.
Для статистической обработки использовали пакет прикладных программ “STATISTIСA for Windows ver 10.0”. Данные представлены в виде n (%), M±SD либо Me (25; 75). В связи с ненормальным распределением данных их анализ выполнен непараметрическими критериями. Во всех процедурах статистического анализа данных различия считали достоверными при уровне р<0,05.
Результаты и обсуждение
Получена информация о жизненном статусе 58 больных (93%): 26 пациентов из основной группы, 32 – из контрольной. Клиническое обследование прошло 44 пациента (70%), 14 – умерло (22%): 10 – из основной группы, 4 – из группы контроля. На момент контрольного обследования средний возраст в 1-й группе был 64,8±7,67 лет, во 2-й группе – 61,36±7,46 лет, по данному показателю группы были сопоставимы.
Частота конечных точек и показателей безопасности у больных обеих групп представлена в таблице 3.
В основной группе как общая – 10 (36%) против 4 (12%), p=0,01, так и сердечно-сосудистая летальность – 8 (29%) против 2 (6%), p=0,03 были выше по сравнению с контрольной группой (рис. 1). Получены данные о причинах смерти 13 пациентов. Важно отметить, что все умершие пациенты перенесли передний распространенный ОИМ, у всех было выявлено многососудистое атеросклеротическое поражение коронарных артерий.
Сравнительный анализ клинико-инструментальных данных пациентов 1-й группы в зависимости от исхода болезни выявил, что среди умерших пациентов преходящий дефект перфузии, определенный при нагрузочной сцинтиграфии миокарда с таллием 199 до трансплантации АМККМ, был достоверно больше – 5,1±7,2 против
Таблица 3
Конечные точки и показатели безопасности, М±SD, n (%)
|
Конечные точки |
1-я группа (n=28), М±SD, n, % |
2-я группа (n=34), М±SD, n, % |
р |
|
Смерть по поводу ССЗ |
8 (29) |
2 (6) |
0,03 |
|
Смерть, не связанная с ССЗ |
1 (4) |
2 (6) |
0,69 |
|
Причина смерти неизвестна |
1 (4) |
- |
- |
|
Общая летальность |
10 (36) |
4 (12) |
0,01 |
|
Количество госпитализаций по поводу ССЗ |
1,9±1,27 |
2,45±1,5 |
0,04 |
|
Количество плановых госпитализаций по поводу ССЗ |
1,39±1,03 |
1,76±1,35 |
0,21 |
|
Госпитализации по поводу НС |
5 (18) |
12 (35) |
0,035 |
|
Количество госпитализаций по поводу ОИМ |
0,25±0,58 |
0,28±0,67 |
0,78 |
|
Повторные ИМ |
2 (8) |
5 (16) |
0,48 |
|
ОНМК |
1 (4) |
2 (6) |
0,84 |
|
ХСН II и более ФК |
6 (21) |
10 (31) |
0,05 |
|
ХСН II А и более ст. |
3 (9) |
8 (29) |
0,05 |
|
Плановое ЧТКА |
1 (4) |
3 (9) |
0,53 |
|
Аневризмэктомия |
1 (4) |
- |
|
|
АКШ |
1 (4) |
6 (6) |
0,82 |
|
Показатели безопасности |
|||
|
НРС |
2 (8) |
2 (6) |
0,61 |
|
Онкопатология |
1 (4) |
1 (3) |
0,73 |
Cumulative Proportion Surviving (Kaplan-Meier) о Complete + Censored
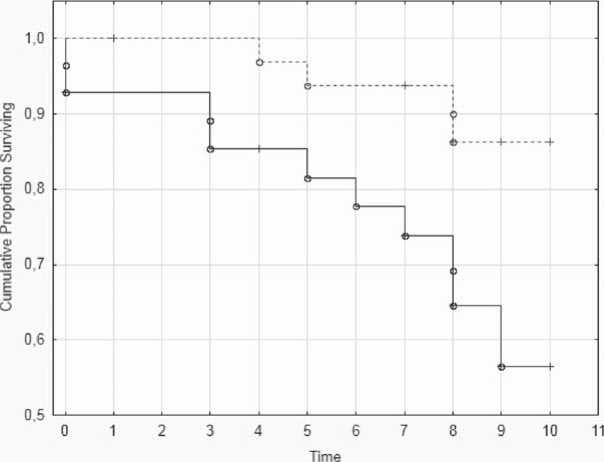
— Group 1,
---- Group 2,
Рис. 1. Сердечно-сосудистая летальность в основной группе и в группе контроля
14,8±9,2, р=0,014 (рис. 2).
Несомненно, в группе вмешательства мы закономерно ожидали более низкую как отдаленную летальность, так и частоту других конечных точек. Так, согласно результатам ранее опубликованных исследований, клеточная кардиомиопластика ассоциировалась с уменьшением общей летальности и более благоприятным течением заболевания в отдаленный период наблюдения [9, 11, 12], поэтому полученные результаты по общей и сердечнососудистой летальности для нас были неожиданны. Причиной такого результата может быть исходно более тя- желая коронарная недостаточность, большая площадь поражения левого желудочка при ОИМ, о чем свидетельствуют данные изучения перфузии миокарда. Однако нельзя исключить проаритмический эффект трансплантации АМККМ в отношении развития злокачественных аритмий, которые не были зарегистрированы на ЭКГ и могли привести к развитию внезапной сердечной смерти. В то же время следует заметить, что в целом наши результаты по 8-летней летальности соответствуют данным, полученным другими авторами. Они показывают, что прогноз болезни плохой, от 17 до 35% больных после перенесенного ОИМ погибают в течение 5-лет [12].
Проведен анализ встречаемости модифицируемых факторов риска (МФР) как при поступлении, так и при контрольном обследовании через 8 лет. Межгрупповой анализ динамики изменения МФР исходно и через 8 лет достоверных отличий не выявил [2]. При этом выявлена невысокая приверженность пациентов к рекомендованной стандартной медикаментозной терапии, результаты представлены на рисунке 3.
В контрольной группе было достоверно больше ком-плаентных пациентов по сравнению с основной (28% против 8%, р=0,045), это могло способствовать более благоприятному течению заболевания. Наиболее часто принимаемыми препаратами были дезагреганты (аспирин и
I -5
I s о
- 5 я
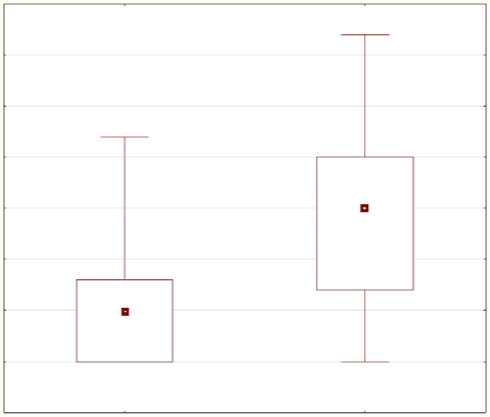
Статус
D Median □ 25%-75%
I Min-Max
Рис. 2. Преходящий дефект перфузии у больных ОИМ в 1-й группе: 1 – пациенты, прошедшие контрольное обследование; 2 – умершие пациенты за период 8-летнего наблюдения
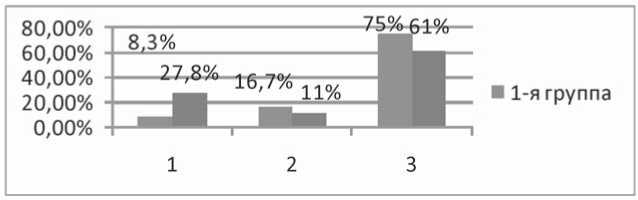
Рис. 3. Приверженность к стандартной медикаментозной терапии: 1 – комплаен-тные; 2 – недостаточно комплаентные; 3 – некомплаентные
Установлено, что ХСН II и более ФК чаще наблюдалась в контрольной группе (31% против 21%, р=0,05), диагноз ХСН IIA и IIБ чаще устанавливался во 2-й группе (29% против 9%, р=0,05). При этом сывороточный уровень BNP в обеих группах был умеренно повышен – 148 (65,7; 173) против 169 (39,4; 252,5 нг/мл), без различий между группами. Здесь важно отметить, что результаты наблюдения за этими больными в течение 6, 12 мес. не демонстрировали различий между группами на тот момент времени [1, 5, 6, 10]. К 8-летнему периоду наблюдения в группе контроля было достоверно больше госпитализации по поводу НС – 37,5% (12) против 19% (5) в основной группе, p=0,035. Эти данные свидетельствуют о более неблагоприятном течении ИБС среди пациентов, прошедших контрольное обследование, во 2-й группе, несмотря на то, что они были более привержены к рекомендованной медикаментозной терапии.
При анализе частоты развития ПИМ, ОНМК, частоты проведения повторных оперативных вмешательств по реваскуляризации миокарда (плановые чрескожная коронарная ангиопластика, аортокоронарное шунтирование) отличий между группами выявлено не было.
При анализе объемных параметров сердца достоверных отличий по группам не выявлено – КДИ (61,7±11,7 мл/м2 против 67±22,2 мл/м2), КCИ (28,9±9,2 мл/м2 против 33,25±16,9 мл/м2), и по ФВ (В-режим) (51±5,6% против 51,5±12,9%) группы были сопоставимы.
его аналоги), бета-блокаторы (БАБ), в значительно меньшей степени – ИАПФ и статины [2].
Мы оценили клинический статус на момент контрольного осмотра, результаты представлены в таблице 4.
Больные показывали хорошую ТФН, у большего количества из них отсутствовала стенокардия напряжения и ХСН, а при их наличии изменения соответствовали I ФК. По результатам ТШХ различий между группами не выявлено (499±92,5 м в основной группе против 488,2±189,8 м в группе контроля).
Немаловажным аспектом является безопасность трансплантации АМККМ в отношении развития проарит-мических эффектов, онкопатологии. По результатам нашего наблюдения, за истекший период частота развития клинически значимых нарушений ритма сердца в обеих группах была одинаковая (8 против 6%, p=0,61), жизнеугрожающие аритмии не регистрировались. Частота новых онкологических заболеваний была одинаковая в обеих группах (4% против 3%, p=0,73). Таким образом, показана ожидаемая клиническая безопасность клеточной кардиомиопластики в отдаленные сроки, которая соот-
Таблица 4
Клинические данные больных на момент контрольного осмотра, М±SD, n (%)
Согласно мета-анализу исследований по данной тематике, опубликованному 31 января 2011 г., наилучшие долгосрочные клинические результаты получены при трансплантации АМККМ в сроки до 7 суток и в количестве более 108 и у пациентов с выраженной дисфункцией левого желудочка (ЛЖ) [9]. В нашем исследовании вводилось достаточное количество АМККМ (120,5±49,2*106), однако трансплантация проводилась пациентам с сохранной фракцией выброса (ФВ) ЛЖ, в более поздние сроки (в среднем на 20±10-е сутки ОИМ). Установлено, что среди пациентов, которым проводилась трансплантация после 20-х суток ОИМ, чаще развивалась клинически значимая ХСН – II и более ФК по NYHA в отдаленный период наблюдения, р=0,01 (рис. 4).
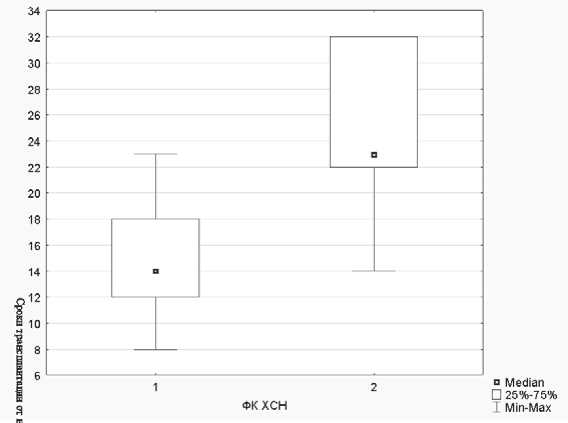
Рис. 4. Зависимость сроков трансплантации АМККМ и развитие ХСН: 1 – ХСН I ФК; 2 – ХСН II и более ФК
Проведен анализ влияния различных уровней факторов роста и цитокинов на частоту повторных ИМ, госпитализации по поводу НС, ХСН II и более ФК, ОНМК, смерти в отдаленный период наблюдения. При этом пациенты были разделены на группы по развитию конечных точек. За истекший период большая частота развитие повторных ИМ наблюдалась у пациентов с более высоким уровнем FGF в острый период ИМ (21,8 против 15,9; p=0,02). Вероятно, повышенный уровень FGF приводит к пролиферации фибробластов в атеросклеротических бляшках, возможно, способствует гемодинамически значимому стенозированию коронарных артерий. Кроме того, выявлено, что среди умерших пациентов наблюдался при ОИМ достоверно более высокий уровень FGF (17,2 против 16,3, p=0,001).
По результатам клинического обследования, развитие ХСН II ФК и более наблюдалось у пациентов с более низким уровнем HGF (706,7 против 4239,7; p=0,017), ХСН II А ст. и более наблюдалось у пациентов с более низким уровнем HGF (758,1 против 3998,5; p=0,025). Как известно, HGF является стимулятором неоангиогенеза, следовательно, установленные зависимости являются закономерными.
Кроме того, корреляционный анализ между уровнями факторов роста и цитокинов, а также объемными параметрами ЭхоКГ, такими как КДИ, КСИ, КДО, КСО, а также ФВ (В-режим) и уровнем BNP, а также количеством повторных ИМ и ФК ХСН. Установлена корреляционная связь между уровнем TNFα и неблагоприятным ремоделированием ЛЖ в отдаленный период наблюдения: выявлены положительные корреляционные связи между уровнями TNFα и КДИ – R=0,62, TNFα и КСИ – R=0,60, TNFα и стадией ХСН – R=0,47, p<0,05 (рис. 5).
Известно, TNFα образуется вскоре после ишемического повреждения кардиомиоцитов, влияет на их выживание и апоптоз и является эндогенным медиатором воспалительной реакции организма. В ранее проведенных исследованиях показана прямая корреляция между
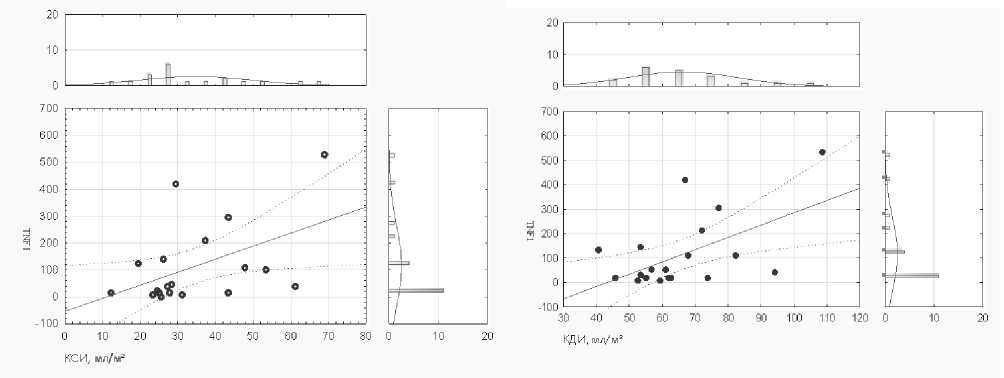
Рис. 5. Корреляционные связи между уровнем TNF α и КСИ, КДИ
уровнем TNFα и высокой частотой сердечно-сосудистых осложнений [13, 14]. Неблагоприятное влияние повышенного уровня TNFα на постинфарктное течение ИБС, в том числе и на эффективность клеточной кардиомиопластики, показано и в нашем исследовании.
Заключение
По результатам проведенного исследования не выявлено позитивного влияния трансплантации АМККМ на отдаленную выживаемость больных. Однако среди пациентов, прошедших контрольное обследование, в основной группе реже выявлялась клинически значимая ХСН и реже диагностировалась НС. Выявлены взаимосвязи между низким уровнем HGF при ОИМ и частотой развития клинически значимой ХСН, высоким уровнем FGF и частотой развития повторного ИМ, а также более высокой общей смертностью. Установлена прямая корреляция между уровнем TNFα и развитием клинически значимой ХСН с увеличением объемных параметров сердца (КСИ и КДИ).
Работы проведены при финансовой поддержке в рамках программы повышения конкурентоспособности ГБОУ ВПО “Национальный исследовательский Томский государственный университет” и на оборудовании Томского регионального центра коллективного пользования, приобретенного при поддержке Минобрнауки России по Соглашению № 14.594.21.0001.
Список литературы Отдаленные клинические результаты трансплантации аутологичных мононуклеарных клеток костного мозга больным при остром инфаркте миокарда
- Карпов Р.С., Рябов В.В., Суслова Т.Е. и др. Результаты шестимесячного наблюдения после трансплантации аутологичных мононуклеарных клеток костного мозга больным с острым первичным трансмуральным инфарктом миокарда//Креативная кардиология. -2007. -№ 1-2. -С. 200-208.
- Киргизова М.А., Рябов В.В. Отдаленные результаты после трансплантации аутологичных мононуклеарных клеток костного мозга больным острым инфарктом миокардом //Концент. -2014. -Приложение № 20 -URL: http://e-koncept.ru/ext/61 (дата обращения 15.06.2014).
- Маслов Л.Н., Рябов В.В., Сазонова С.И. и др. Регенерация миокарда человека//Патологическая физиология и экспериментальная терапия. -2006. -№ 4. -С. 28-32.
- Способ выделения мононуклеарных клеток костного мозга человека: пат. 2292895 Российская Федерация, МПК А61К 35/28/Т.Е. Суслова, В.В. Рябов, Ш.Д. Ахмедов и др.; заявитель и патентообладатель ГУ Научно-исследовательский институт кардиологии Томского научного центра СО РАМН -НИИ кардиологии ТНЦ СО РАМН (RU). -2005111326/15; заявл. 18.04.2005; опубл. 10.02.2007, Бюл. № 4. -5 с.
- Потапов И.В. Клеточная кардиомиопластика аутогенными клетками костного мозга -итоги трех рандомизированных клинических испытаний//Клеточная трансплантология и тканевая инженерия. -2007. -Т. 2, № 1. -С. 22-23.
- Рябов В.В., Суслова Т.Е., Крылов А.Л. и др. Кардиомиопластика с помощью аутологичных и мононуклеарных клеток костного мозга у больных острым инфарктом миокарда//Терапевтический архив. -2006. -Т. 78, № 8. -С. 47-52.
- Рябов В.В., Суслова Т.Е., Попонина Ю.С. и др. Влияние цитокинов и аутологичных мононуклеарные клеток костного мозга в процессах восстановительной регенерации при инфаркте миокарда//Сибирский медицинский журнал (Томск). -2006. -№ 3. -С. 22-25.
- Assmus B., Rolf A., Erbs S. et al. REPAIR-AMI Investigators. Clinical outcome 2 years after intracoronary administration of bone marrow-derived progenitor cells in acute myocardial infarction//Circ. Heart Fail. -2010. -Vol. 3(1). -Р. 89-96.
- Clifford M.D., Fisher S.A., Brunskill S.J. et al. Long-term effects of autologous bone marrow stem cell treatment in acute myocardial infarction: factors that may influence outcomes //PLoS ONE. -2012. -Vol. 4. -URL: www.plosone.org (дата обращения 24.03.2014).
- Karpov R.S., Popov S.V., Markov V.A. et al. Autologous mononuclear bone marrow cells during reparative regeneration after acute myocardial infarction//Bulletin of Experimental Biology and Medicine. -2005. -Vol. 140, No. 5. -Р. 640-643.
- Martin-Rendon E., Brunskill S.J., Hyde C.J. et al. Autologous bone marrow stem cells to treat acute myocardial infarction: a systematic review//Eur. Heart J. -2008. -Vol. 29. -P. 1807-1818.
- Ndrepepa G., Mehilli J., Martinoff S. et al. Evolution of left ventricular ejection fraction and its relationship to infarct size after acute myocardial infarction//J. Am. Coll. Cardiol. -2007. -Vol. 50. -P. 149-156.
- Nian M., Lee P., Khaper N. et al. Inflammation cytokines and postmyocardial infarction remodeling//Circulation Research. -2004. -Vol. 94. -P. 1543-1553.
- Ridker P., Rifai N., Pfeffer M. et al. Elevation of Tumor Necrosis Factor-a and increased risk of recurrent coronary event after myocardial infarction//Circulation. -2004. -Vol. 101. -P. 2149-2153.
- Wollert K.C., Drexler H. Cell therapy for the treatment of coronary heart disease: a critical appraisal//Nat. Rev. Cardiol. -2010. -Vol. 7. -P. 204-215.


