Отдаленные результаты хирургического лечения гигантской GIST пищевода
Автор: Афанасьев Сергей Геннадьевич, Августинович Александра Владимировна, Васильев Николай Вольтович, Савенкова Ольга Владимировна, Перельмутер Владимир Михайлович, Тузиков Сергей Александрович, Самцов Евгений Николаевич, Одышев Василий Михайлович, Авдеев Сергей Вениаминович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 1 (49), 2012 года.
Бесплатный доступ
Представлены отдаленные результаты успешного хирургического лечения гигантской гастроинтестинальной стромальной опухоли пищевода с неблагоприятными прогностическими признаками.
Gist пищевода, хирургическое лечение
Короткий адрес: https://sciup.org/14056191
IDR: 14056191 | УДК: 616.329-006-089.168
Текст научной статьи Отдаленные результаты хирургического лечения гигантской GIST пищевода
Гастроинтестинальные стромальные опухоли (gastrointestinal stromal tumors – GIST) составляют, по разным данным, от 0,1 до 3 % от всех злокачественных новообразований желудочно-кишечного тракта и принадлежат к наиболее часто встречаемым мезенхимальным опухолям пищеварительной трубки и ее дериватов. Типичной локализацией GIST является желудок (60–70 %), тонкая кишка (25–35%), толстая и прямая кишка (5 %). В редких случаях опухоль может выявляться в пищеводе, брыжейке, сальнике, забрюшинном пространстве, мягких тканях. Гастроинтестинальные стромальные опухоли чаще всего встречаются в возрастном интервале 50–70 лет, заболеваемость GIST среди мужчин и женщин приблизительно одинаковая [1, 3, 4, 6].
Поскольку первичная опухоль локализуется в подслизистом слое, то существуют определенные трудности в гистологической верификации диагноза на предоперационном этапе. С помощью эндоскопических методов морфологической верификации процесса до операции удается добиться не более чем в 50 % случаев. Небольшие образования чаще всего не дают клинических симптомов и являются случайными находками при проведении эндоскопических исследований или лапаротомии по поводу других причин. Нередко GIST выявляются в ходе экстренных операций, связанных с перфорацией органа или кровотечением [7, 10, 12]. На момент диагностирования заболевания у 15–50 % больных уже имеются метастазы, но степень распространения опухоли, как правило, ограничена пределами брюшной полости. При этом в 65 % случаев выявляются метастазы в печень, в 21 % наблюдается диссеминация по брюшине. Крайне редко поражаются регионарные лимфатические узлы, кости и легкие [8, 9].
Хирургическое вмешательство является основным методом лечения при отсутствии признаков диссеминации процесса. Однако его эффективность ограничена и определяется степенью локальной распространенности опухолевого процесса, а также радикальностью операции. Важными прогностическими признаками являются размер первичного очага и митотический индекс, опухоли диаметром более 5 см и с митотическим индексом, превышающим 5 на 50 полей зрения, ассоциируются с худшей отдаленной выживаемостью. Вне-гастральные локализации GIST также протекают более злокачественно [2, 5, 11].
Мы располагаем опытом успешного лечения и последующего 4-летнего наблюдения больной гастроинтестинальной стромальной опухолью пищевода с неблагоприятными прогностическими признаками.
Больная Т., 56 лет, поступила в торакоабдоминальное отделение НИИ онкологии СО РАМН г. Томска 12.05.08. При поступлении предъявляла жалобы на постоянное повышение температуры тела до 38ºС в течение нескольких недель, снижение массы тела за последние 6 мес на 15 кг, боли в эпигастрии. Впервые подслизистая опухоль средней трети пищевода была выявлена у пациентки в 2004 г. при ЭГДС. В то время от предложенного оперативного лечения по месту жительства больная отказалась. Находилась на диспансерном учёте у онколога в поликлинике. За последние полгода отметила ухудшение состояния, появление вышеуказанных жалоб. Обратилась за помощью в НИИ онкологии.
При объективном осмотре: состояние пациентки средней степени тяжести. Видимые слизистые, кожа бледноватые. При обследовании: в общем анализе крови отмечается анемия лёгкой степени тяжести, остальные анализы без патологии. При стандартной ЭГДС и эндоскопической ультрасонографии: пищевод свободно проходим до 28 см от резцов, далее его просвет сужается за счёт инфильтративных изменений, на 35 см от резцов бугристая опухоль с участками распада, контактно кровоточит, в центре новообразования имеется свищевой ход длиной до 3 см, просвет пищевода до субкардии представлен некротическими массами. Вход в желудок затруднен, в его просвете светлая жидкость, слизистая гипере-мирована, отёчна, привратник зияет, проходим.
Луковица ДПК деформирована, на передней стенке. Биопсия не бралась из-за высокого риска кровотечения. Заключение: опухоль пищевода с распадом, образованием свища, с возможным прорастанием в левое лёгкое.
Учитывая размеры опухоли, наличие свища, полости распада, было принято решение о вы-
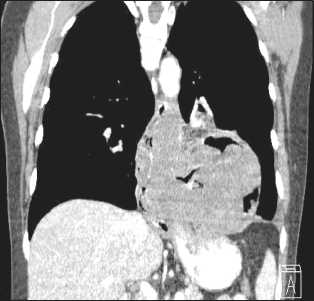
Рис. 1. КТ органов грудной клетки (реконструкция).
Распадающаяся опухоль, исходящая из нижней трети пищевода, пролабирует в левую плевральную полость, сдавливает нижнюю долю левого легкого
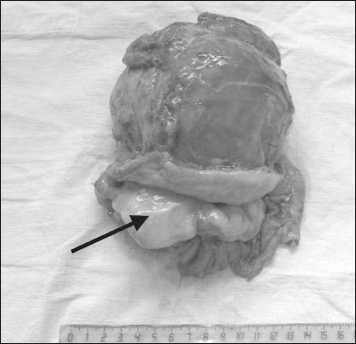
Рис. 2. Макропрепарат. Опухоль до 15 см в диаметре, исходящая из мышечной стенки пищевода. Пищевод рассечен, стрелкой указан его просвет
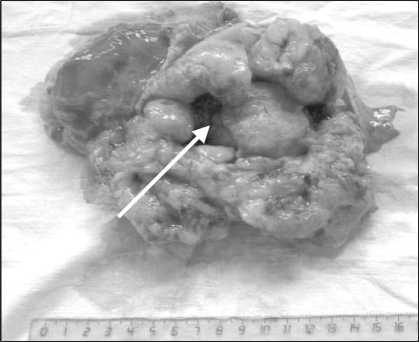
Рис. 3. Макропрепарат на разрезе. Опухоль с обширной полостью распада (указана стрелкой), формированием пищеводно-опухолевого свища
полнении радикальной операции. При планировании лечения основные трудности были связаны с выбором метода анестезиологического пособия, что было обусловлено тяжелым общим состоянием больной, расцененное как III степень по АSA, уровень анестезиологического риска – высокий. В итоге использовалось сочетание верхнегрудной эпидуральной аналгезии и эндобронхиального наркоза, ИВЛ осуществлялось через двухпросветную интубационную трубку.
Оперативное вмешательство выполнено 10.06.08 в объеме резекции пищевода, нижней лобэктомии слева. Учитывая преимущественную локализацию опухоли в левой плевральной полости, в качестве операционного доступа использовалась боковая торакотомия слева в VI межреберье. При ревизии опухоль до 15 см, исходит из мышечной стенки пищевода, занимает его среднюю и нижнюю трети, имеется перифокальная воспалительная инфильтрация диафрагмы и нижней доли левого лёгкого, последняя в состоянии карнификации. Преимущественно острым путём опухоль мобилизована из довольно плотных спаек с перикардом и дугой аорты. Диафрагма резецирована в пределах здоровых тканей. От нижней доли легкого опухоль отделена с помощью сшивающего аппарата, однако оставшаяся часть доли оказалась нежизнеспособной, поэтому выполнена типичная лобэктомия с аппаратным швом бронха. Продлён диафрагмотомический доступ. Желудок мобилизован по обеим кривизнам до антрального отдела, с перевязкой левой желудочной артерии. С помощью аппаратов желудок пересечён на уровне кардиального отдела, линия скрепочных швов дополнительно ушита отдельными узловыми швами. Сформирован желудочный трансплантат. Пилоропластика. С помощью аппарата пищевод пересечён под дугой аорты в пределах здоровых тканей. Желудочный трансплантат проведён в плевральную полость. Сформирован 2-рядный интраторакальный пищеводно-желудочный анастомоз по типу «конец-в-бок». Дополнительно анастомоз укрыт большим сальником. Отдельные узловые швы на диафрагму. Дренирование брюшной и плевральной полостей. Ушивание торакотомной раны.
На макропрепарате опухоль до 15 см в диаметре, исходящая из мышечной стенки пищевода, с обширными участками распада, формированием пищеводно-опухолевого свища. Признаков свищевого хода между пищеводом и легочной паренхимой не выявлено (рис. 2, 3).
Послеоперационный период протекал без осложнений. Операционная рана зажила первичным натяжением. Кожные швы сняты на 13-е сут после операции.
Для планового гистологического исследования операционный материал фиксировали в 10 % растворе нейтрального формалина, заливали в парафин и готовили срезы толщиной 4–5 мкм. Срезы окрашивали в водном растворе гематоксилина и эозина. При микроскопии: опухоль располагается в подслизистой основе, мышечном и адвентициальном слоях стенки пищевода с распространением в висцеральную плевру без признаков врастания опухоли в слизистую оболочку пищевода и ткань легкого. Новообразование построено слабо полиморфными веретеновидными клетками с ядрами овальной или вытянутой формы, с грубодисперги-рованным хроматином, с неотчетливым ядрышком в ядрах отдельных клеток, с бледной эозинофильной цитоплазмой (рис. 4). Клетки формируют неширокие пучки, располагающиеся в умеренно выраженном рыхлом матриксе. Осуществлялась оценка митотической активности опухолевой ткани посредством определения митотического индекса (подсчета митотических фигур в 50 полях зрения гистологического среза при большом увеличении объектива микроскопа). Митотический индекс равен 13. Атипические формы митоза не встречаются.
С целью определения иммунопрофиля опухоли было выполнено иммуногистохимическое исследование. Для этого использовали панель антител к следующим антигенам: SMA (clone 1A4, Dako), Desmin (clone DE-R-11, Novocastra), S-100 (поликлональное, Novocastra), CD34 (clone QBEnd 10, Dako), CD117 (c-kit) (Polyclonal, Dako). Наблюдалась выраженная экспрессия опухолевых клеток CD117 (c-kit) и экспрессия CD34. Иммуногистохимические реакции с антителами к Desmin, SMA, S-100 дали негативные результаты.
По совокупности результатов гистологического и иммуногистохимического исследований был сформулирован следующий диагноз: Злокачественная гастроинтестинальная стромальная опухоль пищевода (GIST). Оценка злокачественности процесса проведена в соответствии с выявленными критериями: размер опухоли – 15 см; МИ=13.
Пациентка находится под динамическим наблюдением в поликлинике НИИ онкологии. При очередном контрольном обследовании в ноябре 2011 г. данных за прогрессирование процесса нет. Больная жалоб не предъявляет, питание адекватное, специальной диеты не придерживается.
Таким образом, данное клиническое наблюдение свидетельствует о том, что, несмотря на ряд неблагоприятных факторов (большие размеры опухоли, наличие осложнений в виде свища, обширной полости распада и резорбтивной лихорадки, длительного анамнеза, изменений в смежных органах),

Рис. 4. Микрофото. Опухоль представлена слабо полиморфными веретеновидными клетками с ядрами овальной или вытянутой формы, с грубодиспергированным хроматином, с неотчетливым ядрышком в ядрах отдельных клеток, с бледной эозинофильной цитоплазмой. Окраска гематоксилином и эозином, ×200
хирургическое вмешательство является ведущим методом в лечении GIST и позволяет надеяться на полное выздоровление.


