Отдаленные результаты использования безимплантационной аннулопластики митрального клапана у пациентов с митральной недостаточностью ишемического генеза
Автор: Гордеев Михаил Леонидович, Майстренко Алексей Дмитриевич, Сухова Ирина Валентиновна, Майстренко Наталья Стелиановна, Исаков Сергей Викторович, Гурщенков Александр Викторович, Гребенник Вадим Константинович
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Ишемическая митральная недостаточность
Статья в выпуске: 1 т.19, 2015 года.
Бесплатный доступ
Цель. Оценить эффективность безимплантационной методики коррекции митральной недостаточности (МН) у больных с осложненной формой ишемической болезни сердца. Материал и методы. В исследование включены 300 пациентов с ишемической болезнью сердца, которым в период с 2009 по 2013 гг. выполнены прямая реваскуляризация миокарда и шовная аннулопластика митрального клапана (МК) в условиях искусственного кровообращения и кровяной кардиоплегии. Критерием отбора пациентов являлось наличие МН II и более степени, отсутствие структурных изменений створок МК по данным эхокардиографии (ЭхоКГ). Результаты.Госпитальная летальность составила 11 (3,6%) случаев. В структуре осложнений преобладала острая сердечно-сосудистая недостаточность (70% пациентов), обусловленная исходно выраженной систолической дисфункцией левого желудочка. В 21 (7%) случаях потребовалось применение внутриаортальной баллонной контрпульсации. По данным интраоперационной чреспищеводной ЭхоКГ, пластика МК признана эффективной у всех пациентов. Контрольное ЭхоКГ-исследование выполняли на 7-е сутки. У 288 пациентов (96%) МН отсутствовала, у 10 (3,3%) была приклапанная МН или I степени. У 2 больных (0,6%) сохранилась МН II степени. Рецидив МН в отдаленном периоде составил 22,8±7,1% (срок наблюдения 28,7±9,4 мес.). Через год после операции МН II степени зафиксирована у 17 человек (из 130 обследованных в отдаленном периоде), у 1 человека - МН III степени. Через 5 лет после операции МН III степени зафиксирована у 8 (6,2%) пациентов, МН II степени - у 34 (26,2%) человек. В отдаленном периоде летальность составила 8 (6,2%) пациентов. Причиной смерти у одного больного являлся разрыв аневризмы брюшного отдела аорты, в четырех случаях - острые нарушения мозгового кровообращения, у трех человек - прогрессирование сердечной недостаточности. Общая свобода от реопераций после аннулопластики МК при ишемической МН составила 97%. Выводы. Восстановление коаптации створок МК достигается за счет уменьшения межкомиссурального размера фиброзного кольца в среднем на 35%, и не сопровождается формированием митрального стеноза: максимальный градиент давления после пластики 4,7±1,1 мм рт. ст., средний - 2,2±0,6 мм рт. ст. Тяжесть сердечной недостаточности в интра- и раннем послеоперационном периодах обусловлена исходными степенью МН и сократительной способностью левого желудочка и не зависит от дополнения объема вмешательства шовной аннулопластикой. Безимплантационная методика позволяет эффективно устранить митральную недостаточность ишемического генеза, обусловленную изолированной дилатацией фиброзного кольца.
Ишемическая болезнь сердца, митральная недостаточность
Короткий адрес: https://sciup.org/142140653
IDR: 142140653 | УДК: 616.126.422-005.4-089.844.168
Текст научной статьи Отдаленные результаты использования безимплантационной аннулопластики митрального клапана у пациентов с митральной недостаточностью ишемического генеза
рование митрального клапана, то к 2000 г. анализ результатов оперативных вмешательств, выживаемости и качества жизни пациентов в совокупности с совершенствованием ЭхоКГ показал необходимость изменений подходов к хирургической тактике при данном пороке МК.
Материал и методы
В исследование включены 300 пациентов с ишемической болезнью сердца (ИБС), которым в период с 2009 по 2013 гг. выполняли прямую реваскуляризацию миокарда и шовную аннулопластику МК. Критериями отбора пациентов являлось наличие МН II и более ст., отсутствие структурных изменений створок МК, по данным ЭхоКГ. Из анализа исключены больные с аневризмой левого желудочка (ЛЖ), требовавшей хирургической коррекции, а также пациенты, которым выполнялось протезирование аортального клапана. Всем исследуемым выполнялась ЭхоКГ на дооперационном этапе. 216 (72%) больных включены в проспективное исследование, которое проводилось с середины 2011 г. В отдаленном периоде доступными для непосредственного контроля являлись 130 (43,3%) человек. Еще 84 (28%) пациента анкетированы отдаленно по телефону. Средний срок наблюдения составил 28,7±9,4 мес. Исходная клиническая характеристика пациентов, включенных в исследование, представлена ниже.
|
Возраст, лет Пол, n (%) |
68,4±5,2 |
|
мужчины |
212 (70,6) |
|
женщины |
88 (29,4) |
|
ФК СН (NYHA) |
3,2±0,6 |
|
ФК стенокардии (CCS) Баллы по шкале EuroScore |
3,09±0,4 |
|
Additive |
8,0±4,3 |
|
Logistic |
13,6±6,1 |
|
Индекс коморбидности (Charlston) |
6,8±0,4 |
В исследование также были включены пациенты, которым оперативное вмешательство выполнялась на фоне текущего инфаркта миокарда (ИМ). Средний срок между операцией и сердечно-сосудистым событием составил 1,6±1,3 года. Для больных с острым коронарным синдромом и текущим ИМ время между госпитализацией и операцией составило 13,2±9,1 ч.
158 (52,6%) пациентов ранее перенесли нижнезадний ИМ, 69 (23%) – боковой, 73 (75,4%) – комбинированный. При этом у 289 (96,3%) человек встречался ИМ II типа, а у 11 (3,7%) больных ИМ ассоциирован с тромбозами и рестенозами стентов (тип IV).
По данным коронарографии, у 276 (92%) пациентов встречалось трехсосудистое поражение коронарного русла, у 22 (6,7%) – поражение двух коронарных артерий. У двоих (1,3%)
выявлена окклюзия аутовенозных шунтов в бассейнах огибающей и правой коронарной артерий.
216 пациентов (72,1%) находились на синусовом ритме до операции, у 84 пациентов (27,9%) имелась фибрилляция предсердий (ФП) (постоянная или пароксизмальная форма). Желудочковые нарушения ритма, по данным холтеровского мониторирования, зарегистрированы у 105 пациентов (35,3%).
Трансторакальное эхокардиографическое исследование выполнялось на аппарате VIVID 7 (General Electric, США) с использованием трансторакального датчика 3S до и после операции. Особое внимание уделяли объективной оценке степени МН до операции. Применяли комплексный подход с расчетом площади струи, ширины vena contracta, индекс площади потока регургитации и метод PISA. Выраженную (III–IV ст.) МН имели 197 пациентов (66,2%): IV ст. – 22 пациента (7,4%), III ст. – 176 пациентов (58,8%). Степень МН оценивали по данным трансторакальной, чреспищеводной ЭхоКГ и вентрикулографии. Дооперационный протокол включал оценку размеров ЛЖ, его сократительной функции, состояния всех клапанов из стандартных позиций – парастернальной и апикальной (двух- и четырехкамерный вид). При выявлении МН в первую очередь исключали органическую причину порока (отрыв хорд, инфекционный эндокардит и др.), затем подробно оценивали зону коаптации, степень ремоделирования подклапанного аппарата (смещение папиллярных мышц, ПМ) МК и ЛЖ в целом (индекс сферичности, индекс нарушения сегментарной сократимости и др.). У всех пациентов отмечалась дилатация фиброзного кольца (ФК) (средний диаметр 38,9±2,8 мм) (см. табл. 1). Трикуспидальную недостаточность (ТН) III ст. имели 11 (3,7) пациентов, ещё у 4 (1,3%) больных ТН была II ст.
Во всех случаях операция выполнялась через срединную стернотомию, в условиях искусственного кровообращения (ИК), спонтанной гипотермии и тепловой кровяной кардиоплегии. У абсолютного большинства пациентов использовался антеретроградный способ введения кардиоплегического раствора. У 11 (3,7%) больных кардиоплегия проводилась только антеградно в связи с анатомическими особенностями коронарного синуса и высоким риском его повреждения. У 4 (1,3%) пациентов операция имела повторный характер (ранее выполнялось аортокоронарное шунтирование), кроме того в 8 (2,7%) случаях полость перикарда была запаяна после перенесенного инфаркта миокарда, что потребовало кардиолиза. В доперфузионном периоде у 8 (2,7%) пациентов проведена каротидная эндартерэктомия (ЭАЭ).
У большинства пациентов выполнено множественное коронарное шунтирование: среднее количество дистальных анастомозов составило 2,9±1,1, у 280 пациентов (93,3%) сформировано 3–4 дистальных анастомоза, у троих – выпол- нялась ЭАЭ из коронарной артерии. У 11 (3,7%) больных выполнена шовная аннулопластика трикуспидального клапана по R. Batista.
Доступ к МК у 286 (95,3%) пациентов осуществлялся через стенку левого предсердия (ЛП) в зоне межпредсердной борозды по Карпантье – транссептальный доступ с расслоением межпредсердной перегородки без вскрытия правого предсердия (ПП). Транссептальный доступ со вскрытием полости ПП использовался при необходимости коррекции ТН (11 пациентов), а также при технических трудностях выделения ЛП при повторных вмешательствах (двое больных).
После экспозиции проводилась ревизия створок МК и подклапанных структур. Во всех случаях отмечено расширение диаметра ФК при неизмененных или малоизмененных створках. Принципом выполнения используемой нами методики шовной аннулопластики являлось прошивание ФК с прилежащей частью стенки ЛП двумя параллельными линиями швов (Ethibond 2-0), начиная от одной комиссуры и заканчивая у другой, на всем протяжении задней части ФК МК. После каждого стежка (5–10 мм) обе нити связывались между собой, формируя серию узловых швов, гофрирующих и укорачивающих длину заднего кольца МК. Контроль эффективности пластики проводился до восстановления сердечной деятельности с помощью гидравлической пробы, в послепер-фузионном периоде – при помощи чреспищеводной ЭхоКГ (ЧП ЭхоКГ). Средняя продолжительность ИК составила 142,2±56,4 мин, время пережатия аорты – 87,0±34,3 мин.
Статистическая обработка данных проводилась с использованием программного пакета StatSoft Statistica v. 10.0. Средние показатели представлены в виде M± σ , где M – средняя арифметическая, σ – стандартное отклонение. Для оценки результатов использовались непарамерические методы анализа и мультифакторный регрессионный анализ.
Результаты
В структуре осложнений преобладала острая сердечно-сосудистая недостаточность (ССН) (70% пациентов), обусловленная исходно выраженной систолической дисфункцией ЛЖ. В 21 (7%) случаях потребовалось применение внутриаортальной баллонной контрпульсации. Данная группа больных характеризовалась исходно низкой фракцией выброса (ФВ) ЛЖ (34,8±8,3%). Терапия проявлений ССН проводилась комбинацией инотропных, вазопрессорных препаратов, по показаниям в реанимационном отделении начинали насыщение гликозидами. У 87 (29,1%) пациентов в раннем послеоперационном периоде наблюдались нарушения ритма в виде пароксизмов ФП. Во всех случаях синусовый ритм восстановлен на фоне медикаментозной терапии. Острая дыхательная недостаточность, потребовавшая перевода пациента на искусственную вентиляцию легких, обус- ловлена в большинстве случаев обострением хронического бронхита, а в 8 случаях тяжелой пневмонией. Осложнения со стороны раны включали в себя лигатурные свищи (1 случай) и нарушения заживления мягких тканей над грудиной (1 случай), что потребовало длительного стационарного лечения. Случаев медиастинита не зарегистрировано. Также одним из наиболее частых осложнений вмешательств на органах грудной полости являлся постперикардиотомный синдром. В это понятие мы включали – наличие асептического выпота в полости перикарда, выпота в плевральных полостях, эпизоды лихорадки при исключенной инфекционной причине. Основным методом лечения данного осложнения являлась терапия нестероидными противовоспалительными средствами, а в некоторых случаях применение глюкортикостероидных препаратов. В одном случае потребовалась операция фенестрации перикарда в связи с клиникой тампонады сердца выпотом. Статистика осложнений раннего послеоперационного периода представлена ниже.
|
Осложнение |
Абс. (%) |
|
Острая сердечно-сосудистая недостаточность |
254 (84,7) |
|
Нарушения ритма |
74 (24,7) |
|
Метаболические нарушения |
102 (34) |
|
Острая дыхательная недостаточность |
89 (29,7) |
|
Инфекционные осложнения со стороны раны |
2 (0,7) |
|
Неврологические осложнения |
14 (4,7) |
|
Острые нарушения мозгового кровообращения |
5 (1,7) |
|
Тяжелая энцефалопатия |
9 (3) |
|
Постперикардиотомный синдром |
94 (3,1) |
|
Всего |
300 (100) |
По данным интраоперационной ЧП ЭхоКГ, пластика МК признана эффективной у всех пациентов. Контрольное ЭхоКГ-исследование выполняли на 7-е сутки. У 288 пациентов (96%) МН отсутствовала, у 10 (3,3 %) выявлены прикла-панная МН или МН I cт. У двоих больных (0,6%) сохранилась МН II ст. Динамика ЭхоКГ-параметров в отдаленном периоде представлена в табл. 1.
Динамика изменений геометрии МК после операции представлена в табл. 2. Диаметр ФК МК, по данным интраоперационной ЧП ЭхоКГ, составил 28,2±3,1 мм, через 7 дней после операции – 29,3±4,1 мм. Максимальная скорость диастолического тока на МК незначительно увеличилась с 0,9±0,2 до 1,0±0,3 м/с, максимальный градиент после операции составил 4,4±2,1 мм рт. ст., оставаясь близким к физиологическому. При этом не зафиксировано ни одного случая артифициального митрального стеноза.
Рецидив МН в отдаленном периоде составил 22,8±7,1% (срок наблюдения 28,7±9,4 мес.). Так, через год после опера-
Таблица 1 Динамика параметров ЛЖ в отдаленном периоде, по данным ЭхоКГ
|
Параметр |
Период p* до операции 1 год 3 года 5 лет |
|
КДР ЛЖ, мм КСР ЛЖ, мм Поперечный размер ЛП, мм КСО ЛЖ, мл КДО ЛЖ, мл ФВ ЛЖ по Симпсону, % ФВ ЛЖ по Тейхольцу, % Индекс сферичности (в систолу) Индекс сферичности (в диастолу) Индекс нарушений сегментарной сократимости |
64,3±7,8 52,1±4,9 54,3±4,3 55,2±5,1 <0,05 52,8±6,3 44,2±6,1 43,8±6,5 44,2±3,8 <0,05 52,3±6,1 44,5±5,2 42,4±4,8 42,9±4,2 <0,05 161,2±17,3 114,2±14,2 110,7±13,7 118,6±21,1 <0,05 201,3±21,5 172,3±17,3 168,6±16,1 170,4±18,1 <0,05 44,3±15,8 46,1±13,4 45,8±11,9 41,7±13,4 0,6 34,3±11,2 40,2±9,8 40,8±7,9 39,2±9,3 0,08 0,65±0,12 0,5±0,08 0,5±0,09 0,57±1,0 <0,05 0,73±0,2 0,62±0,08 0,60±0,03 0,66±0,12 <0,05 1,4±0,4 1,2±0,4 1,1±0,7 1,3±0,6 0,02 |
* U-критерий Манна – Уитни
Таблица 2 Динамика изменений параметров митрального клапана, по данным ЭхоКГ
|
Показатель |
До операции |
1 год |
3 года |
5 лет |
p* |
|
Длина коаптации, см |
0,2±0,07 |
2,8±0,1 |
2,7±0,2 |
2,7±0,1 |
<0,05 |
|
Глубина коаптации, см |
1,8±0,02 |
0,2±0,08 |
0,5±0,06 |
0,9±0,1 |
<0,05 |
|
Площадь тентинга, см2 |
4,6±0,9 |
1,4±0,7 |
1,5±0,6 |
1,4±0,9 |
<0,05 |
|
Межпапиллярное расстояние, см |
2,7±0,3 |
2,3±0,1 |
2,35±0,3 |
2,5±0,4 |
>0,05 |
|
Диаметр ФК МК, мм |
28,2±3,1 |
29,3±4,1 |
29,8±3,6 |
32,2±1,6 |
– |
* U-критерий Манна – Уитни
ции МН II ст. зафиксирована у 17 человек (из 130 обследованных в отдаленном периоде), у 1 человека – МН III ст. Через 5 лет после операции МН III ст. отмечена у 8 (6,2%) пациентов, МН II ст. – у 34 (26,2%) человек. Мультифакторный регрессионный статистический анализ показал, что основными предикторами рецидива МН являлись: диаметр ФК МК после пластики более 26 мм (ОР 5,5; 95% ДИ 3,2–6,80; р <0,1), тяжелый острый нижнебоковой ИМ до операции (ОР 2,5; 95% ДИ 2,11–6,40; р <0,01), сниженная ФВ на уровне базальных отделов ЛЖ (ОР 3,4; 95% ДИ 1,8–4,1; р <0,05), дилатация полости ЛЖ (увеличение индекса сферичности) (ОР 4,7; 95% ДИ 2,11–6,44; р <0,01) и наличие акинезии в области нижнебоковой стенки (ОР 1,7; 95% ДИ 0,88–2,45; р <0,05).
Наблюдался отчетливый положительный клинический эффект операции в виде полного регресса клинической картины стенокардии напряжения у 100% больных. При этом двое пациентов в отдаленном периоде отмечали рецидив болей за грудиной, сжимающего характера, однако достоверно ишемический генез болевого синдрома не был подтвержден. Также отмечено достоверное уменьшение ФК СН после операции с 3,2±0,6 до 1,1±0,4. При этом в отдаленном периоде лишь у 12 (4%) наблюдалась выраженная СН (III ФК), обус- ловленная исходно сниженной ФВ ЛЖ и высокой легочной гипертензией.
Госпитальная летальность составила 11 (3,6%) случаев. Из них 4 больных прооперированы на фоне текущего ИМ с явлениями выраженной острой СН (II–III по Killip). 7 пациентов имели исходно низкую ФВ и тяжелую клинику СН. В раннем послеоперационном периоде развились явления полиорган-ной недостаточности, результатом которой стал летальный исход.
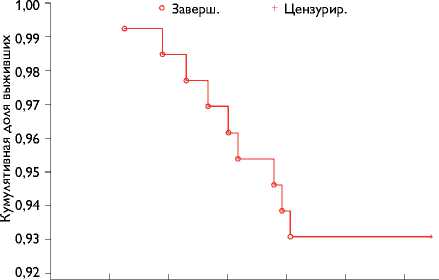
В отдаленном периоде умерли 8 (6,2%) пациентов. Причиной смерти у одного больного являлся разрыв аневризмы брюшного отдела аорты, в четырех случаях – острые нарушения мозгового кровобращения, у трех человек – прогрессирование СН. На рис. 1 представлена выживаемость больных в группах исследования. Общая свобода от реопераций после шовной аннулопластики МК при ИМН составила 97% (рис. 2).
Обсуждение
«Золотым стандартом» коррекции ИМН в настоящее время является рестриктивная аннулопластика опорным кольцом меньшего диаметра, чем измеренное межтригональное расстояние. На ранних сроках после операции (менее 6 мес.)
1,00
0,99
0,98
0,97
I 0,96
0,95
s 0,94 hr
0,93
0,92
° Заверш.
+ Цензурир.
20 25 30 35 40 45 50 55 60
Время жизни
Рис. 1 . Выживаемость больных в отдаленном периоде (Каплан – Майер)
2,8 3,0 3,2 3,4 3,6 3,8 4,0
Время жизни (log-rank)
Рис. 2 . Свобода от реопераций на МК у больных после аннулопластики (Каплан – Майер)
15–30% пациентов имели III–IV ст. МН [4]. Также отметим, что излишнее стремление к уменьшению размера ФК МК не влияет на частоту рецидива МН после пластики и может приводить к формированию градиента на МК и функциональному митральному стенозу [7].
В литературе представлено множество исследований по определению предикторами неудовлетворительных результатов использования ассиметричных опорных колец. Наиболее важными среди них являются дилатация камер сердца, конечный диастолический размер ЛЖ более 70 мм, конечный систолический объем ЛЖ более 145 мл, глубина коаптации створок более 0,5 см, увеличение угла задней створки более 45є, нарушение сегментарной сократимости в области боковой стенки ЛЖ, диаметр ФК МК более 37 мм, центральная или сложная струя МР и др. [3]. В связи с этим опубликовано множество работ, посвященных дополнительным вмешательствам на структурах МК, позволяющим еще больше уменьшить натяжение створок и увеличить их коаптацию, – это методики резекции вторичных хорд, вшивания заплат в заднюю створку МК, апроксимизация папиллярных мышц, их сближение, пликация стенки ЛЖ и др. Важно отметить, что альтернативой использованию опорных колец является шовная аннулопластика МК. В настоящее время работы, посвященные данным методам, являются единичными. За прошедшие 5 лет в иностранной литературе опубликована всего одна статья, посвященная технике аннулопластики МК по Paneth – Burr, где авторы докладывают перспективные результаты как в раннем, так и отдаленном периодах [1]. Нашим коллективом ранее была также опубликована статья о непосредственных результатах использования шовной аннулоплас-тики МК по R. Batista [1, 2]. К сожалению, приведенные исследования во многом лимитированы количеством больных и сроками оценки результатов, что не позволяет в настоящий момент судить об их корректности. В связи с этим представленные нами результаты являются актуальными.
Шовная аннулопластика МК по R. Batista направлена на улучшение коаптации створок за счет уменьшения переднезаднего диаметра ФК. Именно степень уменьшения диаметра ФК мы считаем основным предиктором эффективности операции. Недостаточная редукция его диаметра сопровождается возникновением приклапанной МР, которая в дальнейшем прогрессирует до выраженной.
Представленные нами результаты сопоставимы с результатами использования плоских опорных колец, описанными в литературе [8]. Полученный нами процент рецидива МН (22,8±7,1%) после операции также сопоставим с данными литературы [1, 5]. При подробном подгрупповом анализе выявлены следующие возможные причины. Большинство пациентов с рецидивом МН II и более ст. имели сложную конфигурацию струи митральной регургитации до операции, в том числе и вдоль передней створки. Эффективность применяемой нами методики у пациентов с центральным направлением струи достигает практически 100% в связи с эффективным уменьшением диаметра задней части фиброзного кольца и уменьшением натяжения задней створки. Немаловажным также является функциональное состояние базальных отделов ЛЖ. У всех пациентов с рецидивом МН исходно имелось резкое снижение сократительной способности в данных сегментах ЛЖ. Интересно отметить, что данные пациенты не всегда имели выраженную дилатацию полости ЛЖ и сниже- ние его глобальной ФВ. Это подтверждается работой S. Lima и соавт. [6], в которой они показали, что наличие диссенер-гии в базальных и базально-латеральных отделах ЛЖ является статистически более значимым предиктором возникновения ИМН, чем глобальная систолическая дисфункция. Таким образом, анализ результатов хирургических вмешательств позволил определить группу высокого риска, у которой методика шовной аннулопластики МК не является эффективной. Тщательное и подробное ЭхоКГ-исследование до операции позволяет выделить данный контингент пациентов, что в дальнейшем в значительной степени отразится на тактике хирургического вмешательства. Очевидным является факт необходимости дополнительного воздействия на структуры МК (резекция вторичных хорд, сближение и апроксимиза-ция ПМ). При этом в компетенцию хирурга должно входить адекватное представление о технической возможности исполнения дополнительного вмешательства и будущей пользы с учетом более длительной аноксии миокарда.
По полученным нами данным можно также говорить о безопасности методики. Как уже было показано выше, практически все госпитальные летальные исходы были обусловлены тяжелым исходным состоянием пациентов и запущенностью основного заболевания. По итогам проведенного мультифак-торного анализа, именно острый ИМ на момент операции являлся неблагоприятным предиктором исхода.
Выводы
Представленная в работе методика является безопасной, технически несложной и не требует специального материального оснащения. Наш опыт применения шовной аннуло-пластики позволяет говорить об удовлетворительных непосредственных и отдаленных результатах коррекции МН у больных ИБС. Ее использование позволило устранить или уменьшить степень МН, не прибегая к протезированию клапана, у 96% оперированных больных. При этом эффективная редукция диаметра ФК МК не сопровождалась формированием артифициального митрального стеноза.
Список литературы Отдаленные результаты использования безимплантационной аннулопластики митрального клапана у пациентов с митральной недостаточностью ишемического генеза
- Гордеев М.Л., Майстренко А.Д., Сухова И.В. Хирургическая коррекция митральной недостаточности ишемического генеза с использованием безимплантационной методики//Palmarium Academic Publishing, 2013. 107 с.
- Исаков С.В., Сухова И.В., Паскарь Н.С. и др. Непрерывная шовная аннулопластика митрального клапана при хирургическом лечении пациентов с ишемической болезнью сердца//Вестник СПБГУ. 2012. Т. 11 (3). С. 85-87.
- Bouma W., van der Horst I., Wijdh-den Hamer I. Chronic ischaemic mitral regurgitation: current treatment results and new mechanism-based surgical approaches//Eur. J. Cardio-thoracic Surgery. 2010. Vol. 37. P. 170-85.
- Braun J., van de Veire N.R., Klautz R.J. et al. Restrictive mitral annuloplasty cures ischemic mitral regurgitation and heart failure//Ann. Thorac. Surg. 2008. Vol. 85. P. 430-36.
- Gelsomino S., Lorusso R., De Cicco G. et al. Five-year echo-cardiographic results of combined undersized mitral ring annuloplasty and coronary artery bypass grafting for chronic ischaemic mitral regurgitation//Eur. Heart J. 2008. Vol. 29. P. 231-40.
- Lima S., Ferreira A., Andrade M.J. et al. Inferior and inferior-lateral location of left ventricular dyssynergy after myocardial infarction begets ischemic mitral regurgitation//Rev. Port. Cardiol. 2009. Vol. 28 (11). P. 1191-200.
- Marten C.E., Castaco M., Gomez-Plana J. et al. Mitral stenosis after IMR ETlogix ring annuloplasty for ischemic regurgitation//Asian Cardiovasc. Thorac. Ann. 2012. Vol. 20 (5). P. 534-38.
- Vergnat M., Levack M.M., Jassar A.S. et al. The influence of saddleshaped annuloplasty on leaflet curvature in patients with ischaemic mitral regurgitation//Eur. J. Cardiothorac. Surg. 2012. Vol. 42 (3). P. 493-99.


