Отдаленные результаты комбинированного этапного подхода в лечении больных с фибрилляцией предсердий и коронарным шунтированием
Автор: Богданов Юрий Игоревич, Вечерский Юрий Юрьевич, Баталов Роман Ефимович, Затолокин Василий Викторович, Попов Сергей Валентинович
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.32, 2017 года.
Бесплатный доступ
Статья посвящена проблеме хирургического лечения ишемической болезни сердца (ИБС) в сочетании с фибрилляцией предсердий (ФП). Несмотря на увеличение хирургических вмешательств по коррекции ФП во время коронарного шунтирования (КШ), в среднем хирургическая аблация ФП выполняется лишь у 27,5% пациентов во время КШ. В статье приведены отдаленные результаты одноцентрового, проспективного исследования по оценке эффективности комбинированного этапного подхода в лечении больных с ФП и КШ в сравнении с одноэтапной хирургической аблацией ФП.
Ишемическая болезнь сердца, фибрилляция предсердий, коронарное шунтирование, хирургическая аблация
Короткий адрес: https://sciup.org/14920176
IDR: 14920176 | УДК: 616.12-008.313.2-089
Текст научной статьи Отдаленные результаты комбинированного этапного подхода в лечении больных с фибрилляцией предсердий и коронарным шунтированием
ФП является наиболее распространенным видом нарушения ритма сердца среди наджелудочковых тахиаритмий. По данным многоцентровых клинических исследований выявлено, что распространенность ФП составляет около 0,5% в возрасте от 50 до 59 лет, после 75 лет – до 9%, причем чаще регистрируется у мужчин. По данным Фремингемского исследования, наличие ФП увеличивает риск инсульта в 5 раз. У больных ИБС или сердечной недостаточностью ФП удваивает риск инсульта у мужчин, а у женщин утраивает. Для лиц в возрасте от 80 до 89 лет ФП является единственным сердечно-сосудистым заболеванием, которое независимо от других факторов влияет на частоту инсультов. Атрибутивный риск инсульта снижается с возрастом при всех сердечно-сосудистых состояниях, кроме ФП, при которой риск значительно увеличивается [1].
В ретроспективном исследовании, включавшем 21534 пациента после операции аортокоронарного шунтирования (АКШ), было показано, что ФП в предоперационном периоде является независимым предиктором ранней и отдаленной летальности [2]. Несколько когортных исследований признали ФП маркером для повышенной летальности [3]. Средний возраст пациентов, которым выполняется операция АКШ, увеличивается, следовательно, увеличивается число пациентов с ФП, подлежащих операции АКШ. По данным одного из исследований, распространенность ФП у пациентов с изолированной АКШ составляет от 2,7% у молодых пациентов до 22,3% для пациентов в возрасте 75–80 лет. Как правило, пациенты с ФП, подвергающиеся операции АКШ, более пожилые, со сниженной фракцией выброса (ФВ), они чаще страдают сахарным диабетом и артериальной гипертензией по сравнению с пациентами без ФП [5].
Тем не менее ФП как переменная никогда не входила в калькуляторы расчета периоперационного риска, такие как Euroscore и STS score. ФП особенно ухудшает прогноз у кардиохирургических пациентов с низкой ФВ и хронической сердечной недостаточностью [3, 4].
Материал и методы
Данное исследование относится к проспективным, одноцентровым, контролируемым исследованиям. В НИИ кардиологии (Томск) за период с 2012 по 2015 гг. выполнено 50 операций по коррекции ФП во время операции КШ. В исследование включены больные в возрасте от 18 до 90 лет с верифицированной ИБС, показаниями к КШ и подтвержденной ФП. В исследование включено 28 пациентов (24 мужчины и 4 женщины) в возрасте от 44 до 76 лет (средний возраст – 64,1±7,8 лет) с персистирующей и длительно персистирующей формами ФП и ИБС (табл. 1).
При поступлении в стационар большинство пациентов предъявляли жалобы на перебои в работе сердца (95%), учащенное сердцебиение, давящие боли за грудиной и одышку (91%). Все пациенты получали антиарит-мические терапию на догоспитальном этапе. Однако в 95% она оказалась неэффективна. На госпитальном этапе всем пациентам проводилось следующее обследование: электрокардиограмма (ЭКГ) в 12 отведениях, клинический и биохимический анализ крови, трансторакальная эхокардиография, чреспищеводная эхокардиография для исключения тромбов в ушке левого предсердия, коронарография выполнялась при ее отсутствии на догоспитальном этапе.
В зависимости от методики пациенты были распределены на 2 группы. Пациентам первой группы выполнялась прямая реваскуляризация миокарда и эпикардиальная биполярная радиочастотная аблация легочных вен и крыши левого предсердия с использованием биполярных электродов Atricure и резекцией ушка левого предсердия, а также электрофизиологического исследования через 16±7 дней после операции с катетерной эндокардиальной антральной изоляцией легочных вен, в случае обнаружения восстановления проведения в легочные вены
Таблица 1
Клиническая характеристика пациентов
|
Показатели Эпи+эндокардиальная аблация (n=18) |
Эпикардиальная аблация (n=10) |
|
|
Возраст 64±4 лет |
63±3,3 лет |
|
|
Длительно персистирующая ФП |
11 |
6 |
|
Персистирующая ФП |
7 |
4 |
|
Длительность пароксизма (мес.) |
9±3,2 |
10±2 |
|
ФВ% 65±2% |
62±3% |
|
|
Средние размеры ЛП, мм |
58±1,6 |
53,1±4,4 |
|
Аритмический анамнез (годы) |
3±0,7 |
3±1,3 |
|
NYHA class% I |
29,7% |
32,3% |
|
II |
70,3% |
66,7% |
|
Инфаркт в анамнезе% |
28,8% |
33,3% |
|
Объем поражения коронарного |
||
|
русла Syntax (средний балл) |
24,5 |
25,3 |
(n=18). Во второй (контрольной) группе пациентов выполнялась прямая реваскуляризация миокарда и только биполярная эпикардиальная аблация по вышеописанной схеме (n=10). Всем пациентам выполнена перевязка ушка левого предсердия для предотвращения образования тромбов. Результаты оценивались по суточному мониторированию ЭКГ.
Результаты и обсуждение
В раннем послеоперационном периоде и на 30-е сутки после операции пациентам проведено суточное мониторирование ЭКГ. У 1 пациента основной группы (5,6%) и у 3 пациентов контрольной группы (30%) зарегистрированы рецидивы ФП на госпитальном этапе. По данным ЭФИ, полная электрическая изоляция всех легочных вен после биполярной эпикардиальной аблации была достигнута у 5 пациентов (27,7%). В остальных случаях было выявлено восстановление проведения в легочные вены (72,3%). Во всех случаях обнаружения восстановления проведения выполнялась антральная изоляция легочных вен. Согласно последним данным, восстановление проведения в легочных венах очень часто наблюдается среди пациентов, свободных от ФП. Это было подчеркнуто в других исследованиях на пациентах без клинических рецидивов аритмии. Эти результаты подтверждают необходимость дальнейшего изучения роли восстановления проведения в легочных венах в развитии рецидивов после процедуры аблации. По результатам наблюдения, через 12 месяцев после вмешательства синусовый ритм сохранялся у 15 пациентов группы этапного подхода (83,3%), по сравнению с 6 пациентами контрольной группы (60%), рисунок 1. Осложнение в виде кровотечения зарегистрировано у одного пациента основной группы (5,6%), что потребовало ревизии в первые сутки после операции и переливания свежезамороженной плазмы (табл. 2). Источником кровотечения являлась коллатераль левой внутренней грудной артерии. Летальных исходов в обеих группах не зарегистрировано.
Заключение
Одним из преимуществ эндокардиальной аблации является возможность проведения ЭФИ, так как у пациентов после операции АКШ возникает необходимость верификации электрофизиологических изменений после эпикардиальной аблации.
За последнее десятилетие катетерная аблация и хирургическое лечение ФП достигли значительных результатов. Разработка новых источников энергии и миниин-вазивных подходов вывели лечение ФП на качественно новый уровень. На сегодняшний день аблация ФП при операции КШ улучшает прогноз без значительного увеличения операционного риска для пациента.
Хотя рутинное интраоперационное картирование в настоящее время недоступно для контроля эффективности аблации во время кардиохирургической операции, по всей вероятности, стратегия, основанная на комбинировании преимуществ хирургического метода при операции КШ и электрофизиологического исследования с
Таблица 2
Полученные результаты
|
Показатели |
Эпи+эндокардиальная аблация (n=18) |
Эпикардиальная аблация (n=10) |
|
Рецидив ФП (30 дней) |
5,6% |
30% |
|
Синусовый ритм через 12 мес. |
83,3% (p<0,05) |
60% (p<0,05) |
|
Осложнение (кровотечение) |
5,6% |
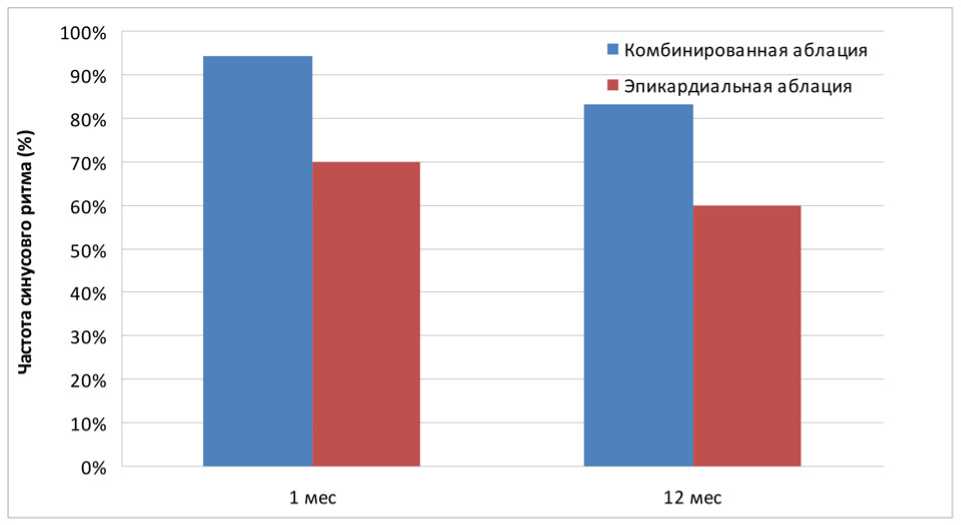
Рис. 1. Эффективность коррекции ФП через 12 мес.
катетерной аблацией, в раннем послеоперационном периоде способна улучшить результаты путем достижения большей трансмуральности, устранения прорывов абла-ционных линий и нанесения дополнительных воздействий на этапе электрофизиологического исследования и катетерной аблации.
Список литературы Отдаленные результаты комбинированного этапного подхода в лечении больных с фибрилляцией предсердий и коронарным шунтированием
- Wolf P.A., Abbott R.D., Kannel W.B. Atrial fibrillation as an independent risk factor for Stroke: the Framingham Study//Stroke. -1991. -No. 22. -P. 983-988.
- Saxena A., Kapoor J., Dinh D.T. et al. Preoperative atrial fibrillation is an independent predictor of worse early and late outcomes after isolated coronary artery bypass graft surgery//J. Cardiol. -2015. -Vol. 65. -P. 224-229.
- Benjamin E.J., Wolf P.A., D’Agostino R.B. et al. Impact of atrial fibrillation on the risk of death: the Framingham Heart Study//Circulation. -1998. -Vol. 98. -P. 946-952.
- Quader M.A., McCarthy P.M., Gillinov A.M. et al. Does preoperative atrial fibrillation reduce survival after coronary artery bypass grafting?//Ann. Thorac. Surg. -2004. -Vol. 77. -P. 1514-1524.
- Ad N., Barnett S.D., Haan C.K. et al. Does preoperative atrial fibrillation increase the risk for mortality and morbidity after coronary artery bypass grafting?//J. Thorac. Cardiovasc. Surg. -2009. -Vol. 137. -P. 901-906.


