Отдаленные результаты многокомпонентного лечения местно-распространенного рака шейки матки с учетом гистологического строения опухоли
Автор: Саевец Валерия Владимировна, Жаров Александр Владимирович, Важенин Андрей Владимирович, Чернова Людмила Федоровна, Шимоткина Ирина Григорьевна, Губайдуллина Татьяна Николаевна, Кравченко Галина Рудольфовна, Аржанникова Диана Фаритовна
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Актуальные вопросы здравоохранения
Статья в выпуске: 2 т.15, 2015 года.
Бесплатный доступ
Цель - оптимизировать лечебную тактику и уточнить прогноз заболевания у больных местно-распространенным РШМ IIB-IIIB стадиями на основании изучения отдалённых результатов многокомпонентного лечения с учётом морфологического варианта опухоли. Материалом для исследования послужили результаты наблюдений за 152 больными с диагнозом: РШМ IIB-IIIB стадиями заболевания, получившие многокомпонентное лечение. Проведена оценка эффективности различных вариантов лечения рака шейки матки в зависимости от гистологического строения опухоли. Метастатическое поражение лимфатических узлов диагностировано у 21 (21,2 %) пациентки с ПлРШМ и у 11 (20,8 %) с аденогенными формами рака - 5 (29,4 %) с ЖПлРШМ и у 6 (16,7 %) с АКШМ. Общая и безрецидивная выживаемость больных в группе с ПлРШМ была достоверно выше, чем при аденогенных формах РШМ. Аденогенные формы рака шейки матки должны рассматриваться как наиболее агрессивные опухоли с неблагоприятным прогнозом, по сравнению с ПлРШМ.
Рак шейки матки, химиолучевое лечение, хирургическое лечение
Короткий адрес: https://sciup.org/147153264
IDR: 147153264 | УДК: 616-006.6 | DOI: 10.14529/ozfk150211
Текст научной статьи Отдаленные результаты многокомпонентного лечения местно-распространенного рака шейки матки с учетом гистологического строения опухоли
Введение. Рак шейки матки (РШМ) является одним из самых распространенных онкологических заболеваний и составляет около 12–20 % злокачественных новообразований женских половых органов [4].
В нашей стране в последние годы отмечена тенденция к росту заболеваемости РШМ – за период 2001–2011 гг. прирост составил 26,94 % [5].
В настоящее время для лечения больных РШМ используют все три метода специального лечения: лучевой, хирургический и химиотерапевтический. Ведущую роль играет лучевая терапия. Её как самостоятельный метод, а также в плане комбинированного и комплексного лечения используют более чем у 90 % пациенток. Хирургическое вмешательство выполняется, как правило, больным с ранними стадиями заболевания. Быстрое развитие химиотерапии привело к тому, что больным с местно-распространённым РШМ всё чаще в схему лечения начали включать цитостатические препараты. Применение полихимиотерапии позволило у ряда пациенток добиться выраженной регрессии опухоли. Таким образом, местно-распространённый опухолевый процесс удавалось переводить в условно локализованную форму заболевания и выполнять хирургическое вмешательство.
Преимуществами хирургического метода являются возможность сохранения функции яичников и эластичности влагалища. Кроме того, во время операции у хирурга есть возможность оценить истинное распространение опухолевого процесса (отдалённые метастазы, метастазы в забрюшинные лимфатические узлы, распространение по брюшине) и тем самым уточнить стадию заболевания. В свою очередь выполнение операции позволяет удалить химио- и радиорезистентные клетки, которые в последующем могут приводить к не-излеченности процесса и локо-регионарным рецидивам заболевания.
Тенденцией последних лет является уменьшение удельного веса пациенток с плоскоклеточным РШМ и увеличение железистого и железисто-плоскоклеточного гистологических вариантов опухоли. В литературе до сих пор нет единого мнения о роли гистологической структуры опухоли при выборе метода лечения и оценке прогноза заболевания.
В этой связи актуальность проблемы выбора тактики лечения и оценке прогноза заболевания у больных местно-распространённым РШМ в зависимости от варианта гистологического строения опухоли не вызывает сомнений.
Цель исследования – оптимизировать лечебную тактику и уточнить прогноз заболевания у больных местно-распространенным
РШМ IIB–IIIB стадиями на основании изучения отдалённых результатов многокомпонентного лечения с учётом морфологического варианта опухоли.
Материалы и методы. За период с января 2000 г. по декабрь 2010 г. было проведено ретроспективное исследование на базе ГБУЗ «Челябинский областной клинический онкологический диспансер» и ОАО «РЖД» Дорожная клиническая больница. Материалом для исследования послужили результаты наблюдений за 152 больными с диагнозом: РШМ IIB–IIIB стадиями заболевания, получившие многокомпонентное лечение. Перед началом лечения всем пациенткам проводилось комплексное клиническое обследование, включающее сбор анамнеза, жалоб, осмотр шейки матки в зеркалах, бимануальный и ректовагинальный осмотр, пересмотр гистологического исследования биопсийного материала с места жительства.
В соответствии с целью исследования все больные были разделены в зависимости от варианта гистологического строения опу- холи на две группы. Первую составили пациентки с плоскоклеточным раком шейки матки (ПлРШМ) 99 человек. Вторую – с железисто-плоскоклеточным раком (ЖПлРШМ) и аденокарциномой шейки матки (АКШМ) составили 53 больные. Данные два гистологических типа с учетом наличия железистого компонента были объединены в одну группу.
До хирургического лечения больные в зависимости от стадии болезни по системе TNM (2009 г.) распределились следующим образом, данные представлены в табл. 1.
Из табл. 1 видно, что большая часть пациенток – 101 (66,4 %) человек была со второй стадией заболевания – T2bNxM0, 51 (33,6 %) с третей – T3bNxM0.
Распределение больных по возрасту с учетом гистологической структуры опухоли и стадии заболевания представлено в табл. 2.
Медиана возраста больных с местнораспространенным ПлРШМ II стадии составила 37,3 лет, с III стадией – 38,1 лет в группе с АКШИ и ЖПлРШМ II стадии – 46,3 лет, с III стадией – 45,9. Следовательно, по возрас-
Таблица 1
Распределение больных по системе TNM (2009 г.)
|
TNM |
Гистологический вариант опухоли |
|||||||
|
ПлРШМ n = 99 |
АКШМ n = 36 |
ЖПлРШМ n = 17 |
АКШМ+ЖПлРШ n = 53 |
|||||
|
абс. |
% |
абс. |
% |
абс. |
% |
абс. |
% |
|
|
T3NxM0 |
28 |
28,3 |
14 |
38,9 |
9 |
52,9 |
23 |
43,4 |
|
Всего |
99 |
100 |
36 |
100 |
17 |
100 |
53 |
100 |
Таблица 2
Распределение больных по возрасту с учётом гистологической структуры опухоли и стадии заболевания
По форме роста первичной опухоли больные распределились следующим образом. У больных с ПлРШМ II и III стадии преобладала экзофитная форма роста опухоли – 57,7 и 60,7 %. При аденогенных формах при II и III стадии существенно чаще встречалась эндофитная форма роста – 50,3 и 60,9 % наблюдений. Смешанная форма диагностировалась не часто при всех гистологических вариантах. Рост железистого рака в превалирующем числе случаев начинается в цервикальном канале, что и обусловливает чаще всего эндофитный рост опухоли.
При внеорганном распространении опухоли было выявлено, что при всех гистологических типах опухоли у пациенток преобладающим вариантом был влагалищно-парамет-ральный вариант. Поражение параметральной клетчатки встречалось с одной и двух сторон в виде различной выраженности опухолевых инфильтратов, распространяющихся вплоть до стенки таза при третьей стадии болезни.
По степени дифференцировки больные распределились следующим образом: при ПлРШМ у 73 (73,1 %) умеренная дифференцировка, 26 (26,3 %) женщин низкая дифференцировка опухоли. При аденогенных формах 39 (73 %) больных с умеренно дифференцированными опухолями и 14 (26,4 %) с низкой степенью дифференцировки. Таким образом, группы между собой сопоставимы.
Всем больным на первом этапе было проведено 2 цикла химиотерапии. В подгруппах 1 и 2 использовалась схема LFP, которая заключалась в пероральном приёме ломустина 80 мг/м2 в первый день, 5-фторурацил по 350 мг/м2 со 2 по 6 дни внутривенно капельно, цисплатин 100 мг/м2 на 7 день. Интервал между циклами химиотерапии составлял 3 недели. В подгруппах 3 и 4 химиотерапия проводилась по схеме САР, которая заключалась во внутривенном введении препаратов цисплатина в дозе 80 мг/м², циклофосфана 800 мг/м², доксорубицина 80 мг/м² в первый день лечения.
При полной или частичной резорбции опухоли и исчезновении инфильтратов в параметриях, выполнялось хирургическое лечение в объеме расширенной гистерэктомии III типа (модификация Вертгейма-Мейгса). У 15 (9,9 %) пациенток (10 – ПлРШМ и 5 – АКШМ) с ос- таточной инфильтрацией параметральной клетчатки после 2 циклов НАПХТ проведена предоперационная ДГТ до 30 Гр в традиционном режиме, посредствам которой удалось добиться резорбции опухоли в параметриях и выполнить запланированное хирургическое лечение.
Последним этапом многокомпонентного лечения проводилась послеоперационная лучевая терапия. Послеоперационное лечение местнораспространённого рака шейки матки проводилось до суммарной очаговой дозы в точке В 40–50 Гр. Облучение в статическом или подвижном режиме планировалось с учетом неблагоприятных прогностических факторов (глубокая инвазия, распространение опухоли на тело матки, метастазы в регионарные лимфатические узлы). При наличии вышеперечисленных факторов облучение начиналось со статического режима до СОД в точке В 20 Гр (РОД 2 Гр в т. В), затем в подвижном режиме до СОД 50 Гр в т В (РОД 2 Гр в т. В). В статическом режиме облучение начинали на аппарате Theratron Elite 80, или ускорителе SL 15 или Electa Synergy с двух открытых полей, S = 16·18 – 20 см, разовая очаговая доза 2 Гр в точку В до СОД 20 Гр в т. В, затем в режиме двухосевой ротации под углом 180° с двух параллельных полей, S = 6·18 – 20 см, расстояние между полями на уровне внутреннего зева 6 см, разовая очаговая доза 2 Гр, сyммар-ная очаговая доза 50 Гр. При отсутствии метастазов в тазовых лимфатических узлах ДГТ проводили до СОД 40 Гр в т. В в режиме 2-осевой ротации под углом 180° с двух параллельных полей, S = 6·18 – 20 см, расстояние между полями на уровне внутреннего зева 6 см, РОД 2 Гр в т. В. При отсутствии неблагоприятных прогностических факторов послеоперационное облучение проводилось в ротационном режиме до СОД 40 Гр.
Статистическая обработка результатов проводилась с помощью пакета прикладных программ Statistica 6.0. Для сравнения групп больных по количественным признакам, имеющим нормальное распределение, использовались методы параметрической статистики – критерий Стьюдента. Сравнение качественных признаков проводилось с помощью таблиц сопряженности (хи-квадрат по методу Пирсона). Для сравнения качественных признаков, имеющих малое абсолютное значение, использовался точный двусторонний критерий Фишера.
Результаты исследования. Эффективность проведенного лечения оценивалась с помощью показателей безрецидивной и общей выживаемости. Безрецидивная выживаемость рассчитывалась как время, прошедшее от завершения лечения до наступления первого рецидива заболевания. Общая выживаемость рассчитывалась от времени начала специального лечения до наступления смерти больного от любой причины.
Весь послеоперационный материал направлялся для гистологического исследования на предмет установления размеров опухоли, ее инвазии, оценки лечебного патоморфоза, метастатического поражения лимфатических узлов, степени их замещения, изучения краев линии резекции.
Метастатическое поражение лимфатических узлов выявлено после хирургического вмешательства у 32 (21,1 %) больных. В группе с ПЛРШМ II стадии и АКШМ с ЖПлРШМ II стадии 13 (12,9 %) пациенток после хирургического лечения с подтвержденными метастазами в подвздошные лимфатические узлы и изначально со стадией T2вNxM0 (IIВ стадия) рестадированы в T2вN1M0 (IIIВ стадия). В группе с ПЛРШМ III стадии и АКШМ с ЖПлРШМ III стадии из 51 женщины со стадией T3вNxM0 (IIIВ стадия) у 19 (37,3 %) пациенток диагностированы метастазы в подвздошные лимфатические узлы – T3вN1M0 (IIIВ стадия). Таким образом, метастатическое поражение лимфатических узлов диагностировано у 21 (21,2 %) пациентки с ПлРШМ и у 11 (20,8%) с аденогенными формами рака – 5 (29,4 %) с ЖПлРШМ и у 6 (16,7 %) с АКШМ.
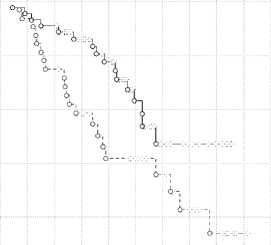
На рис. 1 представлена общая выживаемость больных с ПлРШМ и аденогенными формами независимо от стадии.
1,0
0,5
Общая выживаемость ПлРШМ и АКШМ с ЖПлРШМII и III стадии
0,9
0,8
0,7
0,6
0 20 40 60 80 100 120 140 160 180 200 220
ПлРШМ
II и III стадии
АКШМ и ЖПлРШМ
II и III стадии
Рис. 1. Общая выживаемость всех пациенток с ПлРШМ и АКШМ с ЖПлРШМ
При сравнительном анализе общей выживаемости больных с ПлРШМ и железистыми формами вне зависимости от стадии заболевания показатели трехлетней выживаемости составили 95 и 88 % (P > 0,05), пятилетней 92 и 79 % (P < 0,05), десятилетней (73 и 67 %) (P < 0,05). Таким образом, выживаемость больных при плоскоклеточном гистологическом варианте РШМ достоверно выше, чем при аденогенных формах.
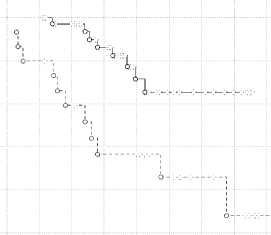
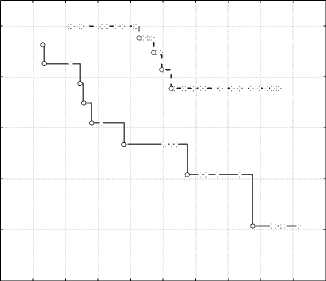
На рис. 2 и 3 представлена общая выживаемость пациенток с ПлРШМ и аденогенны-ми формами РШМ. Вторая стадия без учёта хирургического рестадирования (рис. 2, а) и с его учетом (рис. 2, б) и аналогично третья стадия заболевания (рис. 3).
0,4
1,0
0,9
0,8
0,7
0,6
0,5
0204060 80 100 120 140 160 180 200
ПлРШМ IIст Жел II
0,5
1,0
0,9
0,8
0,7
0,6
0 20 40 60 80 100 120 140 160 180 200
б)
ПлРШМ IIст Жел IIст
а)
Рис. 2. Общая выживаемость больных с ПлРШМ и АКШМ с ЖПлРШМ при II стадии заболевания: а – без рестадирования (Т2NХМ0); б – с учётом хирургического рестадирования (Т2N0М0)
1,0
0,4
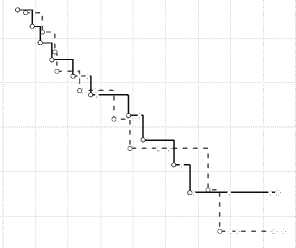
Выживаемость ПлРШМ и АКШМ с ЖПлРШМIIIст до рестадирования
0,8
0,7
0,6
0,5
0204060 80 100 120 140 160 180 200
а)
Жел III
ПлРШМ III
Общая выживаемость ПлРШМ и АКШМ с ЖПлРШМIII стадия
1,0
0,9
0,8
0,7
0,6
0,5
0,4
0,3
0204060 80 100 120 140 160 180 200
Жел IIIст
ПлРШМ IIIст
б)
Рис. 3. Общая выживаемость больных с ПлРШМ и АКШМ с ЖПлРШМ при III стадии заболевания: а – без рестадирования (Т3NХМ0); б – после хирургического рестадирования
Без хирургического рестадирования показатели общей трехлетней выживаемости составили 100 и 90 % (P > 0,05), пятилетней 98 и 79 % (P < 0,05), десятилетней 83 и 63 % (P < 0,05).
Умерло при II стадии (T2NxM0) ПлРШМ 4 (5,6 %) пациентки, на сроке более 5 лет от генерализации процесса. При аденогенных формах при II стадии (T2NxM0) погибло 8 (26,7 %) на сроке до 3 лет – 2 больные, до 5 лет – 2 больные, после 5 лет – 4 пациенток.
После рестадирования показатели трехлетней выживаемости составили 100 и 90,9 % (P > 0,05), пятилетней выживаемости 100 и 80,2 % (P < 0,05), десятилетней выживаемости 88 и 71 % (P < 0,05). Следовательно, выживаемость при II стадии при ПлРШМ статистически достоверно выше при достижении пятилетних показателей и выше, а хирургическое лечение позволяет достоверно определить стадию заболевания, прогноз и подобрать оптимальную тактику адьювантной терапии.
Без хирургического рестадирования показатели общей трехлетней выживаемости составили 85 и 82 % (P > 0,05), пятилетней 78 и 77 % (P > 0,05), десятилетней 55 и 75 % (P < 0,05).
У больных с ПлРШМ умерло 10 (35,7 %) человек. На первому году – 1 больная, на сроке до 3 лет – 3 пациентки, до 5 лет – 2 больные, одна из них от спаечной кишечной непроходимости (данных о прогрессировании заболевания не было). После 5 лет умерло еще 4 женщины от генерализации опухолевого процесса.
При III стадии (T3bNxM0) больных с аде- ногеными формами погибло 9 (39,1 %) женщин. На сроке до 3 лет – 5 больных, до 5 лет – 1 больная, после 5 лет еще 3 больных, все от генерализации процесса.
После рестадирования показатели трехлетней выживаемости составили 87,2 и 80,5 % (P > 0,05), пятилетней 79,6 и 78,1 % (P > 0,05), десятилетней 54 и 60 % (P > 0,05).
При ПлРШМ погибло 13 (46,4 %) женщин. На первом году лечения – 1 пациентка от неизлеченности процесса, до 3 лет – 3 больные, до 5 лет – 3 пациентки, после 5 лет еще 6 женщин (одна из них не от онкологической причины).
При аденогенных формах умерло 10 (43,5 %) женщин. На сроке до 3 лет – 5 женщин, до 5 лет – 1 женщина, после 5 лет – 4 больные.
При анализе групп с III (T2-3N0-1M0) стадией болезни после хирургического реста-дирования у больных с ПлРШМ 21 (55 %) женщина имела метастатическое поражение подвздошных лимфатических узлов, при адено-генных формах лишь у 11 (42 %) больных встречались метастазы в тазовых лимфатических узлах (p < 0,05). Эта ситуация проясняет почему группа с ПлРШМ имеет практически одинаковые показатели общей выживаемости с железистыми формами. Так как метастатическое поражение лимфатических узлов, является наиболее неблагоприятным фактором прогноза.
Заключение. Таким образом, можно сделать вывод, что аденогенные формы рака шейки матки должны рассматриваться как наиболее агрессивные опухоли с неблагоприятным прогнозом, по сравнению с ПлРШМ, течение которого в целом носит более благоприятный прогноз. Адекватное хирургическое стадирование позволяет определить истинную стадию заболевания, исключить отдаленные метастатазы, удалить радиорезистентные клетки и провести многокомпонентное лечение.
Список литературы Отдаленные результаты многокомпонентного лечения местно-распространенного рака шейки матки с учетом гистологического строения опухоли
- Антипов, В.А. Органосохраняющее лечение начальных форм инвазивной аденокарциномы шейки матки/В.А. Антипов, О.В. Новикова, О.С. Балахонцева//Сибир. онколог. журнал. -2010. -№ 1 (37). -С. 5-11.
- Бохман, Я.В. Руководство по онкогинекологии/Я.В. Бохман. -СПб.: ООО Изд-во «Фолиант», 2002. -544 с.
- Важенин, A.B. Актуальные вопросы клинической онкогинекологии/A.B. Важенин, A.B. Жаров, И.Г. Шимоткина. -М.: ООО Фирма «СТРОМ», 2010. -С. 6-33.
- Давыдов, М.И. Статистика злокачественных новообразований в России и в странах СНГ в 2008 г./М.И. Давыдов, Е.М. Аксель//Вестник РОНЦ им. H.H. Блохина РАМН. -2010. -Т. 21, № 2 (прил. 1). -160 с.
- Злокачественные новообразования в России в 2011 году (заболеваемость и смертность)/под ред. В.И. Чиссова, В.В. Старинского, Г.В. Петровой. -М.: Издат. группа РОНЦ, 2013. -289 с.
- Лечение раннего рака шейки матки: выживаемость, осложнения и экономические аспекты/Р. Zola, E. Tripodi, V. Zanfagninetal//Сибир. онколог. журнал. -2012. -№ 3 (51). -С. 14-21.
- Местно-распространенный рак шейки матки: возможности химиолучевого лечения/Л.А. Коломиец, A.B. Важенин, О.Н. Чуруксаева и др.//Современная онкология. -2005. -Т. 7, № 4. -С. 197-201.
- Alfsen, G.C. Histologic subtype has minor importance for overall survival in patients with adenocarcinoma of the uterine cervix: a population-based study of prognostic factors in 505 patients with nonsquamous cell carcinomas of the cervix/G.C. Alfsen, G.B. Kristensen, E. Skovlund//Cancer. -2001. -Vol. 92. -P. 2471-2483.
- Neoadjuvant chemotherapy using low-dose consecutive intraarterial infusions of cisplatin combined with 5-fluorouracil for locally advanced cervical adenocrcinoma/Y. Aoki, T. Sato, M. Watanabe, M. Sasaki//GynecolOncol. -2001. -Vol. 81(3). -Р. 496-499.


