Отдаленный прогноз неблагоприятных сердечнососудистых событий у пациентов с хронической сердечной недостаточностью в зависимости от полиморфизма RS1143634 гена интерлейкина-1
Автор: Хазова Е.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.39, 2024 года.
Бесплатный доступ
Течение и прогноз хронической сердечной недостаточности сопряжены с активацией воспалительных каскадов, выраженность которых имеет генетическую детерминированность.Цель: анализ неблагоприятных сердечно-сосудистых событий у пациентов с хронической сердечной недостаточностью на протяжении 5 лет в зависимости от полиморфизма rs1143634 гена интерлейкина-1β.Материал и методы. Изучены клинические признаки, проведено генотипирование по полиморфному локусу rs1143634 гена IL-1β пациентов с хронической сердечной недостаточностью ишемического генеза (n = 445, средний возраст - 66,4 ± 10,4 года). Информация об исходах пациентов в течение 5 лет получена методом телефонного опроса по конечным точкам: смерть от всех причин, сердечно-сосудистая смерть. Смертельные и несмертельные сердечно-сосудистые события сформировали комбинированную конечную точку. Время до наступления события анализировали методом Каплана - Мейера; отношение рисков - регрессией Кокса. Статистическую обработку проводили в программах Jamovi, R 4.3.1.Результаты и выводы. Встречаемость генотипов полиморфизма rs1143634 гена IL-1β у пациентов с хронической сердечной недостаточностью и группы генетического контроля не различалась и была соразмерна с теоретически ожидаемым равновесием Харди - Вайнберга. Носители ТТ генотипа характеризовались большим уровнем воспаления, развитием инфаркта миокарда в молодом возрасте. У пациентов с хронической сердечной недостаточностью ТТ генотипа риск смерти от всех причин был выше в 2,85 раза, достижения комбинированной конечной точки - в 3,3 раза, смертельного мозгового инсульта - в 17,1 раза в сравнении с CC генотипом, в 14,9 раза - в сравнении с СТ генотипом. У пациентов с хронической сердечной недостаточностью и хронической болезнью почек ТТ генотипа риск смерти от мозгового инсульта был в 29,33 раза выше, чем у пациентов СС генотипа, в 29,12 раза - чем у пациентов СТ генотипа. У пациентов с хронической сердечной недостаточностью в сочетании с сахарным диабетом частота госпитализаций по причине декомпенсации сердечной деятельности при ТТ генотипе была выше, чем при СС и СТ генотипах (χ2 = 6,33; р = 0,042).
Хроническая сердечная недостаточность, полиморфизм rs1143634 гена il-1β, прогноз, кардиоваскулярные осложнения
Короткий адрес: https://sciup.org/149147161
IDR: 149147161 | УДК: 616.12-008.46-002.2-079.3:575.174.015.3 | DOI: 10.29001/2073-8552-2024-39-4-142-149
Текст научной статьи Отдаленный прогноз неблагоприятных сердечнососудистых событий у пациентов с хронической сердечной недостаточностью в зависимости от полиморфизма RS1143634 гена интерлейкина-1
Генетические механизмы распространенных социально значимых многофакторных заболеваний с генетической предрасположенностью, к которым в том числе относится и хроническая сердечная недостаточность, подвергаются интенсивному изучению. В генную сеть хронической сердечной недостаточности, согласно существующим представлениям об этиологии и патогенезе, включают гены-кандидаты, кодирующие белки ренин-ан-гиотензин-альдостероновой системы, контролирующие липидный обмен, гены белков дисфункции эндотелия, коагуляции крови, фибринолиза, а также гены факторов роста и воспаления, участвующие в созревании и разрыве атеросклеротической бляшки в коронарных сосудах. Не вызывает сомнений участие провоспалительных цитокинов в патофизиологических механизмах кардиоваску- лярного риска и неблагоприятного течения хронической сердечной недостаточности [1, 2]. Интересен провоспа-лительный цитокин, интерлейкин-1 бета (IL-1β), инициирующий множество биологических каскадов – важных компонентов воспалительной реакции, а также атероге-неза [3]. Вариабельность воспалительного ответа может иметь генетическую детерминированность.
Однонуклеотидный полиморфизм rs1143634 гена IL-1β лоцируется в регионе 2q14.1 [4, 5] и заключается в замене в положении + 3954 цитозина на тимин, приводя к появлению низкочастотного аллеля Т, ассоциированного с гиперпродукцией и повышением сывороточного уровня IL-1β [6-8]. Минорный аллель Т определяется у 24,8% популяции Европы [9]. Анализ публикаций позволяет судить о функциональной значимости аллеля Т полиморфизма rs1143634 гена IL-1β в развитии атеросклероза коронарных артерий, ишемической болезни сердца [10–12].
Описана связь аллеля Т полиморфизма rs1143634 гена IL-1β с повышенным риском формирования артериальной гипертензии [13]. Противоположные данные приводятся в серии публикации в отношении риска развития хронической сердечной недостаточности, указывающие на больший риск при наличии аллеля С и генотипа СС полиморфизма rs1143634 гена IL-1β (OШ = 3,798: ДИ: 1,060–13,607), тогда как аллель Т (OШ = 0,53; ДИ: 0,360– 0,780), генотипы СТ (OШ = 0,453; ДИ: 0,275–0,746) и ТТ (OШ = 0,263; ДИ: 0,073–0,943) идентифицированы как протективные факторы [14, 15]. Таким образом, в настоящее время нет единого мнения о влиянии полиморфизма rs1143634 гена IL-1β на течение и прогноз хронической сердечной недостаточности.
Цель работы: анализ неблагоприятных сердечно-сосудистых событий у пациентов с хронической сердечной недостаточностью на протяжении 5 лет в зависимости от полиморфизма rs1143634 гена IL-1β.
Материал и методы
Проведено клинико-генетическое исследование 445 пациентов с хронической сердечной недостаточностью (235 мужчин и 210 женщин, средний возраст – 66,4 ± 10,4 года) и 118 пациентов группы генетического контроля. Все включенные в исследование пациенты были европеоидной расы, проживали в г. Казань, добровольно подписали форму информированного согласия. Проведение научной работы одобрено локальным этическим комитетом Казанского ГМУ Минздрава России (протокол № 5 от 23.05.2023 г.). В исследование включались пациенты старше 18 лет с верифицированной хронической сердечной недостаточностью, согласно Российскими рекомендациями по диагностике и лечению хронической сердечной недостаточности1. Критериями невключения были инфаркт миокарда, коронарное вмешательство, мозговой инсульт, декомпенсация сердечной недостаточности в течение 3 мес., предшествующих включению в исследование, гемодинамически значимые врожденные / приобретенные пороки сердца, наличие состояния с ожидаемой продолжительностью жизни менее одного год, беременность или лактация женщины, алкогольная / наркотическая зависимость, выраженные когнитивные расстройства.
Гематологическое (клиническое и биохимическое) исследование пациентов группы исследования проводилось в рамках рутинной клинической практики на базе Городской клинической больницы № 7 имени М.Н. Садыкова (г. Казань). Уровень N-терминального фрагмента мозгового натрийуретического пептида определялся в сыворотке крови иммунохемилюминесцентным методом на автоматическом иммунохимическом анализаторе Vitros 3600. Высокочувствительный С-реактивный белок определялся в сыворотке крови иммунотурбидиметриче-ским методом на анализаторе Roche Cobas 8000 с биохимическим модулем c702. По уровню высокочувствительного С-реактивного белка ранжировался относительный воспалительный риск развития и прогрессирования кардиоваскулярных событий: низкий (высокочувствительный С-реактивный белок < 1 мг/л), средний (1– 3 мг/л) и высокий (> 3 мг/л) [17].
Толерантность к физической нагрузке определяли по данным теста 6-минутной ходьбы, оценивали параметры электрокардиограммы. Размеры камер сердца и сократительную функции миокарда определяли при проведении трансторакальной эхокардиоскопии: при фракции выброса левого желудочка ≥ 50% диагностировали сердечную недостаточность с сохраненной (СНсФВ), при 40– 49% – с умеренно сниженной (СНу/сФВ), при < 40% – с низкой (СНнФВ) фракцией выброса2. Препарат дезоксирибонуклеиновой кислоты из лимфоцитов венозной крови выделяли сорбентным методом согласно инструкции производителя «ДНК-Сорб-В» (ФБУН ЦНИИ эпидемиологии Роспотребнадзора, Россия). Полимеразную цепную реакцию проводили в реальном времени по полиморфному локусу rs1143634 гена IL-1β в соответствии с инструкцией, прилагаемой к реагенту «ТестГен» (Ульяновск, Россия). Полиморфные сайты геномной ДНК генотипиро-вали на амплификаторе CFX96 (БиоРад, США).
Информация об исходах пациентов в течение 5 лет получена посредством телефонного опроса по конечным точкам: смерть от всех причин, сердечно-сосудистая смерть. Смертельные и несмертельные сердечно-сосудистые события сформировали комбинированную конечную точку. При отсутствии событий в течение 5 лет констатировалась бессобытийная выживаемость.
Для анализа и визуализации первичных данных использовали лицензионные программы Jamovi (version 2.3.16) [Computer Software], R 4.3.1 (R Foundation for Statistical Computing, Вена, Австрия). Нормальность распределения количественных переменных проводили с помощью критерия Шапиро – Уилка ( n ≤ 50) или критерия Колмогорова – Смирнова ( n > 50). Непрерывные переменные при нормальном распределении указаны как среднее и стандартное отклонение ( М ± SD ), при отличном от нормального – медиана и межквартильный диапазон ( Ме [25; 75%]). Категориальные переменные приведены в виде абсолютного значения и процента. Межгрупповые различия количественных переменных оценивали тестом Стьюдента либо тестом Манна – Уитни, категориальных – критерием χ2 Пирсона. Соответствие распределения генотипов равновесию Харди – Вайнберга определяли с помощью теста Фишера в Excel. Выявляли ассоциации по отношению шансов (ОШ) c определением 95% доверительного интервала (ДИ). Сравнительный анализ в отношении времени до наступления события проводили методом Каплана – Мейера и лог-рангового теста, для оценки отношения рисков (ОР) и соответствующих 95% ДИ – пропорциональных рисков Кокса. Значимыми различия считали при p < 0,05.
Результаты и обсуждение
У всех включенных в исследование пациентов хронической сердечной недостаточности предшествовала ишемическая болезнь сердца, в том числе у 82,3% пациентов в сочетании с артериальной гипертензией. Длительность хронической сердечной недостаточности составила 8 [5; 10] лет, уровень N-терминального фрагмента мозгового натрийуретического пептида – 825 [338;1209] пг/мл. Функциональный класс (ФК) хронической сердечной недостаточности определялся с учетом результатов теста 6-ми- нутной ходьбы: I ФК – 2,6%, II ФК – 34,3%, III ФК – 43,5%, IV ФК – 19,6% пациентов. В исследуемой когорте превалировала СНсФВ (67%); СНу/сФВ и СНнФВ были характерны для 19 и 14% пациентов соответственно.
До включения в исследование 45,1% пациентов перенесли инфаркт миокарда, 13,5% – коронарное вмешательство, 8,1% – мозговой инсульт. Факторы риска представлены отягощенной наследственностью по сердечно-сосудистым заболеваниям (37,3%), табакокурению (16,6%). Заболеваниями, сопутствующими хронической сердечной недостаточности, являлись:
– хроническая болезнь почек – 40%, (скорость клубочковой фильтрации (СКФ) по CKD-EPI 65,6 ± 19,2 мл/ мин/1,73 м2; умеренное снижение СКФ (С3А) было у 45,8%, существенное снижение (С3Б) – у 20%, резкое снижение (С4) и терминальная хроническая болезнь почек (С5) – у 3 и 2,5% пациентов соответственно. На момент госпитализации ни один пациент не получал заместительной почечной терапии);
– фибрилляция предсердий – 26,7% (в том числе постоянная форма – у 53,5%, пароксизмальная – у 43,3%, персистирующая – у 3,2% пациентов);
– хроническая обструктивная болезнь легких – 22,8% (по степени обструкции легких пациенты с хронической сердечной недостаточностью представлены следующим образом: легкая степень тяжести – 33,8%, средняя степень – 36,4%, тяжелая степень – 29,9%),
– сахарный диабет – 21,8%.
На момент включения в исследование 19,1% пациентов сообщили, что не принимают медикаментозную терапию на постоянной основе. Ингибиторы ангиотен-зинпревращающего фермента применяли 49,6% пациентов, блокаторы рецепторов ангиотензина II – 17,4%, β -адреноблокаторы – 48,7%, антагонисты минералокортикоидных рецепторов – 13,9% пациентов с хронической сердечной недостаточностью. Реже в структуре медикаментозной терапии присутствовали дезагреганты (35%), диуретики (34,6%), антагонисты кальция (22,7%), нитраты (15,7%), сердечные гликозиды (8,9%). На липид-сни-жающей терапии статинами не менее 1 года находились 28,8% пациентов.
Исследование частот встречаемости генотипов полиморфизма rs1143634 гена IL-1β у пациентов с хронической сердечной недостаточностью и группы генетического контроля не выявило различий: СС – 58,7 и 61%, СТ – 36,2 и 34,7%, ТТ – 5,2 и 4,2% ( χ2 = 0,304; р = 0,859) и было соразмерно с теоретически ожидаемым равновесием Харди – Вайнберга ( χ2 = 0,06; р = 0,81 и χ2 = 0,07; р = 0,78).
Сравнение распространенности факторов риска и клинических характеристик пациентов с хронической сердечной недостаточностью СС, СТ и ТТ генотипов полиморфизма rs1143634 гена IL-1β не выявило различий, за исключением дебюта инфаркта миокарда в молодом возрасте у пациентов с ТТ генотипом в сравнении с СТ генотипом (53,1 ± 13,9 и 64,0 ± 11,0 года, p = 0,044). Лабораторные параметры не отличались вариабельностью за исключением меньшего уровня гемоглобина у носителей ТТ генотипа полиморфизма rs1143634 гена IL-1β (124 ± 21,7 г/л) в сравнении с СС (137 ± 19,5 г/л; р = 0,006) и СТ генотипами (137 ± 20,8 г/л; р = 0,009).
Уровень высокочувствительного С-реактивного белка составил у пациентов СС генотипа полиморфизма rs1143634 гена IL-1β 2,65 [1,2; 6,7] мг/л, СТ – 3,37 [1,74;
6,43] мг/л, ТТ – 5,54 [3,32; 9,29] мг/л. Обращает на себя внимание тот факт, что у всех пациентов ТТ генотипа уровень высокочувствительного С-реактивного белка превышал 3 мг/л. Доля лиц с высоким относительным воспалительным риском была меньше при СТ генотипе (53,4%), СС генотипе полиморфизма rs1143634 гена IL-1β (44,6%) ( χ2 = 11,7; p = 0,019). Уровень α1-глобулина носителей ТТ генотипа (3,75 ± 0,65 мг/л) превышал таковой, характерный для СС (3,15 ± 0,63 мг/л; р = 0,006) и СТ генотипов (3,24 ± 0,71 мг/л; р = 0,027).
Структура и функция сердца не различались у пациентов с хронической сердечной недостаточностью СС, СТ и ТТ генотипов полиморфизма rs1143634 гена IL-1β.
С целью выявления возможной ассоциации полиморфизма rs1143634 гена IL-1β с течением хронической сердечной недостаточности собрана информация о событиях в течение 5 лет с момента включения. Сведения о достижении конечных точек были получены от 313 пациентов с хронической сердечной недостаточностью. В течение 5 лет умерли от любой причины 28,1%, несмертельное событие перенесли 25,6% пациентов, комбинированная конечная точка зарегистрирована у 47,6% пациентов. Ведущей причиной смерти была декомпенсация сердечной недостаточности (67%), с равной частотой – мозговой инсульт и инфаркт миокарда (9%), тромбозы (2,3%). Среди внесердечных причин смерти были онкологические заболевания (8%) и другие причины, в том числе инфекция COVID-19 (4,5%).
Распределение аллелей и генотипов полиморфизма rs1143634 гена IL-1β включенных в исследование пациентов и когорты с известным прогнозом в течение 5 лет не различалось (табл. 1).
Таблица 1. Частота встречаемости аллелей и генотипов полиморфизма rs1143634 гена IL-1β у пациентов с хронической сердечной недостаточностью в начале исследования и через 5 лет наблюдения Table 1. Frequency of occurrence of alleles and genotypes of the rs1143634 polymorphism of the IL-1β gene in patients with chronic heart failure at the beginning of the study and after 5 years of follow-up
|
Ген |
Генотип |
Исходно |
Через 5 лет |
χ2 |
p |
||
|
n |
% |
n |
% |
||||
|
IL-1β rs1143634 С/T |
CC |
261 |
58,7 |
164 |
60,1 |
0,31 |
0,85 |
|
CT |
161 |
36,2 |
97 |
35,5 |
|||
|
TT |
23 |
5,2 |
12 |
4,4 |
|||
|
С |
683 |
76,7 |
425 |
78 |
0,27 |
0,59 |
|
|
Т |
207 |
23,3 |
121 |
22 |
|||
У пациентов, достигших комбинированной конечной точки, генотип ТТ полиморфизма rs1143634 гена IL-1β встречался чаще в сравнении с пациентами с благоприятным течением заболевания (83,3 и 16,7% соответственно, χ2 = 6,02; p = 0,027), таблица 2.
У пациентов с хронической сердечной недостаточностью ТТ генотипа полиморфизма rs1143634 гена IL-1β риск смерти от всех причин в течение 5 лет составил (ОР = 2,85; 95% ДИ: 1,2– 6,76; р = 0,018), риск достижения комбинированной конечной точки – (ОР = 3,3; 95% ДИ: 1,62–6,71; р < 0,001). Риск смертельного исхода по причине мозгового инсульта у носителей ТТ генотипа полиморфизма rs1143634 гена IL-1β был выше в 17,11 раза в сравнении с СС генотипом (OШ = 17,11; 95% ДИ: 2,619–112,7; р = 0,008) и в 14,99 раза в сравнении с СТ генотипом (OШ = 14,99; 95% ДИ: 1,999–140; р = 0,018), таблица 3.
Таблица 2. Распределение частот встречаемости генотипов полиморфизма rs1143634 гена IL-1β у пациентов с хронической сердечной недостаточностью с различным прогнозом в течение 5 лет
Table 2. Distribution of genotypes of the rs1143634 polymorphism of the IL-1β gene in patients with CHF with different prognosis over 5 years
|
Генотип |
ККТ+ |
ККТ- |
χ2 |
p |
Смерть+ |
Смерть– |
χ2 |
p |
||||
|
n |
% |
n |
% |
n |
% |
n |
% |
|||||
|
CC |
76 |
46,3 |
88 |
55,7 |
0,92 |
0,33 |
45 |
27,4 |
119 |
72,6 |
0,032 |
0,857 |
|
CT |
47 |
48,5 |
50 |
51,5 |
0,004 |
0,95 |
25 |
25,8 |
72 |
74,2 |
0,32 |
0,572 |
|
TT |
10 |
83,3 |
2 |
16,7 |
6,02 |
0,027 |
6 |
50 |
6 |
50 |
3,06 |
0,079 |
Примечание: ККТ – комбинированная конечная точка.
Таблица 3. Достижение конечных точек пациентами с хронической сердечной недостаточностью в течение 5 лет с учетом полиморфизма rs1143634 гена IL-1β
Table 3. Achievement of end points by patients with CHF over 5 years, taking into account the rs1143634 polymorphism of the IL-1β gene
|
Конечные точки |
Генотип IL-1β |
p |
|||||
|
CC, n = 164 |
CT, n = 97 |
TT, n = 12 |
|||||
|
Абс. |
% |
Абс. |
% |
Абс. |
% |
||
|
Смертность от всех причин: |
45 |
27,4 |
25 |
25,8 |
6 |
50 |
0,207 |
|
Сердечно-сосудистая смертность, в т. ч. от: |
42 |
25,6 |
20 |
20,6 |
5 |
41,7 |
0,246 |
|
– декомпенсации хронической сердечной недостаточности |
32 |
19,5 |
15 |
15,5 |
2 |
16,7 |
0,7 |
|
– инфаркта миокарда |
2 |
1,2 |
2 |
2,1 |
0 |
– |
0,95 |
|
– мозгового инсульта |
3 |
1,8 |
2 |
2,1 |
3 |
25 |
0,00002 |
|
Несмертельные события, всего |
45 |
27,4 |
31 |
32 |
5 |
41,7 |
0,48 |
|
Несмертельные сердечно-сосудистые события: |
33 |
20,1 |
27 |
27,8 |
5 |
41,7 |
0,122 |
|
– инфаркт миокарда |
7 |
4,3 |
7 |
7,2 |
0 |
– |
0,31 |
|
– мозговой инсульт |
2 |
1,2 |
3 |
3,1 |
0 |
– |
0,53 |
|
– коронарное вмешательство |
6 |
3,7 |
2 |
2,1 |
1 |
8,3 |
0,475 |
|
– госпитализация по поводу декомпенсации хронической сердечной недостаточности |
17 |
10,4 |
12 |
12,4 |
4 |
33,3 |
0,06 |
|
– Комбинированная конечная точка |
76 |
46,3 |
47 |
48,5 |
10 |
83,3 |
0,047 |
Проведена визуализация достижения в течение 5 лет комбинированной конечной точки пациентами с хронической сердечной недостаточностью в зависимости от генотипа полиморфизма rs1143634 гена IL-1β (рис. 1).
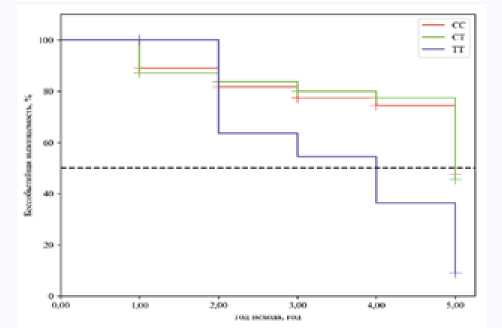
Рис. 1. Кривая достижения комбинированной конечной точки в зависимости от генотипа полиморфизма rs1143634 гена IL-1β
Fig. 1. Curve of achievement of the combined endpoint depending on the genotype of the rs1143634 polymorphism of the IL-1β gene
Бессобытийная выживаемость (недостижение комбинированной конечной точки) наблюдалась достоверно чаще у пациентов СС и СТ генотипов, чем у носителей ТТ генотипа полиморфизма rs1143634 гена IL-1β ( p log-rank = 0,024).
Учитывая возможные межгенные и генно-средовые взаимодействия, проявляющиеся в контексте коморбид- ности, проведен субанализ распределения генотипов и исходов пациентов с хронической сердечной недостаточностью, с сопутствующими хронической болезнью почек, хронической обструктивной болезнью легких и сахарным диабетом в течение 5 лет.
Распределение генотипов полиморфизма rs1143634 гена IL-1β у пациентов с хронической сердечной недостаточностью и в группе генетического контроля не различалось при наличии хронической болезни почек (СС – 57,8 и 61%, СТ – 36,4 и 34,7%, ТТ – 5,9 и 4,2%, χ2 = 0,55; р = 0,75); хронической обструктивной болезни легких (СС – 57 и 61%, СТ – 38,7 и 34,7%, ТТ – 4,3 и 4,2%, χ2 = 0,36; р = 0,83); сахарного диабета (СС – 54,1 и 61%, СТ – 41,8 и 34,7%, ТТ – 4,1 и 4,2%, χ2 = 1,16; р = 0,56).
У пациентов с хронической сердечной недостаточностью в коморбидности с хронической болезнью почек сохранялась тенденция к большей частоте смертельного исхода у носителей ТТ генотипа полиморфизма rs1143634 гена IL-1β (табл. 4). Смертельный мозговой инсульт регистрировался у каждого второго пациента с хронической сердечной недостаточностью в коморбидности с хронической болезнью почек ТТ генотипа полиморфизма rs1143634 гена IL-1β, превышая таковой СС генотип (50 и 2,8%, χ2 = 16,47; OШ = 29,33; 95% ДИ: 1,48–642,6; р = 0,025) и СТ генотип (50 и 2,6%, χ2 = 11,95; OШ = 29,12; 95% ДИ: 1,13–2235; р = 0,04).
Частота достижения конечных точек в течение 5 лет с учетом генотипа полиморфизма rs1143634 гена IL-1β значимо не различалась у пациентов с хронической сердечной недостаточностью в коморбидности с хронической обструктивной болезнью легких.
Таблица 4 . Достижение конечных точек пациентами с хронической сердечной недостаточностью и хронической болезнью почек в течение 5 лет с учетом полиморфизма rs1143634 гена IL-1β
Table 4 . Achievement of end points by patients with CHF and chronic kidney disease over 5 years, taking into account the rs1143634 polymorphism of the
IL-1β gene
|
Конечные точки |
Генотип IL-1β |
p |
|||||
|
CC, n = 71 |
CT, n = 38 |
TT, n = 4 |
|||||
|
Абс. |
% |
Абс. |
% |
Абс. |
% |
||
|
Смертность от всех причин: |
19 |
26,8 |
8 |
21,1 |
3 |
75 |
0,067 |
|
Сердечно-сосудистая смертность, в т. ч. от: |
18 |
25,4 |
7 |
18,4 |
2 |
50 |
0,332 |
|
– декомпенсации хронической сердечной недостаточности |
15 |
21,1 |
4 |
10,5 |
0 |
– |
0,258 |
|
– мозгового инсульта |
2 |
2,8 |
1 |
2,6 |
2 |
50 |
0,00004 |
|
Несмертельные события, всего |
24 |
33,8 |
11 |
28,9 |
0 |
0 |
0,605 |
|
Несмертельные сердечно-сосудистые события, в т. ч.: |
18 |
25,4 |
8 |
21,1 |
0 |
0 |
0,615 |
|
– инфаркт миокарда |
4 |
5,6 |
3 |
7,9 |
– |
– |
0,646 |
|
– коронарное вмешательство |
5 |
7 |
1 |
2,6 |
– |
– |
0,63 |
|
– госпитализация по поводу декомпенсации хронической сердечной недостаточности |
9 |
12,6 |
3 |
7,9 |
– |
– |
0,678 |
|
Комбинированная конечная точка |
36 |
50,7 |
15 |
39,5 |
2 |
50 |
0,53 |
В течение 5 летнего наблюдения все пациенты с хронической сердечной недостаточностью ТТ генотипа полиморфизма rs1143634 гена IL-1β в сочетании с сахарным диабетом были госпитализированы по причине декомпенсации сердечной деятельности, что превышало частоту госпитализаций пациентов СС и СТ генотипов (15,6 и 10,3%, χ2 = 6,33; р = 0,042).
Следующим этапом работы было оценить закономерности достижения конечных точек пациентами с сердечной недостаточностью при сопутствующих неинфекционных заболеваниях в зависимости от диапазона величины фракции выброса левого желудочка. Пациенты с СНсФВ ТТ генотипа полиморфизма rs1143634 гена IL-1β при наличии хронической болезни почек чаще достигали конечной точки смерть от всех причин (75% vs. СС: 20%, vs. СТ: 22,2%, р = 0,043); при наличии хронической обструктивной болезни легких – кардиоваскулярной смерти (100% vs. СС: 42,9% и vs. СТ: 21,4%, р = 0,037). При СНсФВ в сочетании с сахарным диабетом различий в достижении конечных точек с позиции полиморфизма rs1143634 гена IL-1β не наблюдалось.
Исходы пациентов с СНу/сФВ и СНнФВ при наличии хронической болезни почек, хронической обструктивной болезни легких, сахарного диабета значимо не различались в изучаемых генотипах полиморфизма rs1143634 гена IL-1β .
Обсуждение
Генетические исследования интегрируют концепции молекулярной генетики для познания этиологии, патогенетических механизмов клинического многообразия сердечно-сосудистых заболеваний. Однако на современном этапе развития кардиологии остается разрыв между научными достижениями в области молекулярной биологии и генетики с реальной клинической практикой. В то же время большинство исследователей считают целесообразным изучение генетического фона в комплексе с традиционными факторами сердечно-сосудистого риска, влияющими на клиническое течение и исход заболевания. Перспективность генотипирования обусловлена возможностью идентификации групп генетического риска до появления клинических проявлений, а также прогнозирования осложнений сердечно-сосудистых заболеваний, персонифицированного подхода к модификации образа жизни и фармакотерапии.
Проведенное исследование свидетельствует о функциональной значимости аллеля Т полиморфизма rs1143634 гена IL-1β в прогнозировании исходов в течение 5 лет пациентов с хронической сердечной недостаточностью ишемической этиологии. Встречаемость генотипов полиморфизма rs1143634 гена IL-1β у пациентов с хронической сердечной недостаточностью, в том числе при наличии хронической болезни почек, хронической обструктивной болезни легких, сахарного диабета, и группы генетического контроля значимо не различалась. В то же время в единственной работе по изучению данного полиморфизма у пациентов с хронической сердечной недостаточностью сообщается, что аллель С и генотип СС полиморфизма rs1143634 гена IL-1β признаются факторами генетического риска развития хронической сердечной недостаточности (OШ = 3,79; 95% ДИ: 1,06–13,61; χ2 = 4,72; p = 0,03) [14, 15].
U. Zeybek и соавт. (2011), сообщают о повышенном риске инфаркта миокарда в турецкой популяции при наличии аллеля Т полиморфизма rs1143634 гена IL-1β ( χ2 = 4,63; р = 0,03) и о протективном эффекте в отношении инфаркта миокарда при носительстве СС генотипа ( χ2 = 3,97; р = 0,046) [17]. В настоящей работе не было выявлено ассоциации с большим риском развития инфаркта миокарда, однако определен меньший возраст дебюта инфаркта миокарда у пациентов ТТ генотипа полиморфизма rs1143634 гена IL-1β в сравнении с СТ генотипом. В то же время А. Coker и соавт. (2011) не подтвердили ассоциации полиморфизма rs1143634 гена IL-1β с риском инфаркта миокарда ( р = 0,442), а также с возрастом дебюта инфаркта миокарда (< 40 или > 40 лет) ( р = 0,978) в турецкой популяции [18].
Выявлены существенные градиенты в достижении в течение 5 лет конечных точек пациентами с хронической сердечной недостаточностью ТТ генотипа полиморфизма rs1143634 гена IL-1β, что свидетельствует о большем риске смерти от всех причин (ОР = 2,85; 95% ДИ: 1,2–6,76; р = 0,018) и риске достижения комбинированной конечной точки – (ОР = 3,3; 95% ДИ: 1,62–6,71; р < 0,001). Смерть по причине мозгового инсульта чаще фиксировалась у носителей ТТ генотипа полиморфизма rs1143634 гена IL-1β в сравнении с СС (25 и 1,8%, χ2 = 18,23; OШ = 17,11; 95% ДИ: 2,62–112,7; р = 0,008) и СТ генотипом (25 и 2,1%, χ2 = 12,84; OШ = 14,99; 95% ДИ: 1,99–140; р = 0,018).
Результаты настоящей работы не согласуются с данными ранее проведенных исследований, где факторами неблагоприятного течения хронической сердечной недостаточности были аллель С и генотип СС полиморфизма rs1143634 гена IL-1β (OШ = 4,35; 95% ДИ: 2,22–8,49; χ2 = 20,68; p = 5,42 × 10–6 и OШ = 11,83; 95% ДИ: 1,62– 25,52; χ2 = 5,02; p = 0,025),тогда как аллель Т (OШ = 0,23; 95% ДИ: 0,12–0,45; χ2 = 20,68; p = 5,421 × 10–6), СТ и ТТ генотипы (OШ = 0,19; 95% ДИ: 0,09–0,41; χ2 = 20,29; p = 6,65 × 10–6 и OШ = 0,09; 95% ДИ: 0,004–1,61; χ2 = 5,02; p = 0,025) являются протективными факторами [14, 15].
К предполагаемым причинам несогласованности полученных ассоциаций полиморфизма rs1143634 гена IL-1β с исходами пациентов с хронической сердечной недостаточностью с ранее опубликованными работами можно отнести гетерогенность исследуемых популяций по этническим, половозрастным признакам, а также меньшую длительность наблюдения (12 мес.). Так, выборка сравниваемого исследования состояла из 165 пациентов, 121 из которых мужчины в возрасте 56,7 ± 5,3 года. Наблюдаемая в настоящем исследовании ассоциация аллеля Т с неблагоприятным течением хронической сердечной недостаточности обусловлена большей генетически детерминированной выраженностью воспаления (по уровню высокочувствительного С-реактивного белка).
Приоритетным направлением дальнейших исследований можно считать изучение остаточного воспалительного и липидного риска у пациентов с хронической сердечной недостаточностью ишемического генеза для оптимизации терапевтических тактик. Кроме того, учитывая мультифакторность хронической сердечной недостаточности, предполагающую тесное переплетение генетического профиля пациента и глубоких функциональных и структурных изменений организма вследствие внешних факторов, можно предположить разнонаправленность протекции в зависимости от средовых факторов, форми-
Список литературы Отдаленный прогноз неблагоприятных сердечнососудистых событий у пациентов с хронической сердечной недостаточностью в зависимости от полиморфизма RS1143634 гена интерлейкина-1
- Yndestad A., Damas J.K., Oie E., Ueland T., Gullestad L., Aukrust P. Role of inflammation in the progression of heart failure. Curr. Cardiol. Rep. 2007;9(3):236-241. https://doi.org/10.1007/bf02938356.
- Тепляков А.Т., Шилов С.Н., Попова А.А., Березикова Е.Н., Гракова Е.В., Неупокоева М.Н. и др. Роль провоспалительных цитокинов в развитии антрациклин-индуцированной сердечной недостаточности. Сибирский журнал клинической и экспериментальной медицины. 2020;35(2):66-74. https://doi.org/10.29001/2073-8552-2020-35-2-66-74.
- Fang Y., Xie H., Lin Z. Association between IL-1β + 3954C/T polymorphism and myocardial infarction risk: A meta-analysis. Medicine (Baltimore). 2018;97(30):e11645. https://doi.org/10.1097/MD.0000000000011645.
- Tabata N., Sueta D., Akasaka T., Arima Y., Sakamoto K., Yamamoto E. et al. Helicobacter pylori seropositivity in patients with interleukin-1 polymorphism is significantly associated with ST-segment elevation myocardial infarction. PLoS One. 2016;11(11):e0166240. https://doi.org/10.1371/journal.pone.0166240.
- Chen Q., Wang W., Huang Zh., Huang D.L., Li T., Wang F. et al. Correlation of rs1122608 SNP with acute myocardial infarction susceptibility and clinical characteristics in a Chinese Han population: A case control study. The Anatolian Journal of Cardiology. 2018;19(4):249-258. https://doi.org/10.14744/anatoljcardiol.2018.35002.
- Serafin M., Kalinka J. The role of chosen polymorphism of gens coding cytokines IL-1ß, IL1ra, IL-6 and TNFalpha in the pathogenesis of the preterm delivery. Ginekol i Poloznictwo.2014;33(3):9-23.
- Pociot F., Molvig J., Wogensen L., Worsaae H., Nerup J. A TaqI polymorphism in the human interleukin-1 beta (IL-1 beta) gene correlates with IL-1 beta secretion in vitro. Eur. J. Clin. Invest. 1992;22:396-402. https://doi.org/10.1111/j.1365-2362.
- Latkovskis G., Licis N., Kalnins U. C-reactive protein levels and common polymorphisms of the interleukin-1 gene cluster and interleukin-6 gene in patients with coronary heart disease. Eur. J. Immunogenet. 2004;31(5):207-213. https://doi.org/10.1111/j.1365-2370.2004.00476.x.
- rs1143634. Ensembl is a genome browser. URL: http://www.ensembl.org/Homo_sapiens/Variation/Population?db=core;r=2:112832313-112833313;v=rs1143634;vdb=variation;vf=182624122 (08.10.2024).
- Fadl M.A., Noor Аlgalil S.S. IL1 𝛽 exon 395 C/ Polymorphism potential genetic risk factor of heart diseases’ predisposition in Sudanese patients. Sudan Journal of Medical Sciences. 2020;15(4):399-407. https://doi.org/10.18502/sjms.v15i4.8162.
- Pan Q., Hui D., Hu C. A variant of IL1B is associated with the risk and blood lipid levels of myocardial infarction in Eastern Chinese individuals. Immunol. Invest. 2022;51(5):1162-1169. https://doi.org/10.1080/08820139.2021.1914081.
- Захарьян Е.А., Грицкевич О.Ю. Влияние однонуклеотидных полиморфизмов генов IL1β, EDN1 и NOS3 на индивидуальный генетический профиль пациентов с ишемической болезнью сердца в Республике Крым. Вестник современной клинической медицины. 2023;16(6):31-36. https://doi.org/10.20969/VSKM.2023.16(6).31-36.
- Топчиева Л.В., Курбатова И.В., Малышева И.Е., Корнева В.А., Топчиева А.В. Аллельный полиморфизм генов, вовлеченных в продук цию IL-1β, и предрасположенность людей к развитию артериальной гипертензии. Научные результаты биомедицинских исследований. 2023;9(1):53-70.
- Маянская С.Д., Яковлева Н.Ф., Яковлев А.В., Филипенко М.Л., Воронина Е.П., Березикова Е.Н. и др. Полиморфизм генов интерлейкина-1β и рецепторного антагониста интерлейкина-1 у больных хронической сердечной недостаточностью. Журнал сердечная недостаточность. 2008;9(2):60-63.
- Тепляков А.Т., Шилов С.Н., Березикова Е.Н., Яковлева Н.Ф., Торим Ю.Ю., Кистенева И.В. и др. Клинико-генетические детерминанты генов ФНО-ОС, ИЛ-1/3 И ИЛ-1РА в инициации и развитии хронической сердечной недостаточности у больных ишемической болезнью сердца. Сибирский медицинский журнал (Томск). 2009;24(1):40-48.
- Kramer F., Voss S., Roessig L., Igl B.W., Butler J., Lam C.S.P. et al. Evaluation of high-sensitivity C-reactive protein and uric acid in vericiguat-treated patients with heart failure with reduced ejection fraction. Eur. J. Heart Fail. 2020;22(9):1675-1683. https://doi.org/10.1002/ejhf.1787.
- Zeybek U., Toptas B., Karaali Z.E., Kendir M., Cakmakoglu B. Effect of TNF-α and IL-1β genetic variants on the development of myocardial infarction in Turkish population. Mol. Biol. Rep. 2011;38(8):5453-5457. https://doi.org/10.1007/s11033-011-0701-x.
- Coker A., Arman A., Soylu O., Tezel T., Yildirim A. Lack of association between IL-1 and IL-6 gene polymorphisms and myocardial infarction in Turkish population. Int. J. Immunogenet. 2011;38(3):2018. https://doi.org/10.1111/j.1744-313X.2010.00988.x.


