Ответ на неоадъювантную химиотерапию с включением препаратов платины у больной раком молочной железы с делецией гена BRCA1 в опухоли
Автор: Цыганов Матвей Михайлович, Тарабановская Наталья Анатольевна, Дерюшева Ирина Валерьевна, Ибрагимова Марина Константиновна, Казанцева Полина Вадимовна, Певзнер Алина Михайловна, Слонимская Елена Михайловна, Литвяков Николай Васильевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 3 т.18, 2019 года.
Бесплатный доступ
Актуальность. В настоящее время наличие герминальной мутации BRCA1 5382insC у больных раком молочной железы является одним из определяющих факторов для назначения препаратов платины, что связано с высокой эффективностью лечения. Но данный вид мутации обнаруживается не более чем у 10 % больных, что весьма ограничивает возможность назначения препаратов платины. Различные соматические изменения гена BRCA1 в опухоли молочной железы, ведущие к снижению его активности, в частности делеции данного гена, могут играть важную роль в чувствительности опухоли к препаратам платины. Описание клинического случая. Представлено клиническое наблюдение пациентки с диагнозом рак молочной железы, в котором была обнаружена делеция гена BRCA1. В результате лечения у пациентки наблюдается полная морфологическая регрессия на предоперационную химиотерапию по схеме СР Заключение. Частота герминальной мутации гена BRCA1 не превышает 10 %, при этом частота делеций данного гена может варьировать от 30 до 45 %, что расширяет показания для применения препаратов платины у пациентов, отрицательных по герминальной мутации, и позволяет добиться высоких показателей выживаемости и частоты полной морфологической регрессии
Рак молочной железы, мутация brca1 в опухоли, микроматричный анализ, цифровая капельная пцр, неоадъювантная химиотерапия, персонализированная медицина
Короткий адрес: https://sciup.org/140254035
IDR: 140254035 | УДК: 618.19-006.6-08-036.8:615.28:575.113 | DOI: 10.21294/1814-4861-2019-18-3-103-108
Текст научной статьи Ответ на неоадъювантную химиотерапию с включением препаратов платины у больной раком молочной железы с делецией гена BRCA1 в опухоли
Ген BRCA1 расположен на длинном плече 17 хромосомы (17q21.31) и кодирует ядерный фосфобелок, который участвует в репарации ДНК в клетке и в регуляции клеточного цикла (PubMed; OMIM 113705). Это первый ген, для которого было определено явное участие в этиологии семейного рака молочной железы (РМЖ) [1]. Герминальная мутация гена BRCA1 также увеличивает риск развития рака шейки и тела матки, поджелудочной железы и толстой кишки [2]. Герминальная мутация BRCA1 5382insC в 20-м экзоне выявлена в 1994 г. и была показана ее сопряженность с высоким риском развития наследственного рака молочной железы и яичников [3]. Это наиболее распространенная мутация гена BRCA1, которая составляет 80 % мутаций в гене BRCA1 и 60 % от общего объема мутаций в генах BRCA1/2 для славянского населения [4]. При этом показано, что больные РМЖ с данной мутацией BRCA1 особенно чувствительны к неоадъювантной химиотерапии (НХТ) с использованием препаратов платины [5, 6]. Это объясняется тем, что продукт гена-супрессора BRCA1 входит в репарационный комплекс, обладающий высокой чувствительностью к повреждению ДНК. При возникновении генетических дефектов в работе белков комплекса нарушается процесс репарации ДНК и мутантные клетки, подвергающиеся действию генотоксических агентов (таких как препараты платины), как правило, погибают [7, 8]. Предполагается, что различные соматические изменения гена BRCA1 в опухоли молочной железы, которые оказывают влияние на его активность и, в частности, на снижение/повышение экспрессии данного гена, аберрации числа копий (copy number aberration – CNA), делеции и дупликации, точко-вые мутации и др., могут играть важную роль в чувствительности опухоли к препаратам платины, что дает возможность для их назначения на предоперационном этапе лечения [9].
Приводим клинический случай персонализированной неоадъювантной химиотерапии у больной РМЖ, при выборе схемы НХТ в качестве предиктивного маркера определяли мутации гена BRCA1 в опухоли.
Проведенная работа соответствует этическим стандартам, разработанным в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ № 266, от 19.06.2003. От лица, участвующего в исследовании, получено информированное согласие.
Больная В., 42 лет. В марте 2017 г. обнаружила уплотнение в левой молочной железе. Обратилась в клиники НИИ онкологии Томского НИМЦ. Выполнена биопсия. Морфологическое исследование (№№ 10602–07/17) показало наличие инвазивной дольковой карциномы. По результатам иммуно-гистохимичекого исследования: ER – 5 баллов, PR – 8 баллов, Her2/neu+++, Ki67 – 54 %, трижды позитивный вариант. Наследственность не отягощена. Проведено обследование на наличие герминальной мутации BRCA1 5382insC; результат отрицательный.
По данным клинического обследования установлен диагноз (С50.5): Рак нижненаружного квадранта левой молочной железы IIA стадии, T2N0M0. На предоперационном этапе лечения принято решение о проведении неоадъювантной химиотерапии. Для персонализированного выбора схемы НХТ выполнено молекулярно-генетическое исследование биопсийного опухолевого материала (~10 мм3), помещенного в консервирующий раствор RNAlater (Sigma Ink).
Из биопсийного опухолевого материала выделяли ДНК и РНК. Выделение ДНК и РНК производилось с помощью набора QIAamp DNA mini Kit (Qiagen, Germany) и Plus RNeasy mini Kit (Qiagen, Germany) соответственно. Концентрацию и чистоту выделения РНК оценивали на спектрофотометре NanoDrop-2000 (Thermo Scientific, USA) (53,9 нг/мкл, А260/А280=2,09; А260/А230=2,01). Для ДНК концентрация составила 88,4 нг/мкл, А260/А280=1,93; А260/А230=2,09. Целостность РНК и ДНК оценивали при помощи капиллярного электрофореза на приборе TapeStation (Agilent Technologies, USA). Для РНК RIN составил 7,4; фрагменты ДНК имели массу более 50 kbp.
Для получения кДНК на матрице РНК проводили реакцию обратной транскрипции с помощью набора RevertAid™ (Thermo Scientific,
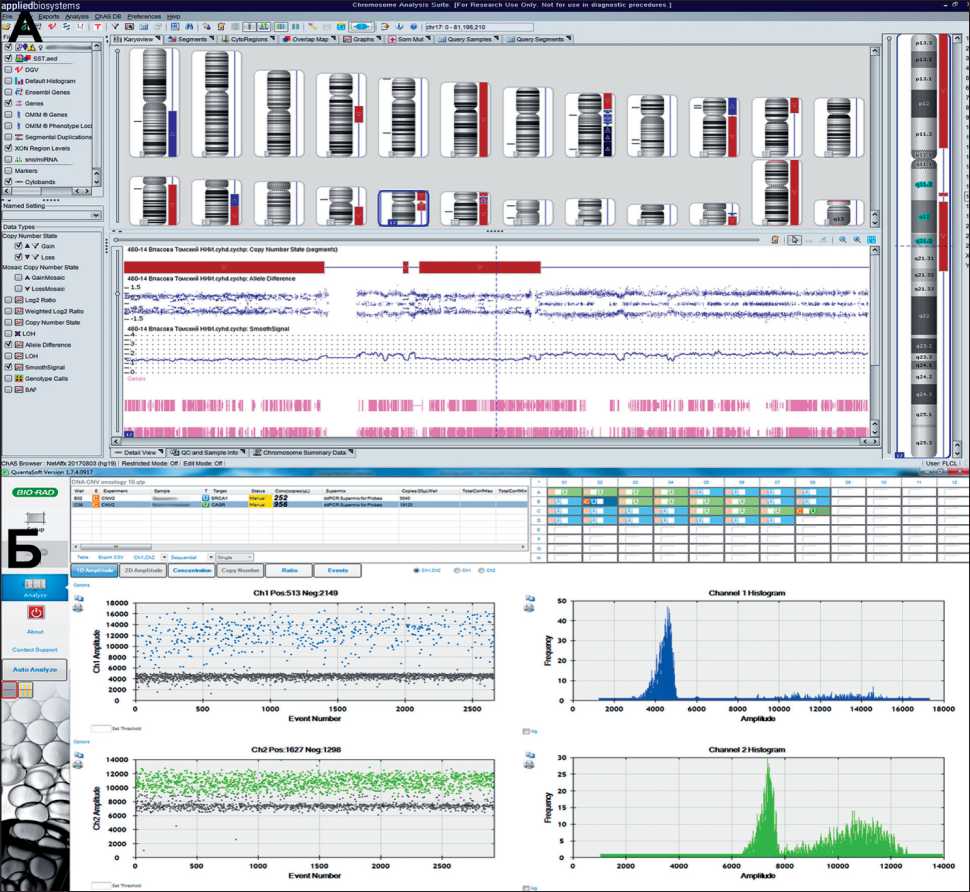
Рис. 1. Результат микроматричного исследования: (А) – хорошо видна делеция 17q21.31; (Б) – результат цифровой ПЦР: представлены графики положительных капель для гена рефери и гена BRCA1 и количество копий/мкл
USA) со случайными гексануклеотидами. Уровень экспрессии гена BRCA1 (PubMed NM_007294.3) оценивали при помощи обратно-транскриптазной количественной ПЦР в режиме реального времени (RT-qPCR) с оригинальными праймерами и зондами по технологии TaqMan (Forward primer 5’-acagctgtgtggtgcttctgtg-3’; Reverse primer 5’-cattgtcctctgtccaggcatc-3’; Probe FAM-5’-catcat-tcacccttggcacaggtgt-3’- BHQ1; Amplicon 107 bp) на амплификаторе Rotor-Gene-6000 (Corbett Research, Australia). ПЦР ставился в трех репликах в объеме 15 мкл, содержащем 250 мкM dNTPs (Sibenzyme, Россия), 300 нM прямого и обратного праймеров, 200 нM зонда, 2,5 мM MgCl2, 19 SE buffer (67 мM Tris–HCl pH 8,8 при 25 ºC, 16,6 мM(NH4)2SO4, 0,01 % Tween-20), 2,5 ед HotStart Taq polymerase (Sibenzyme, Россия) и 50 нг кДНК. Двухшаговая программа амплификации включала 1 цикл – 94 ºС, 10 мин – предварительная денатурация; 40 циклов – 1 шаг 94 ºС, 10 сек и 2 шаг 20 сек – при температуре 60 ºС. В качестве гена-рефери использовались два гена-рефери: GAPDH (glyceraldehydes-3-phosphatedehydrogenase, PubMed NM_001256799.2) (Forward primer 5’-gccagccgagccacatc-3’; Reverse primer 5’- ggcaacaatatccactttaccaga-3’; Probe FAM-5-’-cgcccaatacgaccaaatccg-3’- BHQ1; Amplicon 124 bp) и ACTB (actin beta, PubMed NM_001101.4) (Forward primer 5’-gagaagatgacccagatcatgtt-3’; Reverse primer 5’-atagcacagcctggatagcaa-3’; Probe FAM-5’-agaccttcaacaccccagccat-3’- BHQ1; Amplicon 73 bp), уровень экспрессии гена BRCA1 нормализовался по отношению к экспрессии генов-рефери и измерялся в условных единицах. Относительная экспрессия оценивалась с помощью метода Pfaffl [10]. В качестве калибратора использовалась пулированная от 20 пациентов РНК, выделенная из морфологически нормальной ткани молочной железы, полученной во время операции от больных, которым не проводилась НХТ.
Для изучения CNA гена BRCA1 в опухоли проводили микроматричный анализ на ДНК-чипах высокой плотности фирмы Affymetrix (USA) CytoScan™ HD Array. В качестве проверки результатов микроматричного исследования была использована цифровая ПЦР (Droplet Digital PCR – Система ddPCR QX200, Bio-Rad, USA) (рис. 1). С использованием программного обеспечения QuantaSoft™ 1.7.4.0917 осуществлялся подсчет капель, дающих флуоресцентные положительные и отрицательные сигналы для расчета концентрации целевой ДНК. CNA в опухолевой ткани определялось по отношению к референсным локусам генома человека (гены SLC22A17 (NM_001289050.1), KPNA1 (NM_002264.3), CASR (NM_000388.3)) по формуле
CNV=(A/B)×NB, где A – концентрация молекул-мишеней; B – концентрация референсных молекул; NB – число копий референсных локусов в геноме.
В результате молекулярно-генетического исследования выявлена делеция гена BRCA1 в опухоли молочной железы. Подтверждением этому явился низкий уровень экспрессии данного гена – 0,686.
Исходя из полученных данных была персона-лизированно назначена схема неоадъювантной химиотерапии CP (циклофосфан, цисплатин). Проведено 6 курсов НХТ (Циклофосфан – 1080 мг / Цисплатин 135 мг). Осложнения неоадъювантной химиотерапии: тошнота/рвота II степени, слабость I степени, печеночная токсичность. При оценке эффект лечения по данным УЗИ – полная морфологическая регрессия. 03.11.2017 проведена операция в объеме секторальной резекции левой молочной железы с аксиллярной лимфаденэктомией и интраоперационной лучевой терапией ложа опухоли в дозе 10 Гр. Гистологическое исследование (№№ 28641–64/17): инвазивный дольковый рак без метастатического поражения 15 лимфоузлов. Границы резекции без опухолевой ткани, лечебный патоморфоз I степени по RCB и IV степени по Лавниковой – полная морфологическая регрессия.
В дальнейшем больной назначена послеоперационная гормонотерапии ингибиторами ароматазы (с учетом состояния менопаузы, данных УЗИ и гормонального фона) в течение 5 лет, таргетная терапия трастузумабом в течение года. Кроме того, проведен курс дистанционной лучевой терапии на оставшуюся часть молочной железы в стандартном режиме в дозе 2 Гр до СОД 46 Гр (с учетом интраоперационной лучевой терапии 10 Гр на ложе удаленной опухоли).
Общий срок наблюдения за больной составил 12 мес. Данных о прогрессирования заболевания не получено.
Заключение
Частота герминальной мутации гена BRCA1 не превышает 10 %, при этом частота делеций данного гена может варьировать от 30 до 45 %, что значительно расширяет возможность применения препаратов платины у пациентов, отрицательных по герминальной мутации, в отношении достижения полной морфологической регрессии и высоких показателей выживаемости. Определение делеции гена BRCA1 в опухоли молочной железы при помощи микроматричного исследования является высокотехнологичным и точным методом, но, к сожалению, дорогостоящим. В качестве хорошей альтернативы может использоваться система цифровой капельной ПЦР, что в значительной степени упростит и удешевит проведение данного молекулярно-генетического анализа.
Список литературы Ответ на неоадъювантную химиотерапию с включением препаратов платины у больной раком молочной железы с делецией гена BRCA1 в опухоли
- Johnson N., Fletcher O., Palles C., Rudd M., Webb E., Sellick G., dos Santos Silva I., McCormack V., Gibson L., Fraser A., Leonard A., Gilham C., Tavtigian S.V., Ashworth A., Houlston R., Peto J. Counting potentially functional variants in BRCA1, BRCA2 and ATM predicts breast cancer susceptibility. Hum Mol Genet. 2007 May 1; 16(9): 1051-7. DOI: 10.1093/hmg/ddm050
- Kadouri L., Hubert A., Rotenberg Y., Hamburger T., Sagi M., Nechushtan C., Abeliovich D., Peretz T. Cancer risks in carriers of the BRCA1/2 Ashkenazi founder mutations. J Med Genet. 2007 Jul; 44(7): 467-71. DOI: 10.1136/jmg.2006.048173
- Simard J., Tonin P., Durocher F., Morgan K., Rommens J., Gingras S., Samson C., Leblanc J.F., Belanger C., Dion F. Common origins of BRCA1 mutations in Canadian breast and ovarian cancer families. Nat Genet. 1994 Dec; 8(4): 392-8. DOI: 10.1038/ng1294-392
- Palmero E.I., Alemar B., Schuler-Faccini L., Hainaut P., Moreira-Filho C.A., Ewald I.P., Santos P.K.D., Ribeiro P.L.I., Oliveira Netto C.B.D., Kelm F.L.C. Screening for germline BRCA1, BRCA2, TP53 and CHEK2 mutations in families at-risk for hereditary breast cancer identified in a population-based study from Southern Brazil. Genet Mol Biol. 2016 May 24; 39(2): 210-22. DOI: 10.1590/1678-4685-GMB-2014-0363
- Byrski T., Huzarski T., Dent R., Gronwald J., Zuziak D., Cybulski C., Kladny J., Gorski B., Lubinski J., Narod S. Response to neoadjuvant therapy with cisplatin in BRCA1 -positive breast cancer patients. Breast Cancer Res Treat. 2009 May; 115(2): 359-63. DOI: 10.1007/s10549-008-0128-9
- Byrski T., Huzarski T., Dent R., Marczyk E., Jasiowka M., Gronwald J., Jakubowicz J., Cybulski C., Wisniowski R., Godlewski D., Lubinski J., Narod S.A. Pathologic complete response to neoadjuvant cisplatin in BRCA1-positive breast cancer patients. Breast Cancer Res Treat. 2014 Sep; 147(2): 401-5. DOI: 10.1007/s10549-014-3100-x
- Гафтон И.Г., Имянитов Е.Н., Семиглазов В.В., Мацко Д.Е., Гафтон Г.И., Семилетова Ю.В., Иевлева А.Г, Михнин А.Е., Лемехов В.Г. Экспрессия гена BRCA1 при нейроэндокринных опухолях желудочнокишечного тракта. Сибирский онкологический журнал. 2014; 16(4): 11-15.
- Imyanitov E.N., Moiseyenko V.M. Drug therapy for hereditary cancers. Hered Cancer Clin Pract. 2011 Aug 6; 9(1): 5. DOI: 10.1186/18974287-9-5
- Tsyganov M., Ibragimova M., Deryusheva I., Slonimskaya E., Lit-viakov N. Expression of the BRCA1 gene in a breast tumor: Correlation with the effect of neoadjuvant chemotherapy. AIP Conference Proceedings. 2017; 1882(1): 1-5.
- Pfaffl M.W. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic acids research. 2001; 29(9): e45e45.


