Паллиативная лучевая терапия у больных с локо-регионарными рецидивами и метастазами рака желудка
Автор: Титова Л.Н., Скоропад В.Ю., Гулидов И.а, Бердов Б.А., Силантьева Н.К., Агабабян Т.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2 (44), 2011 года.
Бесплатный доступ
Проанализирован опыт применения лучевой терапии у 37 больных с локо-регионарными рецидивами и метастазами рака желудка. Показано, что проведение паллиативной лучевой терапии у больных локо-регионарными рецидивами и метаста- зами рака желудка безопасно и весьма эффективно - у абсолютного большинства больных было достигнуто купирование болевого синдрома и восстановление проходимости пищи по желудочно-кишечному тракту. Наибольшая эффективность лучевой терапии была отмечена при подведении суммарных очаговых доз в диапазоне от 40 до 50 Гр.
Рак желудка, рецидивы, метастазы, паллиативная лучевая терапия
Короткий адрес: https://sciup.org/14055893
IDR: 14055893 | УДК: 616.33-006.6-033.2-036.65
Текст научной статьи Паллиативная лучевая терапия у больных с локо-регионарными рецидивами и метастазами рака желудка
Таблица 1
Таблица 2
|
Локализация метастазов |
Кол-во больных |
Болевой синдром |
Уменьшение (в т.ч. купирование) болевого синдрома |
|
Грудные позвонки |
4 |
4 |
4 (3) |
|
Надключичные лимфоузлы |
3 |
1 |
1 (1) |
|
Легкие |
2 |
2 |
2 (1) |
|
Мягкие ткани (2) и кости (1) малого таза |
3 |
3 |
3 (3) |
|
Нижнечелюстной сустав, околоушная слюнная железа, послеоперационный шов, брюшная стенка |
4 (по 1 пациенту) |
4 |
4 (3) |
|
Всего |
16 |
14 |
14 (11) |
В группе больных, имевших отдаленные метастазы, локализация поражения была следующей: грудные позвонки (4 больных, в одном случае в последующем были выявлены и также подверглись паллиативной лучевой терапии метастазы в легкое, мягкие ткани ягодицы и кости таза); надключичные лимфатические узлы (3 больных); легкие (2 больных, в одном случае также имел место и подвергался лучевой терапии метастаз в кости кисти); мягкие ткани и кости таза (3 больных); ткани брюшной стенки, в том числе область послеоперационного шва (2 пациента); нижнечелюстной сустав и околоушную слюнную железу (по 1 больному). Размеры метастатических очагов варьировали от 2 до 5 см. Наличие выраженного болевого синдрома имело место у абсолютного большинства (14 из 16) больных. Практически у всех больных была выявлена выраженная сопутствующая патология, преобладали заболевания сердечно-сосудистой системы. Осложнениями рецидивного и метастатического процесса у большинства больных были анемия и дефицит массы тела.
Перед началом лучевой терапии для каждого больного проводилась топографо-анатомическая подготовка с применением всех методов диагностики: спиральная компьютерная томография, ультразвуковое исследование, рентгеновское исследование. На симуляторе определялись положение и размеры полей облучения для каждой локализации опухолевого процесса. Очаговая доза рассчитывалась по 90–95 % изодозе как в статическом, так и в ротационном режиме.
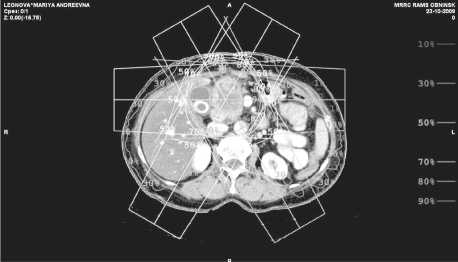
При контрольных УЗИ и эзофагогастро-скопии через 6 и 12 мес данных за рецидив получено не было. При очередном обследовании 23 октября 2009 г. (18 мес после операции) на СКТ органов брюшной полости в проекции культи двенадцатиперстной кишки было выявлено мягкотканое образование неправильной формы, неоднородной структуры и плотности, с бугристыми, нечеткими контурами, размерами 65х46 мм, инфильтрирующее большой сальник и прорастающее левую долю печени. Образование также вовлекало культю двенадцатиперстной кишки, смещало влево верхние брыжеечные сосуды. При эзофагогастроскопии данных за рецидив не получено. Под УЗ-контролем была выполнена чрескожная пункционная биопсия образования, при гистологическом исследовании: среди некротической и соединительной ткани тубулярная аденокарцинома G2. В связи с местной распространенностью и инфильтративным характером опухоли вероятность радикального ее удаления была расценена как низкая. Было принято решение о проведении курса химиолучевой терапии. С 17 ноября по 8 декабря был проведен пролонгированный курс химиолучевой терапии в СОД 40 Гр на фоне приёма кселоды (в дозировке 1850 мг/м2 в сут, в два приёма с интервалом 12 ч) и внутривенного введения элоксатина 85 мг/м2 в начале первой и третьей недели курса. На рис. 1 представлен топографо-дозиметрический план облучения на ускорителе Philips SL-20. Поперечный срез тела выполнен на уровне центра рецидивной опухоли. Дозиметрический план представлен 3 секторной ротацией с углами качания 60 градусов, изоцентрически, расчет дозы выполнен по 90 % изодозе, куда вошла вся зона периферической инфильтрации. Разметка полей облучения проведена на симуляторе «PHILIPS» в положении больной лежа на спине. 12 января 2010 г. была выполнена контрольная СКТ органов брюшной полости, на которой было выявлено выраженное уменьшение размеров рецидивной опухоли до 32х27 мм. Больной было предложено оперативное вмешательство, от которого она отказалась, в связи с чем был продолжен курс лучевой терапии в СОД 28 Гр по 2 Гр за фракцию ежедневно. Больная в удовлетворительном состоянии была выписана из стационара с рекомендациями проведения химиотерапии по месту жительства. Проведено 5 курсов химиотерапии по схеме XELOX. Контрольное обследование было выполнено 15.09.10 (9 мес после завершения химиолучевой терапии). Больная в удовлетворительном состоянии, жалоб не предъявляет. При контрольной СКТ отмечено дальнейшее уменьшение размеров рецидивной опухоли до 19х15 мм. Новых очагов опухолевого роста не зарегистрировано.


