Паллиативное стентирование коарктации аорты у новорожденного пациента в критическом состоянии
Автор: Сойнов И.А., Кулябин Ю.Ю., Горбатых А.В., Войтов А.В., Омельченко А.Ю., Горбатых Ю.Н., Иванцов С.М., Архипов А.Н.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Случаи из клинической практики
Статья в выпуске: 1 т.23, 2019 года.
Бесплатный доступ
Критическая коарктация аорты у новорожденных с нефункционирующим артериальным протоком часто требует экстренного хирургического вмешательства. На фоне стремительно развивающейся полиорганной недостаточности вследствие острой обструкции системного кровотока «открытое» хирургическое вмешательство имеет крайне высокий риск неблагоприятного исхода. Мы представляем случай успешного применения эндоваскулярной методики стентирования перешейка аорты у новорожденного недоношенного мальчика 1,9 кг с критической коарктацией аорты как паллиативного этапа радикального хирургического вмешательства. Показанием к первичному стентированию перешейка был декомпенсированный метаболический ацидоз. Для стентирования выполнен забрюшинный доступ и выделена правая подвздошная артерия. Стандартный коронарный стент (диаметр 4 мм, длина 13 мм) доставлен через интродьюсер 4 Рг. После удаления интродьюсера восстановлена целостность подвздошной артерии. Паллиативное стентирование прошло без осложнений. Через четыре дня после имплантации стента пациент стабилизирован. Ребенку в операционной выполнили эксплантацию коронарного стента, резекцию суженного участка аорты и формирование косого расширенного анастомоза. Операция прошла без осложнений. На 4-е сут. ребенок переведен из палаты реанимации в отделение, на 15-е сут. выписан из отделения в удовлетворительном состоянии. Паллиативная имплантация стента у новорожденных с критической коарктацией аорты при декомпенсированном состоянии позволяет стабилизировать и подготовить пациента к последующей радикальной операции, снижает риск тяжелых осложнений и летального исхода.
Коарктация аорты, паллиативное вмешательство, полиорганная недостаточность
Короткий адрес: https://sciup.org/142230684
IDR: 142230684 | DOI: 10.21688/1681-3472-2019-1-78-82
Текст научной статьи Паллиативное стентирование коарктации аорты у новорожденного пациента в критическом состоянии
Коарктация аорты относится к группе часто встречаемых врожденных пороков сердца, среди новорожденных и младенцев данный порок составляет 6–10% случаев [ 1, 2 ]. Сегментарное сужение аорты часто сочетается с гипоплазией дистальной части или всей дуги аорты, с распространенностью у детей до 70% [ 2 , 3 ]. Критическая коарктация аорты у новорожденных обычно характеризуется выраженным сужением в области перешейка аорты, а выживаемость пациента зависит от степени закрытия артериального протока. Спонтанное закрытие артериального протока приводит к стремительному ухудшению состояния пациента и развитию полиорганной недостаточности
[ 4 ]. Уменьшение почечной перфузии приводит к задержке жидкости и увеличению лактата, провоцируя развитие сердечной недостаточности и метаболического ацидоза [ 4, 5 ]. Назначение простагландина Е1 может оказаться неэффективным в отношении реканализации артериального протока, что обычно требует экстренного хирургического вмешательства. При декоменсированном состоянии, особенно у маловесных пациентов, риск «открытой» хирургической коррекции порока крайне высок, поэтому одним из предпочтительных методов является стентирование перешейка аорты [ 6 ].
Мы представляем случай успешного паллиативного стентирования перешейка аорты у недоношенного маловесного ребенка с критической коарктацией аорты.

Статья доступна по лицензии Creative Commons Attribution 4.0.
Клинический случай
Мальчик 23 сут., недоношенный, 30 нед., весом 1,9 кг поступил в отделение реанимации и интенсивной терапии в критическом состоянии. При осмотре ребенка отмечались бледно-серый кожный покров с цианотичным оттенком, тахикардия с частотой сердечных сокращений около 182 уд./ мин, артериальным давлением на руках 52/31 мм рт. ст., на ногах — 34/22 мм рт. ст.; сатурация на руках 96%, на ногах — 78%; одышка до 70 д.д./мин. В течение 23 ч отмечена анурия. По данным анализа газового состава артериальной крови: рH 7,22, рO2 61 мм рт. ст., рСO2 71 мм рт. ст., лактат 6,9 ммоль/л, калий 4,2 ммоль/л, натрий 142 ммоль/л, кальций 1,2 ммоль/л, BE –5,6 ммоль/л. По данным рентгенографии: кардиомегалия с сердечно-легочным коэффициентом 66%. Выполнена трансторакальная эхокардиография, по данным которой установлен диагноз «критическая коарктация с гипоплазией дистальной дуги аорты». Восходящая аорта 6 мм, проксимальная дуга аорты 3 мм (Z-score –1,8), дистальная дуга аорты 2 мм (Z-score –3,2) в области перешейка аорта сужена до 1 мм (Z-score –4,8), нисходящая аорта 5 мм (Z-score 1). Артериальный проток в стадии спонтанного закрытия, дефект межпредсердной перегородки вторичного типа 4 мм, показатели сократимости левого желудочка снижены (фракция выброса 30%), индекс сферичности левого желудочка 70%. Для стабилизации состояния подключена инфузия вазапростана (простагландина Е1) в дозировке 0,1 мкг/кг/мин. Ребенок интубирован и переведен на механическую вентиляцию легких. Коррекция метаболического ацидоза выполнялась с помощью инфузии натрия бикарбоната, а также кристаллоидных растворов в дозировке 10–20 мл/кг до достижения целевого значения рH 7,3. С учетом снижения сократительной способности левого желудочка назначен допамин в дозировке 5 мкг/кг/мин. В связи с признаками анурии установлен катетер Тенк-хоффа для перитонеального диализа. После наблюдения в течение 2 ч, несмотря на проводимую терапию, отмечалась отрицательная динамика: нарастание ги-перлактатемии до 14,4 ммоль/л, калий увеличился до 5,1 ммоль/л.
Решено выполнить паллиативную коррекцию в объеме стентирования перешейка аорты. После выделения правой подвздошной артерии (3 мм) установлен интродьюсер 4 Fr. Внутривенно введен гепарин 50 МЕ/кг. Выполнена аортография: проксимальная часть аорты 3,5–4 мм (Z-score –1,5), дистальная дуга аорты 2,9 мм (Z-score –2,2), перешеек аорты 1 мм (Z-
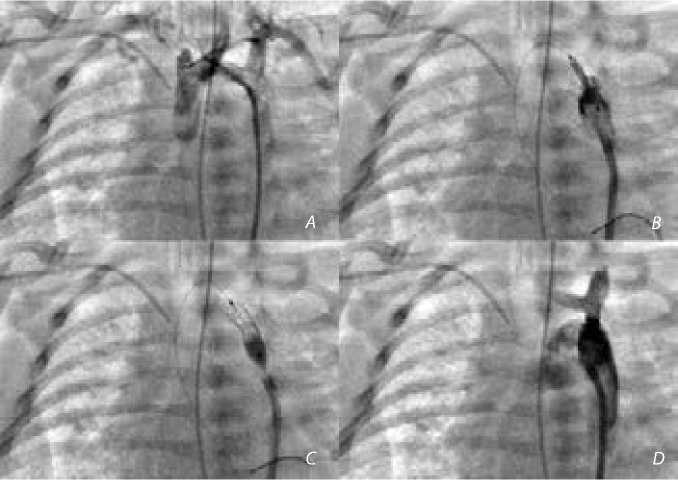
Рис. 1. Стентирование перешейка аорты: аортография ( А ); проведение коронарного стента в перешеек аорты ( B ); раскрытие стента ( C ); контрольная аортография ( D )
score –4,8). Проводник установлен через перешеек в дистальную часть дуги аорты, по нему в область перешейка аорты заведен коронарный стент диаметром 4 мм, длиной 13 мм и раздут на баллоне 4 мм (рис. 1). Контрольная аортография показала хороший ангиографический результат, при прямой тензиометрии градиент давления в области перешейка составил 8 мм рт. ст. После удаления интродьюсера дефект в подвздошной артерии ушит отдельными узловыми швами (рис. 1).
В течение первых суток после операции появился активный диурез, нормализовался газовый состав крови (рH 7,35; рO2 120 мм рт. ст.; рСO2 35 мм рт. ст.; лактат 1,7 ммоль/л; калий 3,5 ммоль/л; натрий 135 ммоль/л; кальций 1,6 ммоль/л; BE –0,9 ммоль/л). На 2-е сут. по данным эхокардиографии восстановилась нормальная сократительная способность левого желудочка (фракция выброса 60%). На 4-е сут. ребенку в операционной выполнили радикальную коррекцию — резекцию суженного участка аорты с формированием косого расширенного анастомоза.
Хирургическая коррекция выполнялась в условиях нормотермии доступом из левосторонней заднебоковой торакотомии по третьему межреберью. Мобилизация аорты включала выделение дуги аорты на протяжении до брахиоцефального ствола, левых общей сонной и подключичной артерий, перешейка аорты, артериальной связки и нисходящей части грудной аорты дистальнее коарктации. Артериальная связка была прошита и пересечена. Проксимально зажимом Сатинского аорта закрыта между брахиоцефальным стволом и левой общей сонной артерией с одновре- менной окклюзией левых общей сонной и подключичной артерий, дистально — ниже участка коарктации. Суженный участок аорты иссекался вместе со стентом и дуктальной тканью в пределах «здоровых» тканей (рис. 2). Для расширения периметра анастомоза производился разрез аорты по малой кривизне, не доходя 2–3 мм до браншей проксимального зажима Сатинского. Дистальный конец пересеченной аорты рассекали по наружной стенке для достижения оптимального соответствия при наложении анастомоза. Анастомоз по типу «конец-в-конец» формировался непрерывным обвивным швом в направлении под дугу аорты. После снятия окклюзии аорты градиента давления между руками и ногами не было. Дальнейшее течение послеоперационного периода было без осложнений, пациент экстубирован на 3-е сут., инфузия кардиотоников (допамин 5 мкг/кг/мин) прекращена в течение 2 сут. На 4-е сут. ребенок переведен в отделение. На 15-е сут. ребенок выписан в удовлетворительном состоянии с артериальным давлением 81/44 мм рт. ст. на руках и 85/46 мм рт. ст. на ногах.
Обсуждение
Баллонная дилатация или стентирование нативной коарктации аорты является общепринятой методикой лечения у детей старшего возраста или взрослых пациентов, по результатам сопоставимой с «открытой» операцией [ 6 ]. Однако эффективность данного подхода у новорожденных и детей раннего возраста с коарктацией аорты остается спорной, «открытое» хирургическое вмешательство является «золотым стандартом» у данной категории пациентов [ 2 , 3, 6–8 ] . Осложнения, связанные с баллонной ангио-
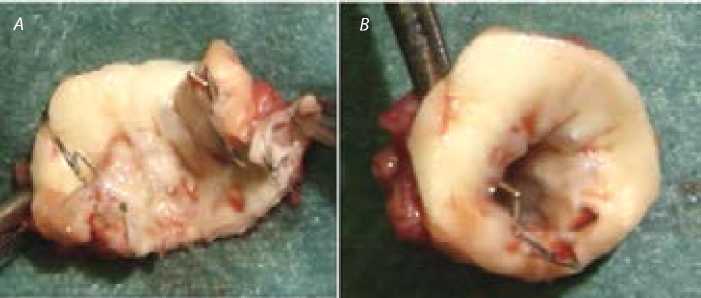
Рис. 2. Удаленный сегмент аорты вместе с коронарным стентом
пластикой или стентированием у новорожденных и младенцев, включают в себя остаточный градиент на дуге аорты, связанный с протяженным суженным сегментом аорты или гипоплазией дуги, более высокой частотой рекоарктации и образованием аневризм по сравнению с открытой хирургической коррекцией [ 6, 8 ]. Однако в некоторых случаях «открытое» хирургическое вмешательство может быть связано с высоким риском летального исхода [ 4–6 ].
В нашем случае стентирование перешейка аорты в качестве первого этапа коррекции в связи с закрытием артериального протока, тяжелым декомпенсированным метаболическим ацидозом и сердечной недостаточностью позволило обеспечить адекватный системный кровоток с последующей стабилизацией состояния пациента. Градиент на уровне дуги аорты, по данным эхокардиографии, составил 12 мм рт. ст., диурез восстановился в течение суток, а сократительная функция левого желудочка нормализовалась через 48 ч после паллиативной коррекции.
Экстренная хирургическая коррекция критической коарктации аорты у новорожденных с полиор-ганной недостаточностью по-прежнему имеет высокую частоту летальности и тяжелых осложнений [ 9, 10 ]. Применение эндоваскулярных методик в качестве паллиативной процедуры способствует улучшению общего клинического состояния и последующей радикальной коррекции порока с минимальным риском летальности и осложнений.
Организация экстренной хирургической помощи может быть непростой во многих центрах, особенно где ограниченны человеческие и материальные ресурсы. При сложных врожденных пороках сердца хирургические возможности радикальной операции ограниченны, а роль транскатетерной паллиативной операции по-прежнему не определена [ 6 ].
J. Al-Ata и коллеги описывают стентирование критической коарктации аорты, выполненное четырем новорожденным детям, которым хирургическое лечение противопоказано в связи с тяжелым метаболическим ацидозом или дисфункцией левого желудочка [ 11 ]. Результаты паллиативных процедур были хорошими, что позволило через небольшой промежуток времени выполнить радикальную операцию.
Большое внимание при паллиативном стентировании перешейка аорты уделяется диаметру баллона для ангиопластики или стентирования [6]. Длина баллона для дилатации в нашем случае выбиралась в зависимости от размера перешейка аорты, а максимальный размер баллона — от размера проксимальной части дуги аорты, как и в исследовании E. Francis и коллег [6]. Существует альтернативный подход, описанный P.S. Rao и соавт., согласно которому максимальный диаметр баллона определялся по нисходящей аорте в области диафрагмы. Однако авторы отмечают, что данный способ измерения несет больший риск разрыва перешейка аорты [7].
Заключение
Паллиативная имплантация стента у новорожденных с критической коарктацией аорты при декомпенсированном состоянии позволяет стабилизировать и подготовить пациента к радикальной операции, снижает риск тяжелых осложнений и летального исхода.
Информированное согласие
Письменное информированное согласие было получено от родителей пациента для публикации этого клинического случая.
Финансирование
Исследование не имело финансовой поддержки.
Список литературы Паллиативное стентирование коарктации аорты у новорожденного пациента в критическом состоянии
- Горбатых А.В., Сойнов И.А., Ничай Н.Р., Иванцов С.М., Войтов А.В., Кулябин Ю.Ю., Горбатых Ю.Н., Богачев-Прокофьев А.В. Факторы риска развития рекоарктации аорты у детей. Педиатрия. Журнал им. Г.Н. Сперанского. 2017;96(3):118-24. https://dQi.org/10.241 10/0031-403X-2017-96-3-1 18-1M
- Сойнов И.А., Войтов А.В., Кулябин Ю.Ю., Омельченко А.Ю., Ничай Н.Р., Горбатых А.В., Зубрицкий А.В., Горбатых Ю.Н. Отдаленные результаты хирургической коррекции гипоплазии дистальной части дуги аорты: проспективное рандомизированное исследование. Сибирский научный медицинский журнал. 2017;37(5):40-8. Режим доступа: http:// sibmed.net/article/550/snmzh 5-2017 soynov i dr.pdf
- Сойнов И.А., Синельников Ю.С., Корнилов И.А., Ничай Н.Р., Гасанов Э.Н., Кулябин Ю.Ю., Омельченко А.Ю., Горбатых Ю.Н. Хирургическая коррекция коарктации аорты с гипоплазией дистальной дуги у пациентов раннего возраста. Патология кровообращения и кардиохирургия. 2016;20(2):66-73. DOI: 10.21688/1681-3472-20162-66-73
- Bugeja J., Cutajar D., Zahra C., Parascandalo R., Grech V., DeGiovanni J.V. Aortic stenting for neonatal coarctation of the aorta - when should this be considered? Images Paediatr Cardiol. 2016;18(3):1-4. PMCID: PMC5270202; PMID: 28405206.
- Sreeram I., Sreeram N., Bennink G. Palliative stent implantation for coarctation in neonates and young infants. Ann Pediatr Cardiol. 2012;5(2):145-50. PMCID: PMC3487202; PMID: 23129903. DOI: 10.4103/0974-2069.99616


