Параллели компьютерной томографии и клинических данных при обструктивных образованиях поджелудочной железы
Автор: Барванян Г.М., Морозова М.В., Церт А.А., Белоликов М.И.
Журнал: Хирургическая практика @spractice
Рубрика: Оригинальные статьи
Статья в выпуске: 1 т.9, 2024 года.
Бесплатный доступ
Цель - выявить объективные причины трудности уточняющей диагностики путем проведения сравнительного анализа КТ-признаков и клинических данных.Материалы и методы. Проведен ретроспективный анализ компьютерных томограмм 36 больных с аденокарциномой головки поджелудочной железы и 24 больных с хроническим панкреатитом с преимущественным поражением головки поджелудочной железы, осложненных билиарной и/или дуоденальной обструкцией. Панкреатодуоденальная резекция выполнена 14 больным с раком железы и 9 - с хроническим панкреатитом. Декомпрессивные вмешательства выполнены 35 больным обеих групп.Результаты. При раке образование в нативную фазу в 97 % изоденсное, в артериальную фазу в 94 % становится гиподенсным, при хроническом панкреатите - 67 и 46 % соответственно. Кривая показателей плотности во всех фазах практически одинакова, но разница в градиенте плотности больше при раке (27 HU против 15 HU). При раке чаще определяется стриктура холедоха по типу «обрыва» (44 %) и инвазия артериальных сосудов (25 %). При хроническом панкреатите чаще определяются вирсунголитиаз (21 %), портальная гипертензия (42 %). Практически одинаково представлены такие признаки, как полостные образования, инфильтрация парапанкреатической клетчатки и регионарная лимфоаденопатия. В 6 случаях рака головки и 7 хронического панкреатита были выявлены одинаковые патологические изменения при интраоперационной ревизии: кистозные образования (2 и 4), участки инфицированного некроза и абсцессы в железе и клетчатке (3 и 2) и идентичная картина на срезе макропрепарата (1 и 1).Заключение. Объективной причиной затруднения дифференциальной диагностики рака и хронического панкреатита с преимущественным поражением головки поджелудочной железы является перекрест КТ-признаков, обусловленный схожими патоморфологическими изменениями.
Компьютерная томография, поджелудочная железа, рак, панкреатит, диагноз
Короткий адрес: https://sciup.org/142240775
IDR: 142240775 | УДК: 616.37-006.6 | DOI: 10.5922/2223-2427-2024-9-1-1
Текст научной статьи Параллели компьютерной томографии и клинических данных при обструктивных образованиях поджелудочной железы
To cite this article: Barvanyan G. M., Morozova M. V., Tsert A. A., Belolikov M. I. Parallels between computed tomography and clinical observations in diagnosing obstructive pancreatic masse. Surgical Practice (Russia). 2024;9(1):6—18.
Основными причинами нарушения оттока желчи, проходимости двенадцатиперстной кишки и панкреатической гипертензии при объемных образованиях головки поджелудочной железы (ГПЖ) являются злокачественный процесс и хронический псевдотуморозный панкреатит с преимущественным поражением головки (ХППГ). Трудности дифференциальной диагностики рака ГПЖ и ХППГ при использовании компьютерной томографии (КТ) обусловлены схожестью изображений из-за перекреста рентгенологических признаков и денситометрических показателей [1—3]. Следует также учитывать субъективность оценки данных КТ рентгенологами [4—6]. Однозначно судить о генезе обструкции не всегда удается и во время проведения интраоперационной ревизии увеличенной ГПЖ. Целью работы является выявление объективных причин трудности уточняющей диагностики объемного образования ГПЖ путем проведения сравнительного анализа КТ-признаков и клинических данных.
Материалы и методы
В исследование включено 60 пациентов с объемными образованиями ГПЖ, осложненными билиарной и/или дуоденальной обструкцией. Пациенты находились на лечении в Коми республиканской клинической больнице с 2014 по 2020 г. В первую группу вошли 36 больных с аденокарциномой ГПЖ. Все больные поступили с механической желтухой. Из них у 3 больных имелось также нарушение проходимости двенадцатиперстной кишки. В 14 случаях выполнена панкреатодуоденальная резекция (ПДР), в 18 наложены билиодигестивные соустья (в 2 — одновременно с гастроэнтеростомией) и в 4 произведено чрескожное чреспеченочное дренирование желчных путей. Во вторую группу вошли 24 больных с ХППГ. В 23 случаях отмечена механическая желтуха. Один больной поступил с изолированным декомпенсированным стенозом двенадцатиперстной кишки. Также в 4 случаях нарушение проходимости двенадцатиперстной кишки сочеталось с механической желтухой. Девяти больным выполнена ПДР, 2 — дуоденум-сохраняющие резекции ГПЖ, 11 наложены билиодигестивные соустья, из них в 1 случае с одновременной декомпрессией панкреатической системы и в 2 проведена консервативная терапия. Во всех случаях диагноз подтвержден гистологическим исследованием операционного комплекса после резецирующих операций, материала трепанобиопсии при выполнении декомпрессивных вмешательств, чрескожной тонкоигольной биопсии под УЗ-контролем и динамическим наблюдением (более 1 года) при отрицательных результатах биопсии. В первую группу вошли 4 пациента с отрицательными результатами биопсии, у которых после контрольного обследования диагноз ХППГ поменялся на рак.
КТ брюшной полости выполняли на аппарате Aqullion 64 Toshiba. Всем пациентам вводили 100 мл йодсодержащего неионного контрастного препарата (350—370 мг/мл), скорость введения — 3,5 мл/с, четырехфазное сканирование: нативно, артериальная фаза — 28—30 с, венозная — 50—60 с, отсроченная — 5 мин.
Информация до проведения вмешательств в 46 случаях (77%) была представлена следующим заключениями: «объемное образование головки ПЖ», «очаговое поражение головки поджелудочной железы», «нельзя исключить опухоль», «больше данных за зло- качественное новообразование», «больше данных за хронический панкреатит» и т. п. Ретроспективный анализ компьютерных томограмм проведен рентгенологом, имеющим большой опыт в интерпретации заболеваний билиопанкреатодуоденальной зоны.
Изучены следующие рентгенологические признаки: а) размеры, контуры ГПЖ, денси-тометрические характеристики 面 разования при нативном и постконтрастном сканировании; б) степень рас 叩 остранения патологических изменений на окружающие ГПЖ структуры; в) состояние холедоха и панкреатического протока (степень расширения, характер стенозирования, патологические изменения и включения); г) состояние регионарных лимфатических узлов; д) денситометрические характеристики дистальных отделов поджелудочной железы. Значимыми в трактовке денситометрических данных считали различия показателей плотности неизмененной ткани железы и патологических образований 10 HU и более [7].
По каждому случаю хирургом выполнен комплексный анализ клинических данных (результаты интраоперационной ревизии, биопсии, макроскопического исследования резецированного комплекса, динамического наблюдения) и их сопоставление с рентгенологическими признаками.
При проведении статистического анализа для сравнения количественных данных групп использовали U-критерий Манна — Уитни, качественных признаков в группах — тест хи-квадрат ( х 2). За уровень статистической значимости принимали р < 0,05.
Результаты
Денситометрические данные рака ГПЖ и ХППГ представлены в таблице 1. В таблице 2 показаны варианты характеристик плотности образования при раке ГПЖ, в таблице 3 — при ХППГ.
Таблица 1. Денситометрические данные рака ГПЖ и ХППГ*
Table 1. Densitometric data of pancreatic head cancer and mass-forming chronic pancreatitis*
|
Плотность образования железы по отношению к дистальным отделам |
Рак ГПЖ, n = 36 ( %) |
ХППГ, n = 24 ( %) |
|
При нативном сканировании: гиподенсна изоденсна гиперденсна |
1 (3) |
6 (25) |
|
35 (97) |
16 (67) |
|
|
2 (8) |
||
|
Артериальная фаза контрастирования: гиподенсна изоденсна гиперденсна |
34 (94) |
18 (75) |
|
2 (6) |
5 (21) |
|
|
1 (4) |
||
|
Венозная фаза контрастирования: гиподенсна изоденсна гиперденсна |
27 (75) |
10 (42) |
|
7 (29) |
12 (50) |
|
|
2 (6) |
2 (8) |
|
|
Отсроченная фаза контрастирования: гиподенсна изоденсна гиперденсна |
10 (28) |
2 (8) |
|
21 (58) |
16 (67) |
|
|
5 (14) |
6 (25) |
Примечание: * — сохраненная ткань ПЖ.
Note: * — preserved pancreatic tissue.
Таблица 2. Варианты характеристик плотности образования при раке ГПЖ
Table 2. Density characteristics of pancreatic head cancer
|
Нативное сканирование |
Артериальная фаза |
Венозная фаза |
Отсроченная фаза |
n = 36 |
|
Изоденсна |
Гиподенсна |
Гиподенсна |
Изоденсна |
14 |
|
Изоденсна |
Гиподенсна |
Гиподенсна |
Гиподенсна |
8 |
|
Изоденсна |
Гиподенсна |
Изоденсна |
Изоденсна |
4 |
|
Нативное сканирование |
Артериальная фаза |
Венозная фаза |
Отсроченная фаза |
n = 24 |
|
Изоденсна |
Гиподенсна |
Гиподенсна |
Гиперденсна |
3 |
|
Изоденсна |
Изоденсна |
Изоденсна |
Изоденсна |
2 |
|
Изоденсна |
Гиподенсна |
Изоденсна |
Гиперденсна |
1 |
|
Изоденсна |
Гиподенсна |
Гиперденсна |
Гиперденсна |
1 |
|
Изоденсна |
Гиподенсна |
Гиподенсна |
Гиподенсна |
1 |
|
Гиподенсна |
Гиподенсна |
Гиподенсна |
Гиподенсна |
1 |
|
Изоденсна |
Гиподенсна |
Гиперденсна |
Изоденсна |
1 |
Таблица 3. Варианты характеристик плотности образования ГПЖ при ХППГ
Table 3. Density characteristics of pancreatic head in mass-forming chronic pancreatitis
|
Нативное сканирование |
Артериальная фаза |
Венозная фаза |
Отсроченная фаза |
n = 24 |
|
Изоденсна |
Гиподенсна |
Гиподенсна |
Изоденсна |
6 |
|
Изоденсна |
Гиподенсна |
Изоденсна |
Изоденсна |
5 |
|
Гиподенсна |
Гиподенсна |
Изоденсна |
Изоденсна |
3 |
|
Изоденсна |
Изоденсна |
Гиперденсна |
Гиперденсна |
2 |
|
Гиперденсна |
Гиподенсна |
Гиподенсна |
Гиподенсна |
1 |
|
Гиперденсна |
Гиперденсна |
Изоденсна |
Гиперденсна |
1 |
|
Гиподенсна |
Гиподенсна |
Изоденсна |
Гиперденсна |
1 |
|
Гиподенсна |
Изоденсна |
Изоденсна |
Гиперденсна |
1 |
|
Изоденсна |
Гиподенсна |
Гиподенсна |
Гиподенсна |
1 |
|
Изоденсна |
Изоденсна |
Гиподенсна |
Изоденсна |
1 |
|
Гиподенсна |
Гиподенсна |
Гиподенсна |
Гиперденсна |
1 |
|
Изоденсна |
Изоденсна |
Изоденсна |
Изоденсна |
1 |
Сравнительный анализ рентгенологических признаков рака ГПЖ и ХППГ представлен в таблице 4.
Таблица 4. Сравнительный анализ КТ-признаков рака ГПЖ и ХППГ
Table 4. Comparative analysis of pancreatic head cancer and mass-forming chronic pancreatitis CT-signs
|
Признаки |
Рак ГПЖ, n = 36 ( %) |
ХППГ, n = 24 ( %) |
p |
|
Полостные образования в железе |
9 (25) |
8 (33) |
p = 0,68 |
|
Кальцификаты в ПЖ |
8 (22) |
9 (38) |
p = 0,32 |
|
Инфильтрация парапанкреатической клетчатки |
7 (19) |
7 (29) |
p = 0,58 |
|
Вовлечение в патологический процесс магистральных вен / артерий |
11 (31) / 9 (25) |
5 (21) / 0 |
p = 0,40 / – |
|
Признаки портальной гипертензии |
7 (19) |
10 (42) |
p = 0,11 |
|
Расширение вирсунгова протока |
29 (81) |
17 (71) |
p = 0,38 |
|
Стриктуры вирсунгова протока |
4 (11) |
2 (8) |
p = 0,73 |
Окончание табл. 4
|
Конкременты в вирсунговом протоке |
1 (3) |
5 (21) |
p = 0,03* |
|
Признаки |
Рак ГПЖ, n = 36 ( %) |
ХППГ, n = 24 ( %) |
p |
|
Атрофия дистальных отделов железы |
10 (28) |
6 (25) |
p = 0,81 |
|
Расширение холедоха |
35 (97) |
18 (75) |
p = 0,03* |
|
Сужение дистального отдела холедоха по типу «конуса» / «обрыва» |
19 (53) / 16 (44) |
14 (58) / 4 (17) |
p = 0,87 / p = 0,03* |
|
Регионарная лимфоаденопатия |
30 (83) |
16 (67) |
p = 0,24 |
Примечание: * — уровень статистической значимости (p < 0,05).
На рисунках 1, 2 представлена динамика средних показателей плотности при нативном исследовании и в фазы постконтрастного сканирования.
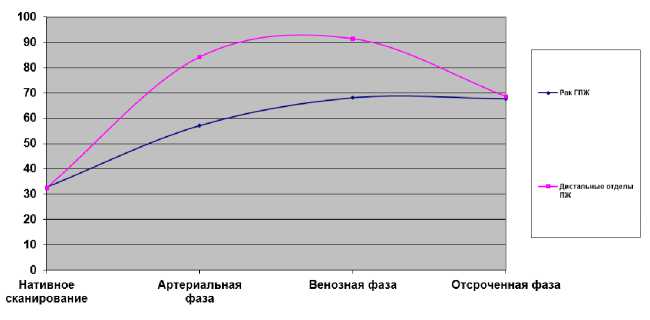
Рис. 1. Средние значения плотности патологической зоны головки и неизмененных дистальных отделов при раке ГПЖ
Fig. 1. Density characteristic curves for head cancer and pancreatic body and tail tissue
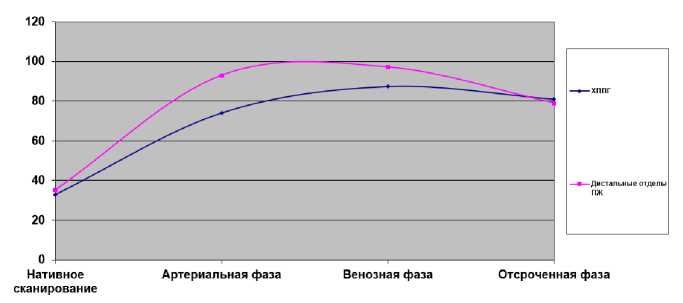
Рис. 2. Средние значения плотности патологической зоны головки и неизмененных дистальных отделов при ХППГ
Fig. 2. Mean density curves for pancreatic head mass-forming chronic inflammation and pancreatic tissue distal to the mass
Обсуждение
В фазу нативного сканирования в 35 (97 %) случаях при раке ГПЖ и в 16 (67 %) случаях при ХППГ объемные образования железы сливались с паренхимой ПЖ и были изоденсны-ми (табл. 1). При ХППГ при нативном сканировании структура ГПЖ чаще была неоднородной за счет гиподенсных (6) и гиперденсных (2) участков (33 %). В артериальную фазу при раке ГПЖ в 33 случаях образование становилось гиподенсным по отношению к неизменной ткани дистальных отделов железы и оставалось таковым в 27 случаях в венозную фазу. При ХППГ в артериальную фазу образование в 12 из 16 случаев становилось гиподенсным и в 3 случаях неоднородность ГПЖ выявлялась в только в венозную фазу контрастирования. В целом кривая показателей средних значений плотности при раке ГПЖ и ХППГ практически одинакова (рис. 1, 2). В обоих случаях плотность ГПЖ увеличивалась в артериальную фазу (средние показатели при раке — 57,1 HU и при ХППГ — 74 HU) и в венозную фазу продолжалось накопление контраста (68,1 HU и 87,3 HU соответственно). Разница средних значений в градиенте плотности между зоной патологической плотности головки и неизмененными дистальными отделами выражена сильнее при раке ГПЖ (27 HU против 15 HU при ХППГ). При раке ГПЖ отставание накопления контраста в опухоли (гиподенсные образования на томограммах) по сравнению с нормальными тканями обусловлено гиповаскуляризацией опухоли и десмопластической реакцией опухолевой стромы [8—10]. Особенности ангиогенеза опухоли (отставание при росте опухоли) могут быть причиной ишемии и развития некроза [11]. При ХППГ гиподенсные очаги обусловлены нарушением архитектоники ткани железы, в том числе сосудистой сети, различными изменениями в исходе некроза железы.
В нашем исследовании в 3 случаях гиподенсные зоны по данным КТ при раке ГПЖ были обусловлены участками инфицированного некроза. Структура гиподенсного участка была неоднородной с перепадом показателей плотности. На операции (ПДР) в головке железы имелись полостные образования до 2 см с детритом. В теле и корне брыжейки поперечной ободочной кишки также выявлены небольшие полостные образования с детритом, из них в 2 случаях — с густым гноем. В 2 случаях диагноз рака был верифицирован до операции, в третьем случае показанием к резецирующей операции был предполагаемый псевдоту-морозный панкреатит.
В 2 случаях гиподенсная неоднородная зона при раке ГПЖ была представлена мелкими кистами.
Аналогичные изменения обнаружены в гиподенсных участках и при ХППГ. В 2 случаях в ГПЖ выявлен хронический воспалительный процесс с мелкими, до 1 см, абсцессами и участками некроза. В 4 случаях гиподенсная зона была представлена небольшими кистозными образованиями.
В 1 случае рака ГПЖ и в 1 случае ХППГ при макроскопическом изучении удаленного панкреатодуоденального комплекса патологические изменения были практически идентичны. В обоих случаях образования имели каменистую плотность. На разрезе ткань была белесоватой, определялись серые овальные пятна размерами 2 × 1 см (гистологически — очаги некроза) и единичные кальцинаты. При раке ГПЖ в крючковидном отростке была выявлена полость с детритом, при ХППГ — несколько мелких кист с гнойным содержимым. Сомнений в злокачественном генезе образования в обоих случаях у хирурга не было. На компьютерных томограммах в обоих случаях отмечены гиподенсные зоны ГПЖ, единичные кальцинаты, одинаковый характер накопления контраста, а изменения трактовались как рак ГПЖ.
В 2 случаях при раке ГПЖ на КТ-изображениях образование было изоденсным во все фазы (табл. 2). При последующей магнитно-резонансной томографии были выявлены небольшие образования 12 и 15 мм в проекции дистального отдела холедоха. После выпол- ненной ПДР гистологически в обоих случаях описана высокодифференцированная аденокарцинома. При высокой дифференцировке опухоли ангиоархитектоника мало отличается от таковой в нормальной ткани. При этом особенности накопления контраста одинаковы и отсутствуют различия в плотности образования ГПЖ и дистальных отделов железы [12; 13]. В 1 случае ХППГ, осложненном прогрессирующей безболевой механической желтухой, железа также была изоденсной во все фазы исследования (табл. 3) с блоком желчных путей в интрапанкреатическом отделе. Результаты магнитно-резонансной томографии только подтвердили блок желчных путей. На операции в ГПЖ определялось небольшое уплотнение, остальные отделы железы были мягкими, размеры вирсунгова протока до 1 мм. Выполнена ПДР. При исследовании макропрепарата выявлено склерозирование стенок дистального отдела желчного протока 叩отяженностью 15 мм. Гистологически описан участок фиброза в проекции дистального отдела холедоха с перифокальным воспалением.
В 4 случаях рака ГПЖ гиподенсные в артериальную фазу образования в венозную и/или от 叩 оченную фазу становились гиперденсными (табл. 2). Такой характер накопления контраста может определяться в опухолях с выраженным фиброзным компонентом за счет задержки «вымывания» контрастного вещества [14; 15]. В 1 случае результаты трепанобиопсии были представлены тканью железы с участками фиброза и склероза и оказались ложноотрицательными. В 1 случае (ПДР) получено следующее гистологическое заключение: «высокодифференцированная аденокарцинома с выраженным фиброзом стромы». Аналогичный характер накопления контраста выявлен в 3 случаях при ХППГ (табл. 3).
Всего при интраоперационной трепан 面 иопсии 面 разования отмечены 4 случая ложноотрицательных результатов. Единственно возможным 面 ъемом вмешательства были декомпрессивные операции. Больные были выписаны с диагнозом псевдотуморозный панкреатит под наблюдение онколога (Iб клиническая группа). Диагноз рака верифицирован через 1—5 месяцев. В 3 из 4 случаев ложноотрицательных результатов интраоперационной трепанобиопсии по результатам КТ было больше данных за рак ГПЖ.
Кальцификаты выявлены в 9 (38 %) случаях при ХППГ и в 8 (22 %) — при раке ГПЖ (p = 0,32) (табл. 4). При ХППГ кальцификаты были множественными, в том числе по всей железе, и в основном единичными при раке (7 из 8).
Признаки инфильтрации описаны в 7 (19 %) случаях рака ГПЖ и в 7 (29 %) — ХППГ (p = 0,58) (табл. 4). При ХППГ во всех случаях инфильтративный процесс представлял собой индуративный парапанкреатит. При раке ГПЖ в 2 случаях выявлен индуративный парапанкреатит подободочного пространства. В 2 случаях отмечено распространение опухолевого 叩 оцесса на клетчатку. В 3 случаях инфильтрат был образован пакетом увеличенных метастатических и реактивных лимфатических узлов.
При проведении уточняющей диагностики большое значение придают характеру сужения дистального отдела холедоха. В нашем исследовании различий по типу конусообразного сужения не выявлено (p = 0,87). «Обрыв» холедоха значимо чаще описан при раке ГПЖ (p = 0,03). Тем не менее в 4 (17 %) случаях признак отмечен и при ХППГ, что не позволяет считать его патогномоничным. Патологоанатомическим субстратом конусообразного сужения при раке ГПЖ было утолщение стенки дистальных отделов холедоха за счет опухолевой инфильтрации, из них в 7 случаях с макроскопическим поражением слизистой в виде мелких узелков. При «обрыве» холедоха опухоль перекрывала просвет протока. При ХППГ конусообразное сужение было обусловлено вовлечением желчного протока в рубцовый процесс и развитием перихоледохеального фиброза. Причиной «обрыва» холедоха при ХППГ было сдавление кистозными образованиями ГПЖ (2 случая), организовавшейся гематомой с густым бурым содержимым со множеством мелких коричневых кристаллов (1) и фиброзным узлом каменистой плотности 3 × 2 см (1).
Расширение вирсунгова протока отмечено одинаково при раке ГПЖ и ХППГ (81 и 71 % соответственно при p = 0,38). Также не было различий по выявленным стриктурам панкреатического протока (11 % и 8 % соответственно при p = 0,73). Камни в панкреатическом протоке — признак, который является специфичным для хронического панкреатита, в 1 случае отмечен и при раке ГПЖ. Очевидно, что этот признак может встретиться при развитии рака на фоне хронического панкреатита. В нашем случае операция была выполнена пациенту с длительным анамнезом алкогольного панкреатита. Диагноз рака был установлен только после срочного гистологического исследования операционного препарата.
Что касается поражения артерий, то в нашем исследовании мы не встретили при ХППГ изменения стенки и диаметра артериальных сосудов.
При раке ГПЖ вовлечение магистральных артерий определяли по следующим признакам: опухолевая деформация стенки и сужение просвета, объем охвата опухолью сосуда. Во всех 9 случаях, кроме вовлечения в опухолевый процесс артериального сосуда, имелись и другие клинико-рентгенологические признаки рака ГПЖ. Диагноз рака до операции не вызывал сомнений. Артериальная инвазия не подтвердилась в 2 случаях выполнения панкреатодуоденальной резекции (рентгенологически инфильтрация стенки менее 50 % окружности без изменения просвета). В остальных случаях опухоль признана неоперабельной по совокупности результатов до- и интраоперационного обследования. Были выполнены желчеотводящие операции, при которых точно установить факт опухолевой инвазии в сосуд невозможно.
Как видно из представленных в таблицах и на рисунках рентгенологических признаков и денситометрических результатов, чувствительность изолированно рассматриваемых признаков невысокая. Даже значимые различия признаков не могут быть абсолютным подтверждением генеза образования [11; 16]. Вирсунголитиаз, специфичный признак хронического панкреатита, встретился в одном случае и при раке ГПЖ (p = 0,03). Характерное для злокачественной стриктуры сужение дистального отдела холедоха по типу «обрыва» (p = 0,03) в 4 (17 %) случаях отмечено и при ХППГ.
Уточняющая диагностика обструктивного объемного образования ГПЖ строится рентгенологом на основании совокупности следующих категорий признаков: денситометриче-ские данные пре- и постконтрастного сканирования, структура патологической зоны, особенности билиарного и панкреатического блока, лимфоаденопатии и сосудистой инвазии, признаки экстрапанкреатического распространения.
В нашем исследовании мы не определяли диагностическую точность КТ-метода при обструктивных образованиях ГПЖ, так как анализ изображений томограмм проводился рентгенологом ретроспективно с известными ему данными о природе образования ГПЖ.
Заключение
-
1. При раке ГПЖ образование в нативную фазу в 97% изоденсное, в артериальную фазу копит контраст, но становится гиподенсным по отношению к неизмененным тканям (94%). При этом разница средних показателей плотности больше, чем при ХППГ. Чаще определяется дистальная стриктура холедоха по типу обрыва и инвазия артериальных сосудов.
-
2. При интраоперационной ревизии и макроскопическом изучении удаленного панкреатодуоденального комплекса в 6 случаях рака ГПЖ и 7 — ХППГ были выявлены одинаковые патологические изменения: участки инфицированного некроза, абсцессы в железе и клетчатке, кистозные образования, практически идентичная картина на разрезе. Очевидно, что рентгенологические признаки, в основе которых лежат схожие патоморфологические изменения, будут одинаковыми. В таких случаях перекрест КТ-признаков делает доопера-ционную дифференциальную диагностику рака ГПЖ и ХППГ крайне затруднительной. Для уточнения генеза объемного образования ГПЖ следует использовать все доступные в учреждении лучевые методы диагностики и биопсию.
-
3. Учитывая объективные причины трудности уточняющей диагностики обструктивных образований ГПЖ, вероятные ошибки следует предупреждать последующей лечебной тактикой. При технической возможности и переносимости пациентом объема
При ХППГ в 33 % в нативную фазу ткань ГПЖ неоднородна за счет гиподенсных (25 %) и гиперденсных (8 %) участков. В артериальную фазу контрастирования образование начинает копить контраст, но только в 46 % случаев, реже чем при раке, становится гипо-денсным. Чаще определяются вирсунголитиаз, множественные кальцификаты в железе и портальная гипертензия.
Практически одинаково при раке ГПЖ и ХППГ представлены такие признаки, как полостные образования, инфильтрация парапанкреатической клетчатки, стриктуры вирсун-гова протока, атрофия дистальных отделов поджелудочной железы, сужение дистального отдела холедоха по типу «конуса» и регионарная лимфоаденопатия.
вмешательства следует выполнять резецирующую операцию (панкреатодуоденальную, дуоденум-сохраняющую). В остальных случаях при отрицательных результатах биопсии после декомпрессивных вмешательств необходимо активное динамическое наблюдение с повторным обследованием.
Список литературы Параллели компьютерной томографии и клинических данных при обструктивных образованиях поджелудочной железы
- Dutta AK, Chacko A. Head mass in chronic pancreatitis: Inflammatory or malignant. World J Gastrointest Endosc. 2015 Mar 16;7(3):258—64. https://doi.org/10.4253/wjge.v7.i3.258
- Manikkavasakar S, AlObaidy M, Busireddy KK, Ramalho M, Nilmini V, Alagiyawanna M, Semelka RC. Magnetic resonance imaging of pancreatitis: an update. World J Gastroenterol. 2014 Oct 28;20(40):14760— 77. https://doi.org/10.3748/wjg.v20.i40.14760
- Jiang S, Li Y. A comparative analysis of CT and MRI in differentiating pancreatic cancer from mass pancreatitis. Am J Transl Res. 2021 Jun 15;13(6):6431—6438.
- Захарова О. П., Кубышкин В. А., Кармазановский Г. Г. Протокол КТ-исследования при оценке резектабельности рака поджелудочной железы. Хирургия. Журнал им. Н. И. Пирогова. 2012;(8):44—50. Zakharova OP, Kubyshkin VA, Karmazanovskiĭ GG. The requirement for the CT-scan protocol for the proper assessment of pancreatic tumors resectability. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N. I. Pirogova. 2012;(8):44—50 (in Russ.).
- Chai L, Zhu N, Wang Q, Wang T, Chai W. Assessment of Malignancy Potential in Intraductal Papillary Mucinous Neoplasms of the Pancreas on MDCT. Acad Radiol. 2021 May;28(5):679—686. https://doi.org/10.1016/j.acra.2020.03.042
- Kamei N, Yamada Y, Hijiya N, Takaji R, Kiyonaga M, Hongo N, Ohta M, Hirashita T, Inomata M, Matsumoto S. Invasive intraductal papillary mucinous neoplasms of the pancreas: relationships between mural nodules detected on thin-section contrast-enhanced MDCT and invasive components. Abdom Radiol (NY). 2019 Sep;44(9):3139—3147. https://doi.org/10.1007/s00261-019-02084-2
- Kim JH, Park SH, Yu ES, Kim MH, Kim J, Byun JH, Lee SS, Hwang HJ, Hwang JY, Lee SS, Lee MG. Visually isoattenuating pancreatic adenocarcinoma at dynamic-enhanced CT: frequency, clinical and pathologic characteristics, and diagnosis at imaging examinations. Radiology. 2010 Oct;257(1):87—96. https://doi.org/10.1148/radiol.10100015
- Кармазановский Г. Г., Ахлынова О. Ю. Целесообразность и диагностическая эффективность болюсного контрастного усиления при компьютерно-томографической диагностике рака поджелудочной железы. Хирургия. Журнал им. Н. И. Пирогова. 2009;(1):60—67. Karmazanovskiy GG, Akhlynova OIu. The role of contrast enhancement in the computed tomography for pancreas cancer diagnostics. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N. I. Pirogova. 2009;(1):60—67 (in Russ.).
- Seo W, Kim YC, Min SJ, Lee SM. Enhancement parameters of contrast-enhanced computed tomography for pancreatic ductal adenocarcinoma: Correlation with pathologic grading. World J Gastroenterol. 2020 Jul 28;26(28):4151—4158. doi: 10.3748/wjg.v26.i28.4151
- Kawaji Y, Yoshikawa T, Nakagawa K, Emori T, Nuta J, Tamura T, Hatamaru K, Yamashita Y, Itonaga M, Ashida R, Terada M, Kawai M, Sonomura T, Kitano M. Computed tomography findings for predicting the future occurrence of pancreatic cancer: value of pancreatic volumetry. Int J Clin Oncol. 2021 Jul;26(7):1304—1313. doi: 10.1007/s10147-021-01915-x
- Ruan Z, Jiao J, Min D, Qu J, Li J, Chen J, Li Q, Wang C. Multi-modality imaging features distinguish pancreatic carcinoma from mass-forming chronic pancreatitis of the pancreatic head. Oncol Lett. 2018 Jun;15(6):9735—9744. https://doi.org/10.3892/ol.2018.8545
- Wang ZQ, Li JS, Lu GM, Zhang XH, Chen ZQ, Meng K. Correlation of CT enhancement, tumor angiogenesis and pathologic grading of pancreatic carcinoma. World J Gastroenterol. 2003 Sep;9(9):2100—4. https://doi.org/10.3748/wjg.v9.i9.2100
- Zaky AM, Wolfgang CL, Weiss MJ, Javed AA, Fishman EK, Zaheer A. Tumor-Vessel Relationships in Pancreatic Ductal Adenocarcinoma at Multidetector CT: Different Classification Systems and Their Influence on Treatment Planning. Radiographics. 2017 Jan-Feb;37(1):93—112. https://doi.org/10.1148/rg.2017160054
- Hattori Y, Gabata T, Matsui O, Mochizuki K, Kitagawa H, Kayahara M, Ohta T, Nakanuma Y. Enhancement patterns of pancreatic adenocarcinoma on conventional dynamic multi-detector row CT: correlation with angiogenesis and fibrosis. World J Gastroenterol. 2009 Jul 7;15(25):3114—21. https://doi.org/10.3748/wjg.15.3114
- Gündüz N, Buyuker F, Seneldir H, Durukan G, Alimoglu O, Kabaalioglu A. Computed Tomography-based Morphological Differences between Histologic Subtypes of Periampullary Ductal Adenocarcinoma. J Coll Physicians Surg Pak. 2021 Aug;31(8):959—964. https://doi.org/10.29271/jcpsp.2021.08.959
- Chen PT, Chang D, Yen H, Liu KL, Huang SY, Roth H, Wu MS, Liao WC, Wang W. Radiomic Features at CT Can Distinguish Pancreatic Cancer from Noncancerous Pancreas. Radiol Imaging Cancer. 2021 Jul;3(4):e210010. https://doi.org/10.1148/rycan.2021210010


