Параметр аутофлюоресценции кожи как фактор неблагоприятного прогноза у пациентов с периферическими формами атеросклероза
Автор: Давыдова H.A., Лебедев П.А., Аюпов A.M., Корнилин Д.В., Гришанов В.Н., Комарова М.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Кардиология
Статья в выпуске: 4 т.18, 2022 года.
Бесплатный доступ
Цель: определение прогностической значимости аутофлюоресценции кожи (АФК) как фактора сердечно-сосудистых осложнений и летальности. Материал и методы. В проспективное исследование включено 122 пациента с заболеваниями периферических артерий: стенозирующий атеросклероз брахиоцефального ствола выявлен у 95 человек (77,9%), хроническая артериальная недостаточность нижних конечностей (ХАН) - у 47 (38,5%). Параметр АФК определяли оригинальным прибором, разработанным авторами. Изучены клинические, антропометрические, биохимические, а также инструментальные параметры сердца и сосудов - методами ультразвукового исследования. Проспективная часть осуществлялась в сроки до 1043 (в среднем 736) дней. Результаты. Параметр АФК положительно и достоверно коррелировал с баллами клинико-прогностических признаков, а также с ХАН, фактом перенесенных операций на артериях ног. За время наблюдения произошло 7 летальных случаев и не менее чем одна госпитализация по сердечно-сосудистым причинам у 42 пациентов. Наиболее частыми были госпитализации с целью консервативного лечения ХАН, необходимости в проведении аортокоронарного шунтирования, стентировании коронарных артерий. Методом логистической регрессии определено, что факт госпитализации или летальности связан с АФК и глюкозой плазмы крови, наличием хронической сердечной недостаточности выше 1-го функционального класса. Параметры модели: чувствительность 71 %, специфичность 68%. Заключение. Параметр АФК может быть использован как интегральный независимый предиктор у пациентов с мультифокальным атеросклерозом.
Аутофлюоресценция кожи, периферический атеросклероз, сердечно-сосудистый риск
Короткий адрес: https://sciup.org/149142942
IDR: 149142942 | УДК: 616.13-004.6
Текст научной статьи Параметр аутофлюоресценции кожи как фактор неблагоприятного прогноза у пациентов с периферическими формами атеросклероза
-
1Введение. Сердечно-сосудистая заболеваемость и летальность являются основной проблемой современной медицины. Заболевания периферических артерий (ЗПА), ассоциированные с атеросклерозом, характеризуются значительным бременем и негативной динамикой распространенности [1]. Так, в 2010 г. проявления ЗПА имели более 202 млн человек, что отражает почти 25%-й рост с 2000 г., причем ⅔ из них проживали в странах с низким и средним уровнями дохода, что объясняется распространенностью сердечно-сосудистых факторов риска, особенно курения и диабета, которые являются мощными предикторами ЗПА [2]. По оценкам, ЗПА страдают 10-20% людей в возрасте 60 лет и старше [3].
В последние десятилетия поиск маркеров сердечно-сосудистых осложнений ведется в направлении конечных продуктов гликирования — неэнзимного связывания белков с глюкозой. Накопление их в коже связано с механизмом ее старения, а также отражает метаболический стресс, способствующий дегенеративным процессам в жизненно важных органах — сердце, мозге, почках [4]. В отличие от определения конечных продуктов гликирования в крови биохимическими методами, требующих забора крови, дорогостоящих методов газово-жидкостной хроматографии, использование аппаратов, фиксирующих АФК с поверхности предплечья, абсолютно не инвазивно, не требует предварительной подготовки, затрат времени, безопасно и в то же время информативно [5]. Важно и то, что содержание конечных продуктов гликирования в поверхностных слоях кожи является стабильным и изменяется медленно, в отличие от крови.
Данное исследование является апробацией простого в эксплуатации устройства — ридера, разработанного авторами, определяющего параметр АФК, независимый от оператора [6].
Цель — определение прогностической значимости аутофлюоресценции кожи как фактора сердечнососудистых осложнений и летальности.
Материал и методы. Основную группу составили 122 мужчины — пациенты в возрасте от 42 до 78 лет отделения сосудистой хирургии Самарской областной клинической больницы им. В. Д. Середа-вина. Критериями включения были клинические признаки периферического атеросклероза как минимум в одном артериальном бассейне. Отсутствие информированного согласия, хроническая сердечная недостаточность (ХСН) 2Б-стадии и выше, хроническая болезнь почек 4-й стадии и выше, а также тяжелые острые и хронические сопутствующие заболевания, деменция, невозможность самообслуживания были основными критериями исключения.
В основной группе изучены клинические (табл. 1), антропометрические, биохимические параметры, а также инструментальные параметры сонных артерий и сердца методами ультразвукового исследования (табл. 2). Необходимо отметить значительную распространенность гипертонической болезни (84%), форм хронического коронарного синдрома — стабильной стенокардии в 40% случаев и перенесенного инфаркта миокарда — у 33% включенных
Таблица 1
Клиническая характеристика пациентов с периферическим атеросклерозом ( n =122)
|
Заболевания, локализация атеросклеротического поражения |
Пациенты, n , (%) |
|
Гипертоническая болезнь Сахарный диабет II типа |
103 (84,43%) 23 (18,85%) |
|
Стенокардия напряжения Перенесенный инфаркт миокарда |
49 (40,16%) 40 (32,79%) |
|
ОНМК в анамнезе |
19 (15,57%) |
|
ХАН стадий 1А, 1Б, 2А, 2Б, 3, 4 |
47 (38,52%) |
|
Атеросклероз экстракраниальных артерий Аневризма артерий |
95 (77,87%) 2 (1,64%) |
|
Стеноз почечных артерий |
3 (2,46%) |
Параметры пациентов с периферическим атеросклерозом ( n =122)
Таблица 2
|
Параметры |
M±SD |
|
Эритроциты, 1х1012/л |
4,54±0,64 |
|
Гемоглобин, г/л |
136,91±19,49 |
|
Гематокрит, % |
40,41±5,92 |
|
Тромбоциты, 1х109/л |
218,49±71,51 |
|
Лейкоциты, 1х109/л |
8,35±2,67 |
|
СОЭ, мм/час* |
11,00 (6,00–22,50) |
Corresponding author — Nailya A. Davydova
Тел.: +7 (927) 0192273
Окончание табл. 2
|
Параметры |
M±SD |
|
Биохимические |
|
|
Тропонин I, нг/мл* |
0,01 (0,00–1,12) |
|
СК-МВ, ед./л* |
21,70 (14,43–54,63) |
|
КФК общ., ед./л* |
186,00 (103,00–1041,50) |
|
Холестерин, ммоль/л |
5,02±1,22 |
|
ХЛВП, ммоль/л |
1,15±0,26 |
|
ХЛНП, ммоль/л |
3,13±0,99 |
|
Триглицериды, ммоль/л |
1,76±0,84 |
|
АЛАТ, ед./л* |
19,00 (14,10–32,00) |
|
АСАТ, ед./л* |
22,10 (15,50–32,00) |
|
Глюкоза, ммоль/л |
6,01±2,29 |
|
Креатинин, мкмоль/л |
105,99±31,07 |
|
Мочевина, ммоль/л |
6,49±2,87 |
|
СКФ, мл/мин |
69,32±18,15 |
|
Инструментальные |
|
|
АФК, отн. ед. |
6,51±1,24 |
|
АДс, мм рт. ст. |
139,99±19,93 |
|
АДд, мм рт. ст. |
79,36±9,27 |
|
Эхокардиографические |
|
|
КДРлж, мм |
49,81±5,74 |
|
КСРлж, мм |
32,75±5,38 |
|
ТМЖПд, мм |
13,96±3,15 |
|
ТЗСд, мм |
12,01±2,47 |
|
ФУДлж, % |
33,30±5,98 |
|
ИММлж, г/м2 |
129,35±32,15 |
|
ЛП, мм |
42,68±6,05 |
|
Аорта, мм |
35,68±5,15 |
|
ФВлж, % |
55,59±8,23 |
|
E , м/с |
0,67±0,16 |
|
A , м/с |
0,75±0,18 |
|
E/A |
0,90±0,35 |
|
S ’, м/с |
7,86±2,00 |
|
E, см/с |
8,84±2,61 |
|
A ’, см/с |
10,59±2,30 |
П р и м еч а н и е : АФК — параметр аутофлюоресценции кожи; АДс — артериальное давление систолическое; АДд — артериальное давление диастолическое; ИМТ — индекс массы тела; СОЭ — скорость оседания эритроцитов; СК-МВ — МВ-фракция креатинфосфокиназы; КФК — креатинфосфокиназа; ХЛВП — холестерин липопротеинов высокой плотности; ХЛНП — холестерин липопротеинов низкой плотности; АЛАТ — аланинаминовая трансфераза; АСАТ — аспартатаминовая трансфераза; СКФ — скорость клубочковой фильтрации по CKD-EPI; КДРлж — конечно-диастолический размер левого желудочка; КСРлж — конечно-систолический размер левого желудочка; ТМЖПд — толщина межжелудочковой перегородки в диастолу; ТЗСд — толщина задней стенки левого желудочка в диастолу; ФУДлж — фракция укорочения диаметра левого желудочка; ИММлж — индекс массы миокарда левого желудочка; ЛП — диаметр левого предсердия; ФВлж — фракция выброса левого желудочка; Е — скорость трансмитрального потока в раннюю диастолу; А — скорость трансмитрального потока в систолу предсердий; S ’ — систолическая скорость смещения кольца митрального клапана; E ’ — скорость смещения кольца митрального клапана в раннюю диастолу; A ’ — скорость смещения кольца митрального клапана в фазу систолы предсердий; * — показатели с резко скошенной вправо формой распределения представлены в виде медианы и квартилей.
в исследование. Среди проявлений ЗПА превалировали стенозы экстракраниальных артерий у 78% пациентов и признаки ХАН нижних конечностей у 38%. В целом оперативной реваскуляризации артерий нижних конечностей подвергнуто 9% пациентов; коронарных — 11,4%; каротидных — 5,7% (см. табл. 1).
Параметр АФК определялся с помощью оригинального прибора (ридера), разработанного коллективом кафедры лазерных и биотехнических систем (заведующий профессор В. П. Захаров) Самарского университета им. академика С. П. Королёва. После
Основные параметры в обследованных группах
Таблица 3
Проспективное исследование проводилось в сроки до 1043 дней (в среднем 736 дней). Информация была получена методом телефонного опроса с самим пациентом или с членом семьи у 112 из 122 больных. Оценивались госпитализации, их причины, в том числе проведенные операции, даты госпитализаций, факт перенесенного COVID-19, используемые лекарственные препараты.
Была сформирована группа контроля, которую составили 35 практически здоровых мужчин в возрасте от 42 до 68 лет без клинических признаков заболеваний, обусловленных атеросклерозом. Тем не менее 15 из них имели диагноз гипертонической болезни; из них у 7 заболевание диагностировано во 2-й стадии. Эта группа была выделена из тех, кто проходил диспансерный осмотр, в соответствии с требованиями которого определялись общий холестерин и глюкоза крови, а также статус курения и индекс массы тела, проводилась стратификация сердечно-сосудистого риска по шкале SCORE1 (Systematic Coronary Risk Evaluation). Основная задача этой группы сводилась к оценке АФК в сопоставлении с аналогичным параметром основной группы. Поскольку участники группы контроля в целом были моложе пациентов основной группы, то из последней были выделены сопоставимые по возрасту 72 пациента.
Статистический анализ данных выполняли в среде пакета SPSS 25.0 (IBM Corporation, Armonk, NewYork, USA, лицензия № 5725-А54). Предварительно графо-аналитически исследовали форму распределения количественных признаков: по гистограммам распределения, по критериям Шапиро — Уилка и Колмогорова — Смирнова с поправкой Лиллиефорса, а также по показателям асимметрии и эксцесса. Для сравнения групп применяли критерий Манна — Уитни. Описательные статистики представлены в виде среднего и стандартного отклонений: M±SD либо, в случае резко скошенной формы распределения, — в виде медианы (Me) и квартилей (Q25; Q75). Исследование взаимосвязей осуществляли с помощью корреляционного анализа Спирмена. Для оценки воздействия различных факторов на риск госпитализаций в связи с сердечнососудистыми событиями применяли логистическую регрессию и регрессию Кокса, строили ROC-кривые и кривые Каплана — Мейера. При анализе кривых Каплана — Мейера использовали логранговый критерий для их сравнения и медиану дожития. Рассчитаны отношения шансов (ОШ) и относительные риски (ОР) и их 95%-е доверительные интервалы (ДИ). Результаты считали статистически значимыми при р<0,05.
Результаты. Параметры контрольной группы в сравнении с аналогичными параметрами части основной группы, сопоставимой по возрасту, приведены в табл. 3. Следует обратить внимание на существенно меньшую величину АФК в группе контроля. В этой группе значение АФК коррелировало с возрастом ( r =0,33, p =0,019), концентрацией общего холестерина ( r =0,40, p =0,008) и балльной оценкой по шкале риска SCORE1 ( r =0,36, p =0,019). В основной группе подобных соотношений не выявлено. Для учета мультифокальных проявлений атеросклероза, сопутствующих синдромов и заболеваний, возраста определялся кумулятивный параметр для каждого пациента по критериям, приведенным далее. ХАН 2А-стадии соответствовала 1 баллу, ХАН 2Б-стадии — 2 баллам, ХАН 3–4-й стадий — 3 баллам, перенесенный инфаркт миокарда — 1 баллу, сахарный диабет II типа — 1 баллу, инсульт в анамнезе — 1 баллу, стенокардия — 1 баллу, каротидный стеноз более 50% — 1 баллу, хроническая болезнь почек 3-й стадии и выше — 1 баллу, возраст 55–65 лет соответствовал 1 баллу, старше 65 лет — 2 баллам. Среднее значение балльной оценки составило 7,57±1,85 в диапазоне от 4 до 14 баллов.
В целом параметры общего анализа крови в основной группе соответствовали нормальным значениям (см. табл. 2). Спектр холестерина свидетельствовал об отсутствии достижения целевых параметров холестерина липопротеинов низкой плотности у 90% больных, у 21 пациента расчетная скорость клубочковой фильтрации по CKD-EPI была в диапазоне 59-35 мл/мин, что свидетельствовало о частоте хронической болезни почек стадий 3А и 4-й — 17%.
Параметры эхокардиографии (см. табл. 2) указывали на высокую распространенность гипертрофии левого желудочка — более 115 г/м2, а также левого предсердия с признаками диастолической дисфункции, что подтверждают сниженные параметры скорости движения фиброзного кольца митрального клапана Em (в норме более 10см/с) в раннюю диастолу, уменьшение Е/А и Em/Am менее 1,0. С учетом высокой распространенности артериальной гипертензии у обследованных с высокой достоверностью эти данные можно объяснить наличием гипертензивного сердца.
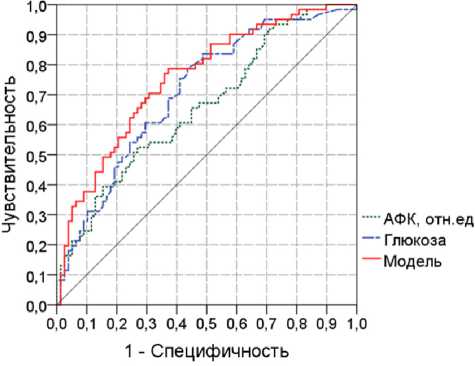
Рис. 1. ROC-кривые для прогнозирования госпитализации по причинам, связанным с сердечно-сосудистыми заболеваниями, и общей смертности на основе параметра аутофлюоресценции кожи, глюкозы сыворотки крови
В основной группе параметр АФК положительно и статистически значимо коррелировал с баллами по шкале клинико-прогностических признаков ( r =0,36, p <0,001), отрицательные корреляции получены с концентрацией гемоглобина ( r = –0,20, p =0,038), гематокрита ( r = –0,25, p =0,008). Из качественных признаков АФК обнаруживал связь с ХАН ( r =0,23, p =0,013) и перенесенными операциями на артериях нижних конечностей ( r =0,30, p =0,002).
За время наблюдения произошло 7 летальных случаев, не менее чем одна госпитализация по сердечно-сосудистым причинам у 42 (37,5%) пациентов. Из них наиболее частыми были госпитализации с целью консервативного лечения при обострении ХАН у 12 пациентов (12%), потребность в проведении аортокоронарного шунтирования была реализована у 11 (10%), стентирование коронарных артерий у 6 (5,3%); потребность в других операциях возникала реже: бифуркационное аорто-бедренное шунтирование проведено 2 больным (2%), ампутации — 3 (3%), стентирование почечных артерий — 3 (3%). Инсульты перенесли 2 (2%) пациента.
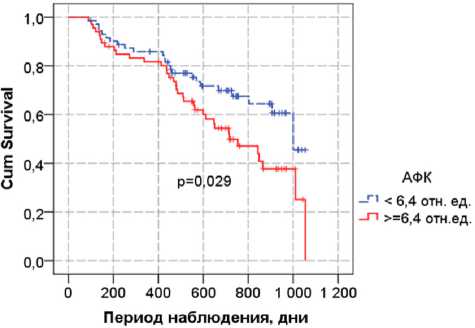
Рис. 2. Кривые Каплана — Мейера для событий, связанных с госпитализацией по поводу сердечно-сосудистых состояний и смертностью, в зависимости от уровня параметра аутофлюоресценции кожи
Методом множественной логистической регрессии определено, что факт госпитализации или летальности был связан с АФК [ОШ=1,71 (95% ДИ: 1,20–2,45), p =0,003] и глюкозой плазмы крови [ОШ=1,23 (95% ДИ: 1,004-1,51), p =0,046]. Качество прогнозирования модели: чувствительность 71%, специфичность 68% при пороговой вероятности 0,4, площадь под ROC-кривой — AUC=0,76 (95% ДИ: 0,68–0,84, р <0,001) (рис. 1).
Кривые Каплана — Мейера, учитывающие данные события и время до их наступления, были достоверно менее благоприятны для повышения АФК более 6,4 отн. ед. (медианы дожития: 1000 и 716 сут.), гликемии натощак (медианы дожития: 1054 и 716 сут.), наличия ХСН выше 1-го функционального класса (медианы дожития: 1000 и 510 сут.) (рис. 2, 3). Все три указанных признака вошли в качестве независимых предикторов в многомерную регрессию Кокса со следующими относительными рисками: АФК в отн. ед. — ОР=1,34 (95% ДИ: 1,05-1,71), р =0,018, глюкоза в ммоль/л — ОР=1,13 (95% ДИ: 1,02-1,25), р =0,016, ХСН (2 ФК vs 0-1 ФК) — ОР=2,93 (95% ДИ: 1,35–6,38), р =0,007.
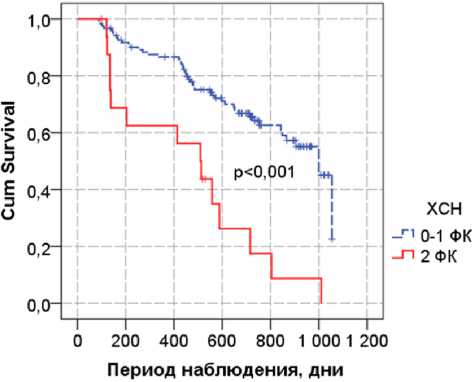
Рис. 3. Кривые Каплана — Мейера для событий, связанных с госпитализацией по поводу сердечно-сосудистых состояний и смертностью, в зависимости от функционального класса хронической сердечной недостаточности
В ходе телефонного визитирования также были опрошены пациенты относительно постоянного приема лекарственных препаратов. Больной должен был назвать препараты, которые он принимает постоянно без наводящих вопросов. Наиболее часто назывались препараты ацетилсалициловой кислоты (76%), в-адреноблокаторы (48%), ингибиторы ангиотензин-превращающего фермента (40%), частота других групп препаратов была существенно ниже: блокаторы кальциевых каналов упоминали 22% пациентов, блокаторы рецепторов к ангиотензину 2-15%, другие дезагреганты — 6%; новые оральные антикоагулянты называли 6% участников исследования. В целом можно отметить низкую приверженность к приему статинов (препараты этой группы назвали только 50%), которые в соответствии с рекомендациями были назначены всем пациентам. Ни один из перечисленных препаратов (групп препаратов) не имел статистически значимого влияния на прогноз.
Обсуждение. Существенным отличием этого исследования следует считать включение пациентов с разной локализацией атеросклеротического поражения, объединенного термином «заболевание периферических артерий». Мы применяем этот термин так, как он используется в рекомендациях ЕОК/ЕОСХ 2017 г.: «…термин “заболевания периферических артерий” охватывает все артериальные поражения, кроме коронарных артерий и аорты. В научной литературе термин “болезнь периферических артерий” используется как характеристика заболеваний нижних конечностей…» [7]. Речь идет о двух основных группах, которые обычно в научной литературе рассматриваются отдельно — пациенты с каротидным гемодинамически значимым стенозом и пациенты с атеросклерозом артерий нижних конечностей. С точки зрения клинических локальных последствий, а также факторов прогноза сердечно-сосудистых осложнений, как и с точки зрения хирургической тактики, эти две группы имеют различия. К тому же в реальной клинической практике проявления этих локализаций сосуществуют у одного больного. Даже правомочно сказать, что клинические проявления атеросклеротического поражения одного бассейна предполагают поражение другого, часто на уровне субклиническом, выявляемые только методами визуализации. Универсальной причиной смертности или инвалидности независимо от клинических проявлений периферического атеросклероза чаще всего являются кардиальные (острый инфаркт миокарда, внезапная кардиальная смерть) или инсульт. В регистре REACH (REduction of Atherothrombosis for Continued Health) с участием 44 стран мира, зафиксировано, что 39% пациентов с ЗПА также имели ишемическую болезнь сердца, 10% — заболевание церебральных артерий, а 13% — оба заболевания в дополнение к ЗПА; менее 40% пациентов с ЗПА не имели сопутствующего заболевания коронарных или церебральных артерий [8]. По сути, больной с проявлениями одного ЗПА является пациентом с мультифокальным атеросклерозом. Это справедливо и для включенных в наше исследование пациентов. Например, перенесенный инфаркт миокарда выявлен в 32,8% случаев, стенокардия напряжения — в 40%, а инсульт в анамнезе был у 15,6%. Интересно, что у пациентов с первоначально установленным диагнозом ишемической болезни сердца вероятность периферического атеросклероза гораздо ниже, чем вероятность ишемической болезни сердца у пациента с ЗПА [7].
Включение больных с разными видами ЗПА отражает взгляд авторов на проблему атеросклероза как системного поражения артериального русла с потенциально злокачественным развитием. Этот тезис также подтверждается значительным количеством поводов для госпитализации по сердечно-сосудистым причинам в проспективной части нашего исследования. Поскольку в основную группу вошли пациенты с мультифокальным атеросклерозом, сахарным диабетом II типа, артериальной гипертензией, хронической ишемической болезнью сердца, часть которых подверглась различным операциям реваскуляризации, то было необходимо учесть эти важные с точки зрения прогноза и тяжести состояния в виде кумулятивного параметра, определяемого для каждого пациента. В доступной литературе применительно к структуре нашей группы нами не обнаружено примеров адекватного решения. Потому мы учли основные клинические параметры и события, сопряженные с негативным прогнозом сердечно-сосудистых исходов, по литературным данным [9, 10].
Настоящее одноцентровое пилотное исследование посвящено изучению АФК у пациентов с атеросклерозом периферических артерий — преимущественно мультифокальным, способности этого параметра отражать процессы сердечно-сосудистого ремоделирования и вероятность неблагоприятных исходов. Несмотря на то, что АФК-ридеры за рубежом применяются в течение последних 15–20 лет для стратификации сердечно-сосудистого риска, в отечественной литературе мы не нашли освещения данной темы.
Привлечение контрольной группы в наше исследование было необходимо для иллюстрации различия по параметру АФК, его зависимости от возраста и холестерина и других модифицируемых факторов риска, которые используются в системе стратификации SCORE-1. Действительно, взаимосвязь с возрастом, общим холестерином, с одной стороны, и АФК — с другой, хорошо описана в литературе [11]. В основной группе такие корреляции не прослеживаются, поскольку, очевидно накопление конечных продуктов гликирования больше зависит от активности патологического процесса, чем от возраста. АФК также имеет ценность для скрининга пациентов на сахарный диабет, однако в основном четко установлена его роль в качестве предиктора осложнений как сердечно-сосудистых, так и специфических для этого заболевания микроваскулярных осложнений [12]. Метод АФК валидирован как неинвазивный способ оценки конечных продуктов гликирования у пациентов с ЗПА не только в коже, но и в артериях и нервах, как было показано на материале больных, перенесших ампутацию нижней конечности: 5 пациентов с сахарным диабетом и 28 — без такового [13].
В метаанализе 10 работ с общим количеством пациентов высокого и очень высокого сердечно-сосудистого риска 4189 исследованных лиц, включая пациентов с ЗПА, была изучена прогностическая роль параметра АФК. Высокие значения АФК соответствовали увеличению риска смерти от сердечно-сосудистых заболеваний (ОР=2,06; ДИ 1,58–2,67) и общей смертности (ОР=1,91; ДИ 1,42–2,56) [14].
В исследовании случай-контроль 492 пациентов с ЗПА установлено, что параметр АФК у них достоверно выше, независимо от известных факторов сердечно-сосудистого риска и коморбидности по сахарному диабету и хронической болезни почек, к тому же эти состояния связаны с дальнейшим увеличением параметра АФК [15]. Данное исследование подтверждает полученные нами результаты как в части увеличения АФК в сравнении с контролем, так и в свя́зи АФК с параметрами клинического статуса и прогноза. Кроме того, в наблюдательном исследовании 252 пациентов с ЗПА нижних конечностей увеличение АФК на единицу было связано с увеличением риска ампутации в 3,05 раза, независимо от коморбидности по сахарному диабету или стадии ХАН [16].
Независимыми предикторами событий в нашей работе были АФК и концентрация глюкозы плазмы крови натощак (см. рис. 1, 2). Гликемические нарушения, следовательно, могут быть объяснены сахарным диабетом II типа, а также феноменом повышенной гликемии натощак, который относится к предиабету. Оба фактора, по данным литературы, имеют существенное влияние на прогноз сердечно-сосудистых осложнений у пациентов независимо от наличия клинических проявлений атеросклероза, а также от клинической формы атеросклероза [17, 18].
Другим выявленным предиктором неблагоприятных исходов был функциональный класс ХСН (см. рис. 3). Наше исследование исключало пациентов с ХСН выше 2-го функционального класса со значительным ограничением толерантности к физической нагрузке. У существенной пропорции наших больных были выявлены структурные изменения миокарда — гипертрофия левых отделов сердца и функциональные нарушения в виде диастолической дисфункции, которые рассматриваются как необходимые компоненты диагноза ХСН в сочетании с жалобами на ограничение толерантности к физической нагрузке и указании в анамнезе на артериальную гипертензию как главного этиологического фактора ХСН. Тяжелая ХАН лимитирует дистанцию ходьбы, препятствуя точному определению тяжести ХСН. Отчасти это обстоятельство может рассматриваться как ограничение значимости нашего исследования, имея отношение к ¼ пациентов в нашей работе: ХАН 3–4-й стадий выявлена у 17 пациентов (17%), ХАН 2Б-стадии — у 11 (9%). Именно поэтому в современных исследованиях у пациентов с заболеваниями нижних конечностей используют биохимические маркеры ХСН. Например, в долговременном проспективном наблюдении пожилых пациентов с ЗПА сердечный высокочувствительный тропонин Т и предшественник натрийуретического пептида — известный маркер сердечной недостаточности — были наиболее сильными независимыми предикторами смерти в сравнении с классическими сосудистыми признаками атеросклероза [19]. Хорошо известно, что сам факт ХСН сопровождается крайне негативным прогнозом для жизни, в том числе у пожилых, сравнимым с прогнозом при онкологической патологии [20].
Заключение. Таким образом, параметр АФК существенно увеличен у пациентов с клиническими проявлениями периферического атеросклероза, его значение пропорционально клиническим предикторам сердечно-сосудистых осложнений. Показана значимость АФК как интегрального независимого предиктора у пациентов с широким спектром ЗПА.
Список литературы Параметр аутофлюоресценции кожи как фактор неблагоприятного прогноза у пациентов с периферическими формами атеросклероза
- Scully RE, Arnaoutakis DJ, DeBord Smith A, et al. Estimated annual health care expenditures in individuals with peripheral arterial disease. J Vasc Surg. 2018; 67 (2): 558–67. DOI: 10.1016 / j.jvs.2017.06.102.
- Aboyans V, Ricco J-B, Bartelink M–LEL, et al. 2017 ESC Guidelines on the diagnosis and treatment of peripheral arterial diseases, in collaboration with the European Society for Vascular Surgery (ESVS). Eur Heart J. 2017; (2017): 1–60. DOI: 10.1093 / eurheartj / ehx095.
- Sigvant B, Wiberg-Hedman K, Bergqvist D, et al. A population- based study of peripheral arterial disease prevalence with special focus on critical limb ischemia and sex differences. J Vasc Surg. 2007; 45 (6): 1185–91. DOI: 10.1016 / j.jvs.2007.02.004.
- Kanauchi M, Tsujimoto N, Hashimoto T. Advanced glycation end products in nondiabetic patients with coronary artery disease. Diabetes Care. 2001; 24 (9): 1620–3. DOI: 10.2337 / diacare.24.9.1620.
- Hofmann B, Jacobs K, Navarrete Santos A, et al. Relationship between cardiac tissue glycation and skin autofluorescence in patients with coronary artery disease. Diabetes Metab. 2015; 41 (5): 410–5. DOI: 10.1016 / j.diabet.2014.12.001.
- Kornilin DV, Grishanov VN, Cherepanov KV. Pulse excitation fluorescence meter for diagnostic purposes. Proc. SPIE 10685, Biophotonics: Photonic Solutions for Better Health Care VI, 1068515. URL: https://spie.org / Publications / Proceedings / Paper / 10.1117 / 12.2306588?SSO=1 (10 Oct 2022). DOI: 10.1117 / 12.2306588.
- Aboyans V, Ricco JB, Bartelink MEL, et al. ECS Scientific Document Group. 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS). 2017. Russ J Cardiol. 2018; 23 (8): 164–221. (In Russ.) Aboyans V, Ricco JB, Bartelink MEL и др. Рекомендации ЕОК / ЕОСХ по диагностике и лечению заболеваний периферических артерий 2017. Российский кардиологический журнал. 2018; 23 (8): 164–221.
- Fowkes FG, Aboyans V, Fowkes FJI, et al. Peripheral artery disease: epidemiology and global perspectives. Nat Rev Cardiol. 2017; 14 (3): 156–70. DOI: 10.1038 / nrcardio.2016.179.
- Feringa HH, Bax JJ, Hoeks S, et al. A prognostic risk index for long-term mortality in patients with peripheral arterial disease. Arch Intern Med. 2007; 167 (22): 2482–9. DOI: 10.1001 / archinte. 167.22.2482.
- Jang SY, Park SW, Kim YW, et al. Survival rates in peripheral artery disease. J Lipid Atheroscler. 2017; 6 (1): 39–45. DOI: 10.12997 / jla.2017.6.1.39.
- Zhang Y, Jiang T, Liu C, et al. Effectiveness of early advanced glycation end product accumulation testing in the diagnosis of diabetes: a health risk factor analysis using the body mass index as a moderator. Front Endocrinol (Lausanne). 2022; (12): 766778. DOI: 10.3389 / fendo.2021.766778.
- Lutgers HL, Gerrits EG, Graaff R, et al. Skin autofluorescence provides additional informationto the UK Prospective Diabetes Study (UKPDS) risk score for the estimation of cardiovascular prognosis in type 2 diabetes mellitus. Diabetologia. 2009; 52 (5): 789–97. DOI: 10.1007 / s00125‑009‑1308‑9.
- Hu H, Jiang H, Zhu L, et al. Accumulation of advanced glycation end products and subclinical inflammation in deep tissues of adult patients with and without diabetes. Can J Diabetes. 2018; 42 (5): 525–32. e4. DOI: 10.1016 / j.jcjd.2018.01.003.
- Cavero-Redondo I, Soriano-Cano A, Álvarez-Bueno C, et al. Skin autofluorescence-indicated advanced glycation end products as predictors of cardiovascular and all-cause mortality in high-risk subjects: A systematic review and meta-analysis. J Am Heart Assoc. 2018; 7 (18): e009833. DOI: 10.1161 / JAHA.118.009833.
- deVos LC, Noordzij MJ, Mulder DJ, et al. Skin autofluorescence as a measure of advanced glycation end products deposition is elevated in peripheral artery disease. Arterioscler Thromb Vasc Biol. 2013; 33 (1): 131–8. DOI: 10.1161 / ATVBAHA.112.300016.
- de Vos LC, Mulder DJ, Smit AJ, et al. Skin autofluorescence is associated with 5‑year mortality and cardiovascular events in patients with peripheral artery disease. Arterioscler Thromb Vasc Biol. 2014; 34 (4): 933–8. DOI: 10.1161 / ATVBAHA.113.302731.
- Bays HE, Kulkarni A, German C, et al. Ten things to know about ten cardiovascular disease risk factors — 2022. Am J Prev Cardiol. 2022; (10): 100342. DOI: 10.1016 / j.ajpc.2022.100342.
- Cosentino F, Grant PJ, Aboyans V, et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur Heart J. 2020; 41 (2): 255–323. DOI: 10.1093 / eurheartj / ehz486.
- Clemens RK, Annema W, Baumann F, et al. Cardiac biomarkers but not measures of vascular atherosclerosis predict mortality in patients with peripheral artery disease. Clin Chim Acta. 2019; (495): 215–20. DOI: 10.1016 / j.cca.2019.04.061.
- Skrzypek A, Mostowik M, Szeliga M, et al. Chronic heart failure in the elderly: still a current medical problem. Folia Med Cracov. 2018; 58 (4): 47–56.


