Параметры эритропоэза и цитоархитектоника циркулирующих эритроцитов крыс с асцитной опухолью яичников
Автор: Генинг Т.П., Федотова А.Ю., Долгова Д.Р., Абакумова Т.В.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 1, 2019 года.
Бесплатный доступ
Развивающаяся неоплазма может влиять на эритропоэз организма-опухоленосителя. Установлено, что степень и характер этого влияния зависят от биологических характеристик опухоли. Цель работы - изучить морфометрические показатели эритроцитов и изменение эритропоэза у животных-опухоленосителей при развитии неопластического процесса. Материалы и методы. В качестве материала для исследования использовалась периферическая кровь экспериментального животного. Забор крови осуществлялся в стационарную (n=64) и терминальную (n=64) фазы роста опухоли. Контрольную группу составляли здоровые половозрелые крысы (n=62). Для оценки эритропоэза определялось содержание эритроцитов, уровень гемоглобина, количество ретикулоцитов и концентрация эритропоэтина в периферической крови животных-опухоленосителей. Методом атомно-силовой микроскопии изучалась цитоархитектоника. Результаты. Установлено значимое по сравнению с контролем снижение количества эритроцитов, а также понижение уровня гемоглобина...
Эритроциты, эритропоэтин, асцитная опухоль яичников
Короткий адрес: https://sciup.org/14116352
IDR: 14116352 | УДК: 612.111.3 | DOI: 10.34014/2227-1848-2019-1-119-125
Текст научной статьи Параметры эритропоэза и цитоархитектоника циркулирующих эритроцитов крыс с асцитной опухолью яичников
Введение. Исследование эритроцитов в патогенезе опухолевого роста привлекает внимание потому, что клетки красной крови - носители информации о процессах, протекающих в организме. Рост опухоли может привести к нарушению метаболизма эритроцитов, в результате чего возможно снижение их жизнеспособности и изменение их эластических свойств [1–5]. Накопление в мембранах эритроцитов высокотоксичных метаболитов за счет активации перекисного окисления липидов и аутокаталитического возрастания количества его продуктов способствует ухудшению физических параметров мембран, снижению способности красных клеток крови к деформации в микроциркуляторном русле [6].
Основная роль в регулировании производства эритроцитов в костном мозге принадлежит эритропоэтину. На сегодня известно, что при канцерогенезе отсутствует адекватное увеличение уровня эритропоэтина [7]. Состояние гипоксии выступает как стимулятор синтеза эритропоэтина, но увеличение уровня гормона при канцерогенезе недостаточно для предотвращения анемии. Таким образом, анемия у онкологических больных возникает в результате нарушения гемопоэза [8].
Атомно-силовая микроскопия (АСМ) -уникальный метод исследования биологических объектов без фиксации. Благодаря большому пространственному разрешению АСМ на сегодняшний день является основным ин- струментом для изучения рельефа биологического объекта. Характерная форма эритроцитов и их относительно небольшая толщина позволяют получить прочный препарат на стекле и изучить стереометрическую характеристику этих форменных элементов [9].
Поскольку эритроциты достаточно быстро изменяют морфофункциональные характеристики при воздействии патологических факторов, очевидно, что изучение состояния их мембран при экспериментальном канцерогенезе может дать ценную информацию о функциональной неполноценности эритроцитов.
Цель исследования. Изучить морфометрические показатели эритроцитов и изменение эритропоэза у животных-опухоленосите-лей при развитии неопластического процесса.
Материалы и методы. Экспериментальные исследования проведены на белых беспородных крысах массой 180–200 г с перевиваемой асцитной опухолью яичников (АОЯ, штамм РЯ, РОНЦ им. Н.Н. Блохина, г. Москва). Прогрессирование данного типа опухоли проходит в 3 фазы: логарифмическая (с 4-х сут после перевивки), стационарная (с 8-х сут после перевивки), терминальная (с 13-х сут после перевивки). В качестве материала для исследования использовали периферическую кровь экспериментального животного. Забор крови осуществляли в стационарную (n=64) и терминальную (n=64) фазы роста опухоли. Контрольную группу составили здоровые половозрелые крысы (n=62). Гематологические показатели крови оценивали с помощью анализатора Mindray BC 3600. Уровень эритропоэтина оценивали в плазме крови иммуноферментным методом (Mouse/Rat Epo Immunoassay, США). Подсчёт ретикулоцитов производили на 1000 клеток. Оценку осуществляли с помощью светового микроскопа Nikon Eclipse E200. Исследование морфометрических показателей эритроцитов проводили на свежевысушенных мазках крови методом АСМ (Solver Pro, NT-MDT, г. Зеленоград, Россия) в полуконтактном режиме. Использовали фирменные кремниевые зонды с жесткостью 0,2 N/m, радиус закругления кончика зонда составлял 10 нм.
Все животные содержались в стандартных условиях вивария при естественном освещении и свободном доступе к воде и корму. Были соблюдены «Правила проведения работ и использования экспериментальных животных», утверждённые Приказом МЗ СССР № 755 от 12 августа 1977 г., положения Хельсинкской декларации Всемирной медицинской ассоциации от 1964 г., дополненной в 1975, 1983 и 1989 гг., а также требования этического комитета ИМЭиФК Ульяновского государственного университета (№ 10 от 15.06.2014).
Результаты и обсуждение. В результате проведенных исследований нами установлено прогрессирующее снижение показателей гематокрита как в стационарную, так в терминальную фазы роста опухоли. Средний объем эритроцита (МСV) на всех сроках роста опухоли статистически значимо не отличался от показателей группы контроля. Показатель среднего содержания гемоглобина в отдельном эритроците (MCH) статистически значимо снижался в стационарную и повышался в терминальную фазу, не достигая однако контрольных значений. Как в стационарную, так и в терминальную фазы отмечалось статистически значимое повышение коэффициента вариации размеров эритроцитов (RDW-CV) и ширины распределения эритроцитов по объему (RDW-SD) относительно контроля, что предполагает возникновение пойкилоцитоза и анизоцитоза (табл. 1).
Данные, представленные в табл. 2, свидетельствуют о статистически значимом повышении высоты эритроцита как в стационарную, так в терминальную фазы роста опухоли, статистически значимом изменении глубины впадины в стационарную фазу роста АОЯ (в терминальную фазу углубление впадины не отмечается). Также установлено достоверное повышение среднего диаметра эритроцита и изменение длины эритроцитов во всех изученных фазах роста экспериментальной неоплазмы. Площадь поверхности эритроцита увеличивалась при прогрессировании опухоли, что соответствует изменению формы от нормоцита к сфероциту.
Таблица 1
|
Показатели |
Контроль, n=62 |
Стационарная фаза, n=64 |
Терминальная фаза, n=64 |
|
Ht, % |
38,1±0,5 |
34,3±0,5* |
31,3±0,3* |
|
MCV, фл |
52,8±0,8 |
53,3±0,7 |
53,0±0,5 |
|
MCH, пг/мл |
21,30±2,01 |
15,8±1,6* |
17,2±1,3 |
|
MCHС, г/л |
401±38 |
295,7±31,3* |
318,5±28,1* |
|
RDW-CV |
0,166±0,002* |
0,185±0,002* |
0,2±0,001* |
|
RDW-SD |
32,1±0,2 |
33,1±0,2* |
34±0,2* |
Примечание. * - статистически значимые различия с показателями контроля (р<0,05).
Морфофункциональные показатели крови крыс с АОЯ
Таблица 2
Морфометрические параметры эритроцитов у животных-опухоленосителей
|
Показатели |
Контроль, n=62 |
Стационарная фаза, n=64 |
Терминальная фаза, n=64 |
|
Высота эритроцита, мкм |
0,453±0,010 |
0,505±0,020* |
0,364±0,010* |
|
Глубина впадины, мкм |
0,374±0,013 |
0,163±0,020* |
Без впадины |
|
Средний диаметр эритроцита, нм |
6,03±0,17 |
6,78±0,12* |
7,17±0,14 |
|
Длина, нм |
7,603±0,118 |
8,350±0,246* |
9,090±0,185* |
|
Площадь, мкм2 |
45,50±1,42 |
55,25±3,08* |
65,27±3,01* |
Примечание. * - статистически значимые различия с показателями контроля (р<0,05).
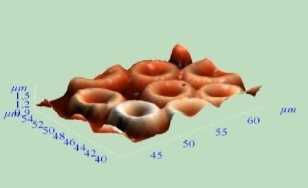
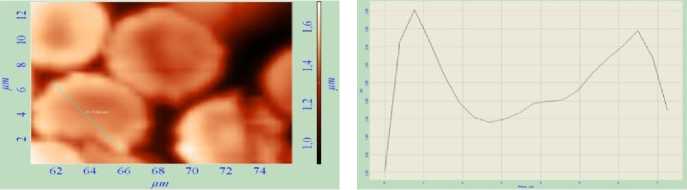
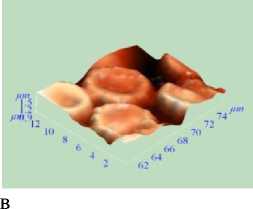
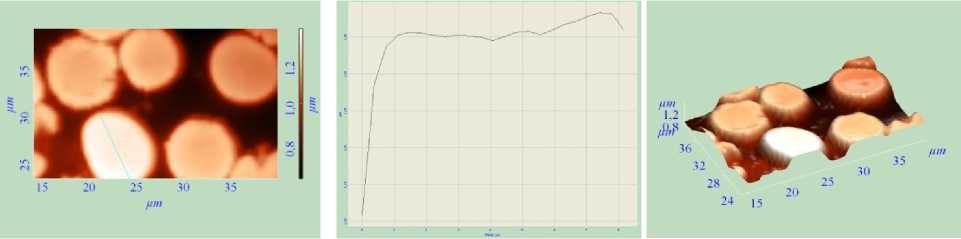
При сканировании образцов эритроцитов крыс контрольной группы методом АСМ в основном (98 %) обнаруживались нормоциты с типичной дисковидной формой (рис. 1). В стационарную фазу цитоархитектоника эритроцитов менялась. Основную массу (52 %) эритроцитов составляли обратимо деформированные формы (рис. 2). В терминальную фазу роста опухоли 50,8 % эритроцитов представляли собой сфероциты (рис. 3).
Таким образом, в процессе экспериментального канцерогенеза наблюдается рост количества дегенеративных форм.
Для оценки эритропоэза определяли объем эритроцитов, уровень гемоглобина, количество ретикулоцитов и концентрацию эритропоэтина в периферической крови живот-ных-опухоленосителей (табл. 3).
Из представленных данных (табл. 3) следует, что количество эритроцитов в периферической крови как в стационарную, так в терминальную фазы роста АОЯ снижается по сравнению с контролем. Одновременно значимо уменьшается количество гемоглобина, что ведёт к нарушению дыхательной функции крови (табл. 3). Подобные изменения зарегистрированы у больных с колоректальным раком, раком шейки матки и раком легкого [10–12]. В эксперименте у крыс «Вистар» при развитии карциносаркомы также зафиксировано токсическое влияние опухоли на систему кроветворения [13]. В то же время показано снижение количества эритроцитов в циркулирующей крови у животных-опухоле-носителей с АОЯ на 4-е и 8-е сут роста опухоли [14].
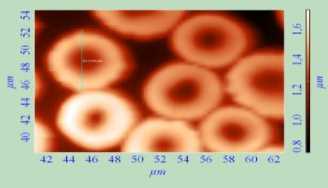
Рис. 1. Топология (а), боковое сечение профиля (б) и 3 D-изображение (в) интактных эритроцитов
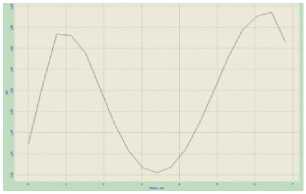
б
а
в
а б
Рис. 2. Топология (а), боковое сечение профиля (б) и 3D-изображение (в) эритроцитов в стационарную фазу
а б в
Рис. 3. Топология (а), боковое сечение профиля (б) и 3D-изображение (в) эритроцитов в терминальную фазу
Таблица 3
Показатели эритропоэза в организме-опухоленосителе при развитии АОЯ
|
Показатели |
Контроль, n=62 |
Стационарная фаза, n=64 |
Терминальная фаза, n=64 |
|
Эритроциты, млн/л |
7,20±0,05 |
6,40±0,08* |
6,00±0,04* |
|
Гемоглобин, г/л |
156,70±9,66 |
112,23±7,87* |
102,67±7,01* |
|
Ретикулоциты, % |
10,5±1,0 |
11,50±1,31 |
13,2±1,0* |
|
ЭПО, пкг/мл |
23,70±0,34 |
74,20±8,82* |
48,10±6,45* |
Примечание. * - статистически значимые различия с показателями контроля (р<0,05).
Регулирование производства эритроцитов в костном мозге осуществляет эритропоэтин. Нами было установлено статистически значимое повышение уровня эритропоэтина в плазме крови, наиболее выраженное в стационарную фазу роста опухоли (табл. 3). Одновременно увеличивается доля ретикулоцитов в крови, что также свидетельствует о стимуляции эритропоэза (табл. 3).
При экспериментальной карциносаркоме у крыс «Вистар» отмечается также повышение концентрации эритропоэтина. Авторы предполагают, что повышение эритропоэтина может являться отражением количественных, а не качественных перестроек механизмов контроля кроветворения при экспериментальном канцерогенезе [13].
Заключение. У крыс с экспериментальной АОЯ в динамике развития неоплазмы на фоне напряжённого эритропоэза снижается количество эритроцитов в периферической крови, количество гемоглобина, а также изменяется их цитоархитектоника, что может свидетельствовать о токсическом влиянии опухоли на систему кроветворения.
Список литературы Параметры эритропоэза и цитоархитектоника циркулирующих эритроцитов крыс с асцитной опухолью яичников
- Сладкова Е.А., Скоркина М.Ю., Забиняков Н.А. Морфофункциональные особенности клеток крови в условиях опухолевого роста. Биомедицина. 2013; 3: 63-67.
- Луговская С.А., Морозова В.Т., Почтарь М.Е. Лабораторная гематология. М.: ЮНИМЕД-пресс; 2002. 120.
- Боровская М.К., Кузнецова Э.Э., Горохова В.Г. Структурно-функциональная характеристика мембраны эритроцита и ее изменения при патологиях разного генеза. Бюллетень Восточно-Сибирского научного центра СО РАМН. 2010; 3 (73): 334-354.
- Крыжановский Г.Н. Дизрегуляционная патология. М.: Медицина; 2002. 632.
- Новицкий В.В., Степовая Е.А., Гольдберг В.Е. Эритроциты и злокачественные новообразования. Томск; 2000. 288.
- Диккер В.Е., Галенок В.А. Диабетическая микроангиопатия и нарушение транспорта кислорода. Обзор литературы и собственные данные. Терапевтический архив. 1986; 6: 106-110.
- Павлов А.Д., Морщакова Е.Ф. Лечение и профилактика анемии при злокачественных новообразованиях. Вопросы гематологии, онкологии и иммунопатологии в педиатрии. 2004; 3 (1): 56-63.
- Блиндарь В.Н., Зубрихина Г.Н. Диагностическая значимость определения уровня эритропоэтина в клинической практике (обзор литературы). Вестник РОНЦ им. Н.Н. Блохина РАМН. 2007; 18 (1): 10-16.
- Плескова С.Н. Атомно-силовая микроскопия в биологических и медицинских исследованиях. Долгопрудный; 2011. 184.
- Пумпур А.С. Роль оценки показателей общего анализа крови, биохимического анализа крови и гемостэзиограммы пациентов с колоректальным раком. Материалы Всероссийской научнопрактической конференции с международным участием «Актуальные вопросы колопроктологии». Воронеж; 2017; 3 (61): 64.
- Стуклов Н.И., Сушинская Т.В. Оценка эритроцитарных показателей периферической крови и активности гемостаза у больных раком шейки матки. Исследования и практика в медицине. 2016; 3 (1): 17-23.
- Даулетпаева Ж.О., Демина Е.В., Паньшина С.С. Состояние параметров красной периферической крови при наличии опухолей легкого. Science Time. 2016; 5 (29): 159-160.
- Тулеутаев М.Е., Узаков О.Ж., Ефремов А.В., Сафронов И.Д., Зубахин А.А., Самсонова Е.Н. Анализ клеток крови, костного мозга и медиаторов гемопоэза у крыс «Вистар» в динамике развития карциносаркомы Walker 256. Медицина Кыргызстана. 2016; 1 (3): 35-38.
- Трашков А.П., Панченко А.В., Васильев А.Г. Особенности роста экспериментальной АОЯ крыс и изменение гематологических показателей у животных-опухоленосителей под действием гемцитабина. Вестник Российской военно-медицинской академии. 2012; 2 (38): 90-96.


