Паразитарный абсцесс как случайная гистологическая находка при лечении рака сигмовидной кишки
Автор: Галлямов Э.А., Агапов М.А., Мальков П.Г., Маркарьян Д.Р., Данилова Н.В., Какоткин В.В., Казаченко Е.А., Лукьянов А.М., Олейникова Н.А., Кубышкин В.А.
Журнал: Хирургическая практика @spractice
Рубрика: Статьи
Статья в выпуске: 3 (43), 2020 года.
Бесплатный доступ
Введение: Высокая частота встречаемости колоректального рака во веем мире приводит к необходимости поиска не только эффективных методов лечения, но и факторов риска развития рака как такового и его худшего прогноза. Влияние многих генетических факторов, экологических особенностей и черт стиля жизни в контексте факторов риска колоректального рака уже доказано, поэтому в последнее время внимание исследователей устремлено на изучение микробиоты и, в частности, различных паразитарных заболеваний кишечника.Клинический случай: мы демонстрируем случайное обнаружение признаков паразитарной инвазии стенки толстой кишки в области злокачественного образования во время проведения гистологического исследования операционного материала у пациентки без отягощенного эпидемиологического анамнеза.Заключение: Необходимы дальнейшие исследования не только для подтверждения и обоснования роли микро- и макроорганизмов, населяющих кишечник в процессе развития онкологических заболеваний, но и для выявления отдельных звеньев патогенеза, патологических путей и сигнальных молекул, участвующих в канцерогенезе. Подобные исследования могут помочь расширить знания как о факторах риска и предикторах колоректального рака, так и о возможных местах приложения таргетной терапии.
Паразитарные заболевания кишечника, колоректальный рак, факторы риска
Короткий адрес: https://sciup.org/142230044
IDR: 142230044 | УДК: 616-006.6-091 | DOI: 10.38181/2223-2427-2020-3-53-58
Текст научной статьи Паразитарный абсцесс как случайная гистологическая находка при лечении рака сигмовидной кишки
В научной литературе встречается описание ряда случаев паразитарных заболеваний кишечника, выявленных случайно при обследовании или лечении пациентов с колоректальным раком [1–3]. Данная находка остается ред-костью,характерной для эндемичных по этим заболеваниям регионов мира. Однако совместная встречаемость гельминтозов или паразитарных заболеваний и колорек-тальногорака натолкнула многих исследователей на мысль о взаимосвязи этих заболеваний. На примере шистосомоза были выделены воспалительные и иммунные факторы, потенциально влияющие на процесс канцерогенеза,однако с абсолютной уверенностью о взаимосвязи этих заболеваний сказать все еще нельзя. Большинство описанных клинических случаев содержат данные об обнаружении именно шистосом у пациентов с колоректальным раком посещавших ранее эндемичныерегионы. В данном клиническом случае мы, однако, демонстрируем случайное выявление признаков паразитарной инвазии во время проведения гистологического исследования операционного материала у пациентки без отягощенного эпидемиологического анамнеза.
Обзор клинического случая
Пациентка 68 лет поступила в стационар с жалобами на слабость, болезненность в левой подвздошной области, чередование запоров и поносов. В амбулаторных условиях были выполнены колоноскопия с биопсией, МСКТ органов брюшной полости и малого таза. Во время проведения ко- лоноскопии в сигмовидной кишке науровне 40 см от ануса была выявлена фиксированная гаустра с признаками гнойного дивертикулита, а проксимальнее в той же фиксированной гаустре — циркулярный стеноз с инфильтрацией стенки кишки. По результатам биопсии слизистой оболочки на границе инфильтрированного участка — признаки аденокарциномы in situ.
По результатам МСКТ органов брюшной полости и малого таза в левой подвздошной области определялся объемный инфильтрат, содержащий петли тонкой кишки циркулярно утолщенный на протяжении 10 см проксимальный отдел сигмовидной кишки, инфильтрированную окружающую клетчатку, содержащую единичные пузырьки газа и полоски жидкости.
По результатам лабораторных анализов было выявлено: снижение концентрации железа в плазме крови (2,90 мкмоль/л),увеличение концентрации С-реактивного белка (152,59 мг/л), лейкоцитоз (11,88 10Е9/л), снижение концентрации гемоглобина (11.40 г/д), тромбоцитоз (379.00 10Е9/л), увеличение содержания нейтрофилов и эозинофилов (нейтрофилы: 8,67 10Е9/л, эозинофилы: до 1,31 10Е9/л).
После обследования, основываясь на данных колоноскопии с биопсией, МСКТ органов брюшной полости и малого таза, был установлен диагноз: рак сигмовидной кишки сT4NxcM0.
Пациентке было выполнено оперативное вмешательство в объеме лапароскопически-ассистированной резек-
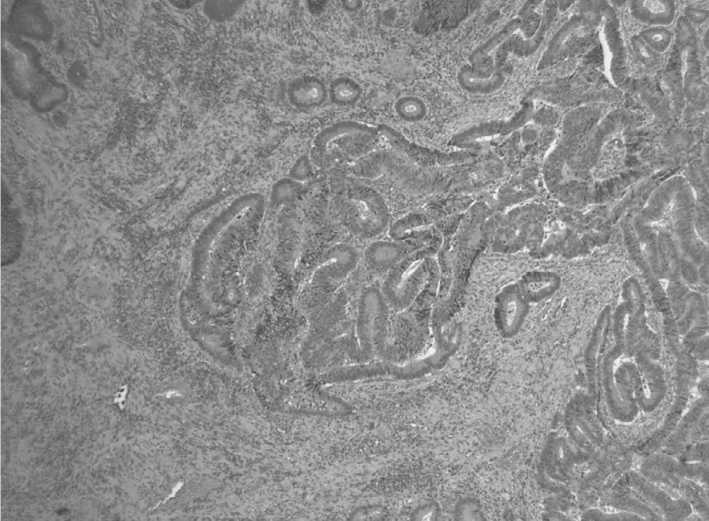
Рис. 1. Аденокарцинома толстой кишки low grade с инвазией в мышечный слой (окраска гематоксилином и эозином, об. х4) Fig. 1. Colon adenocarcinoma low grade, infiltrating to the intestinal wall (hematoxylin and eosin staining, lens х4).
ции сигмовидной кишки с расширенной лимфодиссек-цией, En-bloc резекции тонкой кишки, резекции мочевого пузыря, аднексэктомии слева, двуствольной илеостомии по Торнболлу, дренирования брюшной полости. Во время выполнения интраоперационной ревизии в области малого таза был выявлен конгломерат размером 10 × 9 × 8 см вовлекающий сигмовидную кишку, петлю тонкой кишки на протяжении 12 см, стенку дна мочевого пузыря и левый яичник. В процессе мобилизации конгломерата была выполнена резекция тонкой кишки,пересечение маточной трубы, воронко-тазовой связки, полностенная резекция дна мочевого пузыря из-за опасности возможного прорас-тания.В связи с выраженностью воспалительного процесса в малом тазу, после формирования первичного десцендоректального аппаратного анастомоза была сформирована протективная илеостома.
Пациентка была выписана из стационара на десятый день после операции,послеоперационный период протекал без осложнений.
Исследование операционного препарата показало наличие аденокарциномы толстой кишки low grade, инфильтрирующей все слои кишечной стенки с инвазией в околокишечную клетчатку (рис. 1), без признаков инвазии в рядом расположенные органы, безопухолевогоростав краяхрезекции(pT3 pN0 (0/25) cMx; GradeLow; Bd1; Pn0; L0; V0; R0; (AJCC, TNM 8th)). Кроме того, интра- и перитуморально с вовлечением тонкой кишки и мочевого пузыря был выявлен инфильтрат вокруг хитиновой оболочки паразита (рис. 2).
Обсуждение
Колоректальный рак — третье по распространенности онкологическое заболевание с высокими цифрами летальности ирецидивирования.4 Наряду с совершенствованием техник оперативноголечения и подходов к мультидисцип-линарному ведению пациентов, последнее время большое значениеуделяется определению факторов риска развития колоректального рака и его тяжелого течения. Уже достаточно широко изучено влияние генетических, экологических факторов и особенностей образа жизни на частоту заболеваемости и прогноз [4, 5]. Доказана также потенциальная роль микробиоты кишечника в процессе канцерогенеза, с этой точки зрения в литературе освещаются такие микро- и макроорганизмы, как Enterococcus spp., Helicobacter pylori, Opisthorchis viverrini, Clonorchis sinensis, Ascaris lumbricoides и Schistosoma haematobium [6–11]. Некоторые гельминтозы, например шистосомоз, рассматриваются как паразитарные заболевания с высоким риском развития колоректального рака и рака мочеполовой системы,хотя однозначных данных, подтверждающих этоутверждение, нет [12, 13].
По современным представлениям, патогенетической основой канцерогенеза при паразитарных заболеваниях кишечника считается, с одной стороны, хроническое воспаление, с другой — иммуносупрессивное действие самого паразита на иммунокомпетентные клеткихозяина. Наиболее подробно эти механизмы были описаны на примере шистосомной инвазии. В ответ на паразитарные антигены
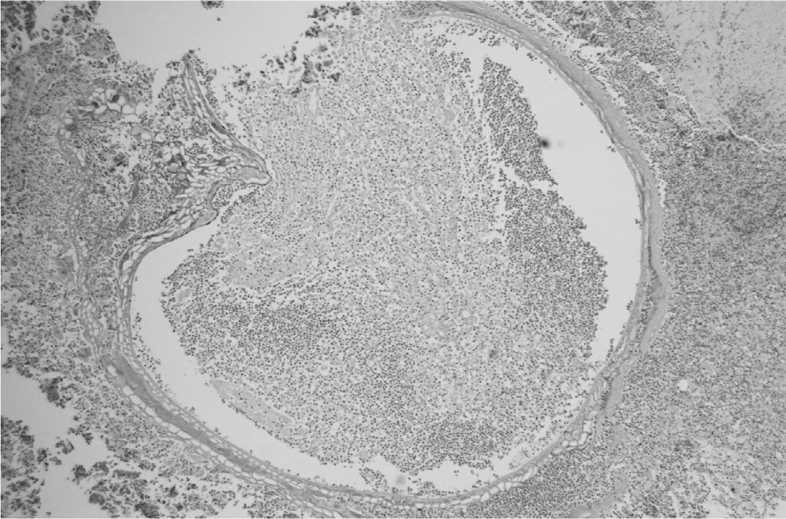
Рис. 2. Выраженная воспалительная реакция вокруг хитиновой оболочки паразита – паразитарный абсцесс (окраска гематоксилином и эозином, об.х4) Fig. 2. Severe inflammatory reaction around the chitinous membrane of the parasite – parasitic abscess (hematoxylin and eosin staining, lens х4)
в эпителии кишечной стенки формируются очаги аденоматозной гиперплазии. На клетки в этих очагах, которые вследствие гиперплазии уже представляют опасность появления канцерогенных мутаций, действуют провоспали-тельные цитокины,выделяемые макрофагами и иммунными клетками,а также активные формы кислорода и азота, что ведет к увеличению вероятности и частоты повреждения ДНК и мутаций [14–17]. С другой стороны, паразиты продуцируют цитокины, ингибирующие Т-клетки и вещества, действующие на метаболические внутриклеточные пути в месте прикрепления (JAK/STAT3 сигнальный путь) [18, 19]. Кроме того, было показано, что те же метаболически и биологически активные вещества способны активировать канцерогенез, опухолевый ангиогенез, а также метастатическую активность путем супрессии активности интерлейкина-10, трансформирующего фактора роста β и подавления CD4+ и CD8+ Т-клеток [20–23]. Таким образом в микроокружении паразитарного агента а также в местных иммунокомпетентных структурах формируются условия, благоприятные для возникновения канцерогенных мутаций и их дальнейшего развития.
Сложно судить о видовой принадлежности обнаруженного нами паразита. Однако, основываясь на приведенных выше данных, можно сказать, что нельзя исключать взаимосвязь между паразитарным заболеванием и колоректальным раком.Представленные в литературе клинические случаи и исследования полностью не подтверждают строгую взаимосвязь между кишечными паразитарными заболеваниями и колоректальным раком. Общность некоторых звеньев патогенеза и потенциальное влияния хронического воспаления на канцерогенез показывают, что при исследовании факторов риска развития онкологических заболеваний прямой и ободочной кишки необходимо учитывать микробиоту кишечника и паразитарные заболевания как возможных непосредственных участников или триггеров запуска канцерогенных процессов.
Заключение
Необходимы дальнейшие исследования не только для подтверждения и обоснования роли микро- и микроорганизмов, населяющих кишечник в процессе развития онкологических заболеваний,но и для выявления отдельных звеньев патогенеза, патологических путей и сигнальных молекул, участвующих в канцерогенезе. Подобные исследования могут помочь расширить знания как о факторах риска и предикторах колоректального рака, так и о возможных местах приложения таргетной терапии.
Список литературы Паразитарный абсцесс как случайная гистологическая находка при лечении рака сигмовидной кишки
- Wei Liu, Hong-Ze Zeng, Qi-Ming Wang, Hang Yi, Yi Mou, Chun-Cheng Wu, Bing Hu, Cheng-Wei Tang. Schistosomiasis combined with colorectal carcinoma diagnosed based on endoscopic findings and clinicopathological characteristics: A report on 32 cases. Asian Pacific J. Cancer Prev.14, 4839-4842 (2013). https://doi.org/10.7314/apjcp.2013.14.8.4839
- H Salim, O. E., Hamid, H. K. S., Mekki, S. O., Suleiman, S. H. & Ibrahim, S. Z. Colorectal carcinoma associated with schistosomiasis: A possible causal relationship. World Journal of Surgical Oncology 8, 68 (2010). https://doi.org/10.1186/1477-7819-8-68
- AM Herman, A Kishe, H Babu, H Shilanaiman, M Tarmohamed, J Lodhia, P Amsi, J Pyuza, A Mremi, A Mwasamwaja, M Nyindo, K Chilonga, D Msuya. Colorectal cancer in a patient with intestinal schistosomiasis: A case report from Kilimanjaro Christian Medical Center Northern Zone Tanzania. World J. Surg. Oncol.15, https://doi.org/7).DOI: 10.1186/s12957-017-1217-1
- RL Siegel, KD Miller, AG Sauer, SA Fedewa, LF Butterly, JC Anderson, A Cercek, RA Smith, A Jemal. Colorectal cancer statistics, 2020. A Cancer J Clin. 2020 May;70(3):145-164. https://doi.org/10.3322/caac.21601
- Hiroshi Asano, Kazuto Kojima, Naomi Ogino, Hiroyuki Fukano, Yasuhiro Ohara, Nozomi Shinozuka.Postoperative recurrence and risk factors of colorectal cancer perforation. Int. J. Colorectal Dis.32, 419-424 (2017). https://doi.org/10.1007/s00384-016-2694-3
- Peterson, M. R. & Weidner, N. Gastrointestinal neoplasia associated with bowel parasitosis: Real or imaginary? Journal of Tropical Medicine 2011, (2011).
- Wang, X. & Huycke, M. M. Colorectal cancer: Role of commensal bacteria and bystander effects. Gut Microbes 6, 370-376 (2015). https://doi.org/10.1080/19490976.2015.1103426
- Ya-Nan Yu, Ta-Chung Yu, Hui-Jun Zhao, Tian-Tian Sun, Hui-Min Chen, Hao-Yan Chen, Hui-Fang An, Yu-Rong Weng, Jun Yu, Min Li, Wen-Xin Qin, Xiong Ma, Nan Shen, Jie Hong, Jing-Yuan Fang. Berberine may rescue Fusobacterium nucleatum-induced colorectal tumorigenesis by modulating the tumor microenvironment. Oncotarget 6, 32013-32026 (2015). https://doi.org/10.18632/oncotarget.5166
- Márcia H Fukugaiti, Aline Ignacio, Miriam R Fernandes, Ulysses Ribeiro Júnior, Viviane Nakano, Mario J Avila-Campos. High occurrence of fusobacterium nucleatum and clostridium difficile in the intestinal microbiota of colorectal carcinoma patients. Brazilian J. Microbiol.46, 1135-1140 https://doi.org/5).DOI: 10.1590/S1517-838246420140665
- Landman, C. & Quévrain, E. Le microbiote intestinal : description, rôle et implication physiopathologique. Revue de Medecine Interne 37, 418-423 (2016).
- Coleman, O. I. & Nunes, T. Role of the Microbiota in Colorectal Cancer: Updates on Microbial Associations and Therapeutic Implications. BioResearch Open Access 5, 279-288 (2016).
- Abdurakhim Toychiev, Sulayman Abdujapparov, Alim Imamov, Behzod Navruzov, Nikolay Davis, Najiya Badalova, Svetlana Osipova. Intestinal helminths and protozoan infections in patients with colorectal cancer: prevalence and possible association with cancer pathogenesis. Parasitol. Res. 117, 3715-3723 (2018). https://doi.org/10.1007/s00436-018-6070-9
- Hamid, H. K. S. Review article schistosoma japonicum associated colorectal cancer: A review. American Journal of Tropical Medicine and Hygiene 100, 501-505 (2019).
- Rosin, M. P., El Din Zaki, S. S., Ward, A. J. & Anwar, W. A. Involvement of inflammatory reactions and elevated cell proliferation in the development of bladder cancer in schistosomiasis patients. Mutat. Res. - Fundam. Mol. Mech. Mutagen.305, 283-292 https://doi.org/4).DOI: 10.1016/0027-5107(94)90248-8
- C Trakatelli, S Frydas, M Hatzistilianou, E Papadopoulos, I Simeonidou, A Founta, D Paludi, C Petrarca, M L Castellani, N Papaioannou, V Salini, P Conti, D Kempuraj, J Vecchiet. Chemokines as markers for parasite-induced inflammation and tumors. International Journal of Biological Markers 20, 197-203 https://doi.org/5).DOI: 10.1177/172460080502000401
- Mayer, D. A. & Fried, B. The Role of Helminth Infections in Carcinogenesis. Advances in Parasitology 65, 239-296 (2007).
- Herrera, L. A., Benítez-Bribiesca, L., Mohar, A. & Ostrosky-Wegman, P. Role of infectious diseases in human carcinogenesis. Environmental and Molecular Mutagenesis 45, 284-303 (2005).
- Quan Yang, Huaina Qiu, Hongyan Xie, Yanwei Qi, Hefei Cha, Jiale Qu, Mei Wang, Yuanfa Feng, Xin Ye, Jianbing Mu, Jun Huang. A Schistosoma japonicum Infection Promotes the Expansion of Myeloid-Derived Suppressor Cells by Activating the JAK/STAT3 Pathway . J. Immunol.198, 4716-4727 https://doi.org/7).DOI: 10.4049/jimmunol.1601860
- Maizels, R. M. & McSorley, H. J. Regulation of the host immune system by helminth parasites. J. Allergy Clin. Immunol.138, 666-675 (2016).
- Nakamura, K., Kitani, A. & Strober, W. Cell contact-dependent immunosuppression by CD4+CD25+ regulatory T cells is mediated by cell surface-bound transforming growth factor β. J. Exp. Med. 194, 629-644 (2001).
- Eleonora Timperi, Ilenia Pacella, Valeria Schinzari, Chiara Focaccetti, Luca Sacco, Francesco Farelli, Roberto Caronna, Gabriella Del Bene, Flavia Longo, Antonio Ciardi, Sergio Morelli, Anna Rita Vestri, Piero Chirletti, Vincenzo Barnaba, Silvia Piconese. Regulatory T cells with multiple suppressive and potentially pro-tumor activities accumulate in human colorectal cancer. Oncoimmunology 5, https://doi.org/6).DOI: 10.1080/2162402X.2016.1175800
- Morteza Motallebnezhad, Farhad Jadidi-Niaragh, Elmira Safaie Qamsari, Salman Bagheri, Tohid Gharibi, Mehdi Yousefi. The immunobiology of myeloid-derived suppressor cells in cancer. Tumor Biology 37, 1387-1406 https://doi.org/6).DOI: 10.1007/ s13277-015-4477-9
- Gabrilovich, D. I. & Nagaraj, S. Myeloid-derived suppressor cells as regulators of the immune system. Nature Reviews Immunology 9, 162-174 https://doi.org/9).DOI: 10.1038/nri2506


