Патофизиология геморрагического шока в условиях экстремальных температур окружающей среды (экспериментальное исследование)
Автор: Крайнюков П.Е., Головко К.П., Носов А.М., Денисов А.В., Кокорин В.В., Демченко К.Н., Жирнова Н.А.
Журнал: Московский хирургический журнал @mossj
Рубрика: Экспериментальные исследования
Статья в выпуске: 3 (77), 2021 года.
Бесплатный доступ
Введение. Целью данной работы стала экспериментальная оценка патофизиологических особенностей течения травматического шока в условиях экстремальных температур окружающей среды.Материалы и методы. Экспериментальное моделирование острой кровопотери тяжелой степени с воздействием экстремальных (высоких и низких) температур окружающей среды выполнено на свиньях массой 45-50 кг в количестве 24 голов, в специализированной операционной для выполнения хирургических вмешательств на крупных лабораторных животных, с необходимым материально-техническим обеспечением и подготовленным квалифицированным персоналом. При проведении исследований соблюдались требования нормативно-правовых актов о порядке работы с лабораторными животными (Директива 2010/63/EU Европейского парламента и совета европейского союза по охране животных, используемых в научных целях, 2012).Результаты. Расстройство кислотно-основного состояния более выражены у животных в группе с воздействием высокой температуры окружающей среды. Спустя 30 минут после воздействия высокой или низкой температуры показатели в артериальной крови составляли: дефицит оснований (-10) или (-4); pH -7,28 или 7,36; лактат - 12,44 или 11,25 ммоль/л; парциальное давление углекислого газа - 38 или 26 mmHg соответственно. Выживаемость животных с геморрагическим шоком при воздействии высоких температур ниже, чем при воздействии низкой температуры окружающей среды (0 из 4 и 2 из 4 животных соответственно).Заключение. Инфузионная терапия позволяет снизить летальность при воздействии высоких и низких температур. При оказании помощи пострадавшим и раненым необходимо выполнять мероприятия по их защите от высокотемпературных и низкотемпературных факторов внешней среды, используя укрытия и термоизоляционные одеяла. Данные мероприятия позволят уменьшить последствия кровопотери и привести к более благоприятному течению травматической болезни.
Травматический шок, геморрагический шок, гипотермия, гипертермия, экспериментальное исследование
Короткий адрес: https://sciup.org/142231473
IDR: 142231473 | УДК: 617-089 | DOI: 10.17238/2072-3180-2021-3-29-39
Текст научной статьи Патофизиология геморрагического шока в условиях экстремальных температур окружающей среды (экспериментальное исследование)
Кровотечение является наиболее частой причиной шока после полученной травмы или ранения, и практически все пострадавшие с множественными травмами имеют ту или иную степень гиповолемии [1–4]. Ранние реакции кровообращения на потерю крови являются компенсаторными и включают прогрессирующее снижение кожного, мышечного и висцерального кровообращения для сохранения кровотока к почкам, сердцу и мозгу. Обычная реакция на быстрое уменьшение циркулирующего объема крови – увеличение частоты сердечных сокращений в попытке сохранить уровень сердечного выброса. В большинстве случаев тахикардия является самым ранним измеримым признаком шока со стороны кровообращения. Это обусловлено высвобождением эндогенных катехоламинов, увеличивающих сопротивление периферических сосудов, что, в свою очередь, увеличивает диастолическое артериальное давление и снижает пульсовое давление. Однако повышение давления мало способствует увеличению перфузии органов и оксигенации тканей [5].
Геморрагический шок в раннем периоде характеризуется сохранением в некоторой степени венозного возврата за счет компенсаторного механизма сокращения объема крови в венозной системе, но этот механизм весьма ограничен. Наиболее эффективным способом восстановления адекватного сердечного выброса, перфузии органов-мишеней и оксигенации тканей является восстановление нормального венозного кровотока путем адекватного восполнения объема циркулирующей крови [6, 7]. Однако этот способ позволит выйти из шокового состояния только при условии своевременного обнаружения и остановки кровотечения.
На клеточном уровне клетки с недостаточной перфузией и насыщения кислородом лишены необходимых субстратов для нормального аэробного метаболизма и производства энергии. Первоначально компенсация происходит за счет перехода к анаэробному метаболизму, что приводит к образованию молочной кислоты и развитию метаболического ацидоза. Если шок будет продолжительным, это может привести к последующему повреждению органов-мишеней и полиорганной дисфункции.
Бороться с этим процессом помогает введение соответствующего количества изотонических растворов электролитов, препаратов крови и ее компонентов. Лечение должно быть сосредоточено на остановке прогрессирования состояния шока путем остановки кровотечения и обеспечения адекватной оксигенации, вентиляции легких и соответствующей жидкостной реанимации. Должен быть обеспечен быстрый доступ в периферическую или центральную вену [8].
Существенное влияние на течение геморрагического шока и результат лечения пострадавшего может оказать экстремальная температура окружающей среды (высокая или низкая), даже с учетом оказания адекватной помощи в пределах золотого часа. Определение степени и направленности этого влияния стало целью данного экспериментального исследования.
Цель исследования
В эксперименте оценить особенности течения травматического шока в зависимости от температурных условий окружающей среды.
Материалы и методы
Экспериментальные исследования выполнены на свиньях массой 45–50 кг в количестве 24 голов в специализированной операционной для выполнения хирургических вмешательств на крупных лабораторных животных с необходимым материально-техническим обеспечением и подготовленным квалифицированным персоналом.
Животные содержались в условиях вивария при температуре окружающей среды +22 – +25°С в проветриваемых помещениях, исключающих возникновение сквозняков.
Перед проведением испытаний персонал инструктировался по порядку проведения испытаний, регистрации его результатов, а также по мерам техники безопасности.
При проведении исследований соблюдались требования нормативно-правовых актов о порядке работы с лабораторными животными – Директива 2010/63/EU Европейского парламента и совета европейского союза по охране животных, используемых в научных целях, 2012 г [9].
Экспериментальные исследования проводились в 4 этапа:
-
1-й этап – подготовительный;
-
2-й этап – моделирование острой кровопотери тяжелой степени с воздействием экстремальных (высоких и низких) температур окружающей среды;
-
3-й этап – наблюдение;
4-й этап – анализ полученных результатов.
1-й этап. Подготовительный этап эксперимента.
За сутки до эксперимента животные ограничивались в пище, но оставался свободный доступ к воде.
Подготовка животных к эксперименту заключалась в предварительном осмотре (для исключения из опытов животных с признаками заболеваний), рандомизации по группам и взвешивании.
С целью создания максимально реалистичной модели тяжелого геморрагического шока на догоспитальном этапе, объем моделируемой кровопотери был определен на границе компенсаторных возможностей биообъекта – 44±3% от объема циркулирующей крови.
По условиям эксперимента наблюдение проводили по 8 контрольным точкам: перед кровопотерей, сразу после окончания кровопотери, через 10 минут после окончания кровопотери (в группах с воздействием экстремальных температур эта точка совпадала со временем воздействия температурных условий), 30, 60, 120, 180 мин и 1 сутки после начала инфузии (в группах без лечения это время после окончания кровопотери).
2-й этап. Моделирование острой кровопотери тяжелой степени.
Выполнение анестезии. В условиях предоперационной в область бедра выполнялась внутримышечная инъекция раствора Zoletil®100 в дозировке 20 мг/кг веса животного. После анестезии животное помещали на перевязочный стол в положении – «на спине», производили интубацию трахеи для профилактики аспирации отделяемого в трахеобронхиальное дерево. Животное находилось на самостоятельном дыхании. Ректально устанавливали датчик измерения температуры.
В правой паховой области под УЗ навигацией выполняли катетеризацию бедренной артерии и бедренной вены по Сельдингеру с установкой интродьюсеров диаметром 5 и 4Fr соответственно, для инвазивного мониторинга артериального давления и для проведения инфузионной терапии. В левую бедренную артерию также устанавливается интродьсер 5Fr для моделирования кровопотери. Интродьюсер, установленный в правую бедренную артерию, соединялся через трехходовый переходник с датчиком для инвазивного мониторинга АД, подключали датчики оценки ЭКГ, ЧДД, ЧСС. Регистрировали и записывали исходные показатели состояния животного перед кровопотерей согласно карте эксперимента.
При нормальных температурных условиях (+19–+23°С) через левую бедренную артерию осуществляется забор крови со скоростью 40 мл в 1 мин. при помощи аппарата ГЕММА до достижения показателей среднего артериального давления (далее – СрАД) у животного равного 35–40 мм рт. ст., в случае повышения СрАД выше 40 мм рт. ст. производится дополнительный забор артериальной крови до достижения целевых показателей артериального давления. Оценивался общий объём кровопотери в мл и в % от общего объёма циркулирующей крови, рассчитанного согласно формуле:
где Vцк – объём циркулирующей крови, мл;
М – масса животного, г.
Животное на носилках переносили в климатическую камеру, в которой температура составляла +50°С или –50°С в зависимости от экспериментальной группы, в течение последующих 10 мин осуществляли наблюдение за животным (моделирование периода нахождения без оказания помощи). Затем в группах с проведением инфузионной терапии начиналась инфузия раствора реополиглюкина в объеме 1000 мл при температуре окружающей среды (+35°С или –10°С в зависимости от группы животных) для моделирования эвакуации с места происшествия.
Затем животное размещали в нормальных температурных условиях +22 – + 25°С для дальнейшего наблюдения.
Выбор раствора для инфузионной терапии в условиях экстремальных температур определили его физические свойства: реополиглюкин, в отличие от традиционно применяемого физиологического раствора, был эффективен в любых температурных условиях, в то время как раствор NaCl 0,9% замерзал в стандартной системе для инфузии уже при температуре –10 0 С. Объем инфузии был ограничен 1000 мл в связи с тем, что по современным рекомендациям объем вводимых инфузионных растворов не должен превышать 1000 мл, после чего производится переливание препаратов крови и ее компонентов [10].
3-й этап. Наблюдение за состоянием животного, фиксирование показателей контрольных точек.
Оценивали выживаемость животных и динамику следующих клинических и лабораторных показателей: артериального давления, частоты сердечных сокращений, изменения кислотно- основного и газового состава крови (дефицит оснований, pH, уровень СО2) и лактата.
Результаты исследования
Как и ожидалось, в целом в группах без лечения выживаемость в течение суток после кровопотери была ниже, чем в группах, получавших инфузионную терапию реополиглюкином – выжило от 0 до 2 животных из 4 (табл. 1). Однако если воздействие экстремально низких температур не оказало существенного влияния на выживаемость, по сравнению со стандартными условиями (+25 0 С) (2 из 4 животных), то при воздействии высоких температур в группе без лечения пали все животные.
При воздействии высоких температур окружающей среды инфузия раствора реополиглюкина стала решающим фактором, позволившим всем животным выжить более суток, в то время как в группе без лечения выживаемость не превысила 180 мин.
Таблица 1
Клиническая оценка эффективности инфузионной терапии при лечении геморрагического шока на догоспитальных этапах в условиях экстремальных температур по общебиологическим критериям (выживаемость)
Table 1
Clinical assessment of the effectiveness of infusion therapy in the treatment of hemorrhagic shock at the prehospital stages in conditions of extreme temperatures according to general biological criteria (survival)
|
Группа животных Group of animals |
Выживаемость животных по контрольным точкам наблюдения (n, выжившие / n, умершие) Survival of animals according to control points of observation (n, survivors / n, deceased) |
||||||
|
время наблюдения observation time |
|||||||
|
Сразу после кровопотери Immediately after blood loss |
10 |
30 |
60 |
120 |
180 |
1 сут |
|
|
Стандартные температурные условия Standard temperature conditions |
|||||||
|
без лечения without treatment |
4/4 |
4/4 |
4/4 |
4/4 |
3/4 |
2/4 |
2/4 |
|
Реополиглюкин Rheopolyglucin |
4/4 |
4/4 |
4/4 |
4/4 |
4/4 |
4/4 |
4/4 |
|
низкие температуры low temperatures |
|||||||
|
без лечения without treatment |
4/4 |
4/4 |
4/4 |
4/4 |
4/4 |
4/4 |
2/4 |
|
Реополиглюкин Rheopolyglucin |
4/4 |
4/4 |
4/4 |
4/4 |
4/4 |
4/4 |
3/4 |
|
высокие температуры high temperatures |
|||||||
|
без лечения without treatment |
4/4 |
2/4 |
2/4 |
2/4 |
2/4 |
2/4 |
0 |
|
Реополиглюкин Rheopolyglucin |
4/4 |
4/4 |
4/4 |
4/4 |
4/4 |
4/4 |
3/4 |
Потеря более 40 % от объема циркулирующей крови у животных приводила к геморрагическому шоку, с максимально выраженными признаками через 10–30 мин после кровопотери (таб. 2, рис. 1–4). В этот период у всех животных происходило резкое снижение среднего АД, увеличение в 1,5 раза частоты сердечных сокращений, наблюдались нарушения кислотноосновного и газового состава артериальной крови в виде метаболического ацидоза с дефицитом оснований (до (–5)–(–8)), компенсаторным снижением уровня СО2 (до 22–34 mmHg) и высоким уровнем лактата (до 7,7–12,3 ммоль/л).
Таблица 2
Клиническая оценка эффективности инфузионной терапии (реополиглюкин) для лечения геморрагического шока на догоспитальных этапах по показателям функционального состояния систем дыхания и кровообращения, m±σ
Table 2
Clinical assessment of the effectiveness of infusion therapy (rheopolyglucin) for the treatment of hemorrhagic shock at the prehospital stages in terms of the functional state of the respiratory and circulatory systems, m ± σ
|
Показатель, группа животных Indicator, group of animals Исходное initial |
Среднее значение показателя по точкам (мин после кровопотери/инфузии) Average value of the indicator by points (min after blood loss / infusion) |
||||||||
|
Сразу после кровопотери Immediately after blood loss |
10 |
30 |
60 |
120 |
180 |
1 сут |
|||
|
среднее артериальное давление/ mean arterial pressure, mmHg |
|||||||||
|
1 к н s ^ |
Без лечения without treatment |
113±22 |
46±16 |
57±15 |
55±22 |
62±25 |
68±16 |
60±9 |
80±7 |
|
Реополиглюкин Rheopolyglucin |
100±19 |
43±16 |
111±25 |
108±23 |
112±23 |
110±15 |
102±14 |
85±14 |
|
|
к а § Й д ^ |
Без лечения without treatment |
84±9 |
67±26 |
44 |
37 |
43±32 |
63±13 |
61±6 |
80±4 |
|
Реополиглюкин Rheopolyglucin |
107±55 |
50±10 |
53±21 |
83±7 |
92±16 |
93±16 |
90±11 |
80±32 |
|
|
д ^ « . ^ W н ^ |
Без лечения without treatment |
102±12 |
43±8 |
43±8 |
53 |
94±20 |
76±13 |
61±9 |
- |
|
Реополиглюкин Rheopolyglucin |
96±10 |
43±5 |
43±5 |
89±15 |
110±12 |
110±21 |
106±30 |
68±23 |
|
|
частота сердечных сокращений/ heart rate |
|||||||||
|
1 к 5 н S 2 U « V) |
Без лечения without treatment |
95±36 |
173±108 |
191±123 |
166±142 |
190±126 |
153±82 |
175±50 |
118±46 |
|
Реополиглюкин Rheopolyglucin |
93±28 |
132±30 |
138±18 |
132±28 |
122±31 |
113±39 |
105±41 |
108±26 |
|
|
К д ^ |
Без лечения without treatment |
106±12 |
104±37 |
130 |
188±17 |
195±7 |
185±7 |
122±31 |
130± |
|
Реополиглюкин Rheopolyglucin |
140±29 |
127±39 |
127±39 |
158 |
160±21 |
161±11 |
150±11 |
155±1 |
|
|
д м . й 8 5 д н S |
Без лечения without treatment |
148±35 |
200±48 |
226±48 |
200 |
216±37 |
230±42 |
196 |
- |
|
Реополиглюкин Rheopolyglucin |
197±42 |
186±36 |
186±36 |
160±31 |
202±15 |
196±34 |
177±21 |
125±5 |
|
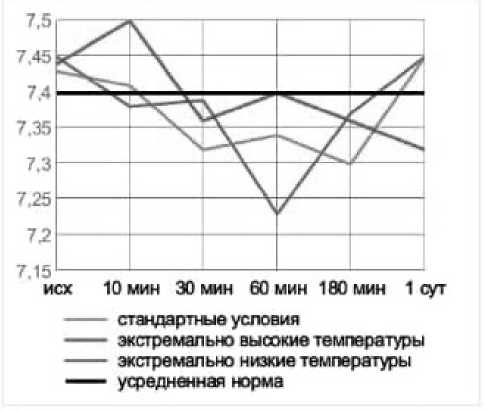
стандартные условия экстремально высокие температуры экстремально низкие температуры усредненная норма
Б.
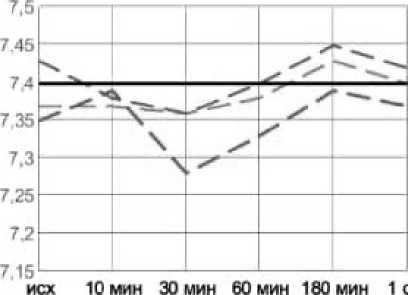
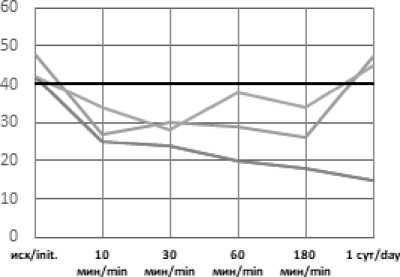
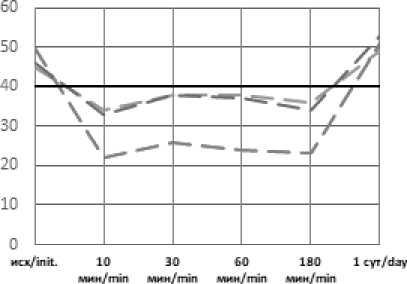
Рис. 1. Динамика рН артериальной крови в эксперименте с острой массивной кровопотерей в условиях экстремальных температур без лечения (А), с инфузионной терапией реополиглюкином (Б) Fig. 1. Dynamics of arterial blood pH in an experiment with acute massive blood loss under extreme temperatures without treatment (A), with infusion therapy with rheopolyglucin (B)
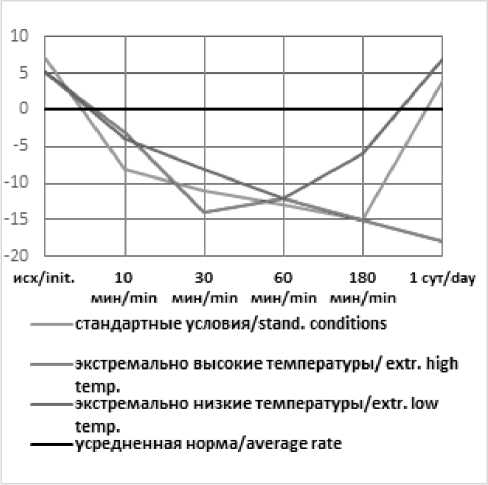
--стандартные условия/stand, conditions
--экстремально высокиетемпературы/extr. high temp.
--экстремально низкие температуры/extr.
low temp.
-----усредненная норма/average rate
Б.
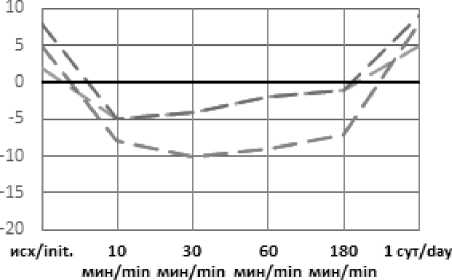
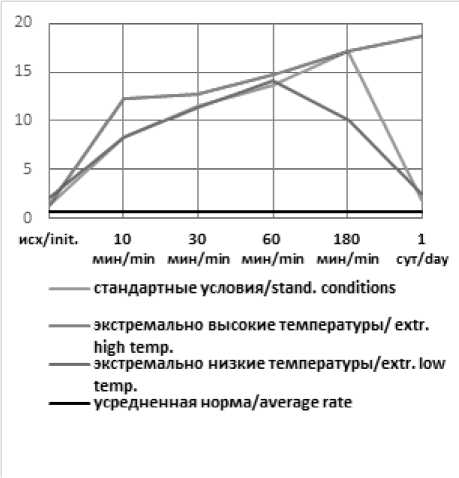
Рис. 2. Динамика ВЕ артериальной крови в эксперименте с острой массивной кровопотерей в условиях экстремальных температур без лечения (А), с инфузионной терапией реополиглюкином (Б) Fig. 2. Dynamics of arterial blood BE in an experiment with acute massive blood loss under conditions of extreme temperatures without treatment (A), with infusion therapy with rheopolyglucin (B)
----стандартные условия/stand, conditions
— стандартные условия/stand, conditions
----экстремально высокие температуры/extr. high temp.
--- экстремально низкие температуры/extr. low temp.
----усредненная норма/average rate
— — экстремально высокие температуры/ extr. high temp.
--экстремально низкие температуры/extr. low temp.
-----усредненная норма/average rate
Рис. 3. Динамика рСО2 артериальной крови в эксперименте с острой массивной кровопотерей в условиях экстремальных температур без лечения (А), с инфузионной терапией реополиглюкином (Б)
Fig. 3. Dynamics of pCO2 of arterial blood in an experiment with acute massive blood loss under conditions of extreme temperatures without treatment (A), with infusion therapy with rheopolyglucin (B)
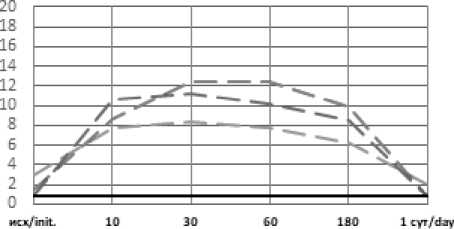
мин/min мин/min мин/min мин/min
--стандартные условия/stand, conditions
--экстремально высокие температуры/extr. high temp.
--экстремально низкие температуры/extr. low temp.
-----усредненная норма/average rate
Рис. 4. Динамика уровня лактата артериальной крови в эксперименте с острой массивной кровопотерей в условиях экстремальных температур без лечения (А), с инфузионной терапией реополиглюкином (Б) Fig. 4. Dynamics of the level of arterial blood lactate in an experiment with acute massive blood loss under conditions of extreme temperatures without treatment (A), with infusion therapy with rheopolyglucin (B)
Без лечения, в течение периода наблюдения в организме животного включались компенсаторные механизмы, в результате чего начинало происходить восстановление показателей сердечно-сосудистой системы к 1-м суткам наблюдения (у выживших животных), либо истощение резервов организма, прогрессирование нарушений и гибель. Дополнительное воздействие в виде высокой температуры окружающей среды способствовало усилению дисбаланса жизненно-важных показателей и гибели животных до окончания эксперимента, в период воздействия высокой температуры +50°С или +35°С. Воздействие низких температур было несущественным, животные погибали в течение суток после нахождения в холодовой камере.
Применение инфузионной терапии давало положительный эффект уже через 30 минут после начала инфузии: происходила стабилизация показателей и их дальнейшая нормализация во всех группах, к первым суткам практически возвращаясь к референтным значениям: рН – 7,37– 7,42; лактат – 0,84–2,09.
Как и в группах без лечения, воздействие экстремально высоких температур оказало влияние на степень выраженности метаболических нарушений и длительность восстановительного периода. Несмотря на то, что в целом инфузионная терапия дала положительный эффект, в течение 3-х часов от окончания кровопотери после воздействия высоких температур компенсация нарушений происходила медленнее, чем в стандартных условиях или на холоде, и только к первым суткам показатели нормализовались. Таким образом воздействие экстремально высоких температур оказало более негативное влияние на степень выраженности метаболических нарушений и длительность восстановительного периода. Несмотря схожую выживаемость животных с инфузией реополиглюкина в группах с холодовым и высокотемпературным воздействием окружающей среды, степень тяжести метаболических нарушений существенно отличалась. Так уровень pH спустя 30 минут после воздействия составлял 7,36 и 7,28; дефицит оснований (BE) – (–4) и (–10); парциальное давление углекислого газа 38 и 26 соответственно. Различия в динамике содержания лактата были несущественны (11,25 и 12,44 ммоль/л соответственно). Схожая картина наблюдается и при сравнении данных показателей в группах без инфузионной терапии.
Обсуждение
Развитие шока при механическом повреждении прежде всего обусловлено влиянием кровопотери. Именно поэтому патологический процесс травматического шока схож с шоком геморрагическим. Стоит указать на то, что в случае травм и ранений развитие шока может произойти и по другим причинам: в результате тампонады сердца, напряженного пневмоторакса или в результате развития септического шока в 3-м периоде травматической болезни.
Общим критерием гиповолемического шока любой этиологии является снижение объема циркулирующей плазмы, интерстициальная и клеточная дегидратация. Геморрагический шок всегда сопровождается развитием метаболического ацидоза различной степени выраженности, при нем потеря факторов свертывания и последующая гемодилюция приводят к гипокоагуляционным нарушениям с развитием летальной триады [11].
Определение тяжести кровопотери в целом определяет характер и объем инфузионно-трансфузионной терапии, а также необходимость переливания препаратов крови. На сегодняшний день выделяют 4 степени тяжести кровопотери, добавляя к классификации 1997 года еще один ключевой лабораторный показатель – избыток основания (BE) (табл. 3). Избыток основания – это количество основания (HCO3 в ммоль/л), которое выше или ниже нормального диапазона в организме. Отрицательное число называется дефицитом оснований и указывает на метаболический ацидоз.
Кроме того, к отягощающим факторам тяжести шока относятся и факторы окружающей среды: высокая или низкая температура. Хотя, казалось бы, высокая температура атмосферного воздуха должна предотвращать или замедлять развитие летальной триады, уменьшая влияние гипотермии. Проведенное нами исследование показало, что развитие шока и его проявления носят более тяжелый характер при воздействии высоких температур окружающей среды (+50…+35°С), что проявляется не только гибелью всех животных, которые не получали инфузионную терапию, но и более тяжелыми нарушениями кислотно-основного и газового состава. Так, в условиях экстремально высоких температур (по сравнению с низкими), дефицит оснований составил –8 (при низких – (–5), уровень лактата – 8,59 ммоль/л (при низких – 10,56 ммоль/л), pH артериальной крови – 7,39 (при низких – 7,38) и уровень СО2 артериальной крови – 22 mmHg (при низких – 33 mmHg) уже через 10 минут после кровопотери. Аналогичная закономерность в течении шока наблюдается у животных, находившихся в стандартных температурных условиях и в камере с низкой температурой окружающей среды: дефицит оснований – (–8) и (–4); уровень лактата – 8,31 и 8,28 ммоль/л; pH артериальной крови – 7,41 и 7,38 и уровень СО 2 артериальной крови – 27 и 34 mmHg через 10 мин после кровопотери соответственно.
Исходя из проведенного исследования можно сделать вывод, что важно дифференцировать воздействие экстремальных температур на состояние пациентов с тяжелой кровопотерей: экстремально высокие способствуют утяжелению симптомов гиповолемического шока и более длительному периоду восстановления жизненно-важных функций, в отличие от экстремально низких, влияние которых не существенно. Вероятно, это связано с расширением сосудов кожи, подкожной клетчатки и частичной децентрализации кровообращения в результате жарких условий окружающей среды, что приводит к уменьшению ударного объема сердца и снижению перфузии органов, превращая кровопотерю из тяжелой в крайне тяжелую.
Таблица 3
Классификация тяжести кровопотери в зависимости от клинических и лабораторных показателей [12]
Table 3
Classification of the severity of blood loss depending on clinical and laboratory parameters [12]
|
Параметр/ Paraтeter |
Класс I Class I |
Класс II Class II (средняя/ medium ) |
Класс III Class III (тяжелая/ heavy ) |
Класс IV Class IV (крайне тяжелая/ extremely heavy ) |
|
Объем кровопотери Blood loss volume |
15% |
15-30% |
31-40% |
>40% |
|
ЧСС Heart rate |
↔ |
↔/↑ |
↑ |
↑/↑↑ |
|
АД Blood pressure |
↔ |
↔ |
↔/↓ |
↓ |
|
Пульсовое давление Pulse pressure |
↔ |
↓ |
↓ |
↓ |
|
ЧДД Respiratory rate |
↔ |
↔ |
↔/↑ |
↑ |
|
Мочеотделение Diuresis |
↔ |
↔ |
↓ |
↓↓ |
|
Оценка сознания по шкале ком Глазго Assessment of consciousness on the Glasgow coma scale |
↔ |
↔ |
↓ |
↓ |
|
Дефицит основания Deficiency base |
От 0 до –2 ммоль/л mmol / l |
От -2 до –6 ммоль/л mmol / l |
От -6 до –10 ммоль/л mmol / l |
Менее less -10 ммоль/л mmol / l |
|
Необходимость гемотрансфузии Need for blood transfusion |
Наблюдение observation |
Вероятно probably |
Необходимы required |
Протокол массивной гемотрансфузии Massive transfusion protocol |
Таким образом помимо ранней остановки продолжающегося кровотечения, начала инфузионно-трансфузионной терапии важно использовать и средства защиты от факторов внешней среды [13]. Необходимо накрывать раненого или пострадавшего термоизоляционным одеялом, перемещать в укрытия для защиты от действия прямых солнечных лучей.
Выводы
Выживаемость животных с геморрагическим шоком при воздействии высоких температур ниже, чем при воздействии низкой температуры окружающей среды (0 из 4 и 2 из 4 животных соответственно).
Инфузионная терапия позволяет снизить летальность при воздействии высоких и низких температур, однако расстройства кислотно-основного состояния более выражены у животных в группе с воздействием высокой температуры окружающей среды. Спустя 30 минут после воздействия высокой или низкой температуры показатели в артериальной крови составляли:
дефицит оснований (–10) или (–4); pH –7,28 или 7,36; лактат – 12,44 или 11,25 ммоль/л; парциальное давление углекислого газа – 38 или 26 mmHg соответственно.
При оказании помощи пострадавшим и раненым необходимо выполнять мероприятия по их защите от высокотемпературных и низкотемпературных факторов внешней среды, используя укрытия и термоизоляционные одеяла. Данные мероприятия позволят уменьшить последствия кровопотери и привести к более благоприятному течению травматической болезни.
Список литературы Патофизиология геморрагического шока в условиях экстремальных температур окружающей среды (экспериментальное исследование)
- Abdel-Razeq S.S., Kaplan L.J. Hyperchloremic metabolic acidosis: More than just a simple dilutional effect. Year book of int. Care and Emerg. Med., 2009, рр. 221–232.
- American College of Surgeons Committee on Trauma. Advanced Trauma Life Support, Student course manual, tenth edition. Chicago, American College of Surgeons, 2018.
- Chatfield-Ball С., Boyle P. Autier Ph. Herzig van Wees S., Sullivan R. Lessons learned from the casualties of war: battlefield medicine and its implication for global trauma care. J. R. Soc. Med., 2015, Vol. 108, № 3, рр. 93–100.
- Khan S., Khan S., Davenport R., Raza I. Damage control resuscitation using blood component therapy in standart doses has a limited effect on coagulopathy during trauma hemorrhage. Intensive Care Med., 2015, Vol. 41, № 2, рр. 239–247.
- Mutschler A., Nienaber U., Brockamp T. et al. A critical reappraisal of the ATLS classification of hypovolaemic shock: does it really reflect clinical reality? Resuscitation, 2013, № 84, рp. 309–313.
- Дежурный Л.И., Махновский А.И., Эргашев О.Н. и соавт. Потенциальная предотвратимость догоспитальной гибели пострадавших при ДТП: Первые результаты клинико-эпидемиологического мониторинга. Скорая медицинская помощь. СПб, 2018. 34 с.
- Йовенко И.А., Кобеляцкий Ю.Ю., Царев А.В. и соавт. Интенсивная терапия кровопотери, коагулопатии и гиповолемического шока при политравме. Медицина неотложных состояний, 2016. № 4. С.64–71.
- Литвицкий П. Ф. Патофизиология. М.: ГЭОТАР-Медиа, 2006. Т. 1. C. 201–244.
- Литвицкий, П.Ф. Нарушения теплового баланса организма: гипертермия, гипертермические реакции, тепловой удар, солнечный удар. Вопросы современной педиатрии, 2010. Т. 9 (1). C. 96–102.
- Немченко Н.С., Денисов А.В., Жирнова Н.А. Особенности синдрома полиорганной недостаточности при тяжелых травмах: диагностика риска развития. Медико-биологические и социально психологические проблемы безопасности в чрезвычайных ситуациях, 2012, № 3, C. 18–23.
- Политравма: травматическая болезнь, дисфункция иммунной системы. Современная стратегия лечения под ред. Е.К. Гуманенко и В.К. Козлова. М.: ГЭОТАР Медиа, 2008, 608 с.
- Самохвалов И.М., Гончаров А.В., Чирский В.С., и соавт. «Потенциально спасаемые» раненые – резерв снижения догоспитальной летальности при ранениях и травмах. Скорая медицинская помощь, 2019. Т. 20. № 3. С. 10–17.
- Самохвалов И.М., Рева В.А. Догоспитальная помощь раненым в военных конфликтах: состояние и перспективы. Воен.-мед. журн., 2015. Т. 336. № 3. С. 15–26.
- Самохвалов И.М., Головко К.П., Бояринцев В.В. и соавт. Обоснование концепции раннего патогенетического лечения тяжелых ранений и травм. Вестник Российской Военно-медицинской академии, 2020. № 3. С. 23–28.


