Патогенетические аспекты развития миомы матки у женщин с уреаплазменной инфекцией
Автор: Кан Нина Ивановна, Потатуркина-Нестерова Наталия Иосифовна, Тарабрина Елена Петровна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 3, 2016 года.
Бесплатный доступ
Цель. Изучить патогенетическую роль адаптивных реакций иммунной системы у женщин с миомой матки, развившейся на фоне уреаплазменной инфекции. Материалы и методы. Обследовано 265 женщин с миомой матки: на фоне уреаплазменной инфекции - 190 чел., без уреаплазменной инфекции - 75. Контроль - 40 здоровых женщин. Для амплификации уреаплазм использовали гены уреазы, которые определяли с применением комплекта «Ампли Сенс», вариант FER для ПЦР-амплификации ДНК; хламидиоза - вариант МФА с овечьей хламидийной антисывороткой, меченной флюоресциномизотиоцинатом; урогенитального герпеса - тест-системы «ВПГ-2-тест», «сэндвич»-варианта ИФА; ДНК ВПГ - метод ПЦР с наружными и внутренними праймерами; урогенитального кандидоза - иммуноферментный анализатор (NIHON Konden). Субпопуляции лимфоцитов (СД+-3, СД+-4, СД+-8, СД+-20) определяли с помощью моноклональных антилимфоцитарных антител в реакции непрямой мембранной иммунофлюоресценции в модификации на поли-Д-лизине (Sigma, Германия). Количество интерлейкинов (ИЛ-1Д -2, -4, -6, -8, -10), фактора некроза опухоли а определяли иммуноферментным методом с использованием тест-систем «Протеиновый контур» (г. Санкт-Петербург), «Вектор-Бест» (г. Новосибирск). Результаты и обсуждение. У женщин с миомой матки на фоне уреаплазмоза нарушена микробиота влагалища с преобладанием анаэробных бактерий. Выявлена выраженная иммуносупрессия: уменьшение содержания CD3+- и СБ4+-лимфоцитов, экспрессирующих СД3- и СД4-рецепторы; сывороточного IgA и повышение уровня регуляторных цитокинов с разнонаправленными эффектами действия, приводящих к иммунопатологическим реакциям и способствующих усилению пролиферативных процессов в матке. Заключение. Выраженная иммуносупрессия клеточного иммунитета создает предпосылки к развитию аутоаллергических и пролиферативных процессов. Повышенная продукция макрофагальных цитокинов (ИЛ-10 и ИЛ-10), ИЛ-2 подавляет противоопухолевый иммунитет и является триггерным фактором быстрого роста миомы матки. Высокая локальная продукция ИЛ-10 нарушает иммунный надзор в миометрии и усиливает процессы клеточной пролиферации в миоматозном узле.
Миома матки, уреаплазмоз, микст-инфекция, цитокины, иммуносупрессия
Короткий адрес: https://sciup.org/14113161
IDR: 14113161 | УДК: 618.14006.36:-097
Текст научной статьи Патогенетические аспекты развития миомы матки у женщин с уреаплазменной инфекцией
Введение . Миома матки является весьма актуальной проблемой, поскольку как в России, так и во всем мире ведущий метод лечения симптомной миомы матки – хирургический. Частота хирургического лечения достигает 45 %, а доля радикальных вмешательств – 80 % [1–3]. Другой аспект проблемы – развитие вторичной хронической анемии, обусловленной маточными кровотечениями, нарушающими качество жизни женщин [4].
Существует несколько теорий возникновения аномальных маточных кровотечений, развивающихся при миоме матки: а) механические препятствия вледствие наличия миома-тозных узлов, нарушающих контрактильность матки [5]; б) сосудистая теория, рассматривающая спиральные сосуды, чувствительные к стероидным гормонам, как фактор, пенетра-ции слизистой оболочки матки; в) нарушение ангиогенеза в гипертрофированных миоцитах
[6]; г) локальная дисрегуляция вазоактивных факторов роста (EGF) и их рецепторов [7].
ДНК. Для обнаружения хламидиоза (А 56,0) использовали прямой вариант МФА с овечьей хламидийной антисывороткой, меченной
Ключевой фактор пролиферации миома-тозных узлов – прогестерон. Прогестерон активирует экспрессию эпидермального фактора роста, белка Blc-2 (B-cell lymphoma, leukmia-2, ингибитора апоптоза) и гена фактора некроза опухоли (ФНО- α ) [8–10].
Разноречивость патогенетических аспектов развития миомы матки и роль инфекции как триггерного механизма изучены недостаточно. Возможно, одним из ключевых механизмов развития миомы матки является уреа-плазменная инфекция, особенно учитывая способность уреаплазм усиливать кластогенный и онкогенный эффекты, нарушающие механизм регуляции клеточного роста, иммунные реакции и продукцию цитокинов. В связи с вышеизложенным нами и проведено данное исследование.
Цель исследования. Изучить патогенетическую роль адаптивных реакций иммунной системы у женщин с миомой матки, развившейся на фоне уреаплазменной инфекции.
Материалы и методы. Было обследовано 265 женщин, состоящих на диспансерном учете в ГУЗ городская поликлиника № 1 им. С.М. Кирова (г. Ульяновск) с верифицированным диагнозом «миома матки»: I группа представлена 190 женщинами с миомой матки, протекающей на фоне уреаплазменной инфекции; II – 75 пациентками с миомой матки без уреаплазменной инфекции. Группу сравнения составили 40 практически здоровых женщин.
Локализацию фиброматозных узлов осуществляли трансвагинальным ультразвуковым датчиком на аппарате Aloka-500, 650.
С целью диагностики урогенитального уреаплазмоза (А 63.8) использовали метод флуорестирующих антител (МФА) с контрастированием фона, а приготовленные из исследуемого материала мазки окрашивали люминесцирующим иммуноглобулином (Ig) против Ureaplasma urealyticum. Данный материал изучали в люминесцентном микроскопе. Мишенями для амплификации уреа-плазм являлись гены уреазы, которые определяли с использованием комплекта «Ампли Сенс», вариант FER для ПЦР-амплификации флюоресциномизотиоцинатом, и бычий альбумин, меченный родамином (НИИ ЭМ им. Н.Ф. Гамалеи АН РФ), для контрастирования фона. Урогенитальный герпес (А 76.0) обнаруживали с помощью иммуноферментной моноклональной тест-системы «ВПГ-2-тест» – «сэндвич»-варианта ИФА. ДНК ВПГ определяли методом ПЦР с наружными и внутренними праймерами; урогенитальный кандидоз (В 37.4) – с помощью твердофазного варианта ИФА с использованием иммунофермент-ного анализатора (NIHON Konden).
Субпопуляции лимфоцитов (СД+-3, СД+-4, СД+-8, СД+-20) определяли с помощью моноклональных антилимфоцитарных антител к дифференцировочным антигенам в реакции непрямой мембранной иммунофлюоресценции в модификации на поли-Д-лизине (Sigma, Германия).
Количество интерлейкинов (ИЛ) 1 β , 2, 4, 6, 8, 10, фактора некроза опухоли α (ФНО- α ) в периферической крови больных с миомой матки определяли иммуноферментным методом (ИФА) с использованием тест-систем
«Протеиновый контур» (г. Санкт-Петербург), «Вектор-Бест» (г. Новосибирск). Результаты исследования регистрировались на спектрофотометре «УНИПЛАН» (АИФР-01) фирмы «ПИКОН».
Статистическую обработку полученных результатов производили с использованием пакета специальных прикладных программ Microsoft Office Excel 7.0 с вычислением значений средней арифметической (М), средней ошибки средней арифметической (m), критерия Стъюдента (t) и степени вероятности (р). Достоверными считали различия при р ≤ 0,05. Определение коэффициента корреляции (r) проводили непараметрическим методом по Спирману. Наличие зависимости показывает значение r > 0,25.
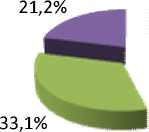
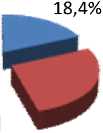
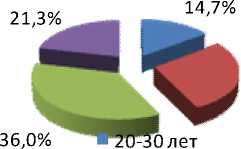
Результаты и обсуждение. Проведенный анализ показал, что миома матки может развиваться в любом возрасте, но наиболее часто – у женщин старше 30 лет с физиологической инволюцией тимуса и депрессией иммунорегуляторных и эффекторных звеньев иммунитета (рис. 1, 2).
■ 20-30 лет
■ 41-50 лет
27,4%
■ 31-40 лет
■ 51 год и старше
28,0%
■ 31-40лет
■ 41-50лет
Рис. 1. Миома матки на фоне уреаплазменной инфекции
Рис. 2. Миома матки без уреаплазменной инфекции
Локализация и размеры фиброматозных узлов представлены на рис. 3, 4. Обнаружено, что смешанная форма фиброматозных узлов превалировала (54,7 %) над мышечной, сли- зистой и подслизистой локализациями (соответственно 23,6; 18,9 и 2,8 %). Наиболее часто встречались узлы 20–30 мм (36 %) и 30–50 мм (32 %).
Мышечная (интерстициальная)Слизистая (субсерозная)
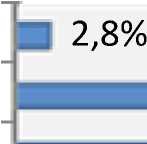
Рис. 3. Локализация фиброматозных узлов
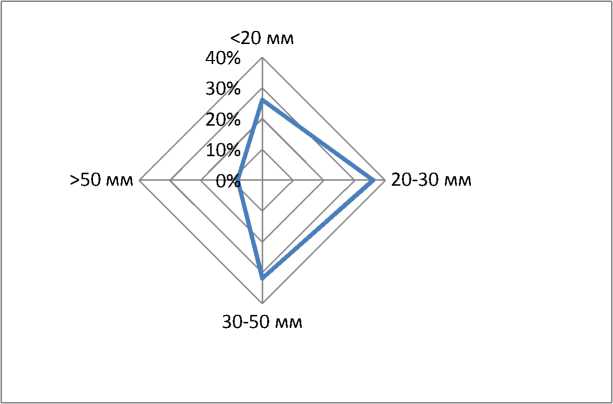
Рис. 4. Размеры фиброматозных узлов
При использовании цитологической классификации Бетесда (The Bethesda-mBS, 1998) отмечены «умеренные изменения кле- ток эпителия шейки матки» и «значительные изменения клеток эпителия». Данные представлены в табл. 1.
Таблица 1
|
Оценка качества препарата |
Здоровые (группа сравнения), n=40 |
Женщины с миомой матки, n=76 |
|
Цитологическая картина в пределах нормы |
40 (100 %) |
- |
|
Умеренные изменения клеток эпителия |
- |
48 (63,1 %) |
|
Значительные изменения клеток эпителия |
- |
28 (36,8 %) |
Цитологическая картина эпителия шейки матки у женщин с миомой
Для уточнения характера сопутствующей бактериальной флоры как триггера развития миомы матки проведен анализ высеянной микробной флоры.
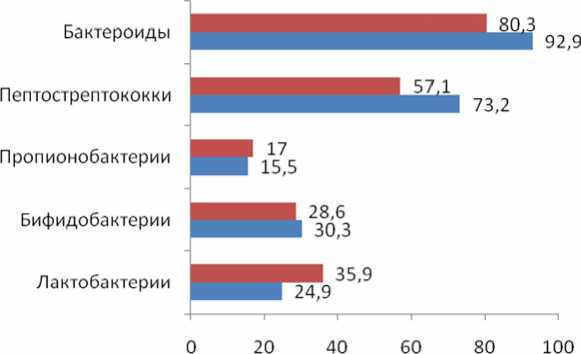
У больных с миомой матки и уреаплаз-мозом 35,4 % выделенных штаммов являлись аэробами, 64,6 % – облигатными и факультативными анаэробами.
■ Больные без уреаплазмоза
■ Больные с уреаплазмозом
ч
Рис. 5. Выявляемость анаэробных представителей микрофлоры влагалища у больных миомой матки
У женщин с миомой матки среди анаэробов доминировали бактероиды, которые наблюдались в 92,9 % случаев (5,08± ±0,37 lg КОЕ/мл), в группе без уреаплазмо-за бактероиды выявлены в 80,3 % случаев (7,67±0,37 lg КОЕ/мл) (рис. 5).
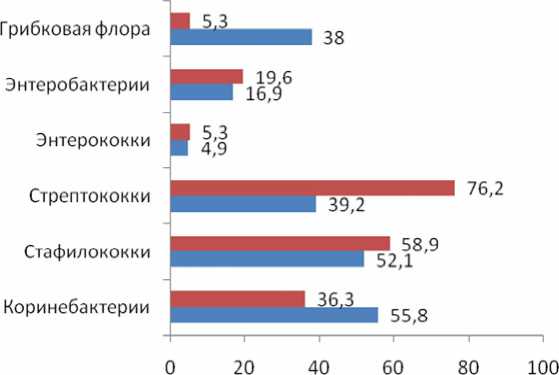
Среди аэробов у женщин с уреаплазмозом достоверно чаще выявляли коринебактерии – в 55,8 % случаев (31,48±0,63 lg КОЕ/мл); без уреаплазмоза – в 36,3 % случаев (2,04± ±0,16 lg КОЕ/мл) (рис. 6).
Следовательно, увеличение количества транзиторной и снижение уровня облигатной флоры свидетельствуют о нарушении микробиоценоза влагалища и поддержании хронического воспалительного процесса.
Значительный интерес представляло вы- явление у женщин особой группы микроорганизмов, обладающих митогенной активностью, – микоплазм, хламидий, вирусов, грибов и простейших.
Обращает на себя внимание тот факт, что во влагалищном содержимом было обнаружено три вида микоплазм: Mycoplasma geni-talium, Ureaplasma urealyticum и Mycoplasma hominis. Однако частота их выявления колебалась от 51,6 % для U. Urealyticum до 21,1 % для M. genitalium (р<0,05) от всех выделенных штаммов микоплазм (табл. 2).
Наиболее частыми ассоциантами урогенитального уреаплазмоза являлись хламидиоз, герпетическая инфекция и кандидоз (табл. 3).
-
■ Больные без уреаплазмоза
-
■ Больные с уреаплазмозом
%
Рис. 6. Выявляемость аэробных представителей микрофлоры влагалища у больных миомой матки
Результаты выявления микоплазм во влагалищном содержимом женщин с миомой матки
Сопутствующие уреаплазмозу урогенитальные инфекции у женщин с миомой матки
Таблица 2
|
Инфекционные агенты |
Количество больных |
|
|
абс. число |
% |
|
|
Mycoplasma genitalium |
40 |
21,1 |
|
Mycoplasma hominis |
52 |
27,3 |
|
Ureaplasma urealyticum |
98 |
51,6 |
Таблица 3
|
Сопутствующая инфекция |
Количество больных |
|
|
абс. число |
% |
|
|
Герпетическая инфекция |
48 |
30,0 |
|
Кандидоз |
17 |
10,6 |
|
Хламидиоз |
76 |
47,5 |
|
Гонорея |
9 |
5,6 |
|
Трихомоноз |
8 |
5,0 |
|
Остроконечная кондилома |
2 |
1,3 |
Цитомегаловирус был выявлен у 8,9 %, вирус простого герпеса – у 21,6 %, папилломавирусы HPV16 – у 5,8 % и HPV18 – у 5,0 % женщин с миомой матки на фоне уреаплаз-моза.
Наличие у 84,2 % больных миомой матки микст-инфекции в сочетании с уреаплазмо-зом можно рассматривать как негативный фактор. Так, сами микроорганизмы, их структурные компоненты и продукты метаболизма обладают онкопотенцирующими иммуносупрессивными свойствами. Все это создает условия для развития миомы матки и ее прогрессирования.
Изучение микробиоты влагалища у женщин с миомой матки на фоне уреаплазмоза показало, что у этих пациенток отмечается значительное нарушение микробиологической системы, проявляющееся достоверным расширением спектра микроорганизмов с преобладанием анаэробных бактерий.
Выявленное увеличение количества транзиторной и снижение уровня облигатной микробиоты свидетельствует о выраженном нарушении микробиоценоза влагалища.
Изучение популяционного и субпопуляционного состава лимфоцитов у обследованных женщин показало следующее (табл. 4).
Таблица 4
|
Показатель |
Группа сравнения |
Больные миомой матки |
|
|
с уреаплазмозом |
без уреаплазмоза |
||
|
CD3-лимфоциты, ×109/л |
1,62±0,08 |
1,320±0,074** |
1,49±0,06 |
|
CD4-лимфоциты, ×109/л |
0,93±0,07 |
0,53±0,12*** |
0,78±0,09 |
|
CD8-лимфоциты, ×109/л |
0,60±0,04 |
0,59±0,06 |
0,56±0,07 |
|
CD4/CD8 (иммунорегуляторный индекс) |
1,34±0,08 |
1,07±0,04* |
1,22±0,07 |
Примечание. * – р<0,05;** – р<0,01;*** – р<0,001 по отношению к группе без уреаплазмоза.
Популяционный и субпопуляционный состав Т-лимфоцитов у больных миомой матки
У женщин с миомой матки и уреаплаз-менной инфекцией сформировалась статистически значимая CD3+ и CD4+ Т-лимфоци-топения. Содержание СD3-лимфоцитов было снижено до (1,320±0,074)·109/л (в группе сравнения – (1,62±0,08)·109/л; р<0,01), CD4-лимфоцитов – до (0,53±0,12)·109/л (в группе сравнения – (0,93±0,07)·109/л; р<0,001).
Иммунорегуляторный хелперно-супрес-сорный индекс CD4/CD8 в группе больных с уреаплазмозом был достоверно снижен – 1,07±0,04 (в группе сравнения – 1,34±0,08; р<0,05).
Депрессия реакций клеточного иммунитета у больных с миомой на фоне уреаплаз-моза создает условия для развития опухолевого процесса и урогенитальной инфекции.
Снижение числа лимфоцитов с хелперной активностью может влиять на образование специфического гуморального иммунитета и выработку цитокинов.
Таким образом, полученные результаты свидетельствуют о депрессии клеточных механизмов защиты, которые играют важную роль в формировании устойчивости к мембранным патогенам – микоплазмам и тормозят митотическую активность эукариотических клеток. Для оценки показателей гуморального звена иммунной системы у женщин с миомой матки и генитальным уреаплазмо-зом определяли содержание В-лимфоци-тов (CD20+-клетки), а также уровень IgА, IgМ, IgG в крови у обследованных женщин (табл. 5).
Таблица 5
|
Показатель |
Группа сравнения |
Больные миомой матки |
|
|
с уреаплазмозом |
без уреаплазмоза |
||
|
СD20+-лимфоциты, ×109/л |
0,29±0,04 |
0,22±0,04 |
0,28±0,04 |
|
IgА, г/л |
2,36±0,06 |
1,41±0,05*** |
2,32±0,06 |
|
IgМ, г/л |
1,73±0,16 |
1,57±0,14 |
1,78±0,15 |
|
IgG, г/л |
12,20±1,36 |
7,22±1,50* |
7,20±1,25 |
Примечание. * – р<0,05; ***– р<0,001 по сравнению со здоровыми женщинами.
Содержание CD20+-лимфоцитов и сывороточных иммуноглобулинов
Уровень IgG был снижен в 1,6 раза (р<0,05). У больных женщин с уреаплазмо-зом наблюдалось также выраженное снижение IgА – до 1,41±0,05 г/л при 2,36±0,06 г/л (р<0,05) в группе сравнения.
Данные показатели свидетельствуют о снижении специфического иммунного ответа и местного иммунитета, что способствует развитию и поддержанию хронической урогенитальной инфекции.
Цитокины инициируют и регулируют иммунный ответ, индуцируют воспаление, апоптоз и многие другие биологические реакции. Нами изучен цитокиновый профиль у женщин с миомой матки и уреаплазмозом.
Так, уровень ИЛ-1 β у обследованных пациенток был в 2,8 раза выше, чем у здоровых женщин (р<0,001), содержание ИЛ-2 составило 90,7±9,4 пг/мл (без уреаплазмоза – 20,8±1,8 пг/мл). Показатель ИЛ-8 у женщин с уреаплазмозом был понижен до 6,4±1,2 пг/мл, у женщин без уреаплазмоза – до 8,3±0,6 пг/мл (в группе сравнения – 9,8±1,5 пг/мл; р<0,05) (табл. 6).
Таблица 6
|
Показатель |
Здоровые (группа сравнения) |
Больные миомой матки |
|
|
с уреаплазмозом |
без уреаплазмоза |
||
|
ИЛ-1 β |
24,4±0,9 |
68,1 ±1,4*** |
26,2±0,7 |
|
ИЛ-2 |
21,6±2,4 |
90,7±9,4*** |
20,8±1,8 |
|
ИЛ-6 |
4,9±0,5 |
4,5±0,8 |
4,7±0,9 |
|
ИЛ-8 |
9,8±1,3 |
6,4±1,2* |
8,3±0,6 |
|
ФНО-а |
1,1±0,1 |
1,0±0,1 |
1,1±0,2 |
Примечание. * – р<0,05; *** – р<0,001 по сравнению со здоровыми лицами.
Содержание провоспалительных цитокинов в периферической крови у обследованных женщин, пг/мл
Уровень цитокинов, обладающих противовоспалительным действием, достоверно повышался у больных миомой матки и уреа-плазмозом по сравнению со здоровыми жен- щинами (табл. 7). У женщин с миомой матки без уреаплазмоза колебания уровня цитокинов были статистически недостоверны.
Уровень противовоспалительных цитокинов в периферической крови обследованных женщин, пг/мл
Таблица 7
|
Показатель |
Здоровые (группа сравнения) |
Больные миомой матки |
|
|
с уреаплазмозом |
без уреаплазмоза |
||
|
ИЛ-4, |
3,9±0,1 |
14,1±1,2*** |
4,7±0,8 |
|
ИЛ-10 |
16,7±0,8 |
35,4±1,1*** |
17,2±1,3 |
Примечание. ***– р<0,001 по сравнению со здоровыми лицами.
У женщин с миомой матки и уреаплазмо-зом содержание ИЛ-4 повышалось до 14,1±1,2 пг/мл (у здоровых – 3,9±0,1 пг/мл; р<0,01). Величина показателя ИЛ-10 значительно увеличивалась – до 35,4±1,0 пг/мл (у здоровых – 16,7±0,8 пг/мл; р<0,01). У больных миомой матки и уреаплазмозом было повышено содержание как провоспалительных (ИЛ-1 β , ИЛ-2), так и противоспалительных (ИЛ-4, ИЛ-10) цитокинов, что может приводить к иммунопатологическим реакциям.
Патогенез миомы матки остается не до конца изученным. Установлено, что образование зачатка миоматозного узла может происходить из перицитов – мышечной оболочки тонкостенного сосуда матки. Однако до настоящего времени не известно, относится ли миома матки к истиной доброкачественной опухоли или к так называемому опухолевидному образованию [11].
Бактериоскопические и бактериологические исследования удаленных миоматозных узлов, проведенные рядом исследователей, указывают на наличие ассоциированной микробной флоры в них в отличие от окружающих неизмененных тканей матки. Идентификация флоры с помощью ПЦР показала присутствие в миоматозных узлах возбудителей ИППП ( Ureaplasma urealyticum ) при их отсутствии в нижележащих отделах половых путей на момент обследования. Это позволило рассматривать миоматозные узлы как реактивные пролифераты вокруг очагов персистирующей инфекции.
Ультразвуковая картина больных миомой характеризовалась преобладанием смешанной формы локализации фиброматозных узлов над остальными (мышечной, слизистой и подслизистой локализаций). Доминирование фиброматозных узлов средних размеров может быть связано с особенностями цито-кинового профиля. Как показали иммунологические исследования, быстрый темп роста миомы матки связан с усилением синтеза фактора роста TGFβ [12].
Обращает на себя внимание высокая ин-фицированность микоплазмами женщин с миомой матки. На фоне выделения трех видовых форм микоплазм во влагалищном содержимом ( Мусор1аsта genitalium, Ureaplas-ma urealyticum и Ureaplasma hominis ) значительно превалировал вид U. Urealyticum.
Из 190 женщин у 84,2 % урогенитальный уреаплазмоз был ассоциирован с другими урогенитальными инфекциями: в виде моноинфекции уреаплазмы были обнаружены у 15,8 % пациенток; при смешанной форме урогенитальный уреаплазмоз протекал на фоне хламидиоза (45,3 % женщин), герпесвирусной инфекции (30,5 %) и кандидоза (12,3 %).
Такая смешанная микробно-вирусногрибковая инфекция является мощным триггерным фактором для активации Toll-рецепторов, в частности TLR2, что способствует развитию и поддержанию хронического воспаления с привлечением патологических процессов: аллергических, пролиферативных [13].
Анализ полученных нами результатов иммунологического обследования дает основание говорить о существенных изменениях в деятельности иммунной системы у больных миомой матки. Они касаются всех звеньев защиты – фагоцитарного, гуморального, клеточного, а также иммунорегуляторного. Последнее может быть связано с депрессией образования активных форм кислорода и антимикробных пептидов за счет нарушения экспрессии Toll-подобных рецепторов [14]. Можно полагать, что все это и обусловило развитие дисбиоза, присоединение микст-инфекции с доминированием урогенитальных микоплазм. За счет постоянного образования патогенассоциированных молекулярных паттернов возможна стимуляция пролиферативных процессов в миометрии с последующим образованием миомы [15].
Заключение. У обследованных нами больных с миомой матки и уреаплазмозом выявлено достоверное снижение не только общего пула лимфоцитов, но и числа зрелых T-лимфоцитов (CD3+- и CD4+-киллерных клеток), а также уменьшение хелперно-супрессивного коэффициента (CD4/CD8), что свидетельствует о выраженной иммуносупрессии клеточного иммунитета и его имму-норегуляторной функции. Можно полагать, что у данной группы больных имеет место развитие количественно-качественной недостаточности клеточных факторов иммунитета, которые могут создавать предпосылки к развитию аутоаллергических и пролиферативных процессов.
Внутриклеточные патогены различных видов (вирусы, бактерии, грибы) подавляют эффективный клеточный ответ Thl-типа двумя способами: нарушая синтез ИЛ-12 или стимулируя ИЛ-10 и TCF-P антигенпредстав-ляющими клетками [15]. Данный факт был установлен у обследуемой группы женщин. Так, выявлено повышение уровня ИЛ-10 и, как следствие, снижение клеточного иммунитета. Повышенная продукция макрофагальных цитокинов (ИЛ-1β и ИЛ-10), а также ИЛ-2 может приводить к подавлению противоопухолевого иммунитета и быстрому росту миомы матки. Высокая локальная продукция ИЛ-10 может нарушать иммунный надзор в миометриии, приводить к усилению процессов клеточной пролиферации в миоматозном узле.
Список литературы Патогенетические аспекты развития миомы матки у женщин с уреаплазменной инфекцией
- Гриценко Я.В., Константинова О.Д., Черкасов С.В. Миома матки в современном мире: актуальные вопросы патогенеза, диагностики и лечения. Бюллетень Оренбургского научного центра УрОРАН. 2012; 3: 5.
- Железнякова Г.Ф. Инфекция и иммунитет: стратегия обеих сторон. Медицинская иммунология. 2006; 8 (5-6): 597-614.
- Кисина В.И. Урогенитальные инфекции у женщин. М.: Медицина; 2005. 276.
- Точиев Г.Ф., Добрецова Т.Н., Алеев И.А. Интермиттирующая терапия симптомной миомы матки. Status praesens. 2015; 4: 29-34.
- Oliveira F.G., Abbeimassih V.G., Diamond M.P., Sterwart K.A. Jmpact of subserosal and intramural uterine fibroids that do not distort the endometrial cavity on the outcome of in vitro fertillzaton -intracytoplasmic sperm injection. Fertil. Steril. 2004; 81: 582-587.
- Тихомиров А.Л., Леденкова А.А., Батаева А.Е. Патогенетическое обоснование профилактики миомы матки. Вопросы гигнекологии, акушерства и перинатологии. 2011; 10 (1): 3-6.
- Fleischer R., Weston G.C., Vollenhoven B.J., Rogers P.A. Pathophysiology of fibroid disease: angiogenesis and regulation of smooth muscle proliferation. Best. Pract. Res. Clin. Obstet. Gynaecol. 2008; 22 (4): 603-614.
- Макаров О.В., Алешкин В.А., Савченко Т.Н. Инфекции в акушерстве и гинекологии. М.: МЕДпресс-информ; 2007. 464.
- Сидорова И. С., Унанян А.П., Коган Е.А., Макаров О.В. Миома матки у больных молодого возраста. Акушерство, гинекология и репродукция. 2010; 1: 16-20.
- Тарабрина Е.П. Иммунологические аспекты патофизиологических процессов у женщин с миомой матки на фоне уреаплазменной инфекции: автореф. дис.. канд. мед. наук. Ульяновск; 2009. 18.
- Namazov A., Karakus R., Gencer E. Dosubmucosis myoma characteristic saffectferthily and men strualaut come sinpatientsunderwent hysteroscopy myomectomy? Jran J. Reprod. Med. 2015; 13 (6): 367-372.
- Малышкина А.И., Посисеева Л.В., Сотникова Н.Ю. Локальные иммунные нарушения при быстром росте миомы матки. Журнал Рос. общества акушеров-гинекологов. 2004; 4: 33-35.
- Колганова И.А., Малышкина А.И., Посисеева Л.В. Взаимосвязь показателей локального иммунного ответа с темпом роста миомы матки. Russian J. of Immunology. 2005; 9 (2): 199-200.
- Darville T. Toll-likereceptor 2, but not Toll-likereceptor 4 isessential for development of oviduct pathology in chlamy dialgenital tract infection. J. Immunol. 2003; 171: 6187-6197.
- Соснина А.Е., Сотникова Н.Ю., Бойко О.М. Изменение экспрессии МРНКТGFB и IL-1P в ткани лейомиомы матки при быстром темпе роста опухоли. Рос. аллер. журнал. 2007; 3 (прил. 1): 257.


