Патогенетические механизмы регенерации дермы после имплантации нитей на основе полидиоксанона
Автор: Оразов М.Р., Сулаева О.Н., Старкова Е.Ю.
Журнал: Московский хирургический журнал @mossj
Статья в выпуске: 4 (56), 2017 года.
Бесплатный доступ
Статья посвящена изучению патогенетических механизмов регенерации кожи после имплантации нитей на основе полидиоксанона.цель исследования: расширить предоставления о патогенетических механизмах регенерации дермы после имплантации нитей на основе по- лидиоксанона.Дизайн: проспективное, независимое, плацебо-контролируемое исследование.Материалы и методы: Проведено проспективное, независимое, плацебо-контролируемое клинико-морфологическое исследование в период 2015-2017гг, в которое на условиях добровольного информированного согласия были включены 22 пациентов с возраст ассоциированными изме- нениями кожи, в возрасте от 35 до 50лет. Общеморфологическое исследование проводили при окраске гематоксилином и эозином, использовали гистохимическое окрашивание биоптатов по методу ван-Гизон, позволяющему визуализировать коллагеновые и эластические волокна дермы. Для оценки характера межклеточных коопераций различные линии клеток визуализировали при помощи иммуногистохимических (ИГХ) методик.Результаты исследования показали, что в основе морфогенетической перестройке кожи после имплантации нитей на основе полидиоксанона, лежит активация механизмов репарации через включение М2-макрофагов. Данный процесс проявляется ангиогенезом через стимуляцию экспрес- сии VEGF и реорганизацией сосудистого русла кожи, а стимуляцией собственного резерва клеток фибробластического ряда через активацию стро- мальной васкулярной фракции. Следует отметить, что помимо активации неоколлагеногенеза, ведущей к реструктуризации дермы и эпидермиса, введение нитей на основе полидиаксанона, оказывает позитивное влияние на баланс ММР/ТИМР, ограничивая механизмы деградации и способ- ствуя накоплению матрикса соединительной ткани дермы.Вывод: Результаты исследования позволяют сделать вывод о том, что нитевая имплантация с использованием нитей на основе полидиоксанона оказывает патогенетически обоснованный выраженный регенеративный эффект на дерму.
Нитевая имплантология, регенерация кожи, биостимуляция, тредлифтинг
Короткий адрес: https://sciup.org/142212753
IDR: 142212753 | УДК: 611.7-
Текст научной статьи Патогенетические механизмы регенерации дермы после имплантации нитей на основе полидиоксанона
Актуальность проблемы
В основе патогенетических механизмов, обеспечивающих старение кожи, лежат нарастающие со временем изменения основной клеточной популяции дермы – фибробластов. Речь идет о таких параметрах, как количество, пролиферативный потенциал, морфология и функциональная активность[1]. В норме их функция заключается в поддержании гомеостаза межклеточного матрикса дермы, а также обеспечении его ремоделирования и обновления при правильном соотношении синтеза новых компонентов дермы — коллагена, эластина и основного вещества, и их биодеградации [2]. Но это не все.
Важно отметить, что на сегодня выделяют отдельным звеном регенерацию, которая в целом является достаточно хорошо изученным стереотипным процессом, однако имеет свои особенности при различных изменениях/повреждениях кожи, в том числе и при старении. Различают следующие типы регенерации:
Регенерация репаративная – регенерация участков органов или тканей, погибших в результате травмы или какого-либо патологического процесса.
Регенерация патологическая – регенерация, характеризующаяся замедленным течением процессов заживления или избыточным развитием замещающей ткани.
Регенерация физиологическая – регенерация тканей, отмирающих в процессе нормальной жизнедеятельности организма.
Гистологические изменения включают изменения во всех слоях кожи. В первую очередь это отражается на структуре эпидермиса, толщина которого уменьшается за счет ограничения пролиферации кератиноцитов. Кроме того, заметно сглаживается эпидермо-дермальная граница вследствие уменьшения размеров сосочков и выраженности сосочкового слоя дермы в целом, что ассоциировано с дезорганизацией микроциркуляторного русла, предопределяющей ограничение трофики эпидермиса и детерминирующей его прогрессирующие изменения[3,4].
Значимые изменения происходят и в самой дерме. Процесс старения захватывает в первую очередь постмитотические компартменты дермы, представленные фи- бробластами и межклеточным веществом [5]. Одним из ключевых событий, обусловливающих старение кожи, ее дряблость и снижение механической прочность, является снижение синтеза коллагена. Не менее важным фактором старения кожи является снижение образования эластических волокон и типичный для стареющей кожи эластолиз в сосочковом и средней части сетчатого слоя дермы. Результатом уменьшения количества эластических волокон в дерме является потеря эластичности кожи. Данные изменения напрямую связаны со структурно-функциональной перестройкой ключевых клеток, продуцирующих компоненты матрикса дермы – фибробластов [4,5].
Следует отметить, что детальное исследование регенерации имеет не только фундаментальную, но и клиническую направленность, так как является основой для разработки оптимальных режимов и методов лечения при возраст ассоциированных изменениях кожи.
Доказательная научная база располагает рядом убедительных доказательств эффективности и безопасности технологии нитевого лифтинга. Примером тому является исследование Han SE et al (2016) [6]. Авторы провели оценку эффективности тредлифтинга нитями REEBORN (PrestigeMedicare, South Korea, Gyeonggi-do) на основании проспективного исследования результатов лечения возрастных изменений кожи 20 пациентов нитями REEBORN thread Lifting. Оценку результатов лечения проводили 3 независимых врача, которые учитывали выраженность носогубных складок и марионеточных линий. Кроме того, проведена оценка удовлетворенности пациентов результатами процедуры и наличия побочных эффектов на основе формализованного анкетирования. Зарегистрировано всего 2 осложнения, обусловленных данной манипуляцией. Пациенты продемонстрировали высокий уровень удовлетворенности результатами (≥80%)[6]. Эти данные созвучны с мнением других исследователей продемонстрировавших высокую эффективность и безопасность использования нитей на основе полидиоксанона для лечения возрастных изменений дермы [7].
В свете сказанного небезынтересными оказались результаты полученных в рамках исследования Savoia A. et al (2014) показавших высокую эффективность и безопасность использования новых синтетической монофиламентных поддерживающих нитей «Happy Lift™ Revitalizing» для лечения возрастных изменений кожи [8]. В ходе работы авторы оценивали результаты нитевой имплантации через 24 месяцев у 37 пациентов с умеренными признаками старения кожи.
Результаты исследования продемонстрировали, что у большинства пациентов (89%) полученный результат оценили, как удовлетворительный. Только у 6% пациентов отмечена слабая постимплантационная асимметрия[8].
Суммируя данные о результативности нитевой имплантации, следует констатировать факто о том, что резуль- татом прогресса стало появление нитей с насечками или конусами способных перемещать мягкие ткани лица. Изменилось и отношение к материалу, из которого изготовлены нити. Ключевым вектором развития стал переход от не рассасывающиеся нитей из полипропилена к биосовместимым абсорбируемым материалам. Это привело к разработке и внедрению нитей на основе поли-L-молочной кислоты и полидиоксанона. Последние на сегодняшний день вызывают огромный интерес, не только в силу доказанной эффективности и безопасности (нити утверждены к использованию FDA), но и благодаря выраженному морфогенетическому влиянию на кожу лица[8.9].
Полидиоксанон(ПДО) – прочный синтетический моно-филаментный материал, абсорбируемый в течение 4-6 месяцев (в зависимости от толщины). Они прочные, гибкие, упругие, гидрофобные. Разрушение полидиоксанона происходит путем гидролиза с образованием СО2. ПДО-нити биосовместимы, не обладают антигенными и пирогенными свойствами.
Suh DH (2015) полагает, что стимуляция регенерации кожи нитями на основе полидиоксанона – безопасный и эффективный метод, сопряженный с минимальными осложнениями. Результаты проспективного исследования эффективности нитевой имплантации с привлечением независимых экспертов показало, что у большей части пациентов (более 80%) эстетические ожидания от процедуры были оправданы. Распространенность осложнений была низкой[9].
При этом следует отметить, что большинство исследований эффективности нитевой имплантации базируются на данных оценки удовлетворенности пациентов и субъективной оценки врачами.
В этой связи следует подчеркнуть, что за рамками исследований остаются патогенетические механизмы, основанные на регенеративном потенциале клеточного пула после имплантации нитей на основе ПДО. Вместе с тем, следует подчеркнуть, что при анализе морфологических эффектов нитей на основе полидиаксанона, лежит его важное преимущество -значимое регенеративное действие. В данном аспекте, механизмы биостимулирующих эффектов нитей на основе полидиоксанона являются практически не изученными.
Обобщая данные литературы, можно предположить, что практически не изучена морфогенетическая основа регенераторных возможностей клеток кожи после имплантации нитей на основе ПДО, что и определило выбор цели настоящего исследования.
Цель исследования расширить предоставления о патогенетических механизмах регенерации дермы после имплантации нитей на основе полидиоксанона.
Материал и методы исследования
Проведено проспективное, независимое, плацебо-кон-тролируемое клиническое исследование в период 2015-
2017гг, в которое на условиях добровольного информированного согласия были включены 22 пациентов с возраст ассоциированными изменениями кожи, в возрасте от 35 до 50лет. Панч-биопсию проводили до и через 2 недели и 1,5; 3 месяцев после имплантации нитей на основе полидиоксанона. Основную группу составили биоптаты, полученные из переднебоковой поверхности живота после имплантации нитей на основе полидиоксанона (ПДО) Lead Fine Lift с использованием иглы проводника. Для морфологического контроля использовали анализ результатов панч-биопсии у тех же пациенток, из аналогичных зон только с контрлатеральной стороны, который выполняли путем введения иглы проводника на аналогичную глубину и на протяженность без нитей с использованием в качестве плацебо 0,9% раствора NaCl2. Общеморфологическое исследование проводили при окраске гематоксилином и эозином, использовали гистохимическое окрашивание биоптатов по методу ван-Гизон, позволяющему визуализировать коллагеновые и эластические волокна дермы.
Для оценки характера межклеточных коопераций различные линии клеток визуализировали при помощи иммуногистохимических (ИГХ) методик. Для оценки источника ангиогененных сигналов в коже в динамике оценивали экспрессию фактора роста сосудистого эндотелия (VEGF) (Clone VG1, code No. M7273, DAKO, Дания). Для оценки состояния сосудов использовали МАТ к α-актину гладких миоцитов (α-SMA) (Clone αsm-1; DAKO, Дания). А также была проведена оценка количества и распределения эндотелио-цитов сосудов (CD31), включая активированный эндотелий (CD105), отражающий активацию ангиогенеза («Diagnostic BioSystems», США). Анализе процессов ремоделирования матрикса осуществляли на основе оценки баланса экспрес- сии металлопротеиназ руководствовались методикой Баринова Э.Ф., Сулаевой О.Н.
Для «демаскировки» антигенов регидратированные срезы подвергали термической обработке в растворе Target Retrieval Solution (DAKO, Дания) с использованием бытовой микроволновой печи Samsung CE118KFR при 450W 3 раза по 3,5 мин. После блокирования эндогенной пероксидазной активности пероксидазным блоком (DAKO) и неспецифического связывания белков протеиновым блоком (DAKO) наносили первичные антитела (RTU). Визуализацию первичных антител проводили с помощью полимерной системы детекции DAKO EnVision+. В качестве субстрата для пероксидазы хрена использовали DAB+ (DAKO). Препараты докрашивали гематоксилином Майера. Далее окрашенные срезы заключали в полусинтетической среде Permanent Mounting Medium (DAKO).
С целью объективизации морфологического исследования использовали комплексный морфометрический анализ, который проводили с помощью специального программного обеспечения ImageTool version 3.0. и графического редактора Adobe Photoshop CS4 Extended v.11.0.1. Снимки выполняли на микроскопе Olympus BX51 с цифровой камерой DP70 (Olympus, Япония).
Результаты исследования и их обсуждение
Исследованны биоптаты кожи, полученной путем панч-биопсии у пациентов с возрастными изменениями кожи до имплантации нитей на основе ПДО. Анализ морфологии продемонстрировал наличие типичных признаков старения. Определены сглаженность эпидермо-дермальной границы и слабое развитие сосочкового слоя дермы, при этом обращали на себя внимание неравномерное кровенаполнение сосудов поверхностного и глубокого дермального сплетения.
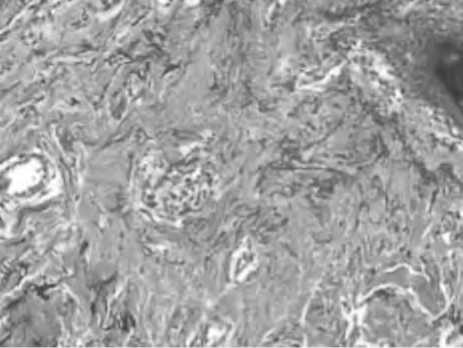
Рис. 1. Изменение гистоархитектоники кожи при старении. Коллагеновые и эластические волокна дермы. Окраска по методу Ван Гизон
А – молодая кожа, Б – возрастные изменения в коже
Далее в ходе исследования обнаружено, что эпидермис характеризовался неравномерным скоплением меланоцитов, вакуолизацией цитоплазмы отдельных кератиноцитов. Сетчатый слой дермы характеризовался снижением плотности фибробластов. Было отчетливо видно, что ядра последних были гиперхромными, в ряде случаев выявлялись признаки фрагментации клеток и ацеллюлярные участки. В межклеточном веществе дермы определялись снижение плотности коллагеновых волокон, их дезорганизация, а также явления эластолиза. Эти результаты соответствуют данным литературы, свидетельствующим о превалировании деградации матрикса над синтетическими процессами [10]. Интересно, что последнее связывают не только с уменьшением количества фибробластов, но и с изменением спектра секретируемых ими продуктов, которое убедительно показано в результатах исследований Waldera L. et al., (2015) [11]
Анализ морфологии кожи продемонстрировал, что в дерме определялась умеренная инфильтрация – преимущественно в периваскулярном регионе. Кроме того, лимфоги-стиоцитарные инфильтраты были выявлены и вокруг придатков кожи – желез и волосяных фолликулов, к тому же в последних определялись признаки дистрофии клеток. Все это позволяет судить, во-первых, о наличии признаков инфильтрации и развитии вяло текущего хронического воспаления, что закономерно, учитывая данные литературы о повышении экспрессии провоспалительных молекул, включая NF-kB и серии провоспалительных цитокинов не противоречит данным Salminen A Kauppinen et al., (2012) [12] в коже при старении. Во-вторых – понятно, что воспалительный процесс, как правило, сопряжен с нарушением микроциркуляции и трофики клеток.
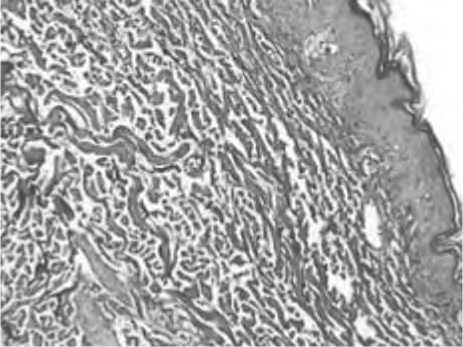
Редукция сосудистого русла дермы у пациенток с возрастными изменениями закономерна, что подтверждает иммуногистохимическая оценка биоптатов кожи, полученная в ходе
Б
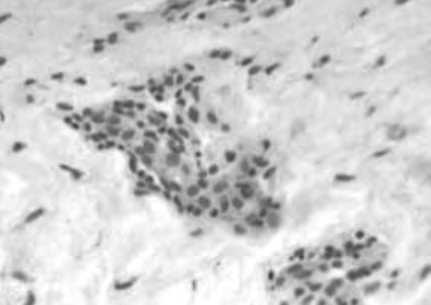
Рис. 2. Инфильтрация периваскулярного региона в области поверхностного (А) и глубокого (Б) сосудистого сплетения дермы у пациенток с возрастными изменениями кожи. Окраска гематоксилином и эозином. Ув. 200
А

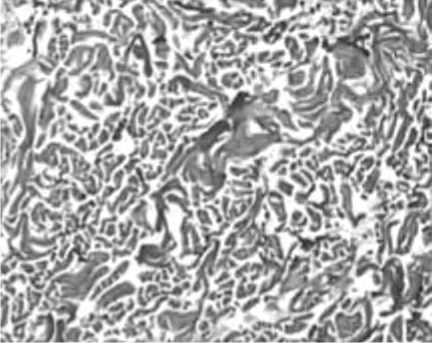
Рис. 3. Сетчатый слой дермы у пациенток с возрастными изменениями кожи. Уменьшение количества фибробластов, снижение плотности коллагеновых волокон, эластолиз, дезориентация волокон.
А – окраска гематоксилином и эозином. Б – окраска по методу Ван Гизон.
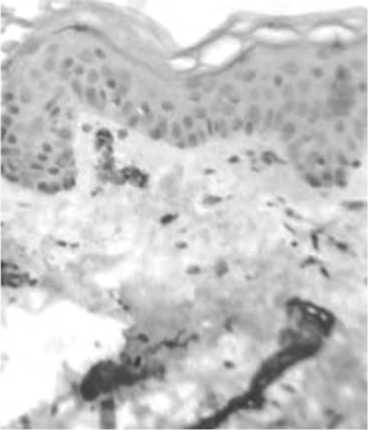
Рис. 4. Сосудистое русло кожи с возрастными изменениями.
Снижение плотности эндотелиальных клеток в сосочковом слое дермы (А), превалирование неактивных эндотелиоцитов (Б). А – иммуногистохимическое исследование с использованием моноклональных антител к CD31, Б – МАТ к CD105.
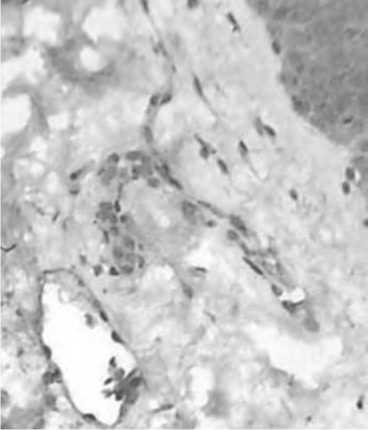
настоящего исследования. Вместе с тем, следует отметить, что низкая плотность сосудов в поверхностном слое дермы была ассоциирована с отсутствием экспрессии CD105, отражающем активность эндотелия и ангиогенеза в целом.
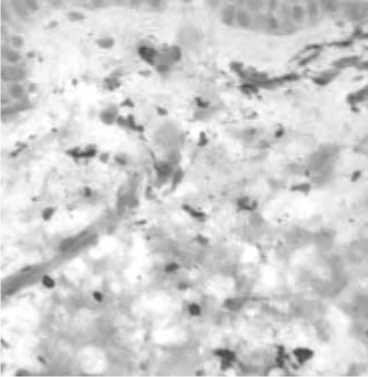
Рис. 5. Макрофаги дермы кожи с возрастными изменениями. Иммуногистохимическое исследование с использованием МАТ к CD68
Интересно, что оценка экспрессии CD68 также оказалась весьма информативной, продемонстрировав наличие значимого количества макрофагов (6,4±0,35; 95% ДИ 5,66 - 7,14) как в сосочковом, так и в сетчатом слоях дермы. Анализ распределения иммунопозитивных клеток показал их превалирование вблизи сосудов, что было ассоциировано с явлениями периваскулярной инфильтрации. Помимо этого, выявлялись диффузно расположенные свободные интерстициальные макрофаги, вероятно вовлеченные в процессы деградации матрикса дермы.
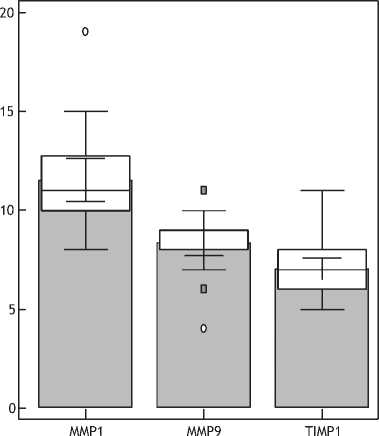
Закономерно, что провоспалительные изменения в дерме кожи отражались на балансе процессов продукции и деградации матрикса в сторону последнего. Этот вывод подтверждался в данном исследовании результатами анализа экспрессии матриксных металлопротеиназ (ММР-1 и ММР-9) и их ингибитора ТИМР-1.
Следует отметить, что возрастные изменения в дерме сопровождались увеличением экспрессии не только ММР-9 (6,87±0,79; 95% ДИ 5,71 - 7,98), более характерной для макрофагов, но и ММР-1 (11,52±1,32; 95% ДИ 8,92-13,76), экспрессируемой преимущественно в фибробластах (рис. 6). Тогда как экспрессия TIMP1 была слабо выраженной и варьировала в разных участках дермы.
Таким образом, с возрастом в коже имеет место перестройка эпидермиса и дермы, статус которых важно учитывать при проведении терапевтических манипуляций, направленных на стимуляцию кожи. Комплекс возраст-ассоциированных изменений в коже включает перестройку сосудистого русла и развитие провоспалительных изменений, сдвиг контроля объема матрикса в сторону деградации за счет повышения экспрессия ММР-1 и ММР-9 при низком уровне ТІМР-1, сопровождающихся снижением количества фибробластов и объема матрикса соединительной ткани дермы.
Анализ морфологии кожи через 2 недели после введения ПДО-нитей в сравнении с группой плацебо выявил ряд интересных фактов, отражающих реакцию кожи на повреждение вследствие пенетрации тканей и на сам имплан-


Рис. 6. Распределение клеток, экспрессирующих ММР1 (А), ММР (9), TIMP1 (В) и их количественное соотношение (Г) в коже при возрастных изменениях.
Примечание. В рис. 6Г по оси ординат — изучаемые молекулы, по оси абсцисс — количество клеток в поле зрения.
Г
тируемый материал. При анализе и интерпретации морфологических изменений в коже мы исходили из следующих известных фактов: 1) кожа представлена обновляющимися тканями с резервом стволовых клеток и высокой способностью к регенерации; 2) повреждение кожи запускает стереотипную морфогенетическую программу, аналогичную заживлению ран; 3) учитывая классическую хронологию процесса заживления, через 14 суток после повреждения имеет место завершение фазы репарации с последующей активацией ремоделирования дермы.
По факту, в биоптатах основной группы было выявлено увеличение плотности расположения клеток сосочкового и сетчатого слоев дермы. Этот феномен был в первую очередь связан с перестройкой сосудистого русла кожи. В сосочковом слое дермы было отмечено увеличение плотности капилляров и умеренный интерстициальный отек. Последнее
Рис. 7. Периваскулярная инфильтрация и умеренный отек в зонах поверхностного и глубокого сосудистого сплетения через 14 суток после введения нитей. Окраска гематоксилином и эозином. Ув. 200.
Б
сопровождалось явлениями вакуолизации кератиноцитов. Хотя параллельно этому отмечалось увеличение площади эпидермо-дермального соединения и плотности клеток в базальном слое эпидермиса, опосредованно отражающее усиление пролиферативных процессов. Аналогичная сосудистая реакция был выявлена и в глубоких отделах дермы. Интересно, что вдоль сосудов поверхностного сосудистого сплетения и вокруг сосудов глубокого сосудистого сплетения отмечалось увеличение плотности клеток за счет умеренной инфильтрации.
Иммуногистохимический анализ вывил, что перестройка сосудистого русла в поверхностном и глубоком слоях дермы была связана с увеличением количества CD68-позитивных клеток, то есть макрофагов, более, чем в 3 раза (p<0,001). Последние у пациентов после имплантации ПДО-нитями превалировали в периваскулярном регионе, и в отличии такового в группе морфологического сравнения, редко встречались в свободном виде в сетчатом слое дермы.
Аналогичное увеличение количества СD68-позитивных клеток (в 3,3 раза; p<0,001) имело место и в биоптатах группы сравнения (рис. 9). Однако при этом распределение макрофагов носило несколько иной характер.
А
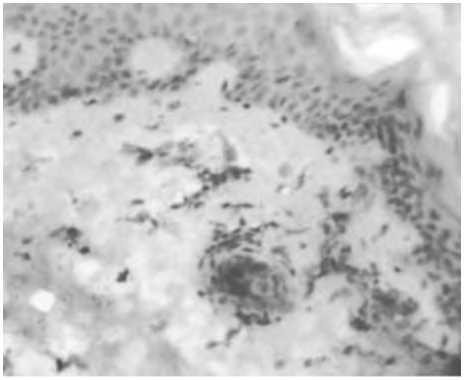
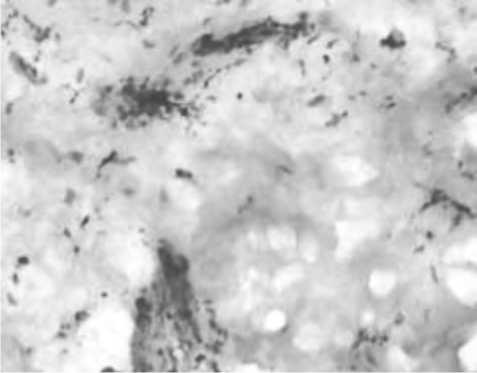
Рис. 8. Увеличение количества макрофагов вокруг сосудов поверхностного (А) и глубокого (Б) сосудистого сплетения дермы через 14 сут после введения ПДО-нитей. Иммуногистохимическое исследование с МАТ к СD68
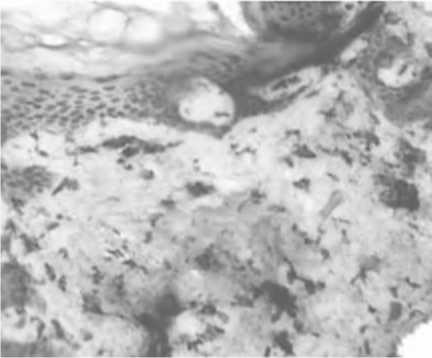
Рис. 9. Увеличение количества CD68-позитивных клеток при ложном лифтинге. Иммуногистохимическое исследование с использованием МАТ к CD68. Ув. 200.
Б
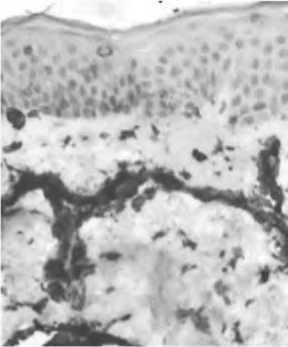
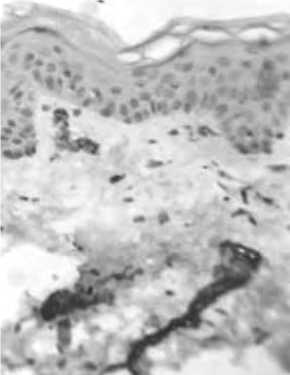
Рис. 10. Увеличение суммарного количества сосудов в дерме по СD31.
Примечание: А – до введения нитей, Б – через 14 суток после введения нитей.
Последние выявлялись как в периваскулярном регионе, так и свободно – в соединительной ткани сосочкового и сетчатого слоев дермы.
В трактовке полученных результатов возникает закономерный вопрос: о чем свидетельствует увеличение количества макрофагов в дерме на 14 сутки после нитевой имплантации? Означает ли это пролонгирование воспалительной реакции? Ответ на данный вопрос был получен изучении маркеров сосудистого эндотелия.
Оказалось, что уже через 2 недели после проведения ни-тевого лифтинга, в дерме определяется увеличение количества эндотелиоцитов (CD31+ клеток; p<0,01), что собственно объясняет повышение количества сосудов (рис. 10).
Несомненно, развитие данной реакции было напрямую ассоциировано с повышением количества CD105+ активного эндотелия на 137% (p<0,001) и усилением экспрессии VEGF (рис. 11). Характерно, что источником ангиогенных сигналов при введении ПДО-нитей, был как эпидермис кожи, так и клетки периваскулярной зоны дермы (рис. 11В).
Выявленная ассоциация между клеточной реакцией в периваскулярном компартменте за счет макрофагов и стимуляцией ангиогенеза, по сути, означает 2 факта: 1) вероятно, увеличение количества макрофагов в дерме кожи через 14 суток происходит за счет М2-фенотипа макрофагов; 2) макрофаги принимают участие в перестройке сосудистого русла кожи при тредлифтинге ПДО-нитями, являясь одним из источников продукции VEGF, стимулирующего ангиогенез.
Параллельно сосудистой реакции было отмечено увеличение количества клеток, ответственных за репарацию дермы – миофибробластов (p<0,001). Последние определяли по экспрессии α-SMA. Как известно, α-SMA экспрессируется в гладких миоцитах и миофибробластах. Поэтому при трактовке полученных данных учитывали локализацию α-SMA-позитивных клеток. Как видно на рис. 12, до введения нитей, экспрессия α-SMA обнаруживалась только вдоль сосудов поверхностного и глубокого сосудистого сплетения, что соответствовало расположению гладких миоцитов в стенке сосудов. Однако, через 14 суток после нитевой имплантации ПДО нитями, α-SMA+ клетки выявлялись не только вокруг сосудов, но и в виде свободных клеток (10,19±1,35), расположенных как сосочковом, так и в сетчатом слоях дермы. Это позволяет идентифицировать свободные клетки, как миофибробласты, хотя стоит отметить наличие пространственной ассоциации миофибробластов с сосудистым руслом кожи.
Ассоциация α-SMA-позитивных клеток с сосудами, вероятно, отражает тот факт, что основным источником формирования репаративного пула клеток фибробластического ряда являются собственные дермальные предшественники, а именно - перициты сосудов микроциркуляторного русла дермы. То есть регенерация дермы при нитевой имплантации нитями на основе ПДО происходит за счет мобилиза-
А
В
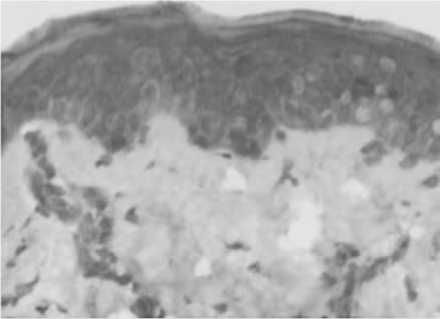
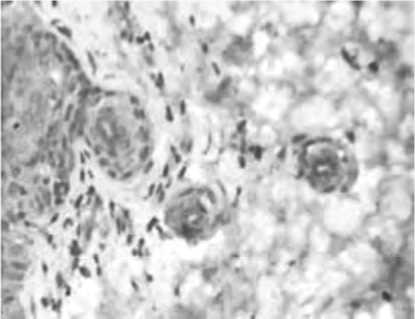
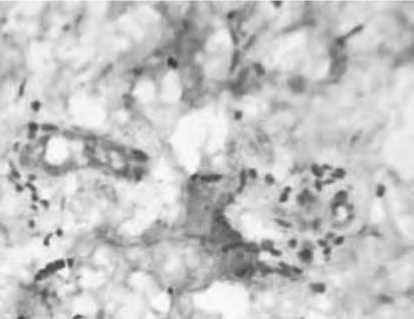
Рис. 11. Стимуляция ангиогенеза в поверхностных (А) и глубоких (Б) слоях дермы через 14 суток после введения ПДО нитей у пациенток с возрастными изменениями кожи.
Примечание: А и Б – иммуногистохимическое исследование с использованием МАТ к CD105, В – экспрессия VEGF.
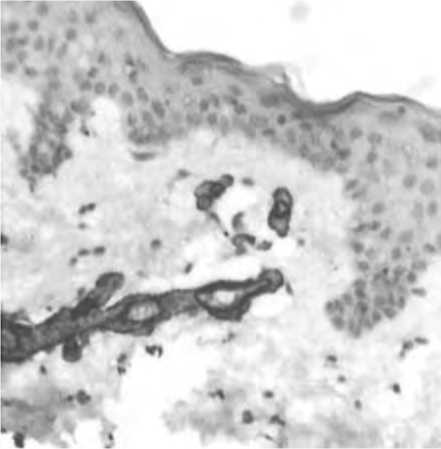
Б
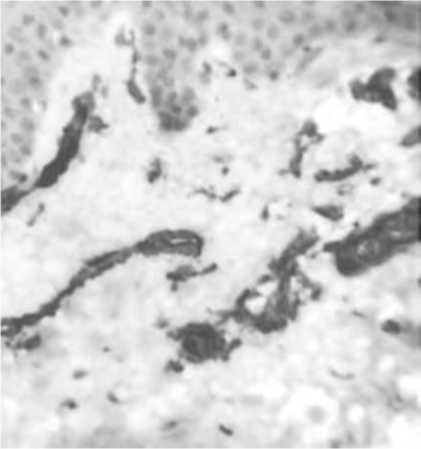
Рис. 12. α-SMA позитивные клетки в дерме пациенток с возрастными изменениями кожи до (А) и через 14 суток после тред-лифтинга ПДО нитями (Б). Иммуногистохимическое исследование. Ув. 200.
ции собственных резервов кожи вследствие стимуляции стромальной васкулярной фракции предшественников.
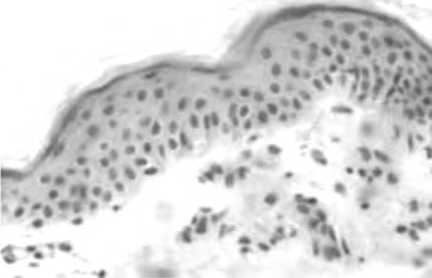
Интересно, что в ряде случаев была отмечена взаимосвязь между распределением α-SMA+ клеток с волосяными фолликулами, преимущественно в поверхностных зонах кожи, соответствующих локализации перешейку волосяных фолликулов, где расположены эпидермальные стволовые клетки (ЭСК). Последние, как известно, являются не только источником циклических изменений волоса, но и обеспечивают регенерацию межфолликулярного эпидермиса. Учитывая роль миофибробластов в поддержании жизнеспособности и стимуляции ЭСК, полученные факты позволяют сформулировать гипотезу, что стимуляция репаративного потенциала дермы через миофибробласты, может модулировать активность ЭСК, стимулируя в том числе морфогенез эпидермиса. Действительно, в эпидермисе кожи пациенток после имплантации нитями отмечалось увеличение плотности клеток, отражающей стимуляцию пролиферации, увеличение толщины эпидермиса в целом, в том числе за счет углубления гребешков и увеличения эпидермо-дермального соединения.
Хотя при этом стоит отметить, что в группе плацебо отмечалось увеличение α-SMA-позитивных клеток в дерме до 7,58±1,07, отражая стимуляцию репаративных процессов в коже после травматического повреждения. Однако, дальнейшая динамика показателей ремоделирования кожи выявила яркие различия в реакции тканей на механическое повреждение и введение нитей на основе ПДО.
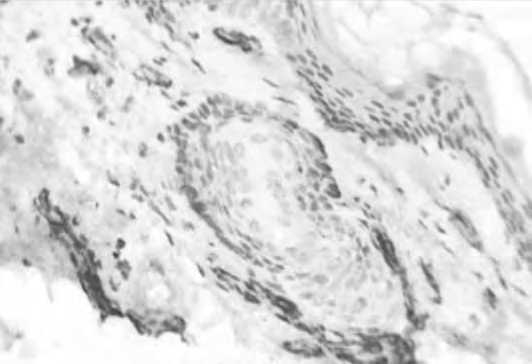
Рис. 13. Распределение α-SMA-позитивных клеток в дерме через 1,5 мес после имплантации нитей на основе ПДО.
Ассоциация миофибробластов с микроциркуляторным руслом и волосяным фолликулом.
Изучение морфологии кожи в панч-биоптатах через 1,5 и 3 мес после имплантации ПДО нитями показало наличие комплекса изменений, характеризующегося реструктуризацией как эпидермиса, так и дермы кожи. В ходе настоящего исследования установлено, что в эпидермисе отмечалось увеличение толщины за счет шиповатого слоя, углубление сосочков и гребешков, определяющее увеличение эпидермо-дермальной границы. Эти изменения были связаны с морфогенезом сосочкового слоя дермы, в котором отмечено увеличение плотности сосудов микроциркуляторного русла. При этом после нитевой имплантации по-прежнему определялось значимое количество CD105 позитивных клеток, отражая пролонгирование процесса ангиогенеза (рис. 14). Ситуация была противоположной в группе сравнения, где через 1,5 и 3 мес после введения плацебо активация эндотелия практически полностью нивелировалась.
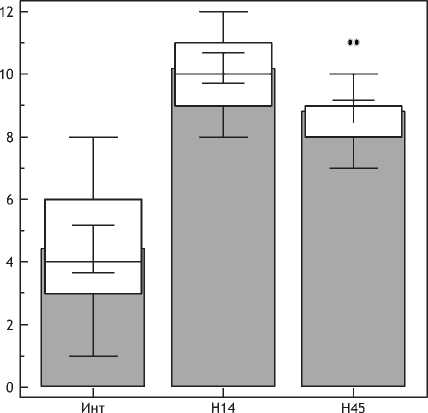
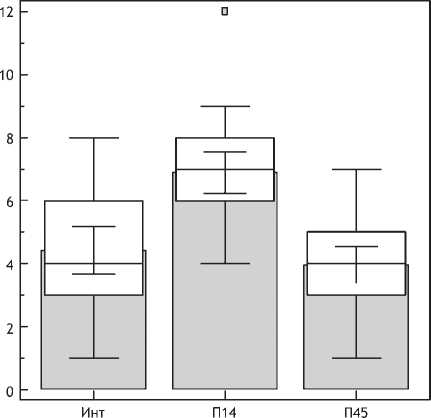
Рис. 14. Активация эндотелия при введении ПДО-нитей (А) и плацебо (Б).
Примечание. По оси абсцисс – сроки наблюдения (интактная кожа, через 14 и 1,5 и 3 месяца).
По оси ординат – количество CD105-позитивных клеток).
Параллельно перестройке сосудистого русла дермы, отмечались признаки продолжающегося ремоделирования дермы. Об этом свидетельствовало сохранение реакции миофибробластов, хотя количество макрофагов существенно снижалось по сравнению с предыдущим сроком исследования (Р<0,05), хотя по-прежнему было выше исходного уровня.
Междутем,следуетотметитьсохранениеэкспрессииVEGF как в клетках эпидермиса, так в и клетках дермы. (рис. 17).
При этом распределение экспрессии данного фактора роста через 1,5 мес после имплантации отличалась от пространственного паттерна макрофагов и миофибробластов. αSMA-иммунопозитивные клетки обнаруживались как в сосочковом, так и в сетчатом слое дермы, и по морфологическим характеристикам соответствовали фенотипу клеток фибробластического ряда. Это может свидетельствовать о роли миофибробластов в регуляции перестройки сосудистого русла кожи после нитевой имплантации.
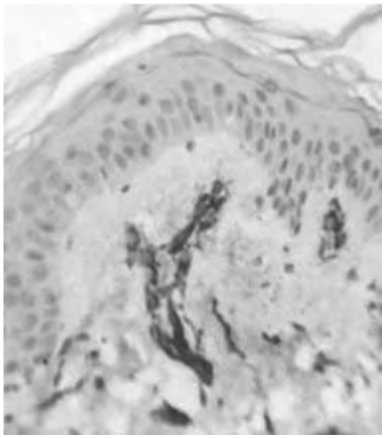
Рис. 15. Значительное количество сосудов (A) и миофибробластов (Б) (α-SMA+ клетки, не связанные с сосудами) в дерме кожи через 1,5 мес после введения ПДО нитей.
Иммуногистохимическое исследование с использованием МАТ к CD31 и α-SMA. Ув. 200.
Б
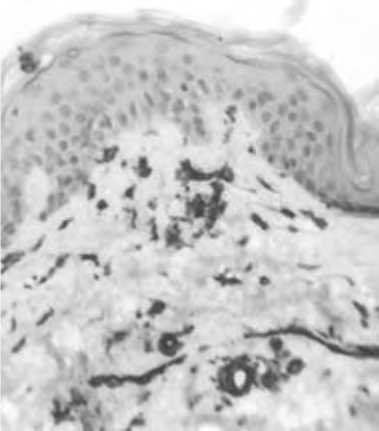
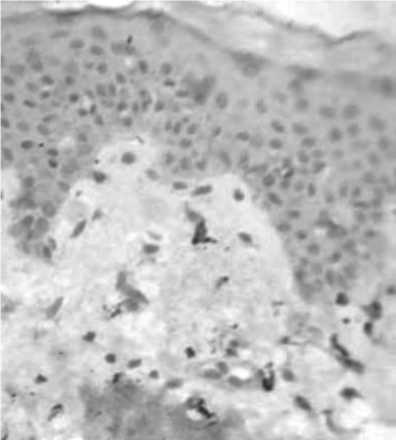
Рис. 16. Уменьшение количества макрофагов в дерме кожи через 1,5 мес после введения ПДО нитей.
Иммуногистохимическая окраска. Ув. 400.
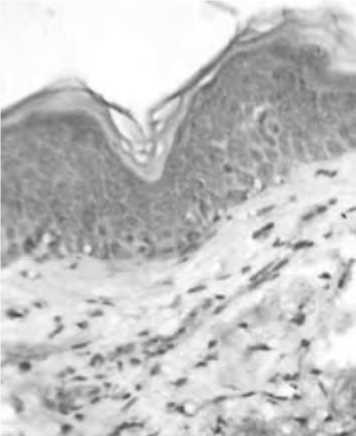
Рис. 17. Экспрессия VEGF через 1,5 мест после введения ПДО-нитей.
Иммуногистохимическое окрашивание. Ув. 200.
Суммарный анализ клеточных популяций дермы через 1,5 и 3 мес после нитевой имплантации выявил позитивную тенденцию в сторону сохранения численности клеток фибробластического ряда (показатель был в 2 раза выше, чем в группе сравнения) и ограничения пула макрофагов (рис. 18).
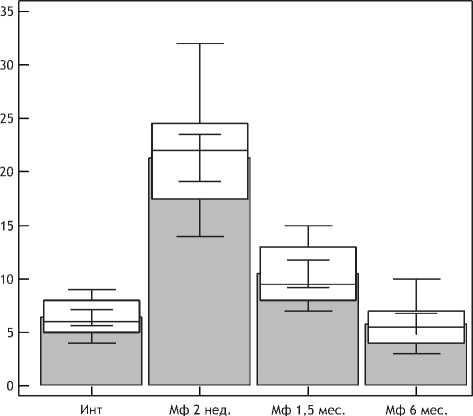
Рис. 18. Динамика количества макрофагов в дерме после нитевой имплантации.
Примечание. По оси абсцисс – сроки наблюдения, по оси ординат – количество CD68 позитивных клеток.
Количество последних снизилось до 10,5±0,67 (95% ДИ 9,22 - 11,78), что было практически в 2 раза ниже показателя в предыдущий срок исследования (p<0,01), но по-прежнему существенно превышало исходное количество макрофагов в дерме (на 64%; p<0,01). Такая смена клеточных популяций по сути отражает превалирование фазы репарации в дерме через 1,5 мес после введения ПДО нитей.
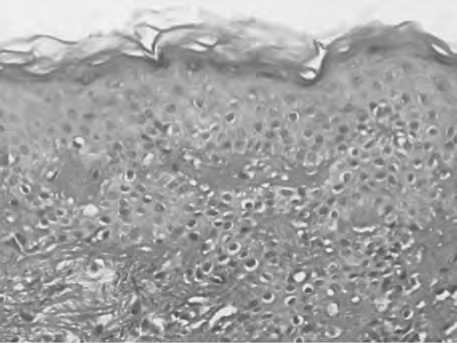
Рис. 19. Реструктуризация эпидермиса и поверхностной дермы после введения ПДО-нитей. Увеличение эпидермо-дерамального соединения и выраженности сосочкового слоя дермы.
Окраска по методу Ван Гизон.
Реорганизация сосудистого русла поверхностных и глубоких слоев дермы, а также реакция миофибробластов привели к существенной реструктуризации матрикса дермы, заметной уже через 1,5 мес после введения ПДО нитей и сохранялись и через 3 мес. Сосочковый слой дермы характеризовался увеличением плотности тонких коллагеновых волокон, организованных в упорядоченную сеть (рис. 19).
В сетчатом слое максимальной перестройке были подвержены зоны вокруг введения нитей и в периваскулярных участках. Здесь на фоне сохранения толстых пучков коллагеновых волокон, появлялись зоны нежнофибриллярного матрикса, представленного сетью новообразованных коллагеновых волокон.
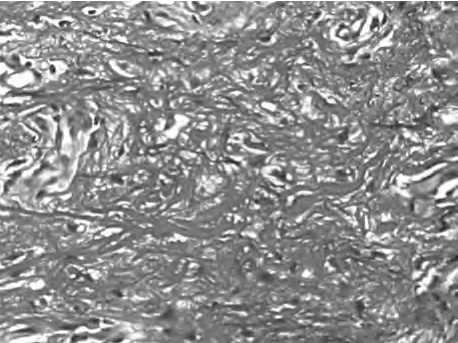
Рис. 20. Ремоделирование сетчатого слоя дермы за счет неоколлагеногенеза в периваскулярных зонах сетчатого слоя. Увеличение плотности коллагеновых и эластических волокон в поверхностном и глубоком слоях дермы после тред-лифтинга.
Окраска по методу ван Гизон. Ув. 200.
Такие структурные изменения матрикса были напрямую связаны с изменением характера контроля объема межклеточного вещества. Через 1,5 и 3 мес после введения ПДО-нитей отмечено умеренное ограничение экспрессии ММР-1 и ММР-9 (рис. 21). При этом количество ММР-9-позитивных клеток снизилось на 34% по сравнению с предыдущим сроком исследования (p<0,05), хотя по-прежнему несколько превышало исходный показатель (на 10%). Такие клетки выявлялись исключительно в периваскулярном компартменте, что вероятно сопряжено с ролью данного фермента в ремоделировании сосудистого русла. Экспрессия ММР1 снизилась более существенно – до 8,46±0,91 (95% ДИ 7,41 - 9,42), и оказалась на 23 % ниже исходного показателя (p<0,05). Характерно, что при этом было обнаружено повышение экспрессии ТІМР-1 (p<0,01) (рис. 21), в результате чего количество ТІМР1-позитивных клеток оказалось более, чем в 3 раза выше исходного показателя (p<0,001). Причем экспрессия тканевого ингибитора металлопротеиназ 1 носила универсальный характер, и наблюдалась как в поверхностном, так и в глубоком слоях дермы.
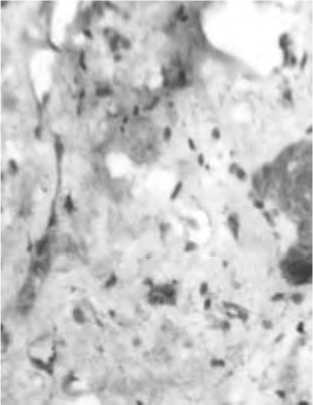
Рис. 21. Экспрессия ММР1 (А) и ММР9 (Б) в клетках кожи через 1,5 мес после тред-лифтинга. Иммуногистохимическое окрашивание. Ув. 400.
Б
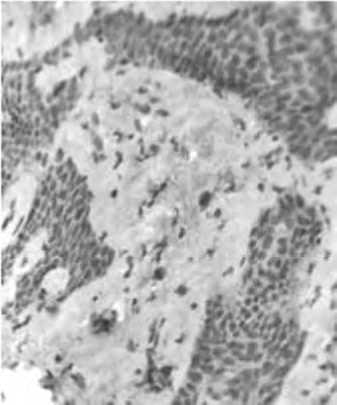
Важно также отметить, что в отличие от группы морфологического сравнения, экспрессия TIMP1 сохранялась не только через 1,5, но и через 3 мес после введения ПДО-нитей. Учитывая роль TIMP1 в накоплении матрикса, можно предположить о том, что именно изменение баланса ММР/TIMP1 при введении ПДО-нитей играет ведущую роль в реструктуризации межклеточного вещества дермы.
А
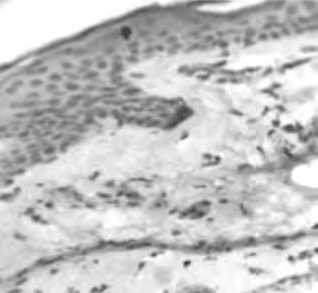
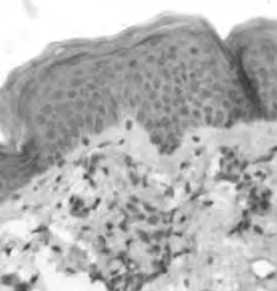
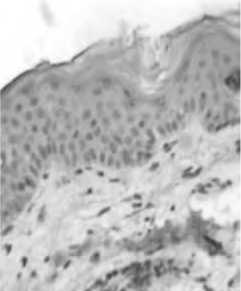
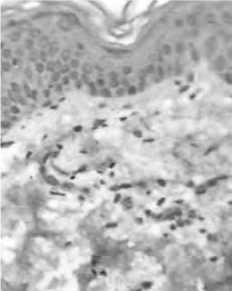
Рис. 22. Динамика экспрессии TIMP1 в коже
А – усиление экспрессии через 2 нед, Б – экспрессия TIMP1 в зонах ремоделирования матрикса через 1,5 мес после нитевой имплантации; В – сохранение умеренной экспрессии TIMP1 через 3 мес после имплантации нитей на основе ПДО;
Г – слабая реакция TIMP1 в группе сравнения (ложный лифтинг) через 1,5 мес.
Не менее важен и известный механизм активации экспрессии TIMP1. Как известно, активация данного ингибитора металлопротеиназ зависит от эффектов TGFβ. Последний является важнейшим фиброгеном, мишенями которого являются все клетки фибробластического ряда, а также противовоспалительным агентом, ограничивающим активность лейкоцитов, макрофагов, также снижающим продукцию провоспалительных цитокинов.
Заключение
Таким образом, результаты исследования позволяют сделать вывод о том, что нитевая имплантация с использованием нитей на основе полидиоксанона оказывает патогенетически обоснованный выраженный регенеративный эффект на дерму. Полученный результат был обеспечен включением реакции нескольких клеточных линий, а именно: макрофаги, эндотелий и миофибробласты. Основное значение для перестройки кожи имеет активация механизмов репарации через включение М2-макрофагов. Данный процесс обусловлен ангиогенезом через стимуляцию экспрессии VEGF и реорганизацией сосудистого русла дермы, а также стимуляцией собственного резерва клеток фибробластического ряда через активацию компонентов стромальной васкулярной фракции. Вместе с тем, следует отметить, что помимо активации неоколлагеногенеза, ведущей к реструктуризации дермы и эпидермиса, имплантация ПДО нитей оказывает позитивное влияние на баланс ММР/ ТИМР, механизмы деградации и способствуя накоплению матрикса соединительной ткани дермы.
Список литературы Патогенетические механизмы регенерации дермы после имплантации нитей на основе полидиоксанона
- Зорин В.Л., Зорина А.И., Черкасов В. Р., Копнин П.Б. Способ диагностики состояния кожи пациента (варианты). Патент на изобретение RU 2466680, 2012
- Zorin V. L., Zorina A. I., Cherkasov V.R., Kopnin P.B. «Diagnostic method for connective tissue and its application» (US 8.790.890 В2-29.07.14)
- Баринов Э.Ф., Сулаева О.Н. Свистунов И.В. Функциональная морфология кожи. -2014. -Д. -128 с
- Завгородняя М.И., Макеева Л.В., Славчева О.С., Сулае-ва О.Н. Клеточные и молекулярные механизмы заживления ран.//Морфология -2016. -Т. 10, № 3. -С. 19-23
- Tigges J, Krutmann J, Fritsche E, Haendeler J. The hallmarks of fibroblast ageing. Mech Ageing Dev. 2014;138:26-44
- Han S. A Prospective Evaluation of Outcomes for Midface Rejuvenation With Mesh Suspension Thread: «REEBORN Lift» Cosmet Dermatol 15 (3), 254-259. 2016 Apr 18
- Dong Hye Suh. Outcomes of Polydioxanone knotless Thread Lifting for Facial Rejuvenation. Dermatol Surg 41 (6), 720-725. 6 2015
- Savoia A. Outcomes in thread lift for facial rejuvenation: a study performed with happy lift™ revitalizing. Dermatol Ther (Heidelb) 2014 Jun 17;4(1):103-14. Epub 2014 Jan 17
- Suh DH, Jang HW, Lee SJ, Lee WS, Ryu HJ. Outcomes of polydioxanone knotless thread lifting for facial rejuvenation. Dermatol Surg. 2015;41(6): 720-5
- Fore J. A review of skin and the effects of aging on skin structure and function. Ostomy Wound Manage 2006; 52(9): 24-35
- Waldera Lupa DM, Kalfalah F, Safferling K, Boukamp P, Pos-chmann G, Volpi E. Characterization of Skin Aging-Associated Secret-ed Proteins (SAASP) Produced by Dermal Fibroblasts Isolated from Intrinsically Aged Human Skin. J Invest Dermatol. 2015;135(8):1954-68
- Salminen A, Kauppinen A, Kaarniranta K. Emerging role of NF-κB signaling in the induction of senescence-associated secretory phenotype (SASP).» Cell Signal. 2012; 24(4):835-45
- Sahin M, Cure E, Goren I, et al. Wegener’s granulomatosis presenting with acute renal failure and gastric ulcer. Case Rep Clin Prac Rev. 2006; 7:236-9


