Патогенетические основы эффективности миниинвазивных вмешательств в неотложной хирургии
Автор: Власов Алексей Петрович, Болотских Виктор Александрович, Салахов Ерикен Калымгиреевич, Власов Павел Алексеевич, Шейранов Никита Сергеевич, Зайцев Павел Павлович, Власова Татьяна Ивановна, Абрамова Светлана Викторовна
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Патофизиология и экспериментальная медицина
Статья в выпуске: 3, 2017 года.
Бесплатный доступ
Введение. Целью работы является изучение ряда проявлений ответной метаболической реакции организма на хирургическое лечение острого деструктивного холецистита и перитонита при различной травматизации брюшной стенки («открытая» лапаротомная рана или миниинвазивный доступ). Материалы и методы. Проведен клинико-лабораторный анализ больных острым холециститом и острым перитонитом. Все больные были оперированы с выполнением необходимого объема хирургического вмешательства. Пациенты были разделены на 2 группы: контрольную (1) и основную (2). В контрольной группе выполняли лапаро-томный оперативный доступ, в основной использовали миниинвазивную лапароскопическую технологию. Обследование больных обеих групп выполнялось при поступлении и в динамике послеоперационного периода (1, 2, 4, 6-е сут. после операции). Наряду с рутинными биохимическими анализами крови у пациентов оценивали выраженность эндотоксемии (в плазме крови определяли уровень молекул средней массы, общую и эффективную концентрацию альбумина), интенсивность перекисного окисления мембранных липидов, активность супероксиддисмутазы и фосфолипазы А2. Результаты исследования. В раннем послеоперационном периоде было выявлено уменьшение индекса токсичности по альбумину относительно контроля: при холецистите - на 25,1-37,7 % (p
Хирургическая агрессия, миниинвазивные хирургические технологии, эндогенная интоксикация, мембранодеструктивный процесс, холецистит, перитонит
Короткий адрес: https://sciup.org/14720265
IDR: 14720265 | УДК: 617-089 | DOI: 10.15507/0236-2910.027.201703.410-427
Текст научной статьи Патогенетические основы эффективности миниинвазивных вмешательств в неотложной хирургии
Бесспорным достижением современной хирургии является разработка новых операций, базирующихся на малотравматичных технологиях. Благодаря такому роду оперативных подходов получены обнадеживающие результаты в различных областях хирургии и, прежде всего, абдоминальной. Подчеркнем, что сам объем оперативного миниинвазивных вмешательства на органе (органах) поражения существенно не изменился. Различия касаются только операционной травмы брюшной стенки, которая при новых подходах минимальна и зачастую проявляется в виде одного или нескольких проколов брюшной стенки диаметром до 12 мм. При таком щадящем травмировании брюшной стенки ранний послеоперационный период у больных протекает заметно более благоприятно, чем при традиционных (лапаротомных) вмешательствах. Проявления хирургической агрессии минимизируются. Что кроется за этим феноменом? Получить исчерпывающий ответ на данный вопрос чрезвычайно сложно, поскольку в патогенезе проявлений этих расстройств задействованы многие системы.
Целью работы является изучение ряда проявлений ответной метаболической реакции организма на хирургическое вмешательство при различной травматизации брюшной стенки. В качестве объекта исследований выбран ряд показателей, по которым предоставляется возможным судить о состоянии важнейших компонентов гомеостаза, в частности эндотоксемии и липопероксидации.
Обзор литературы
Лапароскопия стала обычной процедурой в лечении острой ургентной патологии органов брюшной полости и может рассматриваться как отличный терапевтический и дополнительный диагностический инструмент в отдельных случаях. Однако для проведения такого рода манипуляций требуется высокий уровень опыта в лапароскопической и неотложной хирургии [1– 3]. С одной стороны, ряд рандомизированных контролируемых испытаний доказали, что при остром холецистите, панкреатите и перфоративных осложнениях язвенной болезни лапароскопический подход настолько же безопасен и эффективен, как открытая хирургия, с меньшим количеством осложнений и более быстрым послеоперационным восстановлением1 [4–8].
С другой, принятие лапароскопической хирургии в качестве новой методики лечения ургентной патологии привело к появлению нового спектра осложнений, связанных с увеличением времени хирургического вмешательства, особенностями течения воспалительного процесса (формирование спаек) и т. д. [9]. Непреднамеренная энтеротомия инструментарием, в т. ч. троакаром, приводит к конверсии от лапароскопии к открытой лапаротомии почти в 100 % случаев. Отсроченное послеоперационное выявление энтеротомии является особенностью лапароскопии и способствует высокому уровню летальности [10]. Кроме того, ряд клинических состояний (таких как гемодинамическая нестабильность, вздутие живота, фекальный перитонит и рак кишки с перфорацией) являются относительными противопоказаниями для лапароскопического подхода [11]. Неоднозначным остается также экономический аспект целесообразности применения лапароскопических технологий [12]. Проведение лапароскопических операций в хирургических и гинекологических стационарах требует больших ресурсов относительно традиционного под- хода [13]. Однако по данным литературы США и Великобритании, после лапароскопической хирургии пребывание больных в стационаре сократилось на 6–8 дней, причем было использовано меньше медикаментов, а продолжительность нетрудоспособности пациента была сокращена на 20–30 дней [14].
Принципиально важным и наиболее значимым остается изучение физиологических эффектов лапароскопической и открытой хирургии [15]. Лапароскопическая малоинвазивная техника уменьшала травму ткани, гомеостаз организма был менее поврежден, поэтому патологические метаболические и воспалительные реакции были менее выражены, а газовый состав крови – ближе к норме, чем при лапаротомии. Кроме того, болевой синдром при лапароскопической хирургии менее выражен, а послеоперационный период по сравнению с обычной хирургией, как правило, более короче2 [16–18].
Использование традиционных хирургических технологий часто отличается формированием синдрома ранней системной воспалительной реакции, характеризующейся высвобождением провоспалительных цитокинов, нарушением микроциркуляции и опосредуемой клетками иммунной дисфункцией. Данная реакция сопровождается синдромом компенсаторного противовоспалительного ответа, который предрасполагает пациента к оппортунистической инфекции. Указанные изменения в организме могут трансформироваться в синдром множественной органной дисфункции и привести к летальному исходу [12; 19]. Хирургическая травма вызывает глубокую иммунологическую дисфункцию, потенциально создавая условия для роста опухолевых клеток, снижение в плазме уровня нативных и тотальных тиоловых групп, что предполагает нарушение антиоксидантной способности плазмы [20].
Таким образом, вопрос сравнительной эффективности миниинвазив-ных способов хирургического лечения и традиционной «открытой» операции до настоящего времени остается дискуссионным. Оба подхода являются выполнимыми, безопасными и в ряде ситуаций имеют относительно сопоставимые результаты [21–22]. Кроме того, уровень развития современной медицины таков, что экстренные абдоминальные патологии могут успешно корригироваться лапароскопически [23–27]. В то же время объем хирургической агрессии как дополнительного патологического фактора и условий изменения гомеостаза является неоспоримым аргументом в пользу выбора малотравматичных лапароскопических технологий.
Материалы и методы
Был проведен клинико-лабораторный анализ больных острым холециститом и острым перитонитом. Больные были разделены на 2 группы: контрольную (1) и основную (2). Рандомизированный подбор пациентов в группы осуществлялся по возрасту, гендерному составу, характеру патологий, общепринятым и специальным лабораторным показателям.
При остром холецистите группу сравнения (1) составили больные (n = 46) в возрасте от 31 до 63 лет (48,3 ± 5,2), из них 6 (13,0 %) мужчин и 40 (87,0 %) женщин. Основная (2) группа включала пациентов (n = 58) в возрасте от 30 до 62 лет (49,4 ± 6,0), из них 6 (10,3 %) мужчин и 52 (89,7 %) женщины.
У всех больных на уровне приемного отделения после анализа кли- нических, лабораторных и инструментальных данных (ультразвуковое исследование печени, желчных путей, поджелудочной железы и эндоскопическое исследование пищевода, желудка и двенадцатиперстной кишки) был диагностирован деструктивный холецистит. Основной причиной воспаления желчного пузыря явилась желчнокаменная болезнь: в 1-й группе острый холецистит на фоне желчнокаменной болезни возник у 39 (84,7 %), во 2-й группе – у 51 (87,9 %) больных. В группе сравнения холецистэктомия осуществлялась лапаротомным оперативным доступом, в основной группе – лапароскопическим.
У больных исследованных групп была диагностирована флегмонозная форма холецистита в 82,6 и 81,0 % случаев соответственно, гангренозная – в 17,4 и 19,0 %.
При остром перитоните группу сравнения составили больные (n = 26) в возрасте от 31 до 63 лет (48,3 ± 5,2), из них 7 (26,9 %) мужчин и 19 (73,1 %) женщин. Основная группа включала пациентов (n = 28) в возрасте от 30 до 62 лет (49,4 ± 6,0), из них 7 (25,0 %) мужчин и 21 (75,0 %) женщина.
Среди причин распространенного перитонита были выявлены острый деструктивный аппендицит (19,2 и 17,8 % соответственно), заболевания и травмы тонкой и толстой кишок (11,2 и 10,3 %), заболевания желудка (15,3 и 14,3 %), панкреонекроз (19,2 и 21,4 %), послеоперационный перитонит (19,2 и 21,4 %), другие заболевания органов брюшной полости (15,3 и 14,3 %).
Больные перитонитом были прооперированы. Им производилась ликвидация источника перитонита и санация брюшной полости. Пациентам 1-й группы в раннем послеоперационном периоде выполнялись программированные лапаротомные санации, 2-й – программированные лапароскопические санации брюшной полости.
Степень тяжести перитонита оценивалась по Мангеймскому перитонеальному индексу (Mannheim Peritonitis Index). У больных по совокупности оценочных баллов первая степень тяжести диагностирована у 15,4 и 14,3 % соответственно, вторая – у 80,8 и 78,6 %, третья – у 3,8 и 7,1 %.
Пациентам проводилась периоперационная терапия (при остром холецистите в течение 4–18 ч, остром перитоните – 2–4 ч), которая включала инфузионную, дезинтоксикационную, антибактериальную, спазмолитическую и обезболивающую терапию. При необходимости назначалось лечение, направленное на стабилизацию гемодинамики и других витальных функций.
Обследование больных обеих групп выполнялось при поступлении и в динамике послеоперационного периода (1, 2, 4, 6-е сут. после операции). Наряду с рутинными биохимическими анализами крови оценивалась выраженность эндотоксемии (в плазме крови определяли уровень молекул средней массы [28], общую и эффективную концентрацию альбумина3 с расчетом индекса токсичности и резерва связывания альбумина по формулам, предложенным в методике), интенсивность перекисного окисления мембранных липидов и фосфолипазную активность по уровню малонового диальдегида4, активность супероксиддисмутазы [29] и фосфолипазы А25.
Статистическую обработку полученных результатов проводили с помощью пакета прикладных программ
Statistica 6.0 на персональном компьютере. В процессе работы применялся метод вариационной статистики с использованием критерия t Стьюдента и χ2; корреляционная зависимость оценивалась с помощью критерия r. Различия показателей относили к статистически значимым при p < 0,05.
Научные разработки проводились при информированном согласии больного в соответствии с международными нравственными требованиями ВОЗ (правила GCP – Good Clinical Practice), предъявляемыми к медицинским исследованиям с участием человека (г. Женева, 1993). С целью получения данных, которые в дальнейшем были приняты за норму, соответствующие исследования проведены у 14 здоровых добровольцев обоего пола в возрасте от 25 до 65 лет (44,9 ± 4,7).
Результаты исследования
В ходе клинических исследований было установлено, что у больных острым холециститом и острым перитонитом, перенесших малотравматичные операции, ранний послеоперационный период протекал более благоприятно. Подтверждением этого является не только сравнительно быстрое восстановление общего состояния, но и ряд других признаков: сравнительно меньшие температурная реакция, продукция экссудата брюшной полости, лейкоцитарная реакция, быстрое восстановление функции кишечника и др.
Отметим, что объем оперативных вмешательств на органах поражения в исследованных группах не отличался. Нами была предпринята попытка, как указано выше, установить некоторые основы такого рода реакции организма на травму при малотравматичных вмешательствах. Акцент был сделан на исследованиях одного из интегральных показателях гомеостаза – эндогенной интоксикации и одного из ключевых механизмов эндогенной интоксикации (кроме основного заболевания) – катаболических процессов, обусловленных
MORDOVIA UNIVERSITY BULLETIN мембранодеструктивными явлениями. Данный спектр исследований позволяет установить причинно-следственную связь между указанными явлениями, что во многом определяет некоторые основы сравнительно благоприятного течения раннего послеоперационного периода.
При поступлении в клинику у больных острым холециститом регистрировался синдром эндогенной интоксикации (табл. 1).
После проведения холецистэктомии с использованием лапаротомного доступа в раннем послеоперационном периоде было зарегистрировано увеличение содержания токсических продуктов в плазме крови пациентов. В первые трое суток показатели среднемолекулярных пептидов превышали таковые при поступлении и были выше нормы даже на 3-сут. исследования на 80,1 и 105,1 % (p < 0,05) соответственно для λ = 280 нм и λ = 254 нм. На конечном этапе наблюдения отмечалась положительная динамика гидрофильного компонента эндогенной интоксикации, данные показатели снижались относительно таковых при поступлении, но оставались выше нормы на 28,2 и 35,2 % (p < 0,05) соответственно. Аналогичная динамика была выявлена при изучении гидрофобного компонента эндогенной интоксикации по альбумину: положительные изменения показателей отмечены только на конечном этапе наблюдения.
Применение миниинвазивных технологий в лечении острого деструктивного холецистита выявило положительную динамику всех маркеров эндогенной интоксикации уже с первых сут. послеоперационного периода. Отметим, что через двое сут. все изучаемые показатели были ниже таковых при поступлении. На конечном этапе клинического наблюдения (5-е сут.) уровень молекул средней массы (λ = 254 нм) и общая концентрация альбумина достигли нормальных значений.
Т а б л и ц а 1
T a b l e 1
Е
s
с ©
s
-о
о
|
о^ H'g £ > a Я ffi CD § о О" Я, о ё о 85 5 о О т G о м 00 Л сЗ 95 m |
^-S |
1^ ОО |
хг 40 |
-н * сч у |
-н ^lo" |
-н* °Чо сТА' |
-H ^ 0 |
^ 00 |
^оо о\ А |
00 0 |
-H * Йо |
-H # 5S |
-H # |
|
^-8 S ^ |
-н * |
-нж с-1 m °„ |
-н * |
-н * ss |
^* MP хг |
-H 0 00 00 °\ oo"^l |
r- O\ |
O'S |
-H # ^0 |
-H * ой 5-0 |
-H * 5-0 |
§§ |
|
|
“^ V Ai СЧ |
хГ ^ А о) |
-н * О А о |
-н * оо °® £о |
-н * 9§ |
^*_ О^<^ М^-Г |
^M |
-H* Ox XT |
00" o' ri |
"^ -/- |
-H # |-~. 0 5-o |
-H # ^0 |
-H # ^ 0 |
|
|
CD " (D , |
-н * СЧ |
-н * % 8 |
-н * оо А % 8 |
-н # оо |
-н* ю оо оо" А' |
'sD ^ MA |
^*_ O'O\ s 0 |
^ 00 я° |
-H # ^ O'1 va О |
-H * §§ |
-H * 5-0 |
-H » 55 |
|
|
К S > &&£ § 8 ” |
-н * % g |
сч°2 £о |
^ оо |
-н * |
-н |
o^> |
^* r1 ^ cq ^ |
A 0 S! d° |
-H * SA |
-H # 00 % %g |
-H # m 00 ^0 |
-H # Xt- ^ ^0 |
|
|
1ё £z |
-н АМ |
-H 00 0 0 5^ |
^0 |
01 0 |
|||||||||
|
С Р ^и |
СЧ |
Г1 |
ri |
ri |
ri |
ri |
|||||||
|
О Рн С |
'о . S т А Id 8 s У сч У |
о ЙА s 8 “id 9 я t“E В'О о h;x § я S g.^ и II |
'S’S) I! I |
5§ s « а-Й "аь ® £ о” ®“В «нВ и й s ^; о ^ S ^ S т^ |
4 11 E CD |
e2 A 0 -8 0 s 0 s |
|||||||
В сравнительном аспекте было установлено, что после проведения холецистэктомии с использованием лапароскопичеких технологий (группа сравнения) индекс токсичности плазмы крови по альбумину был ниже, чем в контрольной группе, на 25,1 % (p < 0,05) на 1-е сут. исследования; на 37,7 % (p < 0,05) – на 2-е сут.; на 28,2 % (p < 0,05) – на 3-и сут.; на 34,3 % (p < 0,05) – к концу наблюдения. Достоверно ниже были также показатели гидрофобного компонента эндотоксикоза: уже на 1-е сут. показатель среднемолекулярных пептидов был ниже контроля на 15,3 и 20,1 % (p < 0,05) соответственно.
Изучение выраженности интоксикационного синдрома у пациентов с перитонитом при поступлении и в динамике раннего послеоперационного периода показало существенную выраженность патологического процесса (табл. 2).
Следует отметить, что применение миниинвазивных технологий лечения приводило к снижению выраженности интоксикационного синдрома уже на 2-е сут. послеоперационного периода. При использовании лапаротомного доступа уменьшение содержания токсических продуктов в плазме крови регистрировалось только к 3–5-м сут. наблюдения (рис. 1).
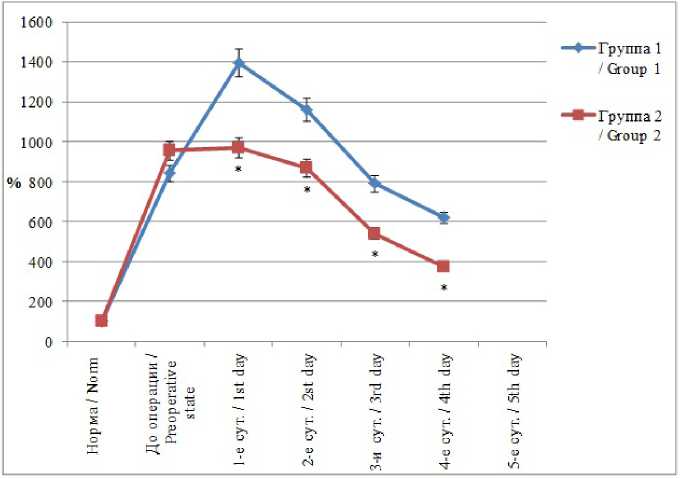
Р и с. 1. Индекс токсичности у больных перитонитом (*– достоверность отличия данных контрольной группы (1) от основной (2) при р < 0,05)
F i g. 1. The toxicity index in the patients with peritonitis (* – the reliability of the difference in the control group (1) from the main group (2) at p < 0,05)
Было выявлено, что содержание гидрофильных токсических продуктов в плазме крови у пациентов 2-й группы исследования было ниже контрольных данных на 12,7–37,8 % (p < 0,05) в динамике послеоперационного периода.
Изучение состояния универсальных молекулярных механизмов клеточного повреждения при различных способах терапии острой ургентной патологии как одного из важнейших источников эндогенных токсинов показало следующие результаты (табл. 3–4).
Т а б л и ц а 2
T a b l e 2
Е
-н S
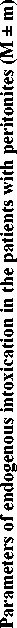
|
сЗ с л £ > § О о р 5 о О т G о м СЮ Л сЗ 9 v m |
о 45 V ^ |
СП |
-н # г-. ОД од 40^0 |
-н # |
-н # оо ^ |
о^- |
-н 'xf 00 о °\ v-fPl |
-н* 40 о ^40 оГ^-Г О1 |
04 оо 01 |
-Н # ОО £о |
-Н # |>. 04 ® о |
-Н # ^о |
-н * 5 s |
|
б^ |
2=9 |
-н # 40 ° |
-н * |
-н # ^ о |
^^ о of |
^^ |
^°ч |
°ч°ч |
-н * §д |
-н # |
^н 40 5о" |
-н # 40 ^о |
|
|
б^ V ОД ОД |
-н # о о |
-н # оо gS |
-Н # ^о |
-Н ^ ^о |
Ol^xr оо" ^н" О1 |
в* оо ^ ^" of |
-н* О1 04 40^ щ |
о^ СЧ°Ч |
-н * |
-н # оо Sr о |
-н * 9 § |
-н # § о |
|
|
б^ о В-, |
-н * |
-н # 04 |
-н # §§ |
-Н #^ |
оо" ш" |
о^- О\ of |
-н* Я г? |
-и» S3 40" о" |
-н # оо m £о |
-н # |
-н # ^ ^ |
2 О |
|
|
К V S > сз g jy g g^ |
-н # °0-о |
ОО |
-нж 40 я |
-н * |
Ol^in rf m" |
-н* о О) |
■и * 40 ОО ^40^ S |
-н * ^ о |
-н * §§ |
-н # со ^ |
-Н * Г^ 40 |
||
|
£z |
-н |
-н оо ^о |
^о" |
01 о |
|||||||||
|
с S’ |
ОД |
О1 |
О1 |
О1 |
О1 |
О1 |
|||||||
|
С |
с u Е ■ и 5 § 5 g^TS Я Ре§ ш cS £ ^ 5^ |
н# v S S ^Е 5 Ш 4—1 S^-S |
5 ” "So аЗ й »2.3 я й 2 уН й g Ч § « ^ О Ю S О 2 |
з U ’So
h’S
н V о S^o m . s щ й h s й И 5 Й у ^to£ |
у д § V
® 8 5^ о |
к |
|||||||
Т а б л и ц а 3
T a b l e 3
|
cd s .2 с л £ > g 5 G CD § О О" о (D ^ р 5 о G (D м е^ Л cd 9^ |
^-S |
-h* |
-H ^ Ro |
-H co |
01 0 |
"^ co |
^ co ri° |
-H* |
m ° |
ю 00 |
-и m |
|
CD " g ^ |
-H * %s |
-H oo O\ ^ ЧО О О о |
-H# Pl 22 g |
m2 Я ^ |
-H # |
V-) 04 ^h of ° |
-H » §s |
00 2 §„ |
9^ |
-H * 00 2 |
|
|
“^ V 04 oi |
-H * |
Pl o |
m22 |
4 m ^0 |
ro Pl |
-H * 40 2 |
00 'Pi So |
-H * xT 40 o§ |
-H # |
-H * co § |
|
|
CD " CD , |
-H * £Й |
-H m |
-H » ^g |
41 5 ^o" |
CO co <4 |
-H * |
-H* 2 g |
-H * m X, |
-H * g 22 |
-H * 0 |
|
|
К cd g g р^х ч^ |
Pl ^ |
-H * 04 22 04 ^ |
-H » ^_4 |
^2 |
-H # 1^ ^0 |
^5 |
-H * So |
-H » Oo” |
-H * 22^2 |
-H * 0 s |
|
|
1ё £z |
^2 40 о |
m2 ^o |
co of ° |
41 ^ |
^ xt |
||||||
|
cd л С 5 G о ^о |
oi |
01 |
01 |
01 |
01 |
||||||
|
£ & О Рн С |
g • д 2 ад "et-S P 2 X ь ад 2 s 2 p' Щ CD co о G m G § tB |
s3 2 ад 5 « Л 0 G CD ! 8 M G |
2 25 Pi И H |
S.a -BP Bq 0 "o
8.& В 'о 0 -©Ч О CD О Ph e |
cd to p ад cd v И S * и |
||||||
При остром холецистите на момент поступления регистрировали существенную активизацию процессов свободно-радикального окисления липидов и повышение активности фосфолипаз. Содержание первичных и вторичных продуктов липопереокис-ления возрастало относительно нормы на 21,5–50,7 и 45,3–51,7 % (p < 0,05) соответственно, активность фосфолипазы А2 – на 198,8–207,1 % (p < 0,05). Активность антиоксидантного фермента супероксиддисмутазы компенсаторно снижалась и была ниже нормы на 18,7–20,6 % (p < 0,05).
Использование миниинвазивных технологий способствовало более быстрому уменьшению выраженности данных мембранодеструктивных процессов, чем при выполнении лапаротомно-го доступа. Например, показатель ТБК- активных продуктов у пациентов 2-й группы был ниже контроля на 16,2 % (p < 0,05) – на 1-е сут. терапии; на 19,6 % (p < 0,05) – на 2-е сут.; на 27,9 % (p < 0,05) – на 3-и сут.; на 22,8 % (p < 0,05) – на 5-е сут. Активность фосфолипазы А2 в динамике наблюдения у пациентов 2-й группы была ниже контроля на 22,5–37,3 % (p < 0,05). Быстрее проходило восстановление активности супе-роксиддисмутазы.
Аналогичная динамика показателей мембранодеструктивных процессов в раннем послеоперационном периоде была выявлена у пациентов с перитонитом. Использование малотравматичных операций способствовало более быстрому восстановлению показателей перекисного окисления липидов и фосфолипазной активности относительно результатов контрольной группы (рис. 2).
Р и с. 2. Показатель ТБК-активных продуктов у больных перитонитом (* – достоверность отличия данных контрольной группы от основной при р < 0,05)
F i g. 2. The index of TBA-active products in the patients with peritonitis (* – the reliability of the difference in the control group from the main group at p < 0,05)
Т а б л и ц а 4
T a b l e 4
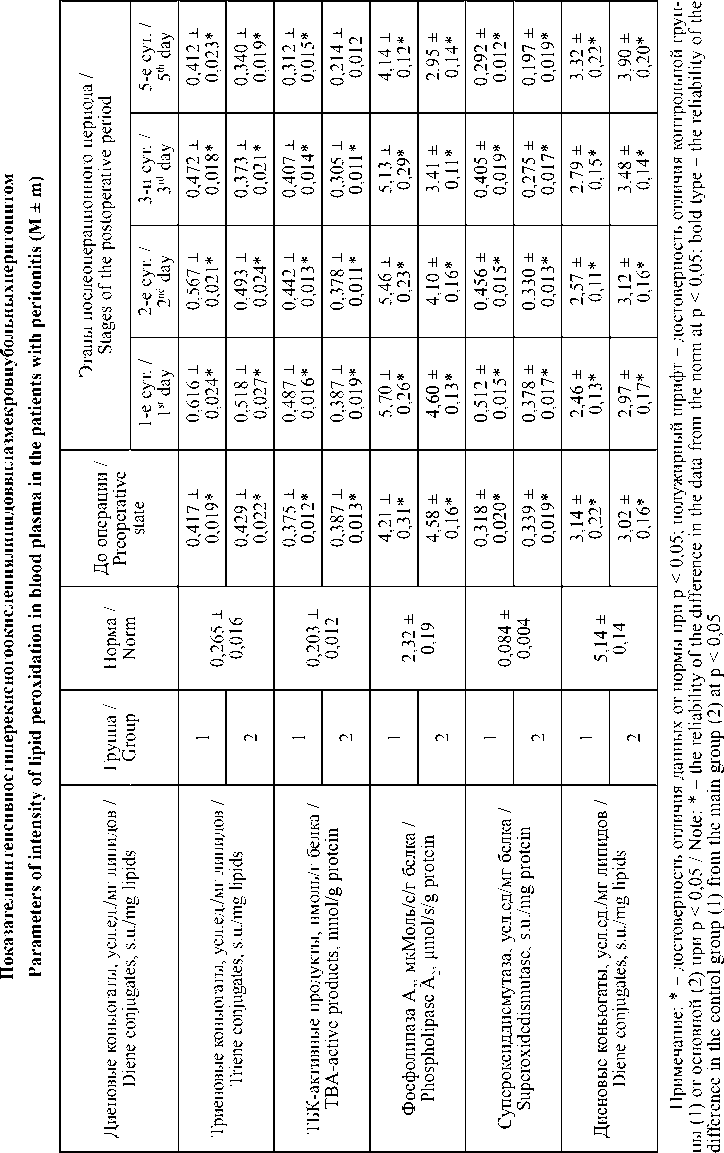
Следует отметить, что у пациентов контрольной группы исследования в первые трое суток послеоперационного периода регистрировали прогрессирование патологических изменений всех вышеописанных показателей, что, вероятно, связано со значительным негативных влиянием хирургической агрессии и объема хирургической травмы на состояние гомеостаза при ургентной патологии.
Обсуждение и заключения
При применении миниинвазивных вмешательств вне зависимости от патологии в раннем послеоперационном периоде отмечались существенно меньшие расстройства гомеостаза, в частности сравнительно низкая выраженность эндотоксемии, проявляющаяся уменьшением накопления биологически активных токсических компонентов. Ярким подтверждением данного положения является уменьшение индекса токсичности по альбумину (при холецистите – на 25,1–37,7 % (p < 0,05), при остром перитоните – на 25,5–39,3 % (p < 0,05)), что указывало на понижение загруженности активных центров альбумина лигандами (в основном гидрофобными токсическими продуктами). Учитывая, что метаболизм этих токсических продуктов в основном осуществляется в печени, становится очевидным факт сравнительно меньшей ее детоксикационной загруженности, а следовательно, быстрого восстановления функционального состояния. Данный фактор играет большую роль в сравнительно
быстром восстановлении гомеостатических показателей организма в целом и, следовательно, быстрой реабилитации больных. Особенно высока значимость данного процесса при деструктивном холецистите, поскольку печень вовлекается в патологический процесс и контактным путем.
Преимущество малотравматичных операций заключается также в сравнительно быстром купировании явлений перекисного окисления мембранных липидов и уменьшения активности фосфолипаз. Подчеркнем чрезвычайную важность этого факта, поскольку от интенсивности указанных процессов (агентов) зависит выраженность мембранодеструктивных явлений (ка-таболичесских процессов) – одного из важнейших источников эндогенной интоксикации, что существенно уменьшает нагрузку на печень.
Отметим, что особенно значимые положительные эффекты малотравматичных вмешательств наблюдаются при остром распространенном перитоните, что предотвращает чрезмерную нагрузку на печень. Сохранение (меньшее угнетение) функциональных возможностей печени положительно сказывается на состоянии больного и течении заболевания в целом, поскольку печень в этих условиях обеспечивает необходимую степень жизненных процессов, во многом обусловливая поддержание гомеокинетических показателей на таком уровне, при котором создаются реальные условия для манифестирования саногенетических механизмов.
Поступила 02.05.2017; принята к публикации 08.06.2017; опубликована онлайн 29.09.2017
Все авторы прочитали и одобрили окончательный вариант рукописи.
Submitted 02.05.2017; revised 08.06.2017; published online 29.09.2017
All authors have read and approved the final version of the manuscript.
Список литературы Патогенетические основы эффективности миниинвазивных вмешательств в неотложной хирургии
- Philipp S. R., Miedema B. W., Thaler K. Single-incision laparoscopic cholecystectomy using conventional instruments: early experience in comparison with the gold standard//J. Am. Coll. Surg. 2009. No. 209. Р. 632-663 DOI: 10.1016/j.jamcollsurg.2009.07.020
- Meta-analysis comparing early versus delayed laparoscopic cholecystectomy for acute cholecystitis/X. D. Wu //Liu. Br. J. Surg. 2015. Aug. Р. 12 DOI: 10.1002/bjs.9886
- Navez B., Navez J. Laparoscopy in the acute abdomen//Best Pract. Res. Clin. Gastroenterol. 2014. Vol. 28, no. 1. P. 3-17 DOI: 10.1016/j.bpg.2013.11.006
- Кашевкин С. А. Результаты консервативного и малоинвазивных методов лечения тотально-субтотального панкреонекроза в ранние сроки//Вестник Ивановской медицинской академии. 2012. № 1. С. 41-44. URL: http://cyberleninka.ru/article/n/rezultaty-konservativnogo-i-maloinvazivnyh-metodov-lecheniya-totalno-subtotalnogo-pankreonekroza-v-rannie-sroki
- Кулиш В. А., Коровин А. Я., Балаклеец Е. Н. Применение миниинвазивных технологий в лечении больных с осложненным острым холециститом//Вестник экспериментальной и клинической хирургии. Воронеж, 2012. Т. 5, № 2. С. 277-281. URL: http://elibrary.ru/item.asp7id = 17849647
- Antoniou S. A., Pointer R., Granderath F. A. Single-incision laparoscopic cholecystectomy: a systematic review//Surg. Endosc. 2010 DOI: 10.1007/s00464-010-1214-8
- Erbella J. Jr., Bunch G. M. Single-incision laparoscopic cholecystectomy: the first 100 outpatients//Surg. Endosc. 2010. № 24. Р. 1958-1961 DOI: 10.1007/s00464-010-0886-4
- Hong Т. H., You Y. K., Lee K H Transumbilical single-port laparoscopic cholecystectomy: scarless cholecystectomy//Surg. Endosc. 2009. Vol. 23, no. 6. Р. 1393-1397 DOI: 10.1007/s00464-008-0252-y
- Complications of laparoscopic cholecystectomy: our experience from a retrospective analysis/M. Radunovic //Open Access Maced J. Med. Sci. 2016. Vol. 4, no. 4. P. 641-646. DOI: 10.3889/oamjms.2016.128
- Van Goor H. Consequences and complications of peritoneal adhesions. Colorectal Dis. 2007. Suppl. 2. P. 25-34 DOI: 10.1111/j.1463-1318.2007.01358.x
- Суковатых Б. С., Иванов П. А., Блинков Ю. Ю. Показания, противопоказания и технология видеоэндоскопических санаций брюшной полости при распространенном гнойном перитоните//Эндоскопическая хирургия. 2011. № 5. С. 5-8. URL: http://elibrary.ru/item.asp7id = 18167279
- Ni Choileain N., Redmond H. P. Cell response to surgery//Arch. Surg. 2006. Vol. 141, no. 11. P. 1132-1140 DOI: 10.1001/archsurg.141.11.1132
- Laparoscopic versus open appendectomy for complicated and uncomplicated appendicitis in children/S. R. Markar //J. Gastrointest. Surg. 2012. Vol. 16, no. 10. P. 1993-2004. DOI: 10.1007/s11605-012-1962-y
- Ndofor B., Mokotedi S., Koto M. Comparing laparoscopic appendectomy to open appendectomy in managing generalisedpurulent peritonitis from complicated appendicitis: the uncharted path//S. Afr. J. Surg. 2016. Vol. 54, no. 3. P. 30-34. URL: https://www.ncbi.nlm.nih.gov/pubmed/7term=28240465
- Impact of surgery on immunologic function: comparison between minimally invasive techniques and conventional laparotomy for surgical resection of colorectal tumors/C. Evans //Am. J. Surg. 2009. Vol. 197, no. 2. P. 238-245 DOI: 10.1016/j.amjsurg.2008.01.021
- Винник Ю. С., Здзитовецкий Д. Э. Послеоперационная санация брюшной полости при распространенном перитоните//Дальневосточный медицинский журнал. 2011. № 3. С. 19-21. URL: http://cyberleninka.ru/article/n/posleoperatsionnaya-sanatsiya-bryushnoy-polosti-pri-rasprostranennom-peritonite
- Jung B. H., Park J. I. Impact of scheduled laparoscopic cholecystectomy in patients with acute cholecystitis, following percutaneous transhepatic gallbladder drainage//Ann. Hepatobiliary Pancreat. Surg. 2017. Vol. 21, no. 1. P. 21-29 DOI: 10.14701/ahbps.2017.21.1.21
- Delayed laparoscopic cholecystectomy for acute calculous cholecystitis: is it time for a change7/J. B. Yuval //World J. Surg. 2017. Mar. 1 DOI: 10.1007/s00268-017-3928-4
- Об определении показаний к этапной санации брюшной полости при распространенном гнойном перитоните/А. Б. Ларичев //Вестник экспериментальной и клинической хирургии. 2013. Т. IV, № 3. С. 335-342. URL: http://vestnik-surgery.ru/arhiv/20/20_11.pdf
- Changes in thiol-disulfide homeostasis of the body to surgical trauma in laparoscopic cholecystectomy patients/M. Polat //J. Laparoendosc. Adv. Surg. Tech. A. 2016. Vol. 26, no. 12. P. 992-996 DOI: 10.1089/lap.2016.0381
- Острый деструктивный холецистит у больных старческого возраста/О. Э. Луцевич //Хирург. 2013. № 5. С. 19-26.
- Малков И. С., Салахов Е. К. Лапароскопическая санация брюшной полости в комплексном лечении больных с распространенным перитонитом//Казанский медицинский журнал. 2012. Вып. 2. С. 287-289. URL: http://www.kazan-medjournal.ru/ru/2012/2/93p287
- Салахов Е. К., Салахов К. К. Возможности лапароскопических технологий в диагностике и лечении больных с распространенным перитонитом//Казанский медицинский журнал. 2016. Вып. 2. С. 268-274 DOI: 10.17750/KMJ2016-268
- Шаповальянц С. Г., Линденберг А. А., Марченко И. П. Особенности проведения санаци-онных вмешательств при распространенном перитоните//Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2009. № 3. С. 46-50. URL: http://www.gastro-j.ru/article/32-osobennosti-provedeniya-sanatsionnyih-vmeshatelstv-pri-rasprostranennom-peritonite
- Mbatha S. Z., Anderson F. Outcomes in laparoscopic cholecystectomy in a resource constrained environment//S. Afr. J. Surg. 2016. Vol. 54, no. 3. P. 8-12. URL: https://www.ncbi.nlm.nih.gov/pubmed/28240461
- Laparoscopic cholecystectomy in patients aged 60 years and over -our experience/D. Serban //J. Med. Life. 2016. Vol. 9, no. 4. P. 358-362. URL: https://www.ncbi.nlm.nih.gov/pubmed/27928438
- Laparoscopic management of cholecystoenteric fistula: a single-center experience/X. Y. Li //J. Int. Med. Res. 2017. Jan 1:300060517699038 DOI: 10.1177/0300060517699038
- Пикуза О. И., Шакирова Л. З. Диагностика интоксикации плода при гестозах по уровню молекул средней массы//Казанский мед. журн. 1994. Т. 75, № 6. С. 445-149.
- Гуревич В. С., Конторщикова К. Н., Шатилина Л. В. Сравнительный анализ двух методов определения активности супероксиддисмутазы//Лабораторное дело. 1990. № 4. С. 44-47.


