Патогенетические закономерности каскадного механизма развития хронических гастродуоденальных заболеваний у детей, обусловленных потреблением питьевой воды ненадлежащего качества по содержанию продуктов гиперхлорирования и марганца
Автор: Устинова О.Ю., Лужецкий К.П., Маклакова О.А., Землянова М.А., Долгих О.В., Уланова Т.С.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Медико-биологические аспекты оценки воздействия факторов риска
Статья в выпуске: 3 (7), 2014 года.
Бесплатный доступ
Исследованы патогенетические механизмы развития у детей хронических гастродуоденальных заболеваний, обусловленных потреблением питьевой воды ненадлежащего качества по содержанию продуктов гиперхлорирования (хлороформ) и марганца. Установлено, что клиническая манифестация патологического процесса у детей с повышенным содержанием марганца и хлороформа в крови сопряжена с развитием вегетативных дисфункций по парасимпатическому типу, реактивных изменений ткани печени, билиарной дисфункции по гипомоторному типу, нарушения моторики желудка и двенадцатиперстной кишки по гиперкинетическому варианту. Патогенетические закономерности развития у детей хронических гастродуоденальных заболеваний [Hp -], ассоциированных с воздействием продуктов гиперхлорирования (хлороформ) и марганца, предопределяют патоморфоз патологического процесса с развитием атрофических/субатрофических измененений слизистой верхних отделов желудочно-кишечного тракта.
Хроническая гастродуоденальная патология, дети, качество питьевой воды, продукты гиперхлорирования, марганец
Короткий адрес: https://sciup.org/14237879
IDR: 14237879 | УДК: 616-008
Текст научной статьи Патогенетические закономерности каскадного механизма развития хронических гастродуоденальных заболеваний у детей, обусловленных потреблением питьевой воды ненадлежащего качества по содержанию продуктов гиперхлорирования и марганца
развития хронической гастродуоденальной патологии, ассоциированной с воздействием химических веществ техногенного происхождения, требуют дальнейшего изучения. Присутствие в питьевой воде остаточных продуктов гиперхлорирования и тяжелых металлов обусловливает возникновение дополнительных случаев гастродуоденальных заболеваний на уровне 18 ‰ в год, способствует увеличению частоты встречаемости тяжелых и осложненных форм с рецидивирующим течением и устойчивостью к консервативной терапии [1, 4, 9].
Целью исследования являлось изучение особенностей патогенеза хронических гастродуоденальных заболеваний [Hp-] у детей, обусловленных потреблением питьевой воды ненадлежащего качества по содержанию продуктов гиперхлорирования и марганца.
Материалы и методы. Оценка качества питьевой воды и атмосферного воздуха на территориях проживания детей проводилась на основании данных мониторинговых исследований ФИФ СГМ (согласно Постановлению правительства РФ № 60 от 02.02.2006 г. «Положение о проведении социально-гигиенического мониторинга» с изменениями от 04.09.2012 г.).
Оценка риска для здоровья населения, обусловленного потреблением питьевой воды ненадлежащего качества по содержанию продуктов гиперхлорирования и марганца, осуществлялась по стандартизованной методике в соответствии с «Руководством по оценке риска для здоровья населения при воздействии химических веществ, загрязняющих окружающую среду» (Р 2.1.10.1920-04) [8].
Медико-биологические исследования проводились с соблюдением этических принципов, изложенных в Хельсинкской декларации (1975 г., с дополнениями 1983 г.) и в соответствии с Национальным стандартом РФ ГОСТ-Р 52379-2005 «Надлежащая клиническая практика» (ICH E6 GCP) (утвержденным 27.09.2005 г.).
Группу наблюдения составили 116 детей в возрасте 7–10 лет (8,6±1,2 г.) с хрони- ческой гастродуоденальной патологией [Hp-] (МКБ-10: К29.3-29,9), проживавших на территории с неудовлетворительным качеством питьевой воды по санитарнохимическим показателям (продукты гиперхлорирования, марганец). В группу сравнения вошли 56 детей аналогичного возраста (8,4±1,4 г., р ≥ 0,05) с хронической гастродуоденальной патологией [Hp-] (МКБ-10: К29.3-29,9), проживавших на территории, где качество питьевой воды соответствовало гигиеническим нормативам. Группы были сопоставимы по гендерному параметру.
Лабораторное обследование включало: оценку состояние окислительно-антиоксидантных процессов (общая антиоксидантная активность сыворотки крови, содержание малонового диальдегида, Сu/Zn-супероксид-дисмутазы, глутатионпероксидазы, глутати-он-S-трансферазы, гидроперекисей липидов), факторов неспецифической резистентности (абсолютный фагоцитоз, процент фагоцитоза, индекс фагоцитоза, фагоцитарное число), иммунологического статуса (абсолютное и относительное содержание CD4+, CD25+, CD95+-лимфоцитов), неспецифической сенсибилизации (JgE общ ), гормонального статуса (уровень серотонина, дофамина, кортизола), нейромедиаторов, регулирующих процессы возбуждения и торможения (уровень глутамата и гамма-аминомасляной кислоты), содержания в крови пепсиногена 1 и пепсиногена 2, щелочной фосфатазы, аланиновой и аспарагиновой аминотрансфераз. Исследования выполнялись по традиционным методикам с использованием микроскопа Micros MC-200 (Австрия), автоматического биохимического анализатора Kone-lab (Финляндия), иммуноферментного анализатора EL×808 и стандартных тест-наборов. Методами иммуногенетического исследования (ПЦР-диагностика в режиме реального времени) определялась распространенность патологических аллелей генов СРОХ, CYP1A1 и частота полиморфизма гена сульфотрансферазы.
Полученная информация анализировалась статистическими методами (Statistica
-
6.0) и с помощью специальных программных продуктов, сопряженных с приложениями MS-Office. Сопоставление качественных бинарных признаков проводили методами непараметрической статистики с построением и анализом двумерных таблиц сопряженности с использованием критерия хи-квадрат (χ2). Для сравнения групп по количественным признакам использовали двухвыборочный критерий Стьюдента. Оценку зависимостей между признаками осуществляли методом однофакторного дисперсионного анализа (для качественных признаков) и методом корреляционнорегрессионного анализа (для количественных переменных).
Результаты и их обсуждение. Анализ санитарно-гигиенической ситуации по данным мониторинговых исследований показал, что на территории проживания детей группы наблюдения имело место превышение гигиенических нормативов качества питьевой воды по хлороформу – до 2,70 ПДК; хлору остаточному свободному – до 2,20 ПДК; хлору остаточному связанному – до 1,25 ПДК; дихлорметану – до 8,0 ПДК, марганцу – до 3,3 ПДК. На территории сравнения гигиенические нормативы качества питьевой воды по исследуемым ингредиентам не были превышены.
Оценка опасности возникновения нарушений здоровья населения, обусловленных потреблением питьевой воды ненадлежащего качества по содержанию продуктов гиперхлорирования и марганца, выявила наличие неприемлемого риска ( HI = 1,75–2,18) развития патологии нервной системы и гепатобилиарного тракта.
В ходе анамнестического обследования установлено, что дети, включенные в группы исследования, рождены от 1–3-й беременности, не имели врожденной патологии желудочно-кишечного тракта, были доношенными (95 % – группа наблюдения и 94,1 % – группа сравнения; p = 0,34), имели близкие при рождении весоростовые показатели (3241,3±154,6 г и 51,2±0,6 см – группа наблюдения; 3132,4±162,4 г и 50,37±1,56 см – группа сравнения; p = 0,43–0,48) и оценку по шкале Апгар (8,12±0,20 против 8,58±0,10 усл. ед. соответственно; p = 0,20). Частота регистрации в анамнезе острых кишечных инфекций в сравниваемых группах не имела различий (10,3 и 12,5 % соответственно, р = 0,67). В группе наблюдения в 41,7 % случаев ежемесячный доход на одного члена семьи составлял от 4001 до 7000 рублей (в группе сравнения - у 34,5 %, р = 0,42), менее 4000 рублей - в 42 % (52,4 % в группе сравнения, р = 0,08), более 7000 рублей - в 16,3 % (13,1 % в группе сравнения, р = 0,08). Большая часть детей (79,3 и 73,2 % соответственно, р = 0,37) проживали в благоустроенном жилье и использовали водопроводную воду без дополнительной очистки (95,0 и 87,5 % соответственно, р = 0,24). Нарушения режима питания отмечали 32,8 % родителей детей группы наблюдения и 25,0 % - группы сравнения (р = 0,29). Длительность заболевания в исследуемых группах составляла 2,1±1,1 г. и 1,9±1,2 г. соответственно (р = 0,72).
Результаты химико-аналитического исследования показали, что содержание марганца в крови у детей группы наблюдения достигало 0,0283±0,0042 мкг/см3 (референтная концентрация - 0,011 мкг/см3, р < 0,01), а хлороформа - 0,019891±0,006675 мкг/см3 (референтная концентрация - 0,0 мкг/см3, р < 0,01). В группе сравнения уровень марганца не превышал 0,0110±0,0004 мкг/см3 ( р = 0,78 к референтному), а хлороформа -0,001801±0,000001 мкг/см3 (р = 0,89 к референтному). В целом содержание марганца в крови детей группы наблюдения в 2,6 раза превышало показатель группы сравнения (р < 0,01), а хлороформа - в 10 раз (р < 0,001).
Сравнительный анализ частоты жалоб гастроинтестинального характера выявил, что дети группы наблюдения чаще отмечали снижение аппетита (91,4 и 61,0 % соответственно, р = 0,04), отрыжку воздухом (45,5 против 25,4 %, р = 0,03), боли в животе (58,6 против 37,2 %, р = 0,03), локализующиеся в эпигастрии (58,2 против 23,2 %, р < 0,001) или правом подреберье (61,2 против 32,1 %, р < 0,001), нарушение стула (78,5 против 57,1 %; р = 0,004). Среди жалоб астеновеге-тативного характера наиболее часто отмеча- лись: потливость (37,1 против 10,9 %, р = 0,02), быстрая утомляемость (16,4 и 8,6 % соответственно, р = 0,04), непереносимость транспорта (6,9 и 5,4 %, р = 0,82). У детей группы наблюдения признаки гепатобилиарной дисфункции регистрировались в 1,4 раза чаще, чем в группе сравнения (87,9 и 64,3 % соответственно, р = 0,001). Установлена достоверная причинно-следственная связь вероятности развития заболеваний желчевыводящих путей с повышенным содержанием в крови хлороформа (R2 = 0,293-0,448; F = 15,348 - 36,392; р = 0,001) и болезней нервной системы функционального характера - с увеличенным содержанием марганца и хлороформа (R2 = 0,50 - 0,77; F = 93,67 -109,62; р = 0,01-0,001).
Преобладающим типом исходного вегетативного тонуса у детей группы наблюдения являлась эйтония (в 50 % случаев), однако у 37,5 % установлен ваготонический вариант, что в 1,9 раза превышало аналогичные данные группы сравнения (20 %, р = 0,02). В группе наблюдения симпатико-тонический тип вегетативной реактивности отмечался лишь в 25 %, что в 1,2 раза реже, чем в группе сравнения (30 %, ОШ = 1,2; ДИ =1,1 -1,7), преобладающим же типом являлся ги-персимпатико-тонический (62,5 %); в группе сравнения этот вариант встречался в 1,5 раза реже - 43,3 % (ОШ = 1,45; ДИ = 1,16 - 3,11). Установлены прямые достоверные связи «повышенное содержание в крови марганца - развитие исходной ваготонии и гипер-симпатико-тонического типа вегетативной реактивности» ( R 2 = 0,37 - 0,42; F = 87,54 -- 118,12; р = 0,01).
При ультразвуковом сканировании гепатобилиарной области реактивные изменения печени в группе наблюдения регистрировались в 7 раз чаще (31,7 против 4,5 %, p = 0,01), кроме того, в 1,6-1,7 раза чаще определялась билиарная дисфункция по гипо-моторному типу (80,2 против 50,0 %, р = 0,001) и увеличение линейных размеров печени (12,2 и 7,0 % соответственно, ОШ = 1,74; ДИ = 1,32-3,76). Установлена достоверная связь между повышенным содержанием в крови детей хлороформа и раз- витием реактивных изменений печени (R2 = 0,39; F = 76,83; р = 0,01); увеличенным содержанием в крови марганца и наличием билиарной дисфункции по гипомоторному типу (R2= 0,41; F = 99,23; р = 0,01).
В ходе электроэнцефалографического исследования установлено, что измененный тип параметров биоритмики головного мозга у детей группы наблюдения регистрировался в 2 раза чаще (55,5 %), чем в группе сравнения (27,3 %; OR = 2,03; DI = 1,64 – 3,85), и имел преимущественно общемозговой, функциональный характер.
При исследовании биохимических показателей у детей группы наблюдения выявлены признаки оксидативного стресса: уровень гидроперекиси липидов в сыворотке крови составил 325,44±23,72 мкмоль/дм3, а МДА – 3,54±0,117 мкмоль/см3, что в 1,5–1,7 раза выше показателей группы сравнения
(р = 0,000 – 0,001); частота регистрации проб с повышенным уровнем гидроперекиси липидов составила 28 %, при отсутствии таковых в группе сравнения, МДА – 52 %, что в 5 раз выше аналогичных данных в группе сравнения. Установлена связь повышенного содержания гидроперекиси липидов и МДА – с концентрацией марганца в крови (OR = = 3,1 – 4,2; DI = 2,5 – 4,8; р = 0,001). Выявленный оксидативный стресс обусловлен истощением ресурсов антиоксидантной защиты от субклеточного до системного уровня: активность глутатионпероксидазы в сыворотке крови составила 30,95±3,31 нг/см3, Сu/Zn-супероксиддисмутазы – 36,45±2,16 нг/см3, что в 1,2–1,6 раза ниже таковых в группе сравнения (р = 0,001 – 0,0001); кроме того, в 1,2–1,4 раза была снижена активность глутатионпероксидазы, глутатион-S-трансферазы (р = 0,001). В целом частота регистрации пониженных уровней данных ферментов (51– 55 % случаев) была в 3,8–4,2 раза выше показателей группы сравнения (р = 0,001). Общий антиоксидантный статус, как интегральный показатель, у более чем 50 % детей группы наблюдения отражал выраженное снижение активности процессов антиоксидантной защиты (125,64±8,38 мкмоль/дм3, что в 2,2 раза ниже показателя группы сравнения, р = = 0,000). Установлена связь угнетения антиоксидантных процессов с концентрацией марганца и хлороформа в крови (OR = 2,6 – – 5,1; DI = 2,0 – 6,1; р = 0,000). Вклад марганца и хлороформа в развитие дисбаланса окислительно-антиоксидантных процессов составил 41–68 %, (F = 16,19 – 425,05; р = 0,000 – 0,040). В ходе лабораторного исследования у детей группы наблюдения установлен дисбаланс нейромедиаторов, регулирующих процессы возбуждения и торможения: повышенный в 1,5 раза относительно группы сравнения уровень глутамата (148,87±16,76 мкмоль/дм3, р = 0,001) и сниженный в 2 раза уровень гамма-аминомасляной кислоты в сыворотке крови (0,046±0,013 мкмоль/дм3, р = 0,000); частота регистрации измененных показателей была в 4,3–5,0 раза выше таковой в группе сравнения. Установлена связь повышения уровня глутамата и снижения гамма-аминомасляной кислоты с концентрацией марганца в крови (OR = 3,4 – 6,1; DI = 2,2 – 10,5; р = 0,000); вклад марганца в развитие дисбаланса нейромедиаторов составляет 64–79 % (F = = 145,06 – 287,55, р = 0,000). Кроме того, у детей группы наблюдения установлено нарушение синтеза гормонов гипофизарнонадпочечниковой оси (снижение содержания дофамина и кортизола – в 1,3 раза, серотонина – в 2,0 раза относительно таковых группы сравнения), имеющее достоверную связь с повышенным уровнем в крови марганца и хлороформа (R2 = 0,36 – 0,77; F = 28,74 – 94,62; р = 0,01). Результаты иммунологического обследования свидетельствуют о развитии у детей группы наблюдения транзи-торного иммунодефицита (снижение в 1,3– 1,6 раза показателей фагоцитоза, сывороточного IgА, активности Т-лимфоцитарного звена иммунного ответа, содержания IgА в слюне и повышение в 1,3 раза сывороточного IgEобщ относительно аналогичных сведений группы сравнения), достоверно связанного с повышенным содержанием в крови марганца и хлороформа (R2 = 0,33 – 0,63; F = 57,41 – 183,11; р = 0,01 – 0,001). Кроме того, у детей группы наблюдения в 1,3–1,6 раза чаще выявлялось повышение содержания щелочной фосфатазы, активности аспарагиновой аминотрансферазы, пепсиногена 2 на фоне угнетения активности пепсиногена 1, достоверно связанных с повышенным содержанием в крови марганца и хлороформа (R2 = 0,39 – 0,52; F = 33,67 – 121,76; р = 0,01 – 0,001). В ходе иммуногенетического обследования у 10,3 % детей группы наблюдения выявлен полиморфизм гена сульфотрансферазы, отвечающего за детоксикацию органических соединений; у 13,8 % – наличие патологического аллеля CYP1A1 (ген цитохрома), отвечающего за 1-ю фазу детоксикации органических токсикантов; у 14,7 % – патологического аллеля CPOX (копропорфириногено-ксидазы), отвечающего за конъюгацию ме-таллопротеинов. Следует подчеркнуть, что у детей, имеющих полиморфизм гена сульфотрансферазы и/или патологические аллели CPOX и CYP1A1, содержание марганца и хлороформа в крови на 15–25 % превышало среднегрупповые показатели.
Результаты проведенного исследования свидетельствуют о том, что на территориях с ненадлежащим качеством питьевого водоснабжения (превышение гигиенических нормативов по содержанию продуктов гиперхлорирования и марганца до 2,7–3,3 ПДК) риск развития у населения патологии нервной системы и гепатобилиарного тракта ( HI ) составляет 1,75–2,18. В крови детей, потребляющих воду с повышенным содержанием марганца и продуктов гиперхлорирования, обнаруживается хлороформ, а содержание марганца в 2,7 раза превышает референтный уровень (маркеры: содержание марганца и хлороформа в крови).
У детей с наследственной предрасположенностью (10–15 % популяции) (маркеры: патологические аллели СРОХ, CYP1A1, по-лиморфность гена сульфотрансферазы, регулирующих процессы детоксикации хлорор-ганических соединений и металлов) содержание марганца и хлороформа в крови на 15– 25 % выше, чем таковое у детей без генетических дефектов.
Повышенное содержание марганца и хлороформа оказывает негативное влияние на центральную и вегетативную нервную системы, что проявляется дисбалансом гомеостаза нейротрансмиттеров и нейромедиаторов (маркеры: снижение уровня серотонина, дофамина, кортизола и гамма-аминомасляной кислоты; повышение содержания глутамата, обусловленное присутствием в крови повышенных концентраций марганца и хлороформа; R 2 = 0,36 – 0,79), с развитием в 2 раза чаще астеноневротиче-ских и вегетативных расстройств, преимущественно по парасимпатическому типу (маркеры: ваготонический тип исходного вегетативного тонуса с гиперсимпатико-тоническим вариантом вегетативной реактивности, нарушение биоритмики головного мозга по данным электроэнцефалографии, связанные с повышенным содержанием марганца; R 2 = 0,36 – 0,42) (рисунок). Вегетативные расстройства с преобладанием парасимпатических влияний у детей проявля-
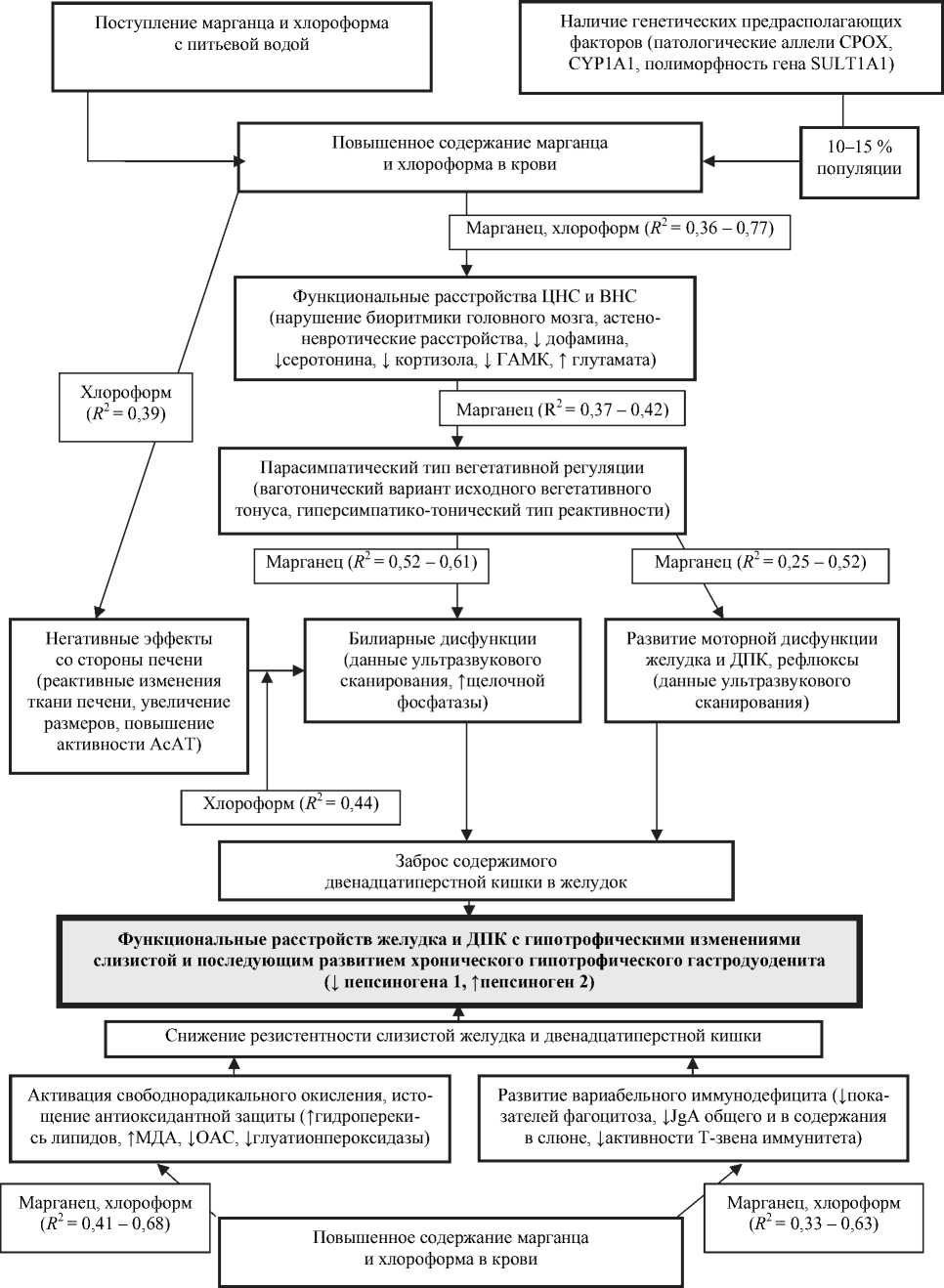
Рис. Патогенетические особенности каскадного механизма развития хронических гастродуоденальных заболеваний, обусловленных воздействием продуктов гиперхлорирования и марганца
Установленные патогенетические закономерности развития риск-ассоциирован-ной гастродуоденальной патологии следует учитывать при разработке программ превентивной и вторичной профилактики у детей, потребляющих питьевую воду ненадлежащего качества по содержанию продуктов гиперхлорирования и марганца.
Список литературы Патогенетические закономерности каскадного механизма развития хронических гастродуоденальных заболеваний у детей, обусловленных потреблением питьевой воды ненадлежащего качества по содержанию продуктов гиперхлорирования и марганца
- Алешко-Ожевский Ю.П. Сезонные колебания макро-и микроэлементов в крови больных с язвенной болезнью желудка и двенадцатиперстной кишки//Вопросы питания. -2005. -№ 2. -С. 9-14.
- Бабак О.А. Атрофический гастрит: прогнозы и перспективы//Здоровье Украины. -2006. -№ 21(1). -С. 1-3.
- Баранов А.А., Климанская Е.В., Римарчук Г.В. Детская гастроэнтерология. -М., 2002. -232 с.
- Баранов А.А., Щербаков П.Л. Актуальные вопросы детской гастроэнтерологии//Вопросы современной педиатрии. -2002. -№ 1. -С. 12-16.
- Зайцева Н.В., Май И.В., Шур П.З. Анализ риска здоровью населения на современном этапе//Здравоохранение Российской Федерации. -2013. -№ 2. -С. 20-24.
- Ивашкин В.Т., Трухманов А.С., Маев И.В. Физиологические основы моторно-эвакуаторной функции пищеварительного тракта//Российский журнал гастроэнтерологии, гепатологии, колопроктологии. -2007. -№ 5. -С. 4-10.
- О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2012 году: Государственный доклад. -М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека, 2013. -176 с.
- Р 2.1.10.1920-04. Руководство по оценке риска для здоровья населения при воздействии химических веществ, загрязняющих окружающую среду. -М.: Федеральный центр Госсанэпиднадзора Минздрава России, 2004. -143 с.
- Рудаева Е.Г., Нейжмак З.Ф., Салманов Ф.Э. Особенности хронического гастродуоденита у подростков на современном этапе//Детская гастроэнтерология: материалы XV Международного конгресса детских гастроэнтерологов. -М., 2008. -С. 170-171.


