Патогенетическое и клиническое значение особенностей экспрессии EPCАM в опухоли и циркулирующих опухолевых клетках
Автор: Перельмутер В.М., Таширева Л.А., Григорьева Е.С., Алифанов В.В., Пудова Е.С., Бузенкова А.В., Завьялова М.В., Чердынцева Н.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 5 т.23, 2024 года.
Бесплатный доступ
Цель исследования - обобщение имеющихся данных о структуре и функции EpCAM и его доменов, их участии в развитии пролиферации, ЭМП, в проявлении стволовости клеток, во взаимодействии с молекулами клеточной адгезии и инвазии. Материал и методы. Проведен поиск русско- и англоязычных статей в научных базах PubMed, Scopus, Web of Science, E-library. Для написания обзора были использованы 79 статей, опубликованных с 1996 по 2024 г.
Epcam, epcamhigh/low/loss, циркулирующие опухолевые клетки, эпителиально- мезенхимальный переход, карциномы, рак молочной железы, инвазия, стволовость
Короткий адрес: https://sciup.org/140307912
IDR: 140307912 | УДК: 616-006-091.811:575.113.1 | DOI: 10.21294/1814-4861-2024-23-5-133-145
Текст обзорной статьи Патогенетическое и клиническое значение особенностей экспрессии EPCАM в опухоли и циркулирующих опухолевых клетках
Молекула адгезии эпителиальных клеток Ep-CAM (epithelial cell adhesion molecule, CD326) представляет собой трансмембранный гликопротеин, играющий важнейшую роль в клеточной адгезии и клеточной сигнализации. EpCAM локализуется преимущественно вдоль латеральной поверхности клеточной мембраны в точках контакта в поляризованных клетках, поэтому не взаимодействует с белками внеклеточного матрикса, включая фибронектин, коллагены и ламинин. Многофункциональная роль EpCAM при карциномах зависит от их типа и модуляции его экспрессии под влиянием внешних и внутренних факторов. Эффекты EpCAM различны для внеклеточного и внутриклеточного доменов. Понимание механизмов функционирования EpCAM не всегда возможно, поскольку в значительной части исследований оперируют термином «EpCAM», и неясно, какой домен EpCAM вызывал наблюдаемые эффекты [1].
Повышение интереса к EpCAM связано с его потенциалом в качестве диагностической и терапевтической мишени и созданием технологии выделения циркулирующих опухолевых клеток (ЦОК) путем детекции EpCAM на их мембране (технология «CellSearch»). Однако во многих исследованиях поднимается вопрос о том, что технология «CellSearch» не позволяет обнаружить весь пул ЦОК [2].
Нельзя не согласиться с мнением S.M. Yahyaza-deh Mashhadi et al. (2019), что, «хотя EpCAM играет важную роль в выявлении карцином, наиболее значимым открытием в отношении ЦОК было выявление отсутствия экспрессии EpCAM в этих клетках» [3]. Это относится и к ЦОК с низким уровнем мембранной экспрессии EpCAM. C. Nicolazzo et al. (2017), оценивая статус EpCAM в ЦОК, выделенных от группы пациентов с метастатическим колоректальным раком, показали, что 40 % ЦОК не были обнаружены системой «CellSearch» [4]. Патогенетическая и прогностическая роль EpCAM неоднозначна и во многом остается недостаточно изученной.
Целью исследования является анализ особенностей экспрессии EpCAM и ее патогенетического и клинического значения при карциномах.
Структура EpCAM
Ген EpCAM человека состоит из 9 экзонов и расположен на хромосоме 2p21. В результате альтернативного сплайсинга мРНК может синтезироваться 6 различных изоформ, которые включают EpCAM -201, EpCAM -202, EpCAM -203, EpCAM -204, EpCAM -205 и EpCAM -206 [5]. EpCAM -201 является преобладающей изоформой, что подтверждается крупномасштабными результатами транскриптомного анализа TCGA (The Cancer Genome Atlas Program) [6]. Интересно, что экспрессия EpCAM -205 также характерна для всех типов рака, даже несмотря на то, что считается, что эта изоформа не транслируема в функциональный белок. Изоформа EpCAM -205 может транскрибироваться и процессироваться при раке, но впоследствии подвергаться посттранскрипционной деградации. Более того, возможно, что EpCAM -205 может играть прямую роль в регуляции канцерогенеза [7]. Однако это всего лишь рабочая гипотеза, и для подтверждения этого утверждения необходимы дальнейшие исследования функции EpCAM -205.
Структура белка EpCAM высококонсервативна у разных видов, включая человека. EpCAM человека – трансмембранный гликопротеин, состоящий из 314 аминокислот: внеклеточного домена (N-концевой домен) (EpEX) – 242, трансмембранного домена – 23, цитоплазматического домена – 26 аминокислот (С-концевой домен) (EpICD) [8].
Антитела, используемые для захвата ЦОК, обычно специфичны к эктодомену антигена Ep-CAM. Они не могут отличить мембраносвязанный полноразмерный EpCAM от расщепленных вариантов. Поэтому характеристика ядерного EpICD в ЦОК, лишенных эктодомена EpCAM и не учитываемых с помощью методов выделения на основе EpCAM, заслуживает особого внимания [9].
Протеолиз EpCAM
Функциональная активность EpCAM сопряжена с «консервативным механизмом передачи сигнала – регулируемым внутримембранным протеолизом» (regulated intramembrane proteolysis, RIP)» [10–13]. Предварительным условием для RIP-зависимой активации EpCAM является внеклеточное отделение EpEX [13]. EpEX действует как гомофильный лиганд для нерасщепленного EpCAM [8]. Расщепление стимулируется связыванием растворимого EpEX с EpCAM, благодаря чему активируется EGFR сигнальный путь [12, 13].
RIP представляет собой ряд последовательных процессов. На первом этапе при участии протеаз ADAM10/17 и BACE1 происходит первоначальное расщепление EpCAM с образованием растворимого внеклеточного домена EpEX и мембраносвязанного С-концевого фрагмента (EpCTF), который все еще находится в плазматической мембране. Далее комплекс γ-секретазы катализирует вну-тримембранное расщепление EpCTF, генерируя внеклеточный фрагмент, подобный EpCAM-Aβ, и внутриклеточный фрагмент EpICD. Скорость протеолиза EpCTF с помощью γ-секретазы в даль- нейшем определяет скорость передачи сигнала через EpICD и удаления EpCAM из плазматической мембраны [14]. Растворимый лиганд EpEX способен вызывать образование EpICD аутокринным или паракринным образом [9]. Длина фрагмента EpICD и его функция заметно отличаются в различных линиях клеток карцином, а также между нормальными клетками и клетками карцином [15].
Существует положительная петля ауторегуляции EpCAM: растворимая фракция EpEX усиливает расщепление EpCAM и запускает передачу сигналов EpICD, благодаря чему обеспечивается сигнал для пролиферации, самообновления, якорь-независимого роста и инвазивности [16] (рис. 1).
Внутриклеточный пептид EpICD инициирует передачу сигнала путем ассоциации с β-катенином и белком 2 с доменами LIM (FHL2). Этот комплекс может транслоцироваться в ядро, где он связывает LEF-1 (Lymphoid enhancer-binding factor 1) и ДНК [8]. О ядерной локализации EpICD сообщалось при раке толстой кишки человека и при различных подтипах рака щитовидной железы [17].
Результаты исследования Y. Huang et al. (2019) позволили получить представление о длительности разных этапов RIP EpCAM. Скорость протеолиза EpCTF у мышей и человека с помощью γ-секретазы оказалась медленной: в различных клеточных линиях 50 % период протеолиза составлял от 45 мин до 5,3 ч [14]. Авторы пришли к выводу, что протеолиз EpCTF γ-секретазой представляет собой медленный процесс, за которым следует высокоэффективная протеосомная деградация EpICD. Учи-
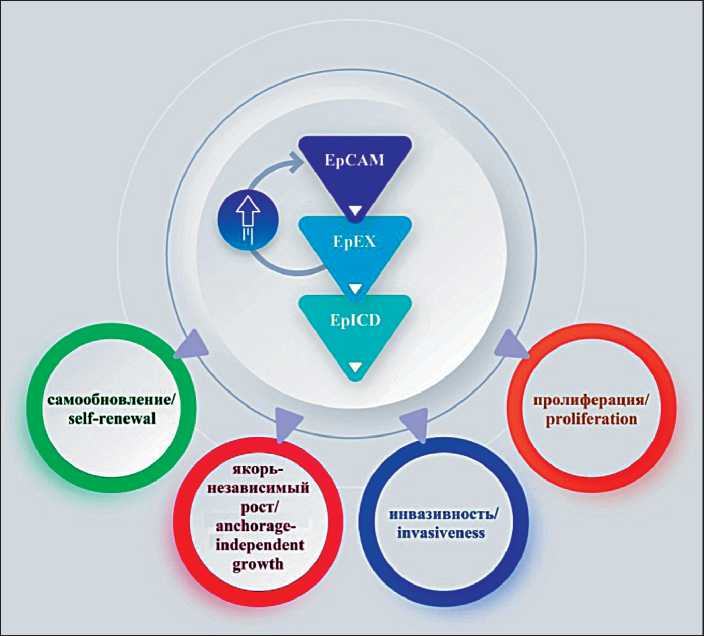
Рис. 1. Петля ауторегуляции EpCAM. Домен EpEX, образующийся в результате RIP EpCAM, усиливает расщепление EpCAM, благодаря чему второй домен EpICD активирует сигнальные пути, обеспечивающие пролиферацию, самообновление, якорь-независимый рост и инвазивность опухолевых клеток. Примечание: рисунок выполнен авторами Fig. 1. The autoregulatory loop of
EpCAM expression. The EpEX domain shedded via regulated intramembrane proteolysis (RIP) enhances the following cleavage of EpCAM. In this instance, the second domain, EpICD, activates signaling pathways that facilitate proliferation, self-renewal, anchorage-independent growth, and the invasiveness of tumor cells. Note: created by the authors
EpCAM и адгезия
EpCAM описана как поверхностная молекула эпителиальных клеток, одной из основных функций которой является адгезия. К настоящему времени получены данные о более сложном участии EpCAM в адгезии. Экспрессия EpCAM может даже снижать силу межклеточной адгезии, воздействуя на другие молекулы адгезии, включая E-кадгерин [1]. Это происходит частично за счет нарушения связи E-кадгерина с цитоскелетом [20]. Вместе с тем, EpCAM модулирует гомофильную адгезию, хотя она более слабая, чем связанная с E-кадгерином. Полагают, что гомофильные адгезионные взаимодействия могут предотвращать метастазирование. С другой стороны, поскольку EpCAM подавляет межклеточную адгезию, опосредованную E-кадгерином, это может способствовать метастазированию [21].
EpCAM и пролиферация
Протеолитическое расщепление молекулы EpCAM способно активировать EpCAM в качестве митогенного сигнала. На основании этого была установлена роль EpCAM как медиатора пролиферативной передачи сигналов. Есть мнение, что вклад EpCAM в прогрессирование опухоли может быть связан с реакцией на факторы роста со стимуляцией пролиферации [22, 23]. EpEX как лиганд индуцирует EGFR-опосредованные сигнальные пути ERK1/2 и AKT и стимулирует умеренную пролиферацию клеток карциномы, но ограничивает EGF/EGFR/pERK1/2-зависимую регуляцию эпителиально-мезенхимального перехода (ЭМП) [24].
EpCAM и ЭМП
Продемонстрировано, что EpCAM напрямую регулирует индукцию ЭМП посредством экспрессии Snail, Slug и виментина [25]. Динамическую экспрессию уровня EpCAM при прогрессировании карцином связывают с ЭМП [26, 27]. Активация программы ЭМП сопровождается потерей EpCAM и снижением экспрессии эпителиальных маркеров [9]. Повышение высвобождения EpEX усиливает расщепление EpICD, что также приводит к активации генов ЭМП. Происходит это за счет образования в ядре комплекса EpICD с LEF-1,
FHL2 и β-катенином [3, 9]. Являясь негативным регулятором E-кадгерина, EpCAM может приводить к освобождению β-катенина с последующей передачей сигналов с помощью EpICD [1].
EpCAM и инвазия
Потеря EpCAM способствовала повышению миграционного потенциала [28]. O. Gires et al. (2014) объясняют роль EpCAM в начальной фазе инвазии развитием ЭМП с потерей экспрессии EpCAM на плазматической мембране (от EpCAM high до EpCAM low), усилением миграционной и инвазивной способности и мезенхимальным фенотипом [13].
EpCAM и стволовость
Имеются многочисленные факты, свидетельствующие об участии EpCAM в приобретении и проявлении стволовости. Показано, что подавление экспрессии цитокератина 18 в клетках рака молочной железы (РМЖ) индуцирует ЭМП и стволовость благодаря увеличению экспрессии EpCAM [29]. EpICD играет важную роль в пролиферации клеток карцином и поддержании фенотипа стволовых клеток [22, 30]. Перемещение EpICD в ядро клетки в комплексе с каркасным белком FHL2 и β-катенином, индуцирует транскрипцию генов-мишеней, включая c-myc, циклины, гены, индуцирующие стволо-вость, и гены, связанные с пролиферацией клеток [9, 22]. Ядерная транслокация EpICD участвует в модуляции генов стволовости, благодаря чему поддерживается выживаемость клеток [16]. Сверхэкспрессия EpCAM также способствовала ЭМП и экспрессии маркеров стволовых клеток (NANOG, SOX2 и OCT4) в условиях гипоксии в клеточных линиях РМЖ. Этот эффект происходил через NF-κβ сигнальный путь [31].
Механизмы потери мембранной экспрессии EpCAM
Отсутствие регистрируемой мембранной экспрессии EpCAM связано с разными причинами. Недооценка наличия ЦОК при использовании технологии «CellSearch» может быть связана с экспрессией изоформ EpCAM, в связи с чем различные конформационные состояния могут не соответствовать активному центру антител [32]. Снижение аффинности связывания может приводить к оценке ЦОК как EpCAMlow или вовсе не обнаруживать их.
Одной из причин потери экспрессии EpCAM может быть подавление транскрипции гена EpCAM из-за гиперметилирования его промотора, что наблюдается при РМЖ [33]. Мембранная экспрессия EpCAM может временно теряться в процессе ЭМП [34, 35]. Имеются исследования, которые продемонстрировали, что EpCAM-негативные ЦОК с мезенхимальным фенотипом и пониженной экспрессией эпителиальных маркеров часто происходят из EpCAM-положительных первичных опухолей [26]. Полагают, что отсутствие экспрессии EpCAM в ЦОК пациентов с агрессивными типами опухолей может быть объяснено удалением внеклеточного домена с плазматической мембраны вследствие протеолиза [9].
RIP и эндоцитоз являются двумя основными механизмами, с помощью которых клетки теряют EpCAM с клеточной поверхности [14]. C. Driemel et al. (2014) предположили, что потеря мембранной экспрессии EpCAM с одновременным появлением цитоплазматической локализации EpCAM отражают эндоцитоз и последующую деградацию EpCAM во внутриклеточных компартментах [26]. И в других исследованиях предполагают, что эндоцитоз лежит в основе потери мембранной экспрессии EpCAM и окрашивания цитоплазмы в инвазивных клетках при колоректальном раке и прогрессирующем РМЖ [28, 36].
Представляет интерес, действительно ли возможна интернализация EpEX домена? Каковы условия и последствия такого механизма потери мембранной экспрессии EpCAM? Можно предполагать, что в случаях эндоцитоза/интернализации внутриклеточно расположенный EpCAM можно визуализировать с помощью антител к EpEX. Указывается, что подавление экспрессии EpCAM может происходить при выходе клеток из первичной опухоли через кровоток [13, 37]. Значит ли это, что потеря мембранной экспрессии EpCAM происходит в процессе интравазации или уже в кровотоке? Высокая динамичность экспрессии EpCAM в кровотоке продемонстрирована на моделях ксенотрансплантатов мышей с линиями клеток РМЖ, экспрессирующих EpCAM. Через 4 ч после внутривенного введения в клетках, экспрессирующих EpCAM, отмечено снижение экспрессия данного белка [34].
Наличие внеклеточного домена при отсутствии EpICD
Описано наличие внеклеточных и трансмембранных доменов, но не имеющих EpICD [17, 19]. Обсуждается возможность селективной RIP-независимой деградация EpICD из интактных молекул EpCAM [13]. При иммуногистохимическом исследовании A. Seeber et al. (2016) продемонстрировали, что 164 из 640 пациентов с колоректальным раком (25,6 %) потеряли экспрессию EpICD, сохранив EpEX на плазматической мембране. Авторы предполагают, что это могло быть связано с регулируемой RIP-независимой активацией EpCAM, которая приводит к избирательной деградации EpICD и удержанию EpEX на клеточных поверхностях [38]. Можно предполагать, что отсутствие белка EpCAM в цитоплазме и ядре клетки может быть обусловлено двумя процессами: отсутствием RIP опосредованного протеолиза EpCAM, вследствие чего нет внутриклеточного EpICD, или RIP-независимой деградацией EpICD.
Экспрессия EpCAM в нормальных тканях
Выраженность экспрессии EpCAM в нормальных тканях обсуждается в ряде работ. Наибольший уровень экспрессии EpCAM имеет толстая кишка. Не экспрессируют EpCAM эпидермальные керати-ноциты, гепатоциты, кортикальные эпителиальные клетки тимуса и миоэпителиальные клетки. Напротив, указывается, что EpCAM широко экспрессируется в клетках карцином человека, особенно в аденокарциномах и плоскоклеточных карциномах [3]. В нормальных органах отмечен разный уровнь экспрессии белка EpCAM. К органам с высокой экспрессией EpCAM относятся паратиреоидные железы, 12-перстная кишка, тонкий кишечник, толстый кишечник, аппендикс, прямая кишка, желчный пузырь, почки, придатки яичек, семенные пузырьки, фаллопиевы трубы, кожа. Средний уровень экспрессии наблюдается в щитовидной железе и эндометрии. Низкая степень экспрессии – в ротоглотке, бронхах, легких, поджелудочной железе, яичках, шейке матки, молочной железе. Органы, в которых не обнаружена экспрессия белка EpCAM, – головной мозг, надпочечники, слизистая рта, слюнные железы, пищевод, желудок, печень, мочевой пузырь, простата, влагалище, яичники, тонзиллы, сердечная мышца, гладкомышечная ткань, скелетные мышцы, жировая ткань, селезенка, лимфоузлы, костный мозг [39]. A. Bantikassegn et al. (2015) указывают, что существуют фракции EpCAMpos CD45pos, которые являются иммунными клетками [40]. Такие клетки могут быть ошибочно расценены как гибридные ЦОК.
EpCAM при регенерации и неоплазии
Если в нормальных гепатоцитах EpCAM не экспрессируется, то в так называемых регенераторных кластерах, которые включают гепатоциты, холангиоциты и клетки-предшественники, играет важную роль в регенерации печени [41]. В плоском эпителии шейки матки экспрессия EpCAM увеличивалась от интраэпителиальной неоплазии низкой степени до высокой степени и коррелировала с повышенной пролиферацией [42]. В предстательной железе экспрессия EpCAM также увеличивалась в ряду «нормальная ткань – интраэпителиальная неоплазия – аденокарцинома» [43, 44]. Экспрессия EpCAM наблюдалась при доброкачественных заболеваниях [45].
Экспрессия EpCAM в карциномах
EpCAM экспрессируется в карциномах с разной степенью выраженности. Самые высокие уровни экспрессии EpCAM наблюдаются в аденокарциномах поджелудочной железы, толстой кишки и простаты [47]. В отличие от других карцином при раке простаты наблюдалось снижение экспрессии ядерного EpICD и мембранного EpEX по сравнению с доброкачественной гиперплазией предстательной железы и нормальными тканями предстательной железы [48]. R. Ralhan et al. (2010) описывают ядерную и цитоплазматическую экспрессию EpICD при РМЖ, предстательной железы, при раке головы и шеи, пищевода, легких, толстой кишки, печени, мочевого пузыря, поджелудочной железы и яичников. В соответствующих нормальных тканях отмечена мембранная экспрессия, но отсутствовала внутриклеточная [49].
Экспрессия EpCAM при карциномах ассоциирована как с неблагоприятным, так и с благоприятным прогнозом
В качестве аргумента в пользу благоприятной ассоциации экспрессии EpCAM B.T. van der Gun et al. (2010) приводят данные о том, что при светлоклеточном раке почки в метастазах экспрессия EpCAM была редкой, а в первичной опухоли – выраженной, и это было связано с лучшей выживаемостью. При раке щитовидной железы аргументом считали низкую экспрессию EpCAM в менее дифференцированных опухолях и корреляцию высокой экспрессии с улучшением выживаемости [21]. Стоит согласиться с авторами, что снижение экспрессии EpCAM в этих опухолях может отражать общую дедифференцировку опухоли. По-видимому, лучший прогноз высокой экспрессии EpCAM при раке почки и щитовидной железы связан не столько со специфическими эффектами EpCAM, сколько с более высокой степенью дифференцировки. Отсутствие связи экспрессии EpCAM с клинико-патологическими характеристиками отмечено и при аденокарциноме легкого [43, 57]. Противоречива информация о роли EpCAM при раке пищевода. При плоскоклеточном раке пищевода выраженная экспрессия EpCAM связана с высокими показателями выживаемости [58]. В противоположность этому, по данным N.H. Stoecklein et al., высокий уровень экспрессии EpCAM при раке пищевода рассматривается как независимый прогностический фактор снижения выживаемости [59].
Экспрессия EpCAM при разных молекулярно-биологических подтипах РМЖ
Накопление EpICD в ядре на ранней стадии РМЖ предсказывает агрессивное клиническое течение [55]. При первичном и метастатическом РМЖ EpCAM сверхэкспрессируется в 100–1000 раз. Подавление экспрессии EpCAM с помощью короткой интерферирующей РНК приводило к снижению пролиферативной способности четырех клеточных линий РМЖ, ингибировало миграционные и инвазивные свойства клеток линии рака молочной железы MDA-MB-23, а также увеличивало белковую экспрессию E-кадгерина и бета-катенина [60]. Оказалось, что экспрессия EpCAM имеет обратную зависимость от экспрессии эстрогена и положительную связь с экспрессией HER2 [61].
В исследовании S.D. Soysal et al. (2013) показано, что в группе с EpCAM-положительным РМЖ чаще, чем в группе с EpCAM-отрицательным, встречались случаи с III степенью злокачественности, со средним размером опухоли pT3–pT4 и с лимфогенными метастазами (pN2). Частота EpCAM-положительных и EpCAM-отрицательных случаев была не одинаковой при разных молекулярнобиологических подтипах РМЖ. При HER2-позитивном и базальноподобном подтипах чаще встречались EpCAM-положительные случаи. При люминальном В HER2-негативном раке различий не было. При люминальном А и люминальном В HER2-позитивном подтипах чаще встречаются EpCAM-отрицательные случаи [61]. Ассоциация экспрессии EpCAM с общей выживаемостью также зависела от молекулярно-биологического подтипа РМЖ. Отсутствовала зависимость при люминальном А подтипе. Экспрессия была связана с худшей выживаемостью при люминальном В HER2-негативном, люминальном В HER2-позитивном и базальноподобном подтипах. Парадоксальным образом при HER2-позитивном РМЖ выживаемость была лучше [61].
Клиническое значение EpCAMlow и EpCAMloss ЦОК
Если исследователи ставили перед собой цель выявлять не только ЦОК с выраженной, но и со слабой экспрессией EpCAM, то такие клетки обычно обнаруживали в достаточно большом количестве. Многие из используемых антител против EpCAM не имеют идентифицированного сайта связывания антигена. Например, среди пациентов с раком простаты 53 % имели ≥5 EpCAMhigh ЦОК, а 28 % – ≥5 EpCAMlow ЦОК. У пациенток с РМЖ в 32 % случаев имелись ≥5 EpCAMhigh ЦОК и 36 % – ≥5 EpCAMlow ЦОК [62]. Снижение экспрессии EpCAM (EpCAMlow) может быть проявлением частичного (гибридного) ЭМП [10, 63, 64].
Не обнаруживаемые с помощью «CellSearch» EpCAM-отрицательные ЦОК коррелируют с плохим прогнозом при колоректальном раке у пациентов, получавших антиангиогенную терапию, а также с метастазами в головной мозг при тройном негативном РМЖ [69, 70]. Выявление с помощью проточной цитометрии EpCAM-отрицательных ЦОК наблюдалось у пациентов с РМЖ со значительно сниженной общей выживаемостью [71].
EpCAM в ЦОК и диссеминированных опухолевых клетках
Количественное сравнение экспрессии EpCAM на шести клеточных линиях, на ЦОК и клетках первичной опухоли при карциноме молочной железы позволило авторам сделать заключение о
10-кратном снижении экспрессии EpCAM в ЦОК по сравнению с первичными опухолями [37]. Для выделения, как полагают авторы, «мезенхимальных» ЦОК (метастатического типа) используют комбинацию антител против EpCAM и виментина [72]. Ксенотрансплантаты клеточных линий РМЖ в месте инъекции мышам и в метастазах экспрессировали мРНК EpCAM, в то время как в ЦОК она отсутствовала, снижаясь в течение 1 ч после инъекции в кровоток [34].
EpCAM в метастазах
Данные об экспрессии EpCAM в метастазах противоречивы. Экспрессия EpCAM в метастазах при раке почки была ниже по сравнению с первичными опухолями [75]. При РМЖ и простаты, наоборот, более высокая экспрессия EpCAM наблюдалась в метастатических поражениях по сравнению с первичными опухолями [76, 77]. В рецидивных и метастатических опухолях карцином яичника наблюдались более высокие уровни экспрессии EpCAM по сравнению с первичными опухолями [78]. Экспрессия EpCAM в метастазах карциномы толстой кишки зависела от величины метастаза: небольшие метастазы были EpCAM-негативными, в больших метастазах определялся такой же уровень экспрессии, как и в первичной опухоли [79].
Обсуждение
Таким образом, многочисленные исследования позволяют считать, что EpCAM играет заметную роль в канцерогенезе и прогрессировании опухоли, включая развитие метастазов при различных типах карцином. EpCAM служит основным маркером ЦОК, позволяющим выделять и изучать их. Многое в механизмах участия EpCAM-положительных ЦОК остается недостаточно изученным. Однако еще меньше информации о слабо экспрессирующих или вовсе не экспрессирующих EpCAM ЦОК.
Обобщение известных фактов дает представление о множественности ситуаций, при которых в разных компартментах клеток карцином могут обнаруживаться различные домены EpCAM или молекула в целом. Результат зависит от специфичности антител и метода исследования. Возможности исследования EpCAM ограничены, поскольку используемые антитела, как правило, специфичны к внеклеточному домену EpCAM [9].
Многие из используемых против EpCAM антител не имеют идентифицированного сайта связывания антигена. Вследствие этого затруднительна интерпретация результатов обнаружения EpCAM внутри клеток при иммуногистохимических исследованиях и при использовании проточной цитометрии с предварительной пермеабилиза-цией клеток. Нормальным является наличие в клетке EpICD вследствие RIP опосредованного протеолиза EpCAM. Однако описано наличие внеклеточного и трансмембранного доменов, при отсутствии в клетках EpICD. Предполагают, что отсутствие EpCAM в цитоплазме и ядре клетки может быть обусловлено двумя процессами: отсутствием RIP-опосредованного протеолиза EpCAM, вследствие чего нет внутриклеточного EpICD, или RIP-независимой деградацией EpICD. При RIP-независимой активации EpCAM, которая приводит к избирательной деградации EpICD, на клеточной поверхности сохраняется EpEX [13].
Поскольку активация EpCAM-связанных функций сопряжена с протеолизом, который сопровождается, в частности, отщеплением внеклеточного домена, важно понимание механизма этого процесса. Становится понятным, что клетка с активацией EpCAM временно может определяться как EpCAM-отрицательная.
В связи с множественностью механизмов потери мембранной экспрессии EpCAM, во-первых, без достаточной глубины исследования затруднительна правильная интерпретация результатов, во-вторых, в части случаев множественность механизмов объясняет противоречивость результатов исследований. Можно назвать шесть причин отсутствия мембранной экспрессии EpCAM. Существование части из них не вызывает сомнения, наличие других скорее предполагается, наконец, третья группа включает мнимое отсутствие мембранной экспрессии EpCAM, связанное с методами определения. К первым относятся RIP, ЭМП, эн-доцитоз и подавление транскрипции гена EpCAM из-за гиперметилирования его промотора. Скорее, предполагаемым является подавление экспрессии EpCAM при интравазации. Третья группа причин связана либо с экспрессией изоформ EpCAM, либо с изменением эпитопов EpCAM под влиянием химиотерапии. В результате используемые антитела теряют аффинность к антигенам и не могут связаться с эпитопами антигена EpCAM.
Имеются косвенные аргументы в пользу возможности потери экспрессии EpCAM при интра-вазации. Несмотря на гетерогенность экспрессии EpCAM в ЦОК от гипер- до слабовыраженной и полного отсутствия, следует обратить внимание на исследования, демонстрирующие снижение по сравнению с первичной опухолью степени экспрессии белка как в ЦОК, так и в диссеминированных опухолевых клетках. Эти результаты вместе со знанием о наличии среди ЦОК EpCAMlow и EpCAМloss клеток можно рассматривать как аргумент в пользу высокой вероятности того, что по крайней мере у части клеток опухоли при интра-вазации уменьшается количество молекул EpCAM на мембране. Хотя данные об уровне экспрессии EpCAM в метастазах по сравнению с первичной опухолью неоднозначны, имеются данные, которые тоже можно отнести в пользу возможности потери EpCAM при интравазации. Это касается наблюдения, в котором экспрессия EpCAM в метастазах карциномы толстой кишки зависела от величины метастаза: в небольших метастазах она отсутствовала, а в больших была такой же, как и в первичной опухоли.
Все механизмы потери мембранной экпрессии EpCAM, с которой связана вероятность локализации доменов в цитоплазме и ядре, можно разделить на две группы: имеющие патогенетическое значение для прогрессирования карцином и не влияющие на ее развитие. К патогенетически значимым относятся механизмы, реализуемые при RIP, ЭМП, эндоцитозе и подавлении транскрипции гена EpCAM. Реализация этих механизмов будет способствовать или препятствовать выполнению основных биологических функций EpCAM (регуляция генов, пролиферация, участие в ЭМП, приобретение стволовых свойств и взаимодействие с молекулами клеточной адгезии).
Результаты изучения клинического значения отсутствия мембранной экспрессии EpCAM противоречивы. Наряду с данными об отсутствии его значимой связи с клиническими проявлениями, есть указания на ассоциацию EpCAMотрица-тельных ЦОК со значительно сниженной общей выживаемостью при раке молочной железы и у пациентов с метастазами в головной мозг при тройном негативном РМЖ.
Кроме названных механизмов/причин отсутствия мембранной экспрессии EpCAM при интерпретации результатов изучения EpCAM в клетках карцином, следует учитывать аберрантный характер его экспрессии. Если в нормальных эпителиальных тканях EpCAM экспрессируется на базолатеральной мембране, то в карциномах наблюдается мембранная экспрессия на всей поверхности клетки, часто также сочетающаяся с цитоплазматическим окрашиванием. Остается неизвестным, насколько аберрантно экспрессируемый EpCAM способен выполнять функции, связанные с опухолевым прогрессированием.
Чтобы понять значение исчезновения мембранной экспрессии EpCAM, как и обнаружения его доменов внутри клеток, полезно было бы знать механизм потери в каждом случае. Это позволило бы понять, способен ли он выполнять одну или нескольких вышеназванных функций EpCAM. Такой подход помог бы объяснить противоречивость результатов, характеризующих роль EpCAM в прогрессировании при разных карциномах.
Из приведенного в обзоре материала следует, что имеются факты, связывающие с плохим или более благоприятным прогнозом течения карцином либо повышенную экспрессию EpCAM в целом, либо ядерную локализацию EpICD. Анализ этих фактов выявляет ассоциации, которые вряд ли являются случайными, между плохим или благоприятным прогнозом и повышенной экспрессией EpCAM в карциномах, с одной стороны, и выраженностью экспрессии EpCAM в нормальных тканях – источниках карцином – с другой. Из 5 карцином, при которых гиперэкспрессия EpCAM связана с плохим прогнозом, – четыре (РМЖ, яичников, поджелудочной железы и мочевого пузыря) возникают в органах с низкой экспрессией EpCAM в условиях нормы и только карцинома желчного пузыря развивается в ткани с высоким уровнем экспрессии EpCAM в нормальной ткани.
Благоприятный же прогноз гиперэкспрессии EpCAM для карцином с исходно высоким уровнем его экспрессии в нормальных тканях может быть сопряжен с более высоким уровнем дифференцировки в этих случаях, маркером которой и является сохранение способности к экспрессии EpCAM. Предотвращение дедифференцировки в этих случаях, по-видимому, имеет большее значение для
Список литературы Патогенетическое и клиническое значение особенностей экспрессии EPCАM в опухоли и циркулирующих опухолевых клетках
- Brown T.C., Sankpal N.V., Gillanders W.E. Functional Implications of the Dynamic Regulation of EpCAM during Epithelial-toMesenchymal Transition. Biomolecules. 2021; 11(7): 956. https://doi.org/10.3390/biom11070956.
- Perelmuter V.M., Grigoryeva E.S., Savelieva O.E., Alifanov V.V., Andruhova E.S., Zavyalova M.V., Bragina O.D., Garbukov E.Y., Menyailo M.E., Khozyainova A.A., Denisov E.V., Cherdyntseva N.V., Tashireva L.A. EpCAM-CD24+ circulating cells associated with poor prognosis in breast cancer patients. Sci Rep. 2024; 14(1). https://doi.org/10.1038/s41598-024-61516-2.
- Yahyazadeh Mashhadi S.M., Kazemimanesh M., Arashkia A., Azadmanesh K., Meshkat Z., Golichenari B., Sahebkar A. Shedding light on the EpCAM: An overview. J Cell Physiol. 2019; 234(8): 12569-80. https://doi.org/10.1002/jcp.28132.
- Nicolazzo C., Raimondi C., Francescangeli F., Ceccarelli S., Trenta P., Magri V., Marchese C., Zeuner A., Gradilone A., Gazzaniga P. EpCAM-expressing circulating tumor cells in colorectal cancer. Int J Biol Markers. 2017; 32(4): 415-20. https://doi.org/10.5301/ijbm.5000284.
- Mohtar M.A., Syafruddin S.E., Nasir S.N., Low T.Y. Revisiting the Roles of Pro-Metastatic EpCAM in Cancer. Biomolecules. 2020; 10(2). https://doi.org/10.3390/biom10020255.
- The Cancer Genome Atlas Program (TCGA) [Internet]. Center for Cancer Genomics at the National Cancer Institute. [cited 2024 Sep 2]. URL: https://www.cancer.gov/tcga.
- Hatami R., Sieuwerts A.M., Izadmehr S., Yao Z., Qiao R.F., Papa L., Look M.P., Smid M., Ohlssen J., Levine A.C., Germain D., Burstein D., Kirschenbaum A., DiFeo A., Foekens J.A., Narla G. KLF6-SV1 drives breast cancer metastasis and is associated with poor survival. Sci Transl Med. 2013; 5(169). https://doi.org/10.1126/scitranslmed.3004688.
- Schnell U., Cirulli V., Giepmans B.N. EpCAM: structure and function in health and disease. Biochim Biophys Acta. 2013; 1828(8): 1989-2001. https://doi.org/10.1016/j.bbamem.2013.04.018.
- Raimondi C., Nicolazzo C., Gradilone A. Circulating tumor cells isolation: the “post-EpCAM era”. Chin J Cancer Res. 2015; 27(5): 461-70. https://doi.org/10.3978/j.issn.1000-9604.2015.06.02.
- Eslami-S Z., Cortés-Hernández L.E., Alix-Panabières C. Epithelial Cell Adhesion Molecule: An Anchor to Isolate Clinically Relevant Circulating Tumor Cells. Cells. 2020; 9(8). https://doi.org/10.3390/cells9081836.
- Paschkowsky S., Hsiao J.M., Young J.C., Munter L.M. The discovery of proteases and intramembrane proteolysis 1. Biochem Cell Biol. 2019; 97(3): 265-9. https://doi.org/10.1139/bcb-2018-0186.
- Liang K.H., Tso H.C., Hung S.H., Kuan I.I., Lai J.K., Ke F.Y., Chuang Y.T., Liu I.J., Wang Y.P., Chen R.H., Wu H.C. Extracellular domain of EpCAM enhances tumor progression through EGFR signaling in colon cancer cells. Cancer Lett. 2018; 433: 165-75. https://doi.org/10.1016/j.canlet.2018.06.040.
- Gires O., Stoecklein N.H. Dynamic EpCAM expression on circulating and disseminating tumor cells: causes and consequences. Cell Mol Life Sci. 2014; 71(22): 4393-402. https://doi.org/10.1007/s00018-014-1693-1.
- Huang Y., Chanou A., Kranz G., Pan M., Kohlbauer V., Ettinger A., Gires O. Membrane-associated epithelial cell adhesion molecule is slowly cleaved by γ-secretase prior to efcient proteasomal degradation of its intracellular domain. J Biol Chem. 2019; 294(9): 3051-64. https://doi.org/10.1074/jbc.RA118.005874.
- Gerlach J.C., Foka H.G., Thompson R.L., Gridelli B., Schmelzer E. Epithelial cell adhesion molecule fragments and signaling in primary human liver cells. J Cell Physiol. 2018; 233(6): 4841-51. https://doi.org/10.1002/jcp.26286.
- Schnell U., Kuipers J., Giepmans B.N. EpCAM proteolysis: new fragments with distinct functions? Biosci Rep. 2013; 33(2). https://doi.org/10.1042/BSR20120128.
- Ralhan R., Cao J., Lim T., Macmillan C., Freeman J.L., Walfsh P.G. EpCAM nuclear localization identifes aggressive thyroid cancer and is a marker for poor prognosis. BMC Cancer. 2010; 10. https://doi.org/10.1186/1471-2407-10-331.
- Hachmeister M., Bobowski K.D., Hogl S., Dislich B., Fukumori A., Eggert C., Mack B., Kremling H., Sarrach S., Coscia F., Zimmermann W., Steiner H., Lichtenthaler S.F., Gires O. Regulated intramembrane proteolysis and degradation of murine epithelial cell adhesion molecule mEpCAM. PLoS One. 2013; 8(8). https://doi.org/10.1371/journal.pone.0071836.
- Fong D., Moser P., Kasal A., Seeber A., Gastl G., Martowicz A., Wurm M., Mian C., Obrist P., Mazzoleni G., Spizzo G. Loss of membranous expression of the intracellular domain of EpCAM is a frequent event and predicts poor survival in patients with pancreatic cancer. Histopathology. 2014; 64(5): 683-92. https://doi.org/10.1111/his.12307.
- Winter M.J., Nagelkerken B., Mertens A.E., Rees-Bakker H.A., Briaire-de Bruijn I.H., Litvinov S.V. Expression of Ep-CAM shifts the state of cadherin-mediated adhesions from strong to weak. Exp Cell Res. 2003; 285(1): 50-8. https://doi.org/10.1016/s0014-4827(02)00045-9.
- van der Gun B.T., Melchers L.J., Ruiters M.H., de Leij L.F., McLaughlin P.M., Rots M.G. EpCAM in carcinogenesis: the good, the bad or the ugly. Carcinogenesis. 2010; 31(11): 1913-21. https://doi.org/10.1093/carcin/bgq187.
- Chaves-Perez A., Mack B., Maetzel D., Kremling H., Eggert C., Harreus U., Gires O. EpCAM regulates cell cycle progression via control of cyclin D1 expression. Oncogene. 2013; 32(5): 641-50. https://doi.org/10.1038/onc.2012.75.
- Maaser K., Borlak J. A genome-wide expression analysis identifes a network of EpCAM-induced cell cycle regulators. Br J Cancer. 2008; 99(10): 1635-43. https://doi.org/10.1038/sj.bjc.6604725.
- Pan M., Schinke H., Luxenburger E., Kranz G., Shakhtour J., Libl D., Huang Y., Gaber A., Pavšič M., Lenarčič B., Kitz J., Jakob M., Schwenk-Zieger S., Canis M., Hess J., Unger K., Baumeister P., Gires O. EpCAM ectodomain EpEX is a ligand of EGFR that counteracts EGFmediated epithelial-mesenchymal transition through modulation of phospho-ERK1/2 in head and neck cancers. PLoS Biol. 2018; 16(9). https://doi.org/10.1371/journal.pbio.2006624.
- Lin C.W., Liao M.Y., Lin W.W., Wang Y.P., Lu T.Y., Wu H.C. Epithelial cell adhesion molecule regulates tumor initiation and tumorigenesis via activating reprogramming factors and epithelial-mesenchymal transition gene expression in colon cancer. J Biol Chem. 2012; 287(47): 39449-59. https://doi.org/10.1074/jbc.M112.386235.
- Driemel C., Kremling H., Schumacher S., Will D., Wolters J., Lindenlauf N., Mack B., Baldus S.A., Hoya V., Pietsch J.M., Panagiotidou P., Raba K., Vay C., Vallböhmer D., Harréus U., Knoefel W.T., Stoecklein N.H., Gires O. Context-dependent adaption of EpCAM expression in early systemic esophageal cancer. Oncogene. 2014; 33(41): 4904-15. https://doi.org/10.1038/onc.2013.441.
- Martowicz A., Spizzo G., Gastl G., Untergasser G. Phenotype-dependent efects of EpCAM expression on growth and invasion of human breast cancer cell lines. BMC Cancer. 2012; 12. https://doi.org/10.1186/1471-2407-12-501.
- Gosens M.J., van Kempen L.C., van de Velde C.J., van Krieken J.H., Nagtegaal I.D. Loss of membranous Ep-CAM in budding colorectal carcinoma cells. Mod Pathol. 2007; 20(2): 221-32. https://doi.org/10.1038/modpathol.3800733.
- Shi R., Liu L., Wang F., He Y., Niu Y., Wang C., Zhang X., Zhang X., Zhang H., Chen M., Wang Y. Down-regulation of cytokeratin 18 induces cellular partial EMT and stemness through increasing EpCAM expression in breast cancer. Cell Signal. 2020; 76. https://doi.org/10.1016/j.cellsig.2020.109810.
- Huang H.P., Chen P.H., Yu C.Y., Chuang C.Y., Stone L., Hsiao W.C., Li C.L., Tsai S.C., Chen K.Y., Chen H.F., Ho H.N., Kuo H.C. Epithelial cell adhesion molecule (EpCAM) complex proteins promote transcription factor-mediated pluripotency reprogramming. J Biol Chem. 2011; 286(38): 33520-32. https://doi.org/10.1074/jbc.M111.256164.
- Zhang D., Yang L., Liu X., Gao J., Liu T., Yan Q., Yang X. Hypoxia modulates stem cell properties and induces EMT through N-glycosylation of EpCAM in breast cancer cells. J Cell Physiol. 2020; 235(4): 3626-33. https://doi.org/10.1002/jcp.29252.
- Nicolazzo C., Massimi I., Lotti L.V., Vespa S., Raimondi C., Pulcinelli F.M., Gradilone A., Gazzaniga P. Impact of chronic exposure to bevacizumab on EpCAM-based detection of circulating tumor cells. Chin J Cancer Res. 2015; 27(5): 491-6. https://doi.org/10.3978/j.issn.1000-9604.2015.04.09.
- Lu T.Y., Lu R.M., Liao M.Y., Yu J., Chung C.H., Kao C.F., Wu H.C. Epithelial cell adhesion molecule regulation is associated with the maintenance of the undiferentiated phenotype of human embryonic stem cells. J Biol Chem. 2010; 285(12): 8719-32. https://doi.org/10. 1074/jbc.M109.077081.
- Gorges T.M., Tinhofer I., Drosch M., Röse L., Zollner T.M., Krahn T., von Ahsen O. Circulating tumour cells escape from EpCAMbased detection due to epithelial-to-mesenchymal transition. BMC Cancer. 2012; 12. https://doi.org/10.1186/1471-2407-12-178.
- Königsberg R., Obermayr E., Bises G., Pfeiler G., Gneist M., Wrba F., de Santis M., Zeillinger R., Hudec M., Dittrich C. Detection of EpCAM positive and negative circulating tumor cells in metastatic breast cancer patients. Acta Oncol. 2011; 50(5). https://doi.org/10.3109/0284186X.2010.549151.
- Alberti S., Ambrogi F., Boracchi P., Fornili M., Querzoli P., Pedriali M., La Sorda R., Lattanzio R., Tripaldi R., Piantelli M., Biganzoli E., Coradini D. Cytoplasmic Trop-1/Ep-CAM overexpression is associated with a favorable outcome in node-positive breast cancer. Jpn J Clin Oncol. 2012; 42(12): 1128-37. https://doi.org/10.1093/jjco/hys159.
- Rao C.G., Chianese D., Doyle G.V., Miller M.C., Russell T., Sanders R.A. Jr, Terstappen L.W. Expression of epithelial cell adhesion molecule in carcinoma cells present in blood and primary and metastatic tumors. Int J Oncol. 2005; 27(1): 49-57.
- Seeber A., Untergasser G., Spizzo G., Terracciano L., Lugli A., Kasal A., Kocher F., Steiner N., Mazzoleni G., Gastl G., Fong D. Predominant expression of truncated EpCAM is associated with a more aggressive phenotype and predicts poor overall survival in colorectal cancer. Int J Cancer. 2016; 139(3): 657-63. https://doi.org/10.1002/ijc.30099.
- The human protein atlas. [Internet]. [cited 2024 Sep 2]. URL: https://www.proteinatlas.org/ENSG00000119888-EPCAM/tissue.
- Bantikassegn A., Song X., Politi K. Isolation of epithelial, endothelial, and immune cells from lungs of transgenic mice with oncogeneinduced lung adenocarcinomas. Am J Respir Cell Mol Biol. 2015; 52(4): 409-17. https://doi.org/10.1165/rcmb.2014-0312MA.
- Hattoum A., Rubin E., Orr A., Michalopoulos G.K. Expression of hepatocyte epidermal growth factor receptor, FAS and glypican 3 in EpCAM-positive regenerative clusters of hepatocytes, cholangiocytes, and progenitor cells in human liver failure. Hum Pathol. 2013; 44(5): 743-9. https://doi.org/10.1016/j.humpath.2012.07.018.
- Litvinov S.V., van Driel W., van Rhijn C.M., Bakker H.A., van Krieken H., Fleuren G.J., Warnaar S.O. Expression of Ep-CAM in cervical squamous epithelia correlates with an increased proliferation and the disappearance of markers for terminal diferentiation. Am J Pathol. 1996; 148(3): 865-75.
- Went P., Vasei M., Bubendorf L., Terracciano L., Tornillo L., Riede U., Kononen J., Simon R., Sauter G., Baeuerle P.A. Frequent highlevel expression of the immunotherapeutic target Ep-CAM in colon, stomach, prostate and lung cancers. Br J Cancer. 2006; 94(1): 128-35. https://doi.org/10.1038/sj.bjc.6602924.
- Poczatek R.B., Myers R.B., Manne U., Oelschlager D.K., Weiss H.L., Bostwick D.G., Grizzle W.E. Ep-Cam levels in prostatic adenocarcinoma and prostatic intraepithelial neoplasia. J Urol. 1999; 162(4): 1462-6.
- Gabriel M.T., Calleja L.R., Chalopin A., Ory B., Heymann D. Circulating Tumor Cells: A Review of Non-EpCAM-Based Approaches for Cell Enrichment and Isolation. Clin Chem. 2016; 62(4): 571-81. https://doi.org/10.1373/clinchem.2015.249706.
- Yanamoto S., Kawasaki G., Yoshitomi I., Iwamoto T., Hirata K., Mizuno A. Clinicopathologic significance of EpCAM expression in squamous cell carcinoma of the tongue and its possibility as a potential target for tongue cancer gene therapy. Oral Oncol. 2007; 43(9): 869-77. https://doi.org/10.1016/j.oraloncology.2006.10.010.
- Went P.T., Lugli A., Meier S., Bundi M., Mirlacher M., Sauter G., Dirnhofer S. Frequent EpCam protein expression in human carcinomas. Hum Pathol. 2004; 35(1): 122-8. https://doi.org/10.1016/j.humpath.2003.08.026.
- Assi J., Srivastava G., Matta A., MacMillan C., Ralhan R., Walfsh P.G. Nuclear Ep-ICD expression is a predictor of poor prognosis in “low risk” prostate adenocarcinomas. PLoS One. 2015; 10(2). https://doi.org/10.1371/journal.pone.0107586.
- Ralhan R., He H.C., So A.K., Tripathi S.C., Kumar M., Hasan M.R., Kaur J., Kashat L., MacMillan C., Chauhan S.S., Freeman J.L., Walfsh P.G. Nuclear and cytoplasmic accumulation of Ep-ICD is frequently detected in human epithelial cancers. PLoS One. 2010; 5(11). https://doi.org/10.1371/journal.pone.0014130.
- Fan Q., Cheng J.C., Qiu X., Chang H.M., Leung P.C. EpCAM is up-regulated by EGF via ERK1/2 signaling and suppresses human epithelial ovarian cancer cell migration. Biochem Biophys Res Commun. 2015; 457(3): 256-61. https://doi.org/10.1016/j.bbrc.2014.12.097.
- Spizzo G., Went P., Dirnhofer S., Obrist P., Simon R., Spichtin H., Maurer R., Metzger U., von Castelberg B., Bart R., Stopatschinskaya S., Köchli O.R., Haas P., Mross F., Zuber M., Dietrich H., Bischoff S., Mirlacher M., Sauter G., Gastl G. High Ep-CAM expression is associated with poor prognosis in node-positive breast cancer. Breast Cancer Res Treat. 2004; 86(3): 207-13. https://doi.org/10.1023/B:BREA.0000036787.59816.01.
- Spizzo G., Went P., Dirnhofer S., Obrist P., Moch H., Baeuerle P.A., Mueller-Holzner E., Marth C., Gastl G., Zeimet A.G. Overexpression of epithelial cell adhesion molecule (Ep-CAM) is an independent prognostic marker for reduced survival of patients with epithelial ovarian cancer. Gynecol Oncol. 2006; 103(2): 483-8. https://doi.org/10.1016/j.ygyno.2006.03.035.
- Somasundaram R.T., Kaur J., Leong I., MacMillan C., Witterick I.J., Walfsh P.G., Ralhan R. Subcellular diferential expression of Ep-ICD in oral dysplasia and cancer is associated with disease progression and prognosis. BMC Cancer. 2016; 16. https://doi.org/10.1186/s12885-016-2507-7.
- Kunavisarut T., Kak I., Macmillan C., Ralhan R., Walfsh P.G. Immunohistochemical analysis based Ep-ICD subcellular localization index (ESLI) is a novel marker for metastatic papillary thyroid microcarcinoma. BMC Cancer. 2012; 12. https://doi.org/10.1186/1471-2407-12-523.
- Srivastava G., Assi J., Kashat L., Matta A., Chang M., Walfsh P.G., Ralhan R. Nuclear Ep-ICD accumulation predicts aggressive clinical course in early stage breast cancer patients. BMC Cancer. 2014; 14. https://doi.org/10.1186/1471-2407-14-726.
- Songun I., Litvinov S.V., van de Velde C.J., Pals S.T., Hermans J., van Krieken J.H. Loss of Ep-CAM (CO17-1A) expression predicts survival in patients with gastric cancer. Br J Cancer. 2005; 92(9): 1767-72. https://doi.org/10.1038/sj.bjc.6602519.
- Kim Y., Kim H.S., Cui Z.Y., Lee H.S., Ahn J.S., Park C.K., Park K., Ahn M.J. Clinicopathological implications of EpCAM expression in adenocarcinoma of the lung. Anticancer Res. 2009; 29(5): 1817-22.
- Kimura H., Kato H., Faried A., Sohda M., Nakajima M., Fukai Y., Miyazaki T., Masuda N., Fukuchi M., Kuwano H. Prognostic signifcance of EpCAM expression in human esophageal cancer. Int J Oncol. 2007; 30(1): 171-9.
- Stoecklein N.H., Siegmund A., Scheunemann P., Luebke A.M., Erbersdobler A., Verde P.E., Eisenberger C.F., Peiper M., Rehders A., Esch J.S., Knoefel W.T., Hosch S.B. Ep-CAM expression in squamous cell carcinoma of the esophagus: a potential therapeutic target and prognostic marker. BMC Cancer. 2006; 6. https://doi.org/10.1186/1471-2407-6-165.
- Osta W.A., Chen Y., Mikhitarian K., Mitas M., Salem M., Hannun Y.A., Cole D.J., Gillanders W.E. EpCAM is overexpressed in breast cancer and is a potential target for breast cancer gene therapy. Cancer Res. 2004; 64(16): 5818-24. https://doi.org/10.1158/0008-5472.CAN-04-0754.
- Soysal S.D., Muenst S., Barbie T., Fleming T., Gao F., Spizzo G., Oertli D., Viehl C.T., Obermann E.C., Gillanders W.E. EpCAM expression varies signifcantly and is diferentially associated with prognosis in the luminal B HER2(+), basal-like, and HER2 intrinsic subtypes of breast cancer. Br J Cancer. 2013; 108(7): 1480-7. https://doi.org/10.1038/bjc.2013.80.
- de Wit S., Manicone M., Rossi E., Lampignano R., Yang L., Zill B., Rengel-Puertas A., Ouhlen M., Crespo M., Berghuis A.M.S., Andree K.C., Vidotto R., Trapp E.K., Tzschaschel M., Colomba E., Fowler G., Flohr P., Rescigno P., Fontes M.S., Zamarchi R., Fehm T., Neubauer H., Rack B., Alunni-Fabbroni M., Farace F., De Bono J., IJzerman M.J., Terstappen L.W.M.M. EpCAMhigh and EpCAMlow circulating tumor cells in metastatic prostate and breast cancer patients. Oncotarget. 2018; 9(86): 35705-16. https://doi.org/10.18632/oncotarget.26298.
- Frederick B.A., Helfrich B.A., Coldren C.D., Zheng D., Chan D., Bunn P.A. Jr, Raben D. Epithelial to mesenchymal transition predicts geftinib resistance in cell lines of head and neck squamous cell carcinoma and non-small cell lung carcinoma. Mol Cancer Ther. 2007; 6(6): 1683-91. https://doi.org/10.1158/1535-7163.MCT-07-0138.
- Santisteban M., Reiman J.M., Asiedu M.K., Behrens M.D., Nassar A., Kalli K.R., Haluska P., Ingle J.N., Hartmann L.C., Manjili M.H., Radisky D.C., Ferrone S., Knutson K.L. Immune-induced epithelial to mesenchymal transition in vivo generates breast cancer stem cells. Cancer Res; 69(7): 2887-95. https://doi.org/10.1158/0008-5472.CAN-08-3343.
- de Wit S., van Dalum G., Lenferink A.T., Tibbe A.G., Hiltermann T.J., Groen H.J., van Rijn C.J., Terstappen L.W. The detection of EpCAM(+) and EpCAM(-) circulating tumor cells. Sci Rep. 2015; 5. https://doi.org/10.1038/srep12270.
- Nicolazzo C., Gradilone A., Loreni F., Raimondi C., Gazzaniga P. EpCAMlow Circulating Tumor Cells: Gold in the Waste. Dis Markers. 2019. https://doi.org/10.1155/2019/1718920.
- Miki Y., Yashiro M., Okuno T., Kitayama K., Tamura T., Toyokawa T., Tanaka H., Muguruma K., Hirakawa K., Ohira M. Clinical signifcance of EpCAM-negative and CEA-positive circulating tumor cells in gastric carcinoma. Cancer Research. 2017; 77(13). https://doi.org/10.1158/1538-7445.AM2017-3791.
- Wen K.C., Sung P.L., Chou Y.T., Pan C.M., Wang P.H., Lee O.K., Wu C.W. The role of EpCAM in tumor progression and the clinical prognosis of endometrial carcinoma. Gynecol Oncol. 2018; 148(2): 383-92. https://doi.org/10.1016/j.ygyno.2017.11.033.
- Gazzaniga P., Raimondi C., Gradilone A., Di Seri M., Longo F., Cortesi E., Frati L. Circulating tumor cells, colon cancer and bevacizumab: the meaning of zero. Ann Oncol. 2011; 22(8): 1929-30. https://doi.org/10.1093/annonc/mdr292.
- Mego M., De Giorgi U., Dawood S., Wang X., Valero V., Andreopoulou E., Handy B., Ueno N.T., Reuben J.M., Cristofanilli M. Characterization of metastatic breast cancer patients with nondetectable circulating tumor cells. Int J Cancer. 2011; 129(2): 417-23. https://doi.org/10.1002/ijc.25690.
- Lustberg M.B., Balasubramanian P., Miller B., Garcia-Villa A., Deighan C., Wu Y., Carothers S., Berger M., Ramaswamy B., Macrae E.R., Wesolowski R., Layman R.M., Mrozek E., Pan X., Summers T.A., Shapiro C.L., Chalmers J.J. Heterogeneous atypical cell populations are present in blood of metastatic breast cancer patients. Breast Cancer Res. 2014; 16(2). https://doi.org/10.1186/bcr3622.
- Satelli A., Brownlee Z., Mitra A., Meng Q.H., Li S. Circulating tumor cell enumeration with a combination of epithelial cell adhesion molecule- and cell-surface vimentin-based methods for monitoring breast cancer therapeutic response. Clin Chem. 2015; 61(1): 259-66. https://doi.org/10.1373/clinchem.2014.228122.
- Steinert G., Schölch S., Niemietz T., Iwata N., García S.A., Behrens B., Voigt A., Kloor M., Benner A., Bork U., Rahbari N.N., Büchler M.W., Stoecklein N.H., Weitz J., Koch M. Immune escape and survival mechanisms in circulating tumor cells of colorectal cancer. Cancer Res. 2014; 74(6): 1694-704. https://doi.org/10.1158/0008-5472.CAN-13-1885.
- Scheunemann P., Stoecklein N.H., Hermann K., Rehders A., Eisenberger C.F., Knoefel W.T., Hosch S.B. Occult disseminated tumor cells in lymph nodes of patients with gastric carcinoma. A critical appraisal of assessment and relevance. Langenbecks Arch Surg. 2009; 394(1): 105-13. https://doi.org/10.1007/s00423-008-0369-4.
- Went P., Dirnhofer S., Salvisberg T., Amin M.B., Lim S.D., Diener P.A., Moch H. Expression of epithelial cell adhesion molecule (EpCam) in renal epithelial tumors. Am J Surg Pathol. 2005; 29(1): 83-8. https://doi.org/10.1097/01.pas.0000.146028.70868.7a.
- Cimino A., Halushka M., Illei P., Wu X., Sukumar S., Argani P. Epithelial cell adhesion molecule (EpCAM) is overexpressed in breast cancer metastases. Breast Cancer Res Treat. 2010; 123(3): 701-8. https://doi.org/10.1007/s10549-009-0671-z.
- Massoner P., Thomm T., Mack B., Untergasser G., Martowicz A., Bobowski K., Klocker H., Gires O., Puhr M. EpCAM is overexpressed in local and metastatic prostate cancer, suppressed by chemotherapy and modulated by MET-associated miRNA-200c/205. Br J Cancer. 2014; 111(5): 955-64. https://doi.org/10.1038/bjc.2014.366.
- Bellone S., Siegel E.R., Cocco E., Cargnelutti M., Silasi D.A., Azodi M., Schwartz P.E., Rutherford T.J., Pecorelli S., Santin A.D. Overexpression of epithelial cell adhesion molecule in primary, metastatic, and recurrent/chemotherapy-resistant epithelial ovarian cancer: implications for epithelial cell adhesion molecule-specifc immunotherapy. Int J Gynecol Cancer. 2009; 19(5): 860-6. https://doi.org/10.1111/IGC.0b013e3181a8331f.
- Jojović M., Adam E., Zangemeister-Wittke U., Schumacher U. Epithelial glycoprotein-2 expression is subject to regulatory processes in epithelial-mesenchymal transitions during metastases: an investigation of human cancers transplanted into severe combined immunodefcient mice. Histochem J. 1998; 30(10): 723-9. https://doi.org/10.1023/a:1003486630314.


