Патохимические процессы при подагре. Обзор литературы
Бесплатный доступ
На сегодняшний день симптом гиперурикемии обнаруживается во время диагностики многих заболеваний. Но будет ли этот симптом главным в валидации подагры? Возникновение ее происходит путём осаждения кристаллов мочевой кислоты, либо кристаллов урата в тканях сустава. Кристалл - инородное тело в организме, которое усиливает защитную систему организма для его устранения и таким образом возникает приступ подагры. На основе этиологических данных и эпидемиологических исследований предоставлен анализ главного патохимического механизма развития подагры. Рассмотрены диагностические методы исследования биологических жидкостей организма для выявления подагры.
Подагра, гиперурикемия, мочевая кислота, воспаление, патогенез, диагностика
Короткий адрес: https://sciup.org/170191366
IDR: 170191366 | УДК: 616-002.78 | DOI: 10.24411/2409-4102-2021-10410
Текст научной статьи Патохимические процессы при подагре. Обзор литературы
Во многих странах мира подагра является значимой медицинской и социальной проблемой из-за широкой распространенности, поражения преимущественно мужчин среднего возраста. Заболевание имеет прогрессирующий характер течения с соответственно высокой частотой осложнений. По данным эпидемиологических исследований существует истинное повышение распространенности болезни как в странах с высоким уровнем жизни, так и в последнее время в регионах, где подагра считалась редким заболеванием. Такие изменения, вероятно, зависят от различных ценностей, традиций и характера питания, к которым можно отнести чрезмерное употребление мяса, жирной пищи и злоупотребление алкогольными напитками.
На сегодняшний день известно, что клинические проявления подагры не заканчиваются исключительным поражением опорно-двигательного аппарата и почек. Особенность подагры заключается в частом сочетании с такими заболеваниями, как артериальная гипертензия, метаболический синдром, сахарный диабет, различные почечные поражения, которые обладают высоким риском сердечно-сосудистых заболеваний. Подагра приводит к частой временной потере трудоспособности, ограничению профессиональной деятельности, инвалидности, что делает данное заболевание актуальной проблемой здравоохранения и тяжелой социально-экономической ситуацией для общества.
Этиология и механизмы развития гиперурикемии
В основании процессов развития подагры стоит гиперурикемия. Гиперурикемия — клинический симптом, который проявляется увеличением плазменной концентрации мочевой кислоты в крови более 360 мкмоль/л, в её избытке или метаболическом нарушении.
Наиболее часто гиперурикемия и подагра возникают из-за таких заболеваний, как артериальная гипертензия, сердечная недостаточность, гипертриглицеридемия, при приёме диуретиков, злоупотреблении алкоголем, дефектах генов [6].
При артериальной гипертензии процесс развития заключается в реабсорбции мочевой кислоты в почечных канальцах, за счет повышения тонуса почечных сосудов. В результате спазма сосудов микроциркуляторного русла происходит ишемия тканей, которая в свою очередь приводит к увеличению образования мочевой кислоты вследствие повышенного распада аденозина. В этот же момент происходит секреция мочевой кислоты в проксимальных канальцах почек секреция мочевой кислоты снижается из-за конкурентного повышения экскреции лактата [4].
Инсулинорезистентность также может являться причиной развития гиперурикемии. Стимуляция инсулином реабсорбции натрия в канальцах почек связана с реабсорбцией мочевой кислоты, за счет этого гиперинсулинемия при инсулинорезистент-ности вызывает гиперурикемию [2].
Причиной возникновения гиперурикемии может стать хроническая почечная недостаточность. Мочевая кислота вызывает токсическое действие, приводя к поражению почечных клубочков, что своевременно проявляется понижением скорости клубочковой фильтрации. Из-за этого возникают кристаллы моноурата натрия в почечной ткани, формируя латентное иммунное воспаление [11].
Причиной гиперурикемии при сердечной недостаточности является увеличение активности ксантиноксидазы и снижение почечного кровотока.
Употребление петлевых диуретиков в дозах, способствующих натрийурезу, уменьшает объем циркулирующей крови, что в свою очередь приводит к повышению реабсорбции уратов в проксимальных канальцах нефрона. Следствием этого является повышение плазменной концентрации мочевой кислоты вплоть до гиперурикемии [14; 15].
Прием тиазидовых диуретиков, вызывая гипокалиемию, создает условия для снижения реабсорбции мочевой кислоты, тем самым обеспечивает рост её концентрации в плазме [15].
Также непосредственной причиной развития гиперурикемии является алкоголизм. Механизм проявляется повышением трансформации пуринов вследствие увеличения вовлеченности ксанти-ноксидазы из-за большого содержания молибдена, являющегося ее кофактором. Таким образом, происходит понижение выделения мочевой кислоты вследствие временной лактат-ацидемии, вызванной избытком алкоголя.
Механизм развития гиперурикемии при гипертриглицеридемии проявляется селективной инсулинорезистентностью, снижением инсули-нопосредованного усвоения глюкозы, а также свободных жирных кислот в клетках почечных канальцев в случае сохранения инсулинопосре-дованной реабсорбции мочевой кислоты [6].
Дефект гена, отвечающего за активность фермента, обеспечивает влияние как на продуцирование мочевой кислоты (гиперпродукция), так и на ее транспортировку в почках (гипоэкскреция). В 10 % от всех ситуаций с повышенным синтезом мочевой кислоты относится к врожденным нарушениям её метаболизма. Выделяют первичную и вторичную гиперурикемию. Первичная ги-перурикемия происходит вследствие генетически опосредованного дефекта ферментов, входящие в состав метаболизма мочевой кислоты. Вторичная гиперурикемия возникает на фоне отдельных заболеваний, при злоупотреблении пищей, богатой пуринами, при действии токсинов и лекарственных препаратов и прочее [13].
Приём продуктов, богатых пуриновыми нуклеотидами, может вызывать в организме избыток субстрата для синтеза мочевой кислоты. Распад аденозинтрифосфата значительно повышается при глюкозо-галактозной мальабсорбции и злоупотреблении алкоголем. Также крайне высокий обмен нуклеотидов проявляется при лимфопролиферативных заболеваниях. Всё это ведёт к увеличению образования уратов.
Мы можем сделать вывод о том, что основными причинами возникновения гиперурикемии и подагры являются гиперпродукция мочевой кислоты, гипоэкскреция, или сочетание этих причин.
Подагра
Подагра (дословно «нога в капкане») по происхождению является гетерогенным заболеванием, которое в свою очередь характеризуется отложением кристаллов моноурата натрия в различных тканях и проявляется кристалл-индуцированным воспалением в местах фиксации уратов (внутренние органы, суставы и др.) или мочевой кислоты. В центре происхождения лежит накопление мочевой кислоты и уменьшение ее выведения почками, что может привести к гиперурикемии. С клинической точки зрения подагра характеризуется рецидивирующими острыми артритами и возникновением тофусов. Наиболее часто заболевание встречается у мужчин, но в последнее время наблюдается распространенность среди женщин, с возрастом частотность подагры увеличвается. В качестве лечения применяют препараты, которые воздействуют на патогенетические механизмы подагры [1].
Эпидемиология и этиология подагры
Отмечено, что гиперурикемия устанавливается у 4—12 % населения, несмотря на то, что подагре подвержено 0,1 % населения России. В Евразии и Америке уровень заболеваемости подагрой составляет 2 % людей, среди мужчин старше 50—60 лет подагрой заболевает 4—6 % [5].
Разница мужчин к женщинам составляет от 2:1 до 7:1. Пик заболеваемости у заболевших женщин приходиться на возраст 60 лет, до менопаузы возникновение болезни очень маловероятно, потому что действие эстрогенов напрямую связано с экскрецией мочевой кислоты, в то время как у мужчин пик заболеваемости приходится на 55 лет [7].
Уровень подагрического артрита в различных популяциях меняется и представляет 5—50 человек на 1000 мужчин и 1—9 человек на 1000 женщин; численность случаев в год составляет 1—3 на 1000 у мужчин и 0,2 на 1000 у женщин [10].
У подростков и молодых людей острый приступ подагры возникает редко и обычно обоснован первичным и вторичным дефектом синтеза мочевой кислоты.
Факторы риска развития подагры многообразны и из них выделяют:
-
1. Многочисленные дефекты, которые несут ответственность за активность ферментов, влияющих как на синтез мочевой кислоты (гиперпродукция), так и на ее транспорт в почках (гипоэкскреция).
-
2. Масштабный распад нуклеотидов из клеточных ядер приводит к болезням крови, тяжелым псориазам, саркоидозам, и к другим заболеваниям нарушающим почечную экскерцию, то есть болезням накопления, гестозам, хронической почечной недостаточности, сердечно-сосудистым заболеваниям, гиперпаратиреозу.
-
3. Использование препаратов, которые вызывают гиперурикемю. К ним принадлежат противотуберкулезные лекарственные средства (этамбутол), способные индуцировать гиперу-рикемию и осложнение течения подагры, усиливать боль в суставах. Идентичное свойство имеет диданозин, который в свою очередь применяется при вирусе иммунодефиците человека. Для данных лекарственных средств гиперурикемия считается прогностическим побочным эффектом, обусловленным конкуренцией с уратами на пути элиминации [2].
-
4. Продукты, богатые пуриновыми нуклеотидами, способствуют развитию в организме избытка субстрата для синтеза мочевой кислоты.
Связь между гиперурикемией и подагрой
Гиперурикемия относится к повышению уровня мочевой кислоты в крови. Мочевая кислота является продуктом распада пурина внутри организма. Постоянное накопление мочевой кислоты может привести к подагре, типу артрита, характеризующемуся эпизодами болезненных воспалительных приступов [8].
Патогенетические механизмы в основе отложения кристаллов урата
В основе общеклинических явлений подагры лежит отложение в тканях кристаллов моноурата натрия. Данный механизм малоизучен. Определенное влияние имеет слабая васкуляризация тканей, что обосновывается частым отложением кристаллов урата в сухожилиях и костях. Главными факторами для образования кристаллов являются концентрация уратов, локальная температура и присутствие сложных белков, сохраняющих ураты в жидкости, — протеогликанов. Возникновение кристаллизации обусловлено увеличением диффузии воды из сустава. Существенное значение в кристаллизации мочевой кислоты имеет рН сыворотки крови. Обосновано, что полнейшее растворение солей мочевой кислоты осуществляется в концентрированном растовре щёлочи с рН = 12,0—13,0, что является невозможным in vivo. Существует зависимость между температурой окружающей среды и растворимостью уратов: гипотермия поверхностных суставов оказывает положительное влияние для формирования кристаллов урата и возникновения микротофусов [12].
Процесс закладки солей мочевой кислоты в тканях определяется клиническими проявлениями подагры. Самым выраженным из них считается выраженный подагрический артрит (рис. 1). Конкретным источником воспалительного процесса является кристаллизация мочевой кислоты в суставной полости, которая наступает под воздействием провоцирующих факторов [5].
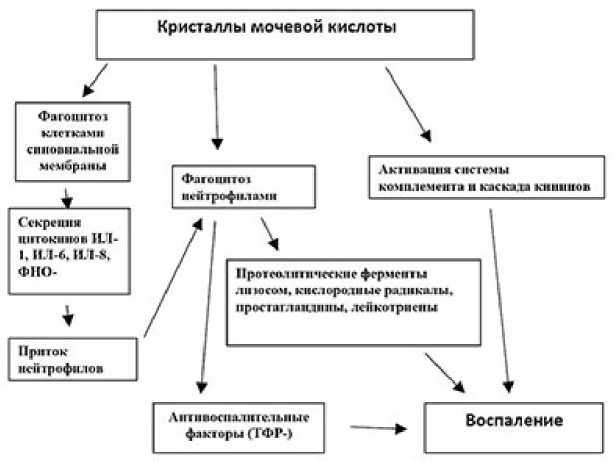
Рис. 1. Патогенез подагрического артрита1
1 Орсич Е. О. Подагра. Этиология и патогенез. Клиническая картина. Принципы лечения и купирования острого приступа. — Минск: БГМУ, 2017. — URL: (дата обращения 13.11.2021).
Клетки синовиальной мембраны запускают процесс воспаления, их активизация сопровождается секрецией цитокинов IL-1, IL-6, TNF-и IL-8. Именно эти цитокины вызывают приход нейтрофилов в суставную полость. Появившиеся кристаллы, покрытые белком (IgG), с помощью реакции с Fc-рецепторами на поверхности клеток способствуют фагоцитозу с образованием фаголи-зосом. Фаголизосомальные ферменты элиминируют IgG с поверхности кристаллов, водородсодержащие соединения вызывают лизис мембран. В итоге происходит высвобождение протеолитических лизосомальных ферментов, инициируется секреция активных форм кислорода, свободных радикалов простагландинов, лейкотриенов и других медиаторов воспаления. Кристаллы уратов активируют систему комплемента, а также фактор Хагемана и запускают каскадную реакцию кининов.
В результате, активация калликреиновой и кининовой систем, повышение проницаемости стенки сосудов, возбуждение системы комплемента, повышая хемотаксис лейкоцитов к кристаллам уратов, способствуют воспалительному процессу. В очаге воспаления снижается рН среды, что способствует еще большей кристаллизации уратов. Создается патогенетический порочный круг [12].
Самостоятельное стихание воспалительного процесса в суставе при подагре определяется способностью фагоцитов переваривать кристаллы и выделять ряд противовоспалительных факторов, в частности TGF-beta [5].
Диагностики подагры
Для диагностики подагры используют следующие методы:
-
1) общий анализ крови;
-
2) биохимический анализ крови;
-
3) общий анализ мочи;
-
4) уровень уратов в сыворотке крови;
-
5) определение мочевой кислоты в суточной моче;
-
6) исследование синовиальной жидкости.
Общий анализ крови — лабораторное исследование, которое проводится для количественной и качественной оценки ключевых классов форменных элементов крови, включает определение концентрации основных форменных элементов крови (лейкоцитов, тромбоцитов), величины гематокрита, а также расчет эритроцитарных индексов (MCV, RDW, MCH, MCHC). При приступе подагры наблюдается нейтрофильный лейкоцитоз со сдвигом влево, а также повышение СОЭ [3].
Биохимический анализ крови — метод лабораторной диагностики предусматривающий оцен- ку работы внутренних органов (почки, желчный пузырь и др.), устанавливающий активные воспалительные и ревматические процессы, а также нарушение водно-солевого обмена и дисбаланс микроэлементов.
Стандартный биохимический анализ крови включает ряд показателей, отражающих состояние белкового, углеводного, липидного и минерального обмена, а также активность некоторых ключевых ферментов сыворотки крови. В процессе обострения подагры происходит повышение серомукоида, фибрина, гаптоглобина, сиаловых кислот, мочевой кислоты [6].
Общий анализ мочи — это комплексное разноплановое тестирование, которое направлено на обнаружение общих свойств мочи, физико-химического и микроскопического её исследования. Исходя из этого определяются такие показатели как цвет, прозрачность, реакция (рН), содержание в моче глюкозы, кетоновых тел, билирубина и продуктов его метаболизма.
В осадке мочи наблюдается наличие элементов клеток, солей и цилиндров. Данный метод в конкретном случае проводится с целью выявления поражения мочевыделительной системы, способствующей развитию подагры или являющихся её осложнением [7].
Уровень уратов в сыворотке крови. Повышение уровня уратов в сыворотке крови обосновывает диагноз подагры, однако не является ни чувствительным, ни специфичным. Уровень уратов в сыворотке крови во время острой фазы заболевания нормальный, это обьясняется урико-зурическими свойствами IL-6. И все же начальный уровень мочевой кислоты в сыворотке крови между обострениями болезни показывает единый пул уратов во внеклеточной жидкости. Для того чтобы выявить исходный уровень уратов с ново-выявленной подагрой, необходимо выполнить измерение 2-3 раза [13].
Определение мочевой кислоты в суточной моче. Мочевая кислота является конечным продуктом распада пуриновых оснований. Содержание мочевой кислоты в моче напрямую зависит от диеты (связь в пище углеводов, жиров), функционирования почек, лекарственной терапии. Проводится с целью диагностики заболеваний мочевыделительной системы, способствующих развитию подагры или являющихся ее осложнением [16].
Диагностика на основе синовиальной жидкости. Синовиальная жидкость — достаточно густая субстанция, выступающая в качестве смазки для суставов. При возникновении подозрения на подагру необходимо сделать артроцентез и анализ синовиальной жидкости. Если возникают повтор- ные приступы у больных с доказанной подагрой, то данная процедура не нужна, но ее необходимо выполнять, если появляется подозрение на присоединение инфекционного артрита. Для подагры характерно присутствие в синовиальной жидкости игольчатых кристаллов уратов, которые находятся в свободном состоянии или фагоцитирующем. Синовиальная жидкость в момент приступа имеет признаки воспаления обычно 2000—100 000 лейкоцитов/мкл и > 80 % полиморфноядерных лейкоцитов. Данные значения в большой степени схожи с изменениями при инфекционном артрите, который необходимо исключить за счет окрашивания по Граму (отрицательный результат) и посева на флору [8].
Рис. 2. Соли в моче при подагре1
Мочевая кислота в сыворотке
Мочевая кислота является продуктом катаболизма пуриновых оснований, которые входят в набор ДНК и РНК клеток организма. Пуриновые основания образуются после гибели клеток, незначительное количество поступает с пищей и жидкостями. Мочевая кислота переносится кровью из печени до почек, где происходит ее частичная фильтрация и выделение с мочой, в то время как оставшаяся доля переходит в желудочно-кишечный тракт и выводится со стулом. Регулярное повышение степени мочевой кислоты является причиной подагры. Возрастание процессов смерти клеток и уменьшение скорости выведения мочевой кислоты почками способствует гиперурикемии.
Диагностические маркёры подагры
Диагностически значимыми маркёрами подагрического процесса в организме являются:
-
1) наличие микрокристаллических уратов в синовиальной жидкости;
-
2) наличие тофусов с отложением кристаллических уратов;
-
1 Atlas of Rheumatology. Ed. by G. Hunder. 2005. — URL: https://link.springer.com/content/pdf/bfm%3A978-1-4615-6499-7%2F1.pdf (дата обращения 12.11.2021).
-
3) более одной острой артритной атаки;
-
4) выраженные признаки воспалительного процесса в суставе в острой фазе;
-
5) эритема кожи над воспалённым суставом;
-
6) тофусоподобные узелки;
-
7) субкортикальные кисты без эрозийного процесса, определяемые рентгенологическим методом;
-
8) отрицательный анализ на бакпосев суставной жидкости.
Генетические аспекты при подагре
На риск развития подагры влияют гены, которые определяют концентрацию мочевой кислоты и выведение мочевой кислоты почками и кишечником. Концентрация мочевой кислоты зависит и от генов, связанных с обменом глюкозы. На данный момент обнаружено 38 генетических локусов, которые могут управлять развитием гипе-рурикемии и, судя по всему, подагры. Исследования показывают, что определённые генетические варианты оказывают влияние на воспалительную реакцию инфламмасом, наличие кристаллов мочевой кислоты. Некоторые варианты генов SLC2A9 и ABCG2 могут повышать риск развития подагры до 50 %. Эти гены определяют ведущее положение в регуляции уровня мочевой кислоты.
Повышением возможного риска развития подагры является носительство аллеля Т и генотипа T/T гена MTHFR C677T, аллеля G и генотипа А/G гена MTR A2756G. Аллель с локуса С677Т гена MTHFR, а также аллель А и генотип А/А гена MTR A2756G предположительно способствуют улучшению иммунитета [16].
Заключение
Несмотря на повышенный интерес в последние десятилетия к проблеме подагры, количество исследований, направленных на патохимические процессы при подагре, недостаточно. Тема требует дальнейшего развития как с лабораторно-диагностической точки зрения, так и патогенеза. Генетический полиморфизм был предложен для предотвращения и распознавания подагры, но прогнозирование подагры по генетическим вариациям все еще ограничено из-за недостаточного знания взаимосвязи между генами и подагрой. Наше предположение заключается в том, что необходимо рассматривать не только активность и мутацию генов, но также непосредственно рассматривать сам механизм реализации этих генов и его взаимосвязь с регулирующими его системами. Рассмотрение механизма образования подагры с этой точки зрения может дать ответы на корреляцию активности вышеперечисленных генов и степенью развития подагры.
Список литературы Патохимические процессы при подагре. Обзор литературы
- Avhad, G. Podagra / G. Avhad, P. Ghuge // Indian Dermatol Online J. — 2014. — № 5 (2). — P. 134— 135. DOI: 10.4103/2229-5178.146196. PMID: 25593807; PMCID: PMC4290180.
- Барскова, В. Г. Подагра и синдром инсулинорезистентности / В. Г. Барскова, В. А. Насонова // Русский медицинский журнал. — 2003. — № 23. — URL: https://www.rmj.ru/articles/revmatologiya/ Podagra_i_sindrom_insulinorezistentnosti/ (дата обращения 01.12.2021).
- Насонова, В. А. Подагра: старая болезнь, новые проблемы диагностики и лечения / В. А. Насонова, В. Г. Барскова // Медицинская кафедра. — 2004. — № 3. — С. 97—100.
- Gois, P. Pharmacotherapy for hyperuricemia in hypertensive patients P. Gois, E. Souza // Cochrane Database Syst Rev. — 2017. — Vol. 4. — № 4. — P. CD008652. DOI: 10.1002/14651858.CD008652.pub3. PMID: 28406263; PMCID: PMC6478066.
- Дзяк, Г. В. Подагра: взгляд в будущее / Г. В. Дзяк, В. Н. Коваленко, Т. А. Хомазюк. — Киев : МОРИОН, 2020. — 192 с.
- Лелевич, С. В. Клиническая биохимия : учеб. пособие / С. В. Лелевич. — Санк-Петербург : Лань, 2018. — 304 c.
- Luk, A. J. Epidemiology of hyperuricemia and gout / A. J. Luk, P. A. Simkin // Am. J. Manag. Care. — 2005. — Vol. 11. — № 15. — P. 435—442. QUIZ S465-8. PMID: 16300457.
- Макаренко, Е. В. Подагра: современные принципы диагностики и лечения / Е. В. Макаренко // Вестник Витебского государственного медицинского университета. — 2017. — T. 16. — № 6. — C. 7—22.
- Кушнаренко, Н. Н. Полиморфизм генов фолатного цикла у больных подагрой в популяции русских Забайкальского края / Н. Н. Кушнаренко, М. Ю. Мишко, Т. А. Медведев // Сибирский медицинский журнал. — 2020. — Т. 35. — № 1. — C. 142—150
- Mikuls, T. R. Gout epidemiology: results from the UK General Practice Research Database, 1990—1999 / T. R. Mikuls, J. T. Farrar, W. B. Bilker, S. Fernandes [et al.] // Ann Rheum Dis. — 2005. — Vol. 64. — № 2. — P. 267—272. DOI: 10.1136/ard.2004.024091. PMID: 15647434; PMCID: PMC1755343.
- Reyes, D. Gender differences in hypertension and kidney disease / D. Reyes, S. Q. Lew, P. L. Kim-mel // Med Clin North Am. — 2005. — Vol. 89. — № 3. — P. 613—630. DOI: 10.1016/j.mcna.2004.11.010. PMID: 15755470.
- Simkin, P. A. The pathogenesis of podagral / P. A. Simkin // Ann Intern Med. — 1977. — Vol. 86. — № 2. — P. 230—233. DOI: 10.7326/0003-4819-86-2-230. PMID: 319726.
- Sivera, F. Multinational Evidence-based Recommendations for the Diagnosis and Management of Gout / F. Sivera, M. Andres, L. Carmona [et al.] // Ann. Rheum. Dis. — 2014. — Vol. 73. — № 2. — P. 328—335. DOI: 10.1136/annrheumdis-2013-203325. Epub 2013 Jul 18. PMID: 23868909; PMCID: PMC3913257.
- Синяченко, О. В. Подагрическая нефропатия / О. В. Синяченко, Н. В. Василенко, Е. А. Дик-штейн // Клиническая медицина. — 1986. — № 8. — C. 104—107.
- Федорова, Н. Е. Подагра: современные представления. Лечение на разных этапах развития заболевания / Н. Е. Федорова, В. Д. Григорьева // Клиническая медицина. — 2002. — № 2. — С. 9—13.
- Шербак, А. В. Фибринолитическая активность мочи как показатель поражения почек при нарушении обмена мочевой кислоты / А. В. Ш^бак, И. М. Балкаpов, Л. В. Козловская, Л. В. Подоpольская [и др.] // Терапевтический архив. — 2001. — № 6. — С. 34—37.


