Патологическая анатомия легких при новой коронавирусной инфекции (COVID-19). Предварительный анализ аутопсийных исследований
Автор: Забозлаев Фдор Георгиевич, Кравченко Эдуард Васильевич, Галлямова Анастасия Ринатовна, Летуновский Николай Николаевич
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 2 т.11, 2020 года.
Бесплатный доступ
Обоснование. В настоящее время углубленно изучаются вопросы пато- и морфогенеза новой коронавирусной инфекции (COVID-19). Актуально проведение сравнительного анализа морфологических изменений легких умерших пациентов в различные временные сроки после появления первых клинических симптомов заболевания. Клинико-морфологические сопоставления должны способствовать повышению квалифицированной медицинской помощи пациентам реанимационного профиля и снижению больничной летальности. Цель исследования - сформировать рабочую гипотезу концептуальной схемы клинико-морфологических фаз развития COVID-19 интерстициальной пневмонии на основе проведенных аутопсийных исследований. Методы. Проведен анализ 80 летально закончившихся случаев в COVID-центре ФГБУ ФНКЦ ФМБА России. Наряду с оценкой макро- и микроскопических изменений респираторного тракта применена дополнительная гистохимическая окраска по Ван Гизону и выполнены иммуногистохимические исследования, позволяющие оценить состояние легких при COVID-19. Результаты. Обнаруженные особенности диффузного альвеолярного повреждения при новой коронавирусной инфекции (COVID-19) позволили представить рабочую гипотезу патоморфогенеза COVID-19 интерстициальной пневмонии. Мы предлагаем три фазы - фульминантную, персистирующую и фибротическую, каждая из которых условно ограничена определенными временными параметрами и характеризуется определенными морфологическими признаками. Дисрегуляторная активация моноцитарных фагоцитов, развитие генерализованного тромбоза микроциркуляторного русла, патологическая репарация, прогрессирующий внутриальвеолярный и интерстициальный фиброз - основные звенья патоморфогенеза COVID-19-интерстициальной пневмонии. В ответ на внедрение вируса SARS-CoV-2 в экссудативной и пролиферативной стадиях преобладают реакции Т-клеточного иммунитета. В фибротической стадии общее количество Т-лимфоцитов резко снижено, клеток гуморального иммунитета не выявлено. Превалирование CD8+ Т-лимфоцитов-супрессоров над CD4+ Т-лимфоцитами-хелперами, возможно, связано с механизмами аутоиммунного поражения. Заключение. Поражение легких с развитием COVID-19-интерстициальной пневмонии - основная причина тяжелого течения заболевания и летальных исходов. Выявленные особенности патоморфогенеза клинико-морфологических фаз COVID-19-интерстициальной пневмонии позволят улучшить качество диагностики и лечения новой коронавирусной инфекции (COVID-19).
Патоморфогенез, коронавирусная covid-19-интерстициальная пневмония, клинико-морфологические фазы
Короткий адрес: https://sciup.org/143172652
IDR: 143172652 | DOI: 10.17816/clinpract34849
Текст научной статьи Патологическая анатомия легких при новой коронавирусной инфекции (COVID-19). Предварительный анализ аутопсийных исследований
На протяжении периода пандемии пополняются научные сведения об этиологии, эпидемиологии, патогенезе и морфологических изменениях, клинических особенностях, лечении и профилактике новой коронавирусной инфекции [4–7].
Распространение COVID-19 представляет особую опасность в отношении декомпенсации хронических заболеваний. Наиболее часто тяжелые формы COVID-19 наблюдаются у пациентов с хронической обструктивной болезнью легких, ожирением, сахарным диабетом, артериальной гипертензией, ишемической болезнью сердца, хро- ническими заболеваниями почек, злокачественными новообразованиями [8–11].
Патогенез COVID-19 находится в процессе активного изучения. В отечественной и зарубежной литературе констатировано, что основным рецептором клеток, с которым связывается S-белок (Spike Protein) оболочки SARS-CoV-2, является ангиотен-зинпревращающий фермент 2 (angiotensin-converting enzyme 2, ACE2). Инфицирование происходит при участии трансмембранной сериновой протеазы 2 (transmembrane protease serine 2, TMPRSS2), необходимой для активации S-белка [12–15].
циническая'™™
пэактика—
Рецептор ACE2 обнаружен на клетках различных органов (легкие, сердце, почки, тонкая кишка и др.), в том числе он присутствует на клетках иммунной системы, эндотелиальных клетках артериальных и венозных сосудов [16–19].
Основной мишенью вируса SARS-CoV-2 является респираторный тракт. Происходит поражение альвеолоцитов 1-го и 2-го типов, клеток эндотелия сосудов, что приводит к нарушению функционирования аэрогематического барьера и сурфактантного альвеолярного комплекса [15, 16].
Одной из наиболее актуальных патогенетических концепций COVID-19 является иммунная дисфункция (дисрегуляция), в основе которой лежит синдром активации макрофагов (macrophage activation syndrome, MAS) [16, 20, 21].
Дисрегуляторная активация моноцитарных фагоцитов, наблюдаемая у пациентов с тяжелыми формами COVID-19, возможно, ассоциируется с гипериммунным ответом, стимулирующим моноцитарно-макрофагальную систему легких с массивным выбросом цитокинов [16, 22, 23].
При генерализации инфекционного процесса наблюдается высокая продукция провоспалитель-ных цитокинов и хемокинов с развитием «цитоки-нового шторма». Тяжелое течение COVID-19 сопровождается наиболее высоким уровнем в сыворотке крови интерлейкинов (interleukin, IL) 6, 8, 18, 1 β и фактора некроза опухоли альфа (tumor necrosis factor-alpha, TNF α ). Риск летального исхода ассоциирован с высоким уровнем IL6 в сыворотке крови [24, 25]. Гиперергическая иммунная реакция лежит в основе развития ОРДС и полиорганной недостаточности при COVID-19 [22].
Один из предполагаемых механизмов гибели клеток, инфицированных SARS-CoV-2, — пироптоз (вид программируемой некротической гибели клетки, при котором в результате активации каспазы 1 происходит нарушение целостности плазматической мембраны с формированием пор и быстрое высвобождение наружу содержимого клетки) [26, 27]. В очагах воспаления (внутриальвеолярно и в интерстиции) активированные макрофаги кроме выработки медиаторов воспаления секретируют ростовые факторы, запускающие процесс репарации и активирующие фибробласты.
В патогенезе ранних изменений важную роль играют активированные нейтрофилы, реагируя на любое нарушение гомеостаза в органах дыхания. Активация нейтрофилов способствует повреждению эндотелия, ухудшению реологических свойств крови, активации тромбоцитов и нарушению микроциркуляции. Объем и степень поражения ми-кроциркуляторного русла напрямую коррелируют с течением и прогнозом заболевания [20]. Активированные нейтрофилы выделяют фактор активации тромбоцитов, обусловливая тем самым агрегацию и секвестрацию тромбоцитов, синтез фактора роста тромбоцитов, стимулирующего процессы фиброзирования.
Система мононуклеарных фагоцитов легких сопоставима с системой мононуклеарных фагоцитов печени, а диффузно развивающийся фиброз ткани легкого в исходе ОРДС при COVID-19 по своему течению целесообразно сравнить с отдельными формами вирусных поражений паренхимы печени (например, при вирусных гепатитах с исходом в цирроз печени). Не исключается возможность распространения (персистенции) коронавируса SARS-CoV-2 в организме за счет инфицирования клеток иммунной системы, более вероятно, макрофагов [28].
Морфологические признаки COVID-19 на современном этапе сводятся в основном к описанию изменений ранней (экссудативной) и поздней (пролиферативной) стадий ОРДС. Также верифицируется повреждение эндотелиоцитов микроциркулятор-ного русла с нарушениями в системе свертывания крови, развитием ДВС-синдрома с мультифокальным микротромбозом и последующей полиорган-ной дисфункцией с преобладанием острой почечной недостаточности [2, 3, 29].
Некоторые специалисты считают, что в отношении определения поражения легких при COVID-19 термин «пневмония» совершенно не отражает морфологию, клинико-рентгенологические признаки патологического процесса, наблюдаемого при поражении легких вирусом SARS-CoV-2. Предлагается к использованию термин «вирусное поражение легких» (вирусный пневмонит, вирусная интер-стициопатия) [30]. Ряд авторов в качестве нового названия тяжелой COVID-19 предлагает термин «микрососудистый обструктивный тромбовоспалительный синдром легких» [31].
Звенья патогенеза и морфологические особенности новой коронавирусной инфекции требуют дальнейшего комплексного изучения с применением современных методов исследований. Остаются актуальными также вопросы правильного учета летально закончившихся случаев и эпидемиологической безопасности при проведении патологоанатомических вскрытий.
Цель исследования — изучить патоморфогенез COVID-19 на основе проведенных аутопсийных исследований с формированием рабочей гипотезы концептуальной схемы клинико-морфологических фаз развития заболевания.
МЕТОДЫ
Условия проведения
Проведено комплексное патологоанатомическое исследование секционного материала, полученного после аутопсий 80 умерших пациентов в ФГБУ ФНКЦ ФМБА России с основным заболеванием COVID-19 тяжелого клинического течения, подтвержденным выявлением методом полимеразной цепной реакции как при жизни, так и посмертно РНК SARS-CoV-2.
Характеристика (градация)исследуемых групп
Учитывая широкий спектр обнаруженных морфологических изменений в легких, в основе которых лежит диффузное альвеолярное повреждение, градация исследуемых групп проведена в соответствии с тремя стадиями ОРДС — экссудативной, пролиферативной и фибротической.
Первая исследуемая группа составила 12 случаев летальных исходов в течение 10 сут от начала клинических признаков COVID-19, вторая — 28 случаев, от 11 до 20 сут, третья — 40 случаев, от 21 до 45 сут.
Во всех случаях были выполнены патологоанатомические вскрытия с соблюдением временных методических рекомендаций по исследованию умерших с подозрением на новую коронавирусную инфекцию [29].
Методы исследования
Для исследования аутопсийного материала применялись гистологические, гистохимические и иммуногистохимические методы. Фрагменты трахеи, крупных бронхов, легких и внутренних органов фиксировали в формалине не менее 72 ч, далее проводили заливку в парафин. Серийные парафиновые срезы окрашивали гематоксилином и эозином, пикрофуксином по Ван Гизону. Из парафиновых блоков изготавливали срезы толщиной 3 мкм, которые окрашивали общепринятыми методиками.
(actin, smooth muscle), сурфактантассоциированно-му белку А (surfactant A), коллагену IV типа (collagen type IV). Депарафинирование, регидратацию, демаскировку и окраску антигенов производили при помощи специализированной автоматизированной системы BenchMark® ULTRA (Ventana, США).
Статистический анализ
Результаты патологоанатомических исследований представлены в предварительном виде, так как набор и исследование материала продолжаются. Статистическая обработка будет выполнена позднее на большем объеме наблюдений.
РЕЗУЛЬТАТЫ
Основные результаты исследования
При аутопсийном макроскопическом и последующем гистологическом исследовании трахеи и легких пациентов, погибших от новой коронавирусной инфекции, были обнаружены морфологические признаки, отличающие ее от других острых респираторных вирусных инфекций.
Особенность макроскопической картины трахеи — неравномерность геморрагических изменений слизистой оболочки, которые чаще отсутствовали или минимально проявлялись в проксимальной части и были умеренно/резко выражены в дистальной части и главных бронхах.
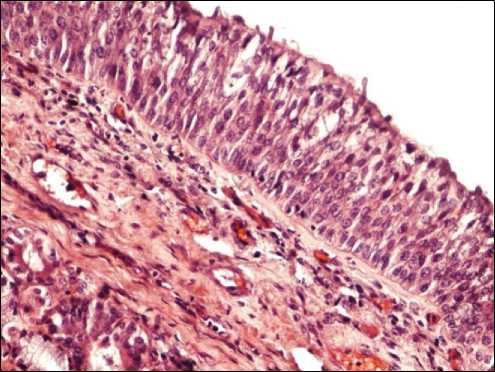
При гистологическом исследовании дистальных отделов трахеи и бронхов крупного и среднего калибров были выявлены процессы нарушения кровообращения в сосудах микроциркуляторного русла подслизистого слоя в виде микроангиопатии (эритроцитарные сладжы, стазы, формирующиеся тромбы, периваскулярный отек). Нарушения кровообращения синхронно развивались с процессами повреждения, десквамации, очаговой базальноклеточной гиперплазии респираторного эпителия (рис. 1) с формированием фокусов плоскоклеточной метаплазии. Активные метапластические процессы, возможно, индуцированные вирусом, усугубляют течение инфекционного процесса, благоприятствуя распространению возбудителя, и нарушают мукоцилиарный клиренс, приводя к снижению барьерной функции эпителия.
В 12 случаях летального исхода в течение 10 сут от начала заболевания макроскопически легкие были увеличены, тяжелые, тестоватой или плотной консистенции, маловоздушные, на разрезе с обширными участками «лакированного» вида, темно-красного (вишневого) цвета (рис. 2, А, Б).
<линическая’2п20 п эакти ка Том 11 №2
Рис. 1. Базальноклеточная гиперплазия эпителия трахеи. Окраска гематоксилином и эозином, × 100
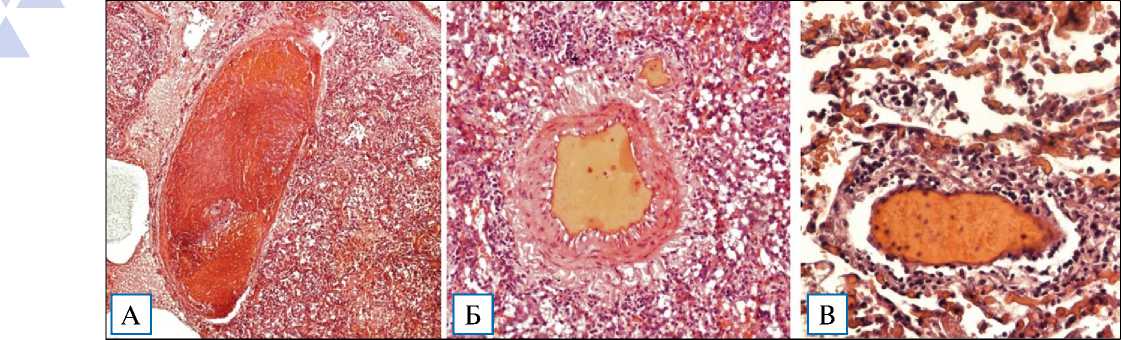
Присутствовали участки неравномерной окраски с чередованием сероватых, светло-багровых очагов, резко выраженного отека. В 5 случаях (смерть от 7 до 10 сут от начала заболевания) также отмечались единичные очаги зернистого вида, серовато-желтого цвета, и четко определялись участки геморрагических инфарктов правильной треугольной формы (рис. 2, В, Г) с наличием обтурирующих тромбов в сегментарных и субсегментарных ветвях легочных артерий.
При гистологическом исследовании во всех случаях обнаружены основные морфологические признаки диффузного альвеолярного повреждения. Массивная гибель альвеолоцитов 1-го типа и синхронное поражение эндотелия капилляров приводят к экссудации жидкости и белковых молекул во внутриальвеолярное пространство, развитию отека легких, представленного серозным экссудатом, с присоединением преципитатов и нитей фи- брина в просветах альвеол (рис. 3, схематическое изображение 1). По контурам альвеолярных ходов, альвеолярных мешочков, альвеол и части бронхиол формируются гиалиновые мембраны в виде полосовидных гомогенных эозинофильных масс (рис. 3, схематическое изображение 2). Погибшие альвеолоциты 1-го типа начинают компенсаторно замещаться пролиферирующими альвеолоцита-ми 2-го типа. Происходит денудация — «оголение» базальных мембран аэрогематического барьера (рис. 3, схематическое изображение 3–4) с разрушением его «рабочей зоны».
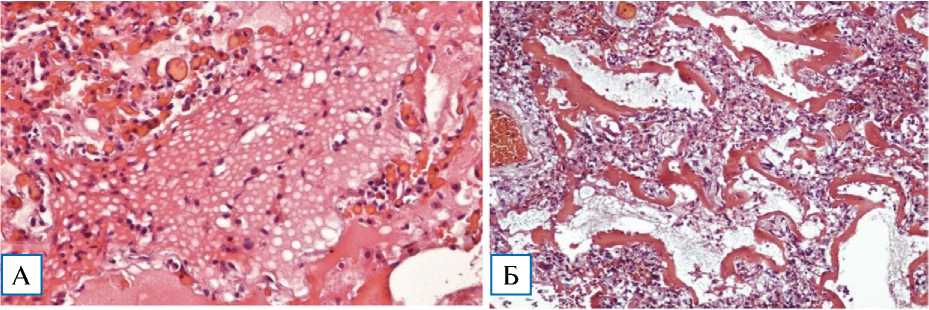
В альвеолах среди фрагментированных гиалиновых мембран наблюдаются диффузно расположенные клеточные инфильтраты из легочных макрофагов (в том числе с формированием поли-нуклеарных форм), полиморфно-ядерных лейкоцитов, немногочисленных лимфоцитов, которые располагаются по типу «опавших листьев». Полиморфно-ядерные лейкоциты локализуются преимущественно вдоль межальвеолярных перегородок, в которых выявляются признаки нарушения микроциркуляции в виде эритроцитарных сладжей, стазов, фокусов экстравазации и дилатации капилляров (рис. 4).
В просветах ветвей легочных артерий — фибриновые и эритроцитарно-фибриновые тромбы. Эндотелий в зонах прикрепления тромботических масс реактивно изменен: с признаками внутриклеточного отека, набухания, укрупненными ядрами. Также имеет место отек субэндотелиального слоя с гиперплазией мышечных клеток медиального слоя. Периваскулярная воспалительно-клеточная реакция во всех случаях выражена слабо, представлена скоплениями лимфоидных клеток и макрофагов. Вместе с тем определяются пост-
Рис. 2. Макроскопическая картина легких при фульминантной фазе COVID-19-интерстициальной пневмонии, 9–10-й дни болезни
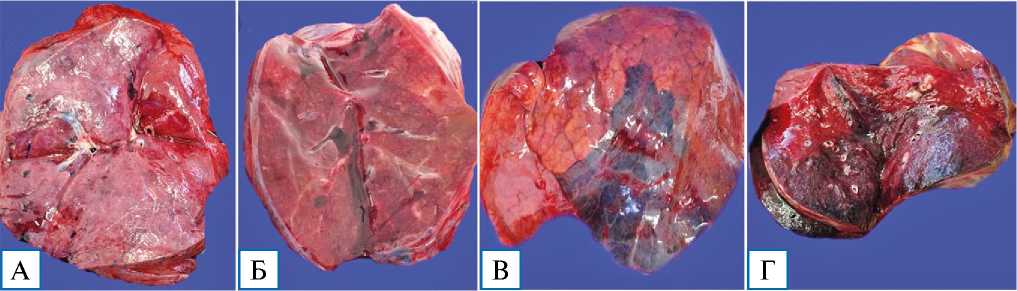
Примечание. A, Б — легкие «лакированного» вида на разрезе; В — участок геморрагического инфаркта легкого; Г — геморрагические инфаркты легкого на разрезе.

Рис. 3. Патоморфологические фазы COVID-19-интерстициальной пневмонии, соответствующие экссудативной (1–5) и пролиферативной (6–9) стадиям острого респираторного дистресс-синдрома (обозначения 1–9 приведены в тексте) [иллюстрация Ф.Г. Забозлаева]
COVID-19 -интерстициальная пневмония фульминантная фаза (до 10 суток)
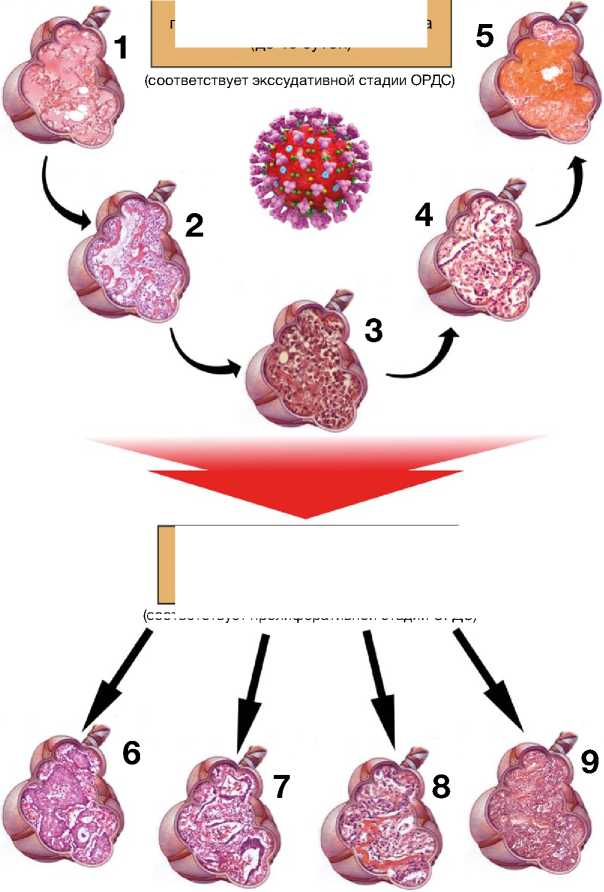
COVID-19- интерстициальная пневмония персистирующая фаза (с 11 по 20 сутки)
(соответствует пролиферативной стадии ОРДС)
капиллярные венулиты с диффузной лимфолейкоцитарной инфильтрацией (рис. 5).
При развитии геморрагического инфаркта из бронхиальной артерии поступает кровь, которая разрывает капилляры и изливается в просвет альвеол (рис. 3, схематическое изображение 5).
Проведено иммуногистохимическое исследование секционного материала 3 пациентов, умерших в течение 10 сут от начала заболевания. Во всех случаях обнаружено преобладание CD3+ Т-лимфоцитов над CD20+ В-лимфоцитами, CD4+ Т-хелперы превалируют над CD8+ Т-супрессорами (рис. 6, А, Б). CD20+ В-лимфоциты, CD57+ NK-клетки, CD138+ плазматические клетки немногочисленны, располагаются преимущественно в виде редких периваскулярных и перибронхиальных скоплений. Позитивная экспрессия антигена CD68 подтверждала наличие большого количества легочных макрофагов, расположенных преимущественно в просветах альвеол (рис. 6, В). Также высокая экспрессия CD31 (PECAM-1) документировалась в эндотелии кровеносных и лимфатических сосудов, макрофагах, гранулоцитах, при этом в данной стадии пролиферации кровеносных и лимфатических сосудов не выявлено (рис. 6, Г).
При оценке экспрессии сурфактантассоцииро-ванного белка А отмечены его гиперпродукция пролиферирующими альвеолоцитами 2-го типа и фагоцитоз легочными макрофагами, которые, заполняя просветы альвеол, входят в состав экссудата, клиническая; 20
тактика ™
Рис. 4. Микроскопическая картина альвеол при фульминантной фазе COVID-19-интерстициальной пневмонии. Окраска гематоксилином и эозином, × 100
А
Б
В
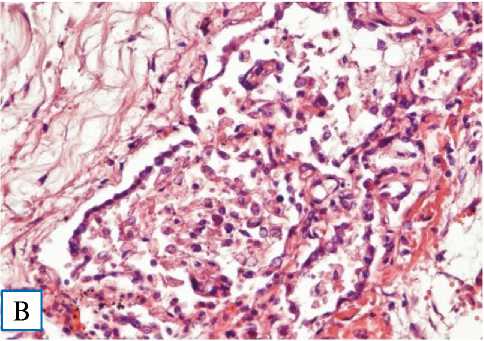
Примечание. А — внутриальвеолярный отек с процессами его резорбции; стазы в мелких капиллярах межальвеолярных перегородок; Б — сформированные гиалиновые мембраны; интерстициальный отек межальвеолярных перегородок со слабо-выраженной круглоклеточной инфильтрацией; В — пролиферация альвеолоцитов 2-го типа с их десквамацией и денудацией базальной мембраны; десквамированные альвеолоциты и легочные макрофаги в просвете альвеол; выраженный интерстициальный отек.
состоящего из погибших альвеоцитов 1-го типа, лизированных эритроцитов, фибрина. Происходит дополнительный перфузионный блок к образованным гиалиновым мембранам, что препятствует газообмену в альвеолах.
Экспрессия коллагена IV типа обнаружена в участках деформированных «оголенных» базальных мембран аэрогематического барьера без накопления данного маркера в межальвеолярных перегородках.
При макроскопическом исследовании легкие 28 умерших пациентов второй группы (11–20-е сут) были увеличены, более плотной консистенции, мало- или безвоздушные. На разрезе отмечались участки «мозаичного» вида в виде резко выраженной гиперемии, распространенных сливных и очаговых кровоизлияний в сочетании с желтовато-розовыми и серовато-белесоватыми участками. В 19 случаях определялись геморрагические инфаркты (с диффузной локализацией в сегментах легких) при наличии в ветвях легочных артерий обтурирующих белесоватых и темно-красных тромбов. В целом морфологическая картина легких на разрезе напоминала порфировидный гранит, что позволило нам образно называть их «порфировые лег- кие» (рис. 7, А). Также имели место кровоизлияния в висцеральной и париетальной плевре. Наряду с вышеописанными макроскопическими признаками с большим постоянством встречались в отдельных сегментах персистирующие участки слабо-/ умеренно выраженного отека, зоны «лакированного» вида. В 16 случаях наблюдались очаги зернистого вида вследствие присоединения вторичной бактериальной инфекции. В субплевральных отделах верифицировались различной протяженности и топографии белесоватые участки фиброза с формированием ретикулярного/сетчатого рисунка сероватого цвета.
При гистологическом исследовании во всех случаях имеет место персистирование морфологических признаков экссудативной стадии диффузного альвеолярного повреждения с наличием внутриальвеолярного и интерстициального отека и формированием вновь образованных гиалиновых мембран. Вместе с тем наблюдается врастание грануляционной ткани в респираторные бронхиолы, альвеолярные ходы и альвеолы (рис. 3, схематическое изображение 8–9; рис. 7, Б). Синхронно определяются участки структурной перестройки архитектоники паренхимы легкого — зоны ателектазов
Рис. 5. Патоморфологические изменения в сосудах легких при фульминантной фазе COVID-19-интер-стициальной пневмонии. Окраска гематоксилином и эозином
Примечание. А — фибриново-эритроцитарный тромб в мелкой ветви легочной артерии, х 40; б — отек субэндотелиального слоя с гиперплазией мышечных клеток медиального слоя; периваскулярная воспалительно-клеточная реакция, х 100; В — посткапиллярный венулит с диффузной лимфоидной инфильтрацией, х 200.
Рис. 6. Иммуногистохимический анализ изменений легких при фульминантной фазе COVID-19-интер-стициальной пневмонии
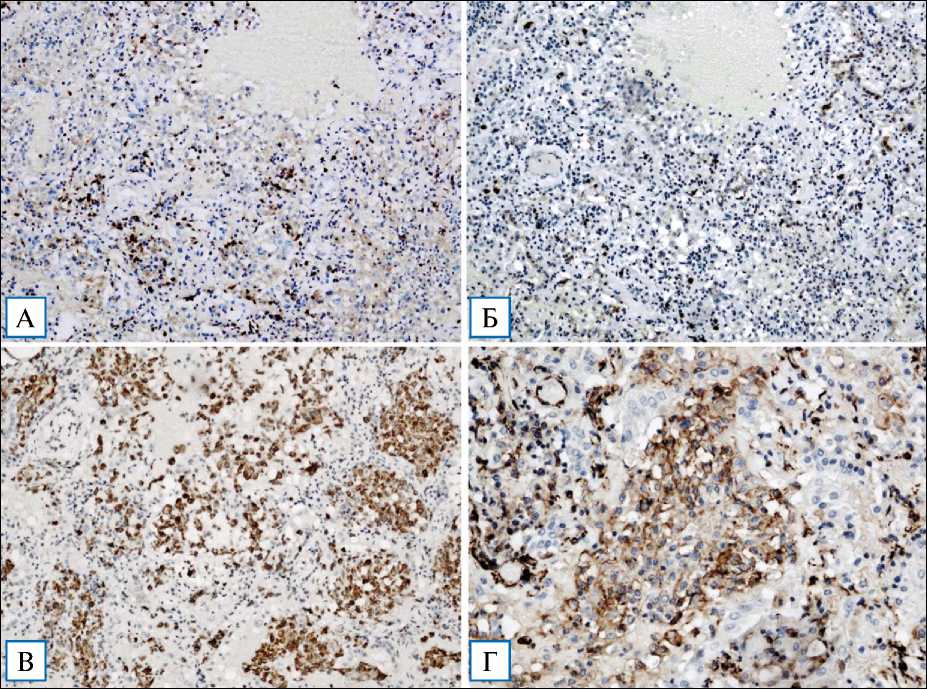
Примечание. А — экспрессия CD4 Т-лимфоцитами-хелперами, х 100; б — экспрессия CD8 Т-лимфоцитами-супрессорами, х 100; в — экспрессия CD68, х 100; г — экспрессия CD31 (PECAM-1), х 200.
и дистелектазов с компенсаторным расширением прилежащих альвеол и терминальных бронхиол. Просветы большинства альвеол щелевидной фор- мы. В просветах альвеол определяются макрофаги, часть из которых с пенистой цитоплазмой, ка-риомегалией и формированием мультинуклеарных клиническая; 20
тактика ™
Рис. 7. Макро- и микроскопическая картина легких при персистирующей фазе COVID-19-интерстици-альной пневмонии, 18-й день болезни. Окраска гематоксилином и эозином, × 100 (Б, В, Д, Е); окраска по Ван Гизону, × 100 (Г)
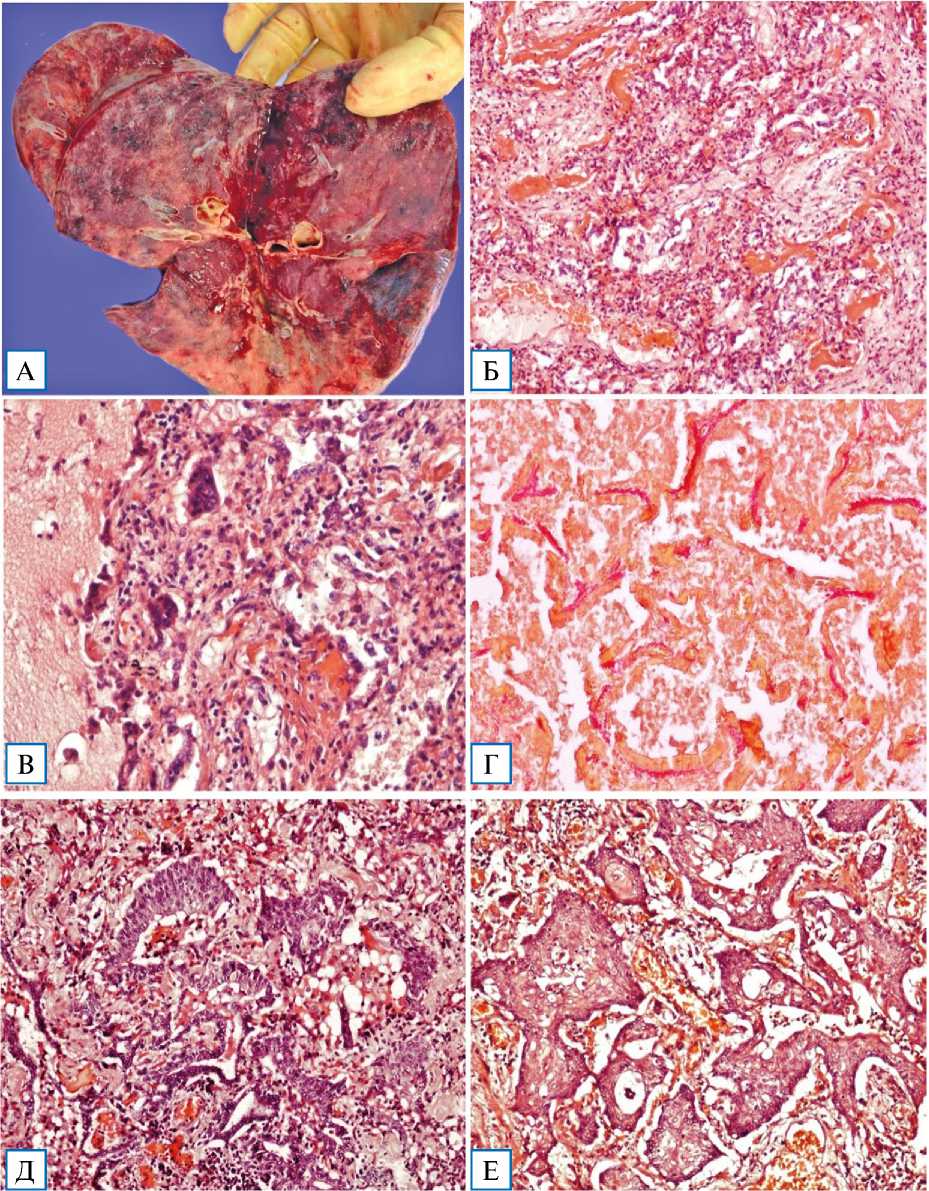
Примечание. А — «порфировое» легкое; Б — участки деформированной альвеолярной паренхимы с гиалиновыми мембранами, врастанием грануляционной ткани в респираторные бронхиолы, альвеолярные ходы и альвеолы; В — внутриальвеолярный отек, макрофаги и десквамированные альвеоло-циты с формированием мультинуклеарных структур, моноциты; Г — слабо-/умеренно выраженный периваскулярный фиброз; Д, Е — гиперплазия альвеолярного и бронхиолярного эпителия с участками плоскоклеточной метаплазии и реактивной дисплазии.
структур, клетки десквамированного альвеолярного эпителия, сливающегося в поликарионы, лимфоидные клетки и полиморфно-ядерные лейкоциты.
В интерстиции многочисленные фокусы сосудистой пролиферации, участки грануляционной ткани. Во всех случаях межальвеолярные перегородки деформированы и утолщены за счет разрастания коллагеновых волокон и воспалительно-клеточной инфильтрации, представленной макрофагами, лимфоидными клетками, полиморфно-ядерными лейкоцитами. Выявлен слабо-/умеренно выраженный периваскулярный фиброз (рис. 7, В, Г).
Отмечается гиперплазия бронхиолярного эпителия с участками плоскоклеточной метаплазии и реактивной дисплазии (рис. 3, схематическое изображение 6–7; рис. 7, Д, Е). Также имеет место смещение границ бронхоальвеолярного перехода в сторону альвеолярных ходов с бронхиолизацией альвеолярного эпителия. На фоне пролиферативных изменений отмечается массивная десквамация альвеолярного и бронхиолярного эпителия.
В случаях присоединения вторичной бактериальной инфекции в легочной паренхиме наблюдаются очаги острого воспаления вокруг бронхов или бронхиол размерами от ацинуса до сегмента. Воспалительная инфильтрация стенок бронхиол с накоплением преимущественно гнойного и смешанного экссудата в просветах альвеол, бронхиол и бронхов.
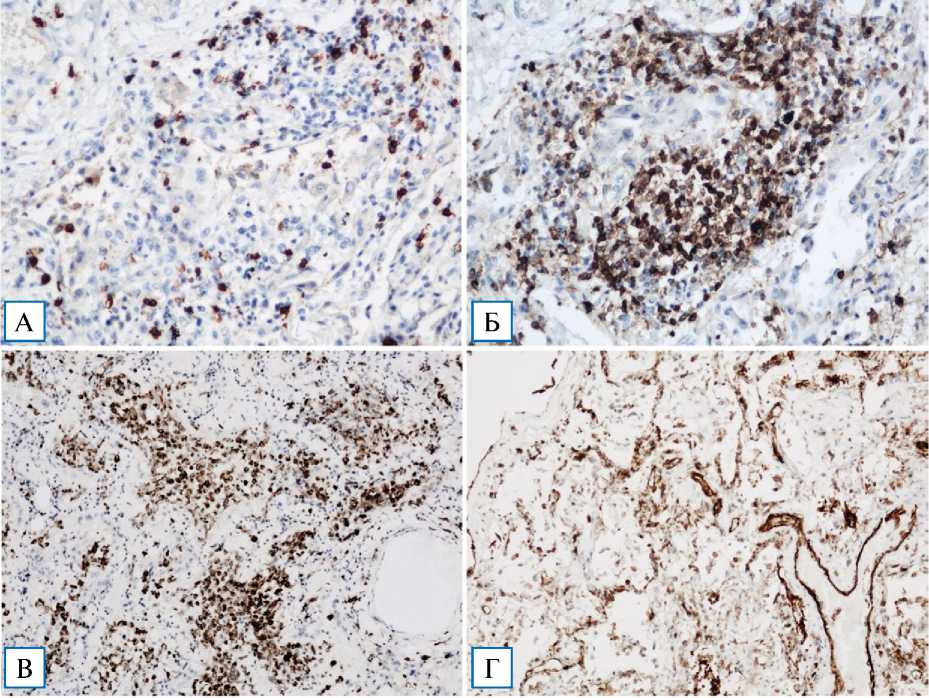
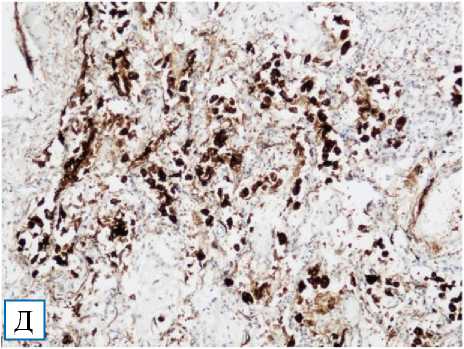
Проведено иммуногистохимическое исследование секционного материала 5 пациентов, умерших в течение 11–20 сут от начала заболевания. Во всех случаях обнаружено преобладание CD3+ Т-лимфоцитов над CD20+ В-лимфоцитами, при этом в 2 случаях пролиферативной фазы — превалирование цитотоксических CD8+ Т-супрессоров над CD4+ Т-хелперами (рис. 8, А, Б), в 3 случаях соотношение двух типов Т-лимфоцитов равное. Резко уменьшено количество CD20+ В-лимфоцитов, CD57+ NK-клеток по сравнению с экссудативной фазой. Плазматических клеток не обнаружено (реакция к CD138 отрицательная). Экспрессия антигена CD68 выявлена во всех случаях в большом количестве функционально активных макрофагов, расположенных преимущественно в просветах альвеол, меньше — в интерстиции межальвеолярных перегородок (рис. 8, В). CD31 (PECAM-1) экспрессируется в эндотелиальных клетках кровеносных сосудов, в том числе грануляционной ткани, малых лимфатических сосудов, также преимущественно в макрофагах (рис. 8, Г). При иммуногистохимическом исследовании с CD31 и CD34 выявлены признаки очагового повреждения эндотелия. Обнаружена положительная реакция к сурфактантассоцииро-ванному белку А, преимущественно в участках локализации альвеолярных макрофагов (рис. 8, Д).
У 40 пациентов, умерших в срок 21–45 сут от начала заболевания, легкие увеличены, безвоздушные. На висцеральной плевре — множественные кровоизлияния, реже формирование спаечного процесса. На разрезе паренхима легкого пестрого вида, с четкой градацией стадий диффузного альвеолярного повреждения, в отдельных случаях — с «этажностью» изменений. Преимущественно в верхних отделах легких — чередование зон резкого полнокровия, фокальных или массивных кровоизлияний, геморрагических инфарктов, синхронно сочетающихся с обширными участками фиброза, начинающегося преимущественно в субплевральных отделах и занимающего несколько сегментов в средних и нижних отделах обоих легких. В 14 случаях имели место признаки присоединившейся вторичной бактериальной инфекции. Паренхима легких в участках фиброза плотная, «каучуковой» консистенции, при суперинфекции — мелко- и крупнодольчатого строения. Прилежащая к участкам фиброза висцеральная плевра легкого с мелкобугристой поверхностью визуально напоминала капсулу цирротически измененной печени (рис. 9, А).
При гистологическом исследовании — структурная дезорганизация паренхимы легкого с изменением нормальной гистоархитектоники за счет быстропрогрессирующего фиброза. Альвеолы преимущественно коллабированы (ателектазы и дистелектазы) с единичными щелевидными просветами (рис. 10, схематическое изображение 1–3). Межальвеолярные перегородки резко утолщены за счет отложения коллагеновых волокон с фокусами пролиферации фибробластов и миофибробластов, редукцией капиллярного русла, диффузной инфильтрацией макрофагами, полиморфно-ядерными лейкоцитами и немногочисленными лимфоцитами. Эпителиальная выстилка деформированных межальвеолярных перегородок представлена пролиферирующими альвеолоцитами 2-го типа, с признаками резко выраженных реактивных и дисреге-нераторных изменений.
Наблюдаются пролиферативные, гиперпластические и метапластические изменения бронхиального эпителия с формированием аденоматозных структур, очагов плоскоклеточной метаплазии клиническая; 20
тактика ™
Рис. 8. Иммуногистохимический анализ изменений легких при персистирующей фазе COVID-19-ин-терстициальной пневмонии
Д
Примечание. А — экспрессия CD4 Т-лимфоцитами-хелперами, х 200; Б — экспрессия CD8 Т-лимфоцитами-супрессорами, х 200; В — экспрессия CD68, х 100; Г — экспрессия CD31 (PECAM-1), х 200; Д — экспрессия сурфактантассоциирован-ного белка А, х 100.
с фокусами ороговения и реактивной дисплазии. В зонах аденоматозной гиперплазии — наползание метаплазированного бронхиолярного эпителия в просветы альвеолярных ходов (рис. 9, Б). Окрашивание по Ван Гизону выявляло на этой стадии диффузный фиброз легких (рис. 9, В).
Проведено иммуногистохимическое исследование секционного материала 5 пациентов, умерших в течение 21–45 сут от начала заболевания. Во всех случаях фибротической фазы обнаружено преобладание CD8+ Т-супрессоров над CD4+
Т-хелперами, при этом общее количество Т-лимфоцитов резко снижено. CD20+ В-лимфоциты, CD57+ NK-клетки не выявлены.
Резко выраженная экспрессия коллагена IV типа определяется по ходу утолщенных базальных
Рис. 9. Макро- и микроскопическая картина, иммуногистохимический анализ изменений легких при фибротической фазе COVID-19-интерстициальной пневмонии, 36-й день болезни. Окраска гематоксилином и эозином, × 100 (Б, Г–Е); окраска по Ван Гизону, × 100 (В)
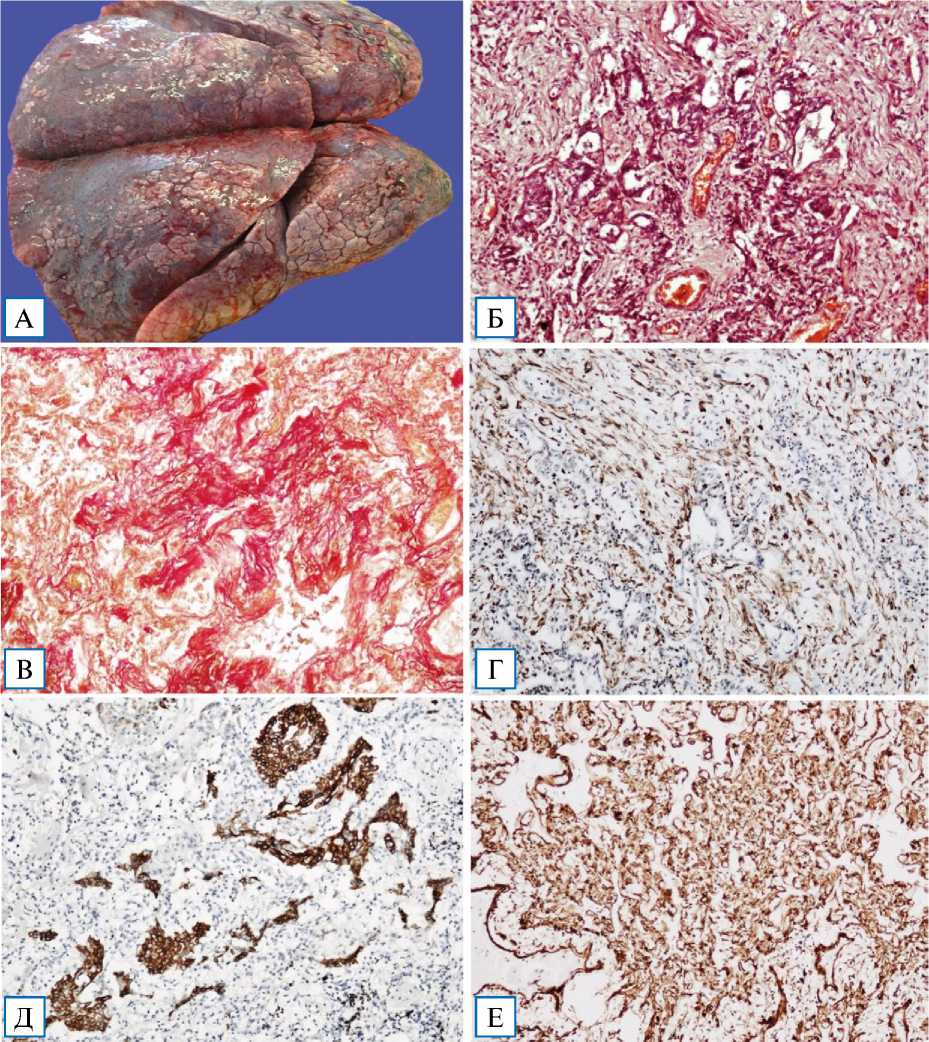
Примечание. А — макропрепарат легких: прилежащая к участкам фиброза висцеральная плевра легкого с мелкобугристой поверхностью, визуально напоминает капсулу цирротически измененной печени; Б — пролиферативные, гиперпластические и метапластические изменения бронхиального и альвеолярного эпителия с формированием аденоматозных структур, очагов плоскоклеточной метаплазии с фокусами ороговения и реактивной дисплазии; В — диффузный фиброз легочной паренхимы при фибротической фазе COVID-19-интерстициальной пневмонии; Г — экспрессия гладкомышечного актина (actin, smooth muscle) пролиферирующих миофибробластов; Д — экспрессия Cytokeratin 5 & 6 в очагах плоскоклеточной метаплазии; Е — экспрессия коллагена IV типа.
мембран, в том числе сосудистого русла, бронхиального дерева, в интерстиции утолщенных и резко деформированных межальвеолярных перегоро- док (рис. 9, Е). На отдельных участках обнаружена более интенсивная реакция вокруг фокусов плоскоклеточной метаплазии.
<линическая’2п20 п эакти ка Том 11 №2
Рис. 10. Патоморфология фибротической фазы COVID-19-интерстициальной пневмонии
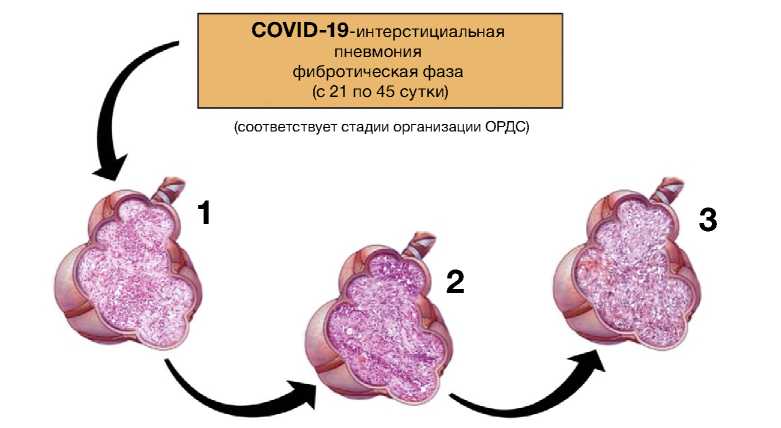
Примечание. ОРДС — острый респираторный дистресс-синдром [иллюстрация Ф.Г. Забозлаева]
ОБСУЖДЕНИЕ
Наш предварительный опыт патологоанатомических исследований умерших пациентов с тяжелыми формами полисегментарных, субтотальных и тотальных пневмоний, вызванных новым коронавирусом (SARS-CoV-2), в сочетании с обширной междисциплинарной информацией позволяет представить рабочую гипотезу патоморфогенеза COVID-19-интерстициальной пневмонии.
Острый респираторный дистресс-синдром при СOVID-19-интерстициальной пневмонии отличается от классической схемы развития диффузного альвеолярного повреждения, модифицированной в 2016 г. [32]. Согласно данной схеме, диффузное альвеолярное повреждение включает 2 стадии общей продолжительностью около 14 дней (рис. 11).
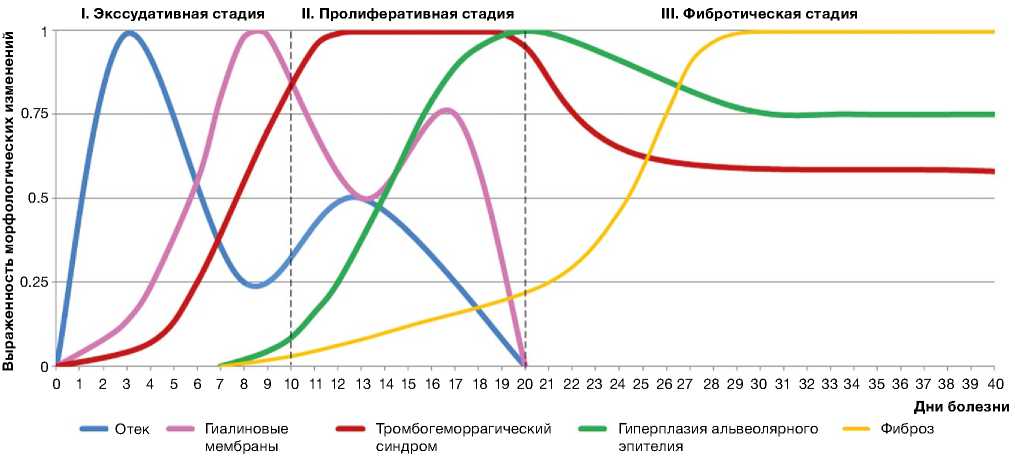
По нашему мнению, ОРДС при СOVID-19 имеет 3 стадии, которые сопровождают развитие соответствующих клинико-морфологических фаз COVID-19-интерстициальной пневмонии:
-
1) экссудативная стадия с развитием фульминантной фазы COVID-19-интерстициальной пневмонии;
-
2) пролиферативная стадия с развитием персистирующей фазы COVID-19-интерстициальной пневмонии;
-
3) фибротическая стадия с развитием фибро-тической фазы COVID-19-интерстициальной пневмонии.
Каждая стадия соответствует определенному времени развития заболевания и представлена характерными макро- и микроскопическими признаками (рис. 12).
Экссудативная стадия соответствует острой фазе диффузного альвеолярного повреждения с развитием распространенного отека легких и формированием в последующем гиалиновых мембран (см. рис. 3), по протяженности занимает до 10 сут от начала клинических симптомов заболевания. Отличительная особенность экссудативной стадии — дисрегуляторная активация моноцитарных фагоцитов, вероятно, ассоциированная с гипериммунным ответом, стимулирующим моноцитарно-макрофагальную систему легких с последующим развитием микротромбоза в сосудах легких, при тяжелых формах — с генерализованным микротромбозом с поражением сосудов сердца, почек, головного мозга, верхних и нижних конечностей. При летальных исходах в течение экссудативной стадии мы посчитали необходимым указать на молниеносное течение соответствующей фульминантной фазы COVID-19-интерстициальной пневмонии.
Особенность пролиферативной стадии, которая составляет до 20 сут от начала клинических симптомов заболевания, — широкий спектр морфологических проявлений, постоянное сочетание персистирующих признаков экссудативной стадии в виде вновь появляющихся фокусов внутриальвео-лярного отека и гиалиновых мембран с гиперпластическими, реактивными и дисрегенераторными
Рис. 11. Стадии острого респираторного дистресс-синдрома по Аnna-Luise A. Katzenstein, 2016 [32]
Острая стадия
Стадия организации
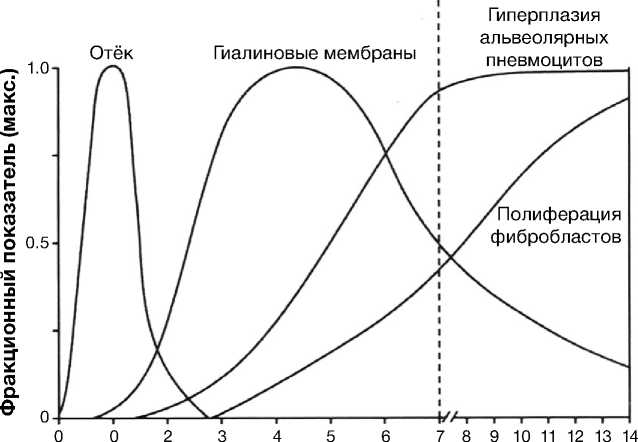
Время от начала повреждения (сутки)
изменениями, начальными признаками развития фиброза. Эти морфологические изменения позволяют говорить об атипическом течении ОРДС при новой коронавирусной инфекции (COVID-19). При этом непосредственные причины смерти наиболее часто связаны с тромбоэмболическими осложнениями и присоединением вторичной (бактериальной) инфекции.
При патологоанатомическом исследовании легких в фибротическую стадию (смерть от 21 до 45 сут и более от начала болезни) отмечалось субтотальное, но чаще тотальное поражение паренхимы с развитием диффузного интрааль-веолярного и интерстициального фиброза при практически полном отсутствии функционально жизнеспособной легочной ткани. Примечательно, что интерстициальный фиброз, который в течение длительного времени развивается и сопровождает течение обычной интерстициальной пневмонии, а также фиброзный вариант неспецифической интерстициальной пневмонии, при фибротиче-ской фазе прогрессирующего тяжелого течения
Рис. 12. Стадии острого респираторного дистресс-синдрома, соответствующие фазам развития
COVID-19-интерстициальной пневмонии
циническая'™™
пэактика—
COVID-19-интерстициальной пневмонии формируется всего за 1,5–2 мес. Ранее данный признак мы также наблюдали при острой интерстициальной пневмонии (синдром Хаммена–Рича).
В случаях выживания пациентов с фибротиче-ской фазой COVID-19-интерстициальной пневмонии требуется квалифицированное катамнестическое наблюдение, поскольку можно прогнозировать их тяжелую инвалидизацию, требующую постоянной респираторной поддержки и рассмотрения вопроса о трансплантации легких вследствие высокой вероятности развития пневмоцирроза и опухолевой трансформации.
Проведенные в небольшом объеме иммуногистохимические исследования предварительно свидетельствуют, что в ответ на внедрение вируса SARS-CoV-2 преобладают реакции Т-клеточного иммунитета, который более выражен в экссудативной стадии с дальнейшим снижением. Превалирование CD8+ Т-лимфоцитов-супрессоров над CD4+ Т-лимфоцитами-хелперами при персистирующей и фибротической фазах коронавирусной (COVID-19) интерстициальной пневмонии может рассматриваться как признак вероятного аутоиммунного поражения.
Слабая выраженность реакций гуморального иммунитета при фульминантной фазе коронавирусной (COVID-19) интерстициальной пневмонии, отсутствие CD20+ В-лимфоцитов и плазматических клеток в фибротической стадии требуют дальнейшего изучения и клинико-морфологических сопоставлений.
Поражение легких с развитием COVID-19-интер-стициальной пневмонии — основная причина тяжелого течения заболевания и летальных исходов. Выраженная воспалительная инфильтрация легочной ткани провоспалительными макрофагами, генерализованное поражение микроциркуляторного русла и более крупных сосудов с развитием тромбоэмболических осложнений, прогрессирующий фиброз паренхимы легких, присоединение вторичной бактериальной инфекции — предикторы неблагоприятного прогноза.
ВЫВОДЫ
-
1. В основе поражения легких при новой коронавирусной инфекции (COVID-19) лежит развитие ОРДС (диффузного альвеолярного повреждения) с атипическим течением, обусловливающим развитие COVID-19-интерстициальной пневмонии c синхронным
-
2. Морфологические признаки фульминантной фазы прогрессирующего тяжелого течения COVID-19-интерстициальной пневмонии, приводящей к быстрому летальному исходу (до 10 сут), соответствуют экссудативной стадии ОРДС в сочетании с моноцитарно-макрофагальной гипериммунной реакцией и развитием обструктивных тромбовоспалительных процессов в микроциркуляторном русле легких, либо носят генерализованный характер.
-
3. Морфологические признаки персистирующей фазы прогрессирующего тяжелого течения COVID-19-интерстициальной пневмонии, приводящей к летальному исходу (до 20 сут), соответствуют пролиферативной стадии ОРДС. В этой фазе имеет место персистенция изменений экссудативной стадии в сочетании с моноцитарно-макрофагальной гипериммунной реакцией, развитием генерализованных обструктивных тромбовоспалительных процессов не только в микроциркуляторном русле, но и в более крупных сосудах, а также распространенных тромбозов и тромбоэмболических осложнений.
-
4. Морфологические признаки фибротической фазы прогрессирующего тяжелого течения COVID-19-интерстициальной пневмонии, приводящей к летальному исходу (от 21 до 45 сут), соответствуют фибротической стадии ОРДС с дисрегенераторными метапластическими и диспластическими изменениями, мультипликативным резко форсированным эффектом фиброза и фибротическим ремоделированием легочной паренхимы.
-
5. Иммуногистохимические исследования, проведенные в небольшом объеме, предварительно свидетельствуют, что при COVID-19-интерстици-альной пневмонии преобладают реакции Т-кле-точного иммунитета. Резкое снижение общего количества Т-лимфоцитов, отсутствие CD20+ В-лимфоцитов, CD57+ NK-клеток в фиброти-ческой стадии — показатель прогрессивного угнетения иммунологической реактивности, при этом повышенная экспрессия CD68 и CD31 (PECAM-1) в макрофагах свидетельствует о неблагоприятном прогнозе.
-
6. Положительные иммуногистохимические реакции к гладкомышечному актину (actin, smooth muscle) пролиферирующих миофибробла
поражением респираторного тракта и микро-циркуляторного русла.
ИСТОЧНИК ФИНАНСИРОВАНИЯ
Работа выполнена при финансовой поддержке ФМБА России.
Список литературы Патологическая анатомия легких при новой коронавирусной инфекции (COVID-19). Предварительный анализ аутопсийных исследований
- Цинзерлинг В.А., Вашукова М.А., Васильева М.В., и др. Вопросы патоморфогенеза новой коронавирусной инфекции (COVID-19) // Журнал инфектологии. - 2020. - Т.12. - №2. - С. 5-11. DOI: 10.22625/2072-6732-2020-12-2-5-11
- Singhal TA. Review of Coronavirus Disease-2019 (COVID-19). Indian J Pediatr. 2020;87(4):281-286. DOI: 10.1007/s12098-020-03263-6
- Epidemiology Working Group for NCIP Epidemic Response, Chinese Center for Disease Control and Prevention. [The epidemiological characteristics of an outbreak of 2019 novel Coronavirus Diseases (COVID-19) - China. (In Chinese)]. Zhonghua Liu Xing Bing Xue Za Zhi. 2020;41(2):145-151. DOI: 10.3760/cma.j.issn.0254-6450.2020.02.003
- Wu F, Zhao S, Yu B, et al. A new coronavirus associated with human respiratory disease in China. Nature. 2020;579(7798):265-269. DOI: 10.1038/s41586-020-2008-3
- Xu Z, Shi L, Wang Y, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir Med. 2020;8(4):420-422. DOI: 10.1016/S2213-2600(20)30076-X
- Zhou F, Yu T, Du R, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020;395(10229):1054-1062.
- DOI: 10.1016/S0140-6736(20)30566-3
- Kuster GM, Pfister O, Burkardet T, et al. SARS-CoV2: should inhibitors of the renin-angiotensin system be withdrawn in patients with COVID-19? Eur Heart J. 2020;41(19):1801-1803.
- DOI: 10.1093/eurheartj/ehaa235
- Ocaranza MP, Riquelme JA, Garcia L, et al. Counter-regulatory renin-angiotensin system in cardiovascular disease. Nat Rev Cardiol. 2020;17(2):116-129.
- DOI: 10.1038/s41569-019-0244-8
- Guo T, Fan Y, Chen M, et al. Cardiovascular implications of fatal outcomes of patients with Coronavirus Disease 2019 (COVID-19). JAMA Cardiol. 2020;e201017. 10.1001/Jamacardio. 2020.1017.
- DOI: 10.1001/Jamacardio.2020.1017
- Zhang H, Penninger JM, Li Y, et al. Angiotensin-converting enzyme 2 (ACE2) as a SARS-CoV-2 receptor: molecular mechanisms and potential therapeutic target. Intensive Care Med. 2020; 46:586-590.
- DOI: 10.1007/s00134-020-05985-9
- Hamming I, Timens W, Bulthuis ML, et al. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol. 2004;203:631-637.
- DOI: 10.1002/path.1570
- Heurich A, Hofmann-Winkler H, Gierer S, et al. TMPRSS2 and ADAM17 Cleave ACE2 differentially and only proteolysis by TMPRSS2 augments entry driven by the severe acute respiratory Syndrome Coronavirus spike protein. J Virol. 2014;88(2):1293-1307.
- DOI: 10.1128/JVI.02202-13
- Tian X, Li C, Huang A, et al. Potent binding of 2019 novel coronavirus spike protein by a SARS coronavirus-specific human monoclonal antibody. Emerg Microbes Infect. 2020;9(1):382-385.
- DOI: 10.1080/22221751.2020.1729069
- Coronavirus: Novel Coronavirus (COVID-19) Infection. Reviewed by: Perlman S, MD, PhD (Professor Department of Microbiology and 38 Immunology Department of Pediatrics University of Iowa). Published February 5, 2020; Updated 2020 March 25. Elsevier; 2020. 10 p.
- Xu H, Zhong L, Deng J, et al. High expression of ACE2 receptor of 2019-nCoV on the epithelial cells of oral mucosa. Int J Oral Sci. 2020;12(1):8.
- DOI: 10.1038/s41368-020-0074-x
- Magrone T, Magrone M, Jirillo E. Focus on receptors for Coronaviruses with special reference to angiotensin-converting Enzyme 2 as a potential drug target- a perspective. Endocr Metab Immune Disord Drug Targets. 2020.
- DOI: 10.2174/1871530320666200427112902
- Wrapp D, Wang N, Corbett KS, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science. 2020;367(6483):1260-1263.
- DOI: 10.1126/science.abb2507
- Абатуров А.Е., Агафонова Е.А., Кривуша Е.Л., Никулина А.А. Патогенез COVID-19 // Здоровье ребенка. - 2020. - Т.15. - №2. - С. 133-144.
- DOI: 10.22141/2224-0551.15.2.2020.200598
- Giamarellos-Bourboulis EJ, Netea MG, Rovina N, et al. Complex immune dysregulation in COVID-19 Patiens with sever respiratory failure. Cell Host Microbe. 2020;27(6):992-1000.
- DOI: 10.1016/j.chom.2020.04.009
- Astuti I, Ysrafil. Severe acute respiratory syndrome Coronavirus 2 (SARS-CoV-2): an overview of viral structure and host response. Diabetes Metab Syndr. 2020;18;14(4):407-412.
- DOI: 10.1016/j.dsx.2020.04.020
- Qin, C, Zhou L, Hu Z, et al. Dysregulation of immune response in patients with COVID-19 in Wuhan, China. Clin Infect Dis. 2020;ciaa248.
- DOI: 10.1093/cid/ciaa248
- Li H, Liu L, Zhang D, et al. SARS-CoV-2 and viral sepsis: observations and hypotheses. Lancet. 2020;395(10235):1517-1520.
- DOI: 10.1016/S0140-6736(20)30920-X
- Ruan Q, Yang K, Wang W, et al. Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. 2020;46(5):846-848.
- DOI: 10.1007/s00134-020-05991-x
- Вартанян А.А., Косоруков В.С. Пироптоз - воспалительная форма клеточной гибели // Клиническая онкогематология. - 2020. - Т.13. - №2. - С. 129-135.
- DOI: 10.21320/2500-2139-2020-13-2-129-135
- Jeremy KY, Moriyama M, Iwasaki A. Inflammasomes and pyroptosis as therapeutic targets for COVID-19. J Immunol. 2020;ji2000513.
- DOI: 10.4049/jimmunol.2000513
- Merad M, Martin JC. Pathological inflammation in patients with COVID-19: a key role for monocytes and macrophages. Nat Rev Immunol. 2020;20(6):355-362.
- DOI: 10.1038/s41577-020-0331-4
- Франк Г.А., Ковалев А.В., Грибунов Ю.П., и др. Исследование умерших с подозрением на коронавирусную инфекцию (COVID-19). Временные методические рекомендации МЗ РФ. Версия 15 (30.04.2020). - М., 2020. - 256 с.
- Зайцев А.А., Чернов С.А., Стец В.В., и др. Алгоритмы ведения пациентов с новой коронавирусной инфекцией COVID-19 в стационаре. Методические рекомендации. - М.: ГВКГ имени Н.Н. Бурденко, 2020. - 16 с.
- Ciceri F, Beretta L, Scandroglio AM, et al. Microvascular COVID-19 lung vessels obstructive thromboinflammatory syndrome (MicroCLOTS): an atypical acute respiratory distress syndrome working hypothesis. Crit Care Resusc. 2020.
- Katzenstein А.-L.A. Diagnostic atlas of non-neoplastic lung disease: a practical guide for surgical pathologists, NY: Demos Medical Publishing, LLC/Springer Publishing Company; 2016. Р. 115-126.
- Цинзерлинг В.А., Вашукова М.А., Васильева М.В., и др. Вопросы патоморфогенеза новой коронавирусной инфекции (COVID-19) // Журнал инфектологии. - 2020. - Т.12. - №2. - С. 5-11.
- DOI: 10.22625/2072-6732-2020-12-2-5-11


