Патоморфологическая характеристика раневого ложа перед кожной аутопластикой
Автор: Богданов С.Б., Мелконян К.И., Поляков А.В., Сотниченко А.С., Веревкин А.А., Гилевич И.В., Аладьина В.А., Богданова Ю.А., Каракулев А.В., Медведева Л.А., Порханов В.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Патологическая физиология
Статья в выпуске: 1 т.18, 2022 года.
Бесплатный доступ
Цель: провести сравнительный патоморфологический анализ ран различного генеза, требующих проведения полнослойной кожной аутопластики. Материал и методы. Проведено гистоморфологическое сравнение дна раны перед пластикой полнослойными кожными аутотрансплантатами в трех группах пациентов: 1 - при иссечении рубцовой ткани в плановой хирургии; 2 - при травматических отслойках кожи с выполнением пластики по Красовитову; 3 - при иссечении грануляционной ткани до фиброзного слоя. Объект исследования - биоптаты больных трех исследуемых групп. Результаты. Гистологическая картина ран после удаления рубцов характеризуется хорошо развитой плотной волокнисто-клеточной соединительной тканью, имеет признаки хронического воспаления. В отличие от рубцовой раны острые повреждения характеризовались грануляционной и зрелой плотной волокнистой соединительными тканями с выраженными воспалительными изменениями, каждая из которых имела особенности. Заключение. Результаты сравнительного анализа выявили особенности морфологической картины ран в зависимости от типа повреждения. В группе острых повреждений, травматической и ожоговой ране, выявлены наиболее выраженные повреждения ткани. Учитывая полученные данные, следует предположить, что полнослойная аутодермопластика будет иметь наилучший результат в группе пациентов после планового иссечения рубцовой ткани.
Аутодермопластика, гранулирующая рана, ожог, отслойка кожи
Короткий адрес: https://sciup.org/149141136
IDR: 149141136 | УДК: 616.5-001.1:616-089.844
Текст научной статьи Патоморфологическая характеристика раневого ложа перед кожной аутопластикой
1Введение. Ожоговые травмы являются важнейшей медико-социальной проблемой современного общества, что обусловлено их распространенностью, высокой смертностью пациентов, значительными показателями временных трудовых потерь и первичной инвалидности. Во всем мире ожоги находятся на четвертом месте среди наиболее распространенных видов травмы; по данным Всемирной организации здравоохранения, ежегодно обращаются за медицинской помощью с ожогами примерно 6 млн человек [1–3]. В хирургической тактике активного лечения ожоговых ран важнейшее значение занимает их своевременное закрытие. Успешность полнослойной аутодермопластики во многом зависит от сроков выполнения операции. Несмотря на многочисленные исследования процессов заживления ран после ожогов, вопросы репарации и ангиогенеза в аутотрансплантатах остаются до сих пор недостаточно изученными [4–6]. Основным видом операций для восстановления целостности кожных покровов у обожженных является дерматомная кожная аутопластика расщепленным трансплантатом, однако результаты пластики полнослойным кожным аутотрансплантатом максимально приближены к здоровой коже. Приживление трансплантатов зависит от уровня васкуляризации раневого ложа и степени его инфицирования. Неблагоприятными местными факторами являются обнаженная рыхлая подкожная жировая клетчатка, сухожилия, недостаточный гемостаз, неполнота удаления некроза, воспаление в ране в связи с поздними сроками операции после травмы [7–9]. Вследствие этого морфологическое изучение дна ожоговой раны на разных сроках выполнения полнослойной аутодермопластики является актуальным.
26 июня 2020 г. исполнилось 85 лет со дня первой свободной пересадки кожи при травматической отслойке кожи по методу Владимира Константиновича Красовитова. Данный метод пластики используется во всем мире и носит название автора. В. К. Красови-тов был основателем пластической школы хирургии на Кубани. В XXI в. в этом регионе продолжают совершенствоваться методы полнослойных пластик не только в чистых хирургических условиях, но и пересадка на гранулирующую ткань — через 2–4 недели после травмы. Основным условием для приживления на гранулирующую (гнойную рану) является иссечение грануляционной ткани до нижнего фиброзного слоя [10].
Полнослойный кожный трансплантат приближен по своим качествам к здоровой коже, он меньше рубцуется, чем расщепленный трансплантат. Вместе с тем при пластике полнослойной кожей возникает дефект на донорском участке, на который выполняется пластика расщепленными трансплантатами или при небольших участках накладываются первичные швы. Данные технические ограничения являются показаниями для оперативного лечения в косметических и функциональных зонах, небольших по площади участках тела [11].
Разработка хирургических приемов пластики полнослойным аутотрансплантатом на гнойную рану и изучение раневого ложа при приживлении полнослойного трансплантата сегодня остается актуальным, поскольку позволяет спрогнозировать течение раневого процесса и добиться оптимальных функциональных и косметических результатов.
Цель — провести сравнительный патоморфоло-гический анализ ран различного генеза, требующих проведения полнослойной кожной аутопластики.
Материал и методы. Проведено гистоморфоло-гическое сравнение дна раны перед пластикой полнослойными кожными аутотрансплантатами в трех группах пациентов: 1 — при иссечении рубцовой ткани в плановой хирургии ( n =10); 2 — при травматических отслойках кожи с выполнением пластики по Красовитову ( n =8); 3 — при иссечении грануляционной ткани до фиброзного слоя ( n =13). Гистологический материал для исследования получен в срок пять дней после проведения операции.
Фрагменты ткани (дно раны) иссекали под общим обезболиванием в ходе оперативного лечения перед пластикой полнослойными аутотрансплантатами.
Все биоптаты подвергались стандартной гистологической обработке, включающей в себя предварительную фиксацию тканевых фрагментов в 10%-м забуференном растворе формалина в течение 18– 24 часов, гистологическую проводку в изопропиловом спирте с использованием гистологического процессора STP-120 Microm, заливку биоптатов гистомиксом в пластиковые кассеты с использованием заливочной станции Microm. Резка материала с приготовлением тонких парафиновых срезов осуществлялась ротационным микротомом Microm Е-340н. Окраска препаратов проводилась по стандартной методике гематоксилином — эозином, пикрофуксином по Ван Гизону. Иммуногистохимическое исследования включало в себя окрашивание препаратов с анти-CD3-,
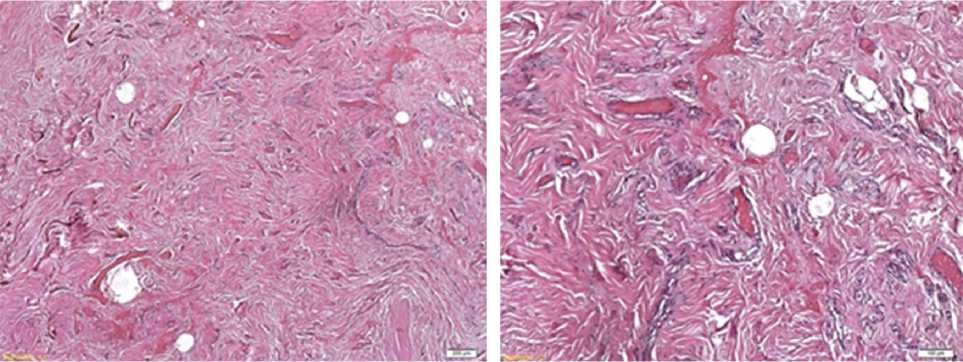
б
Рис. 1. Образец дна раны пациента после планового иссечения рубцовых тканей. Дно раны представлено грубоволокнистой соединительной тканью с очагами периваскулярной лимфомакрофагальной инфильтрации. Окраска гематоксилином и эозином: а) увеличение об. ×40, б) увеличение об. ×200
анти-CD68- и анти-CD31-антителами, а также антителами к эпидермальному цитокератину AE1/AE3 и коллагену IV типа. Микроскопическое исследование производили с помощью микроскопа Olympus IX51 с системой визуализации Olympus CellSense при увеличении ×40 и ×200. Для компьютерной морфометрии использовали программу ImageJ. Для подсчета клеток и определения линейных размеров проводили компьютерную морфометрию с использованием программы ImageJ и надстройки IHC metrics (National Institutions of Health, США). Для вычисления количества клеток применили разработанный авторами алгоритм анализа, включающий в себя получение цифрового изображения тканевых структур, определение общей площади среза с помощью инструмента «Ручное выделение», настройку инструмента «Анализатор частиц» — задание размеров и характера взаиморасположения искомых объектов, определение с помощью анализатора частиц общего числа искомых клеточных элементов в биоптате [12]. Для морфометрии препаратов после иммуногистохимических реакций использовали инструмент IHC metrics, руководствуясь пользовательской инструкцией.
Результаты. Гистологические препараты из группы пациентов, перенесших удаление рубцов в плановом порядке, в целом характеризуются хорошо развитой плотной волокнисто-клеточной соединительной тканью (рис. 1). В большинстве препаратов преобладает волокнистый компонент, коллагеновые волокна не фрагментированы, но расположены неупорядоченно. Толщина слоя соединительной ткани составила в среднем 1,5 мм. Наблюдались единичные случаи формирования многочисленных мелких очагов развития многослойного эпителия в толще соединительной ткани (эпидермальная дифференцировка клеток подтверждена путем иммуногистохимического исследования с антителами к цитокератинам АЕ [13]), а также единичные случаи паракератоза.
В большинстве препаратов отмечено большое количество мелких кровеносных сосудов, базальная мембрана которых хорошо визуализируется при иммуногистохимическом выявлении коллагена IV (рис. 2), а также признаки хронического воспале-
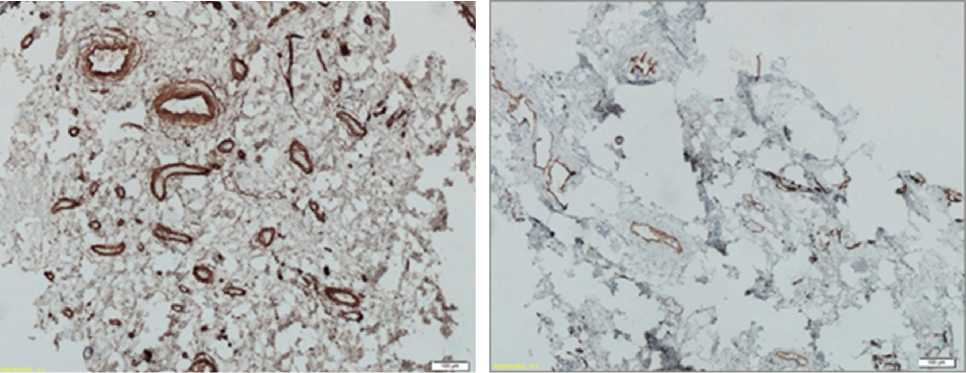
а
б
Рис. 2. Образец дна раны пациента после планового иссечения рубцовых тканей:
а) иммуногистохимическая реакция на коллаген IV типа выявила данное вещество в базальных мембранах сосудов, б) иммуногистохимическое определение тромбоцитарно-эндотелиальных молекул клеточной адгезии CD31 выявило положительную реакцию в эндотелии сосудов. Увеличение ×200
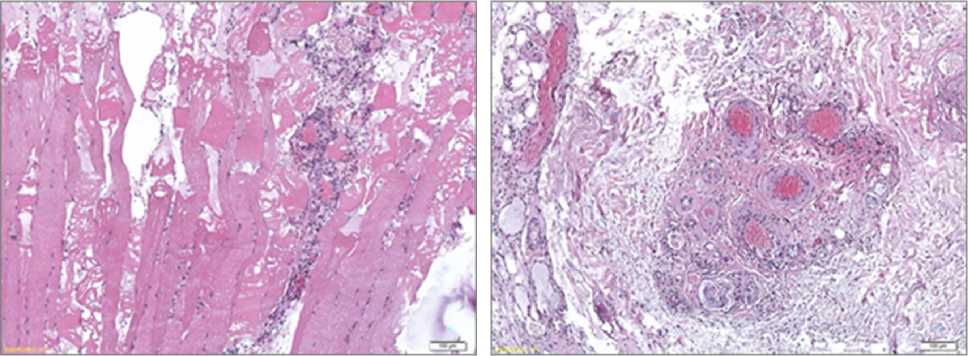
б
Рис. 3. Образцы ткани пациентов после травматической отслойки эпидермиса. В отдельных срезах наблюдается дистрофически измененная ишемизированная мышечная ткань с периваскулярной лимфомакрофагальной инфильтрацией и субфасциальным кровоизлиянием; отдельные капилляры препарата тромбированы. Окраска гематоксилином и эозином: а) увеличение об. ×40; б) увеличение об. ×200
ния — периваскулярные и не связанные с сосудами диффузные и диффузно-очаговые воспалительные инфильтраты, состоящие из лимфоцитов и макрофагов (клеточный состав инфильтрата подтвержден путем иммунофенотипирования CD3-позитивных и CD68-позитивных клеток). Однако стоит отметить, что выраженность воспалительной реакции в целом была незначительной.
Для гистологических препаратов из группы пациентов с травматической отслойкой эпидермиса характерно преобладание явлений острого повреждения. В большинстве срезов отмечены кровоизлияния, как свежие, так и организующиеся, а также некротические и некробиотические изменения. Особенно выраженный характер они носят в скелетной мышечной ткани, присутствующей в значительной доле исследованных образцов (рис. 3).
Плотная волокнистая соединительная ткань, нередко содержащая очаги воспалительной инфильтрации, имела неупорядоченно расположенные коллагеновые волокна и в основном наблюдалась гиподерме.
Грануляционная ткань характеризуется выраженным клеточным компонентом и значительными дистрофическими изменениями, в частности фибриноидным набуханием, с повреждением стенок кровеносных сосудов. Последнее проявлялось их тромбозом и кровоизлияниями.
В целом воспалительная инфильтрация присутствовала в большинстве гистологических препаратов. Многочисленные крупные воспалительные инфильтраты локализовались во всех слоях тканей образцов. Аналогично в группе 1: клеточный состав в значительной мере представлен лимфоцитами и макрофагами (определены путем иммуногистохимического исследования с анти-CD3-и анти-CD68-антителами [14]).
Многослойный плоский эпителий отмечен в половине препаратов. В большинстве случаев эпидермис характеризовался реактивным гиперкератозом. Очагов пролиферации эпителия в толще соединительной ткани не обнаружено (отрицательная реакция с антителами к цитокератину АЕ).
Препараты из группы пациентов с термическими повреждениями объединяло наличие грануляционной и зрелой плотной волокнистой соединительных тканей. Грануляционная ткань характеризовалась наличием значительного количества мелких кровеносных сосудов, большинство из которых были полнокровны. Во всех тканях большинства гистологических препаратов отмечалась значительная диффузно-очаговая воспалительная инфильтрация, представленная лимфоцитами и макрофагами (клеточный состав подтвержден с помощью иммуногистохимического определения CD3+- и CD68+-клеток). Скопление клеток воспаления носило в основном периваскулярный характер (рис. 4).
Коллагеновые волокна плотной волокнистой соединительной ткани располагались неупорядоченно, клеточный компонент был выражен слабо.
В глубоких слоях тканей, как правило, на границе дермы и подкожно-жировой клетчатки, отмечались значительные кровоизлияния. Многослойный плоский эпителий отсутствовал во всех гистологических препаратах.
Обсуждение. Патоморфологическая картина материала пациентов после планового иссечения рубцов в целом характеризовалась преобладанием грубоволокнистой соединительной ткани с неупорядоченным расположением коллагеновых волокон, а также наличием большого количества грануляционной ткани с хорошо выраженным клеточным компонентом и большим количеством сосудов. Воспалительные изменения носили хронический характер и выражены в минимальной степени. Это можно объяснить низкой контаминацией операционной раны. В ряде препаратов отмечено развитие эпидермиса с сохраненной стратификацией. Учитывая наличие кластеров клеток эпителиального происхождения, источником которых, по-видимому, становятся волосяные фолликулы, можно предположить присутствие в ткани значительного количества эпидермального фактора роста. Вкупе с низкой микробной контаминацией, а также хорошо развитым микроциркулятор-ным руслом это создает хорошие условия для полной регенерации участка кожи и приживления дермального аутотрансплантата [15].
Группа образцов ткани после травматической отслойки эпидермиса характеризовалась выраженными изменениями, присущими острому повреждению: некрозом, дистрофией, отеком и фрагментацией ткани. Кроме того, в препаратах данной группы более выражена по сравнению с группой рубцовых поражений
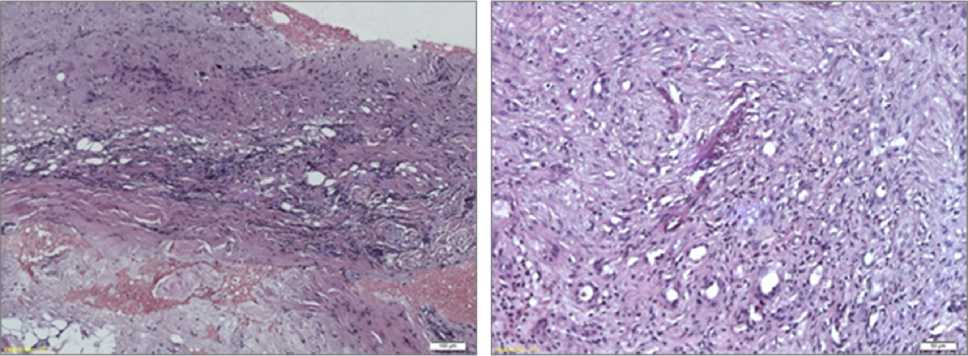
б
Рис. 4. Образец ткани пациента после термического повреждения. Препарат представлен грануляционной тканью с большим количеством тонкостенных сосудов диаметром до 20 мкм и диффузным периваскулярным лимфомакрофагальным инфильтратом. Окраска гематоксилином и эозином:
а) увеличение об. ×40; б) увеличение об. ×200
воспалительная инфильтрация. Однако значительная часть препаратов данной группы содержала эпидермис, по-видимому, сохранный после получения непосредственно травмы и не имеющий отношения к процессу регенерации на момент исследования [16].
Группа образцов после ожоговых поражений характеризовалась значительным повреждением кровеносных сосудов, что отражено в многочисленных кровоизлияниях в разных слоях тканей, а также в полнокровии капилляров и артериол [17]. Значительно выраженными были также и воспалительные изменения, выявленные практически во всех биопта-тах. Подобные глубокие изменения можно объяснить дистрофией стенок кровеносных сосудов в области, непосредственно окружающей очаг поражения [18].
Заключение. Результаты сравнительного анализа выявили особенности морфологической картины ран в зависимости от типа повреждения. В группе острых повреждений, травматической и ожоговой ране, были обнаружены наиболее выраженные повреждения ткани. Учитывая полученные данные, следует предположить, что полнослойная аутодермопластика будет иметь наилучший результат в группе пациентов после планового иссечения рубцовой ткани.
Список литературы Патоморфологическая характеристика раневого ложа перед кожной аутопластикой
- Salamone JC, Salamone AB Swindle-Reilly K, et al. Grand challenge in Biomaterials: wound healing. Regen Biomater 2016; (3): 127–8.
- Andreev SV. Modeling of diseases. Moscow: Medicine, 1973; 336 р. Russian (Андреев С. В. Моделирование заболеваний. М.: Медицина, 1973; 336 с.).
- Shevchenko RV, James SE, Reed MJ, et al. Pork experimental model as an effective tool for transferring scientific knowledge to the clinic to replenish the combustiologist’s arsenal. Combustiology 2007; (30). URL: http://combustiolog.ru / journal / svinaya-e-ksperimental-naya-model-kak-e-ffektivny-j-instrument-perenosa-nauchny-h-znanij-v-kliniku-dlya-popolneniya-arsenala-kombustiologa / (15 Feb 2022). Russian (Шевченко Р. В., Джеймс С. Э., Рид М. Дж. и др. Свиная экспериментальная модель как эффективный инструмент переноса научных знаний в клинику для пополнения арсенала комбустиолога. Комбустиология 2007; (30). URL: http://combustiolog.ru / journal / svinaya-e-ksperimental-naya-model-kak-e-ffektivny-j-instrument-perenosa-nauchny-h-znanij-v-kliniku-dlya-popolneniya-arsenala-kombustiologa / (дата обращения: 15.02.2022)).
- Burd A, Ahmed K, Lam S, et al. Stem cell strategies in burns care Burns 2007; 33 (3): 282–91.
- Chua AWC, Khoo YC, Tan BK, et al. Skin tissue engineering advances in severe burns: review and therapeutic applications. Burns Trauma 2016; 4 (1): 3.
- Climov M, Medeiros E, Farkash EA, et al. Bioengineered self-assembled skin as an alternative to skin grafts. Plastic and Reconstructive Surgery Global Open 2016; 4 (6): e731.
- Keck M, Haluza D, Lumenta DB, et al. Construction of a multi-layer skin substitute: simultaneous cultivation of keratinocytes and preadipocytes on a dermal template. Burns 2011; 37 (4): 626–30.
- Leclerc T, Thepenier C, Jault P, et al. Cell therapy of burns. Cell Proliferation 2011; (44): 48–54.
- Wormald JC, Fishman JM, Juniat S. Regenerative medicine in otorhinolaryngology. J Laryngol Otol 2015; 129 (8): 732–9.
- Bogdanov SB, Gilevich IV, Fedorenko TV, et al. Cell therapy application in skin grafting surgery. Innovative Medicine of Kuban 2018; (3): 16–21. Russian (Богданов С. Б., Гилевич И. В., Федоренко Т. В. и др. Возможности применения клеточной терапии в кожно-пластических операциях. Инновационная медицина Кубани 2018; (3): 16–21).
- Bogdanov SB, Kurinniy NA, Polyakov AV, et al. Method of skin plasty after early necrectomy. Patent for invention RU 2295924 C, 27.03.2007. Application №2005123211 dated 21.07.2005. Russian (Богданов С. Б., Куринный Н. A., Поляков А. В. и др. Способ пластики кожных покровов после ранней некрэктомии. Патент на изобретение RU 2295924 C, 27.03.2007. Заявка №2005123211 от 21.07.2005).
- Slavinsky AA, Verevkin AA, Sotnichenko AS, et al. Immunohistochemical profile of mononuclear infiltrate in the myocardium of transplanted heart. Computer morphometry data. Kuban Scientific Medical Bulletin 2020; 27 (2): 92–101. Russian (Славинский А. А., Веревкин А. А., Сотниченко А. С. и др. Иммуногистохимический профиль мононуклеарного инфильтрата в миокарде пересаженного сердца. Компьютерная морфометрия. Кубанский научный медицинский вестник 2020; 27 (2): 92–101).
- Grellner W, Madea B. Demands on scientific studies: vitality of wounds and wound age estimation. Forensic Sci Int 2007; 165 (2-3): 150–4.
- Velnar T, Bailey T, Smrkolj V. The wound healing process: an overview of the cellular and molecular mechanisms. J Int Med Res 2009; 37: 1528–42.
- Delavary BM, van der Veer WM, van Egmond M, et al. Macrophages in skin injury and repair. Immunobiology. Elsevier GmbH 2011; 216 (7): 753–62.
- Demidova-Rice TN, Durham JT, Herman IM. Wound healing angiogenesis: innovations and challenges in acute and chronic wound healing. Adv Wound Care 2012; (1): 17–22.
- Pober JS, Tellides G. Participation of blood vessel cells in human adaptive immune responses. Trends Immunol 2012; (33): 49–57.
- Landén NX, Li D, Ståhle M. Transition from inflammation to proliferation: a critical step during wound healing. Cell Mol Life Sci 2016; (73): 3861–85.


