Перекисное окисление липидов во внутренних органах крыс при тревожно-депрессивных расстройствах
Автор: Цеиликман В.Э., Козочкин Д.А., Синицкии А.И.
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Проблемы здравоохранения
Статья в выпуске: 19 (195), 2010 года.
Бесплатный доступ
Исследования выявили, что введение глюкокортикоидного препарата после завершения редко чередующихся иммобилизаций предотвращает постстрессорную активацию липопероксидации в паренхиматозных и в иммунных органах.
Анксиогенный стресс, глюкокортикоиды, пол
Короткий адрес: https://sciup.org/147152705
IDR: 147152705 | УДК: 616.008.93-06:616.895-092.9
Текст краткого сообщения Перекисное окисление липидов во внутренних органах крыс при тревожно-депрессивных расстройствах
В настоящее время доказано, что повышенный уровень тревожности связан с чрезмерной активацией гипоталамо-гипофизарно-адреналовой системы (ГГАС). В свою очередь, это обусловлено нарушением регуляции последней по механизму «отрицательной обратной связи», проявляющимся в повышении гипоталамического порога чувствительности к ингибирующему действию глюкокортикоидных гормонов. Поэтому при стрессорных ситуациях, обуславливающих тревожно-депрессивные расстройства, наблюдается повышенный уровень стрессорных гормонов. Однако «тяжесть» стресса определяется не только содержанием катехоламинов и глюкокортикоидов, но и уровнем чувствительности к ним органов-мишеней. Это, в свою очередь, может отразиться и на процессах свободнорадикального окисления в клетках органов-мишеней.
Цель исследования: изучить влияние стрессорных воздействий с пассивно-тревожным характером поведенческой активности на чувствительность к глюкокортикоидам и соотношение между прооксидантными и антиоксидантными системами в крови и во внутренних органах.
Исследования проведены на 100 половозрелых беспородных крысах обоего пола массой 190220 г. Все животные были распределены на 4 экспериментальные группы. Крыс двух изученных групп подвергали четырёхкратному иммобилиза-ционному стрессу по методу В.Э. Цейликмана и соавт. (1991). Длительность однократной иммобилизации составляла 60 минут, стрессовые воздействия повторяли с интервалом в 72 часа. Описанное является способом моделирования анксиоген-ного стресса, т. е. данный временной интервал между отдельными стрессорными эпизодами затрудняет развитие габитуации и содержит определённый элемент внезапности. Поэтому данный метод иммобилизационного стресса гомологичен «стрессу повседневной жизни» и сопровождается развитием поведенческих расстройств тревожнодепрессивного характера.
С целью моделирования стрессорной активации ГГАС подкожно вводили пролонгированный глюкокортикоидный препарат триамцинолона аце тонид («кеналог», Veb Berlin Chemie, Германия) в дозе 2 мг/кг. Животные другой группы получали эквиобъёмное количество 0,9 %-ного раствора NaCl. Еще две группы крыс получали аналогичные инъекции без предварительного стрессирования.
Через 96 ч с момента подкожного введения триамцинолона ацетонида или 0,9 %-ного раствора NaCl крыс забивали под эфирным наркозом. Чувствительность к ГКГ оценивали по степени кена-логиндуцированного снижения массы вилочковой железы [1].
Поведенческие реакции животных исследовались в актографе «открытое поле». Содержание продуктов перекисного окисления липидов оценивали спектрофотометрически в липидном экстракте исследуемых тканей (И.А. Волчегорский и соавт., 2000). Кроме того, в гомогенатах тканей органов определяли каталазную активность по методу М.А. Королюк и соавт. (1988) и активность супер-оксиддисмутазы по методу С. Чевари и соавт. (1985).
Исследованный режим стрессирования вызывал уменьшение локомоции и исследовательской активности крыс в актографе «открытое поле», кроме того, снижение частоты груминга. Подобные сдвиги рассматриваются как результат подавления мотивации изучения незнакомого пространства, а также выполнения гигиенического стереотипа (груминг). Отмеченные мотивационные нарушения сопровождались нарастанием частоты дефекаций, что считается вегетативным эквивалентом тревоги у крыс (см. рисунок). Полученные результаты соответствуют ранее опубликованным данным и согласуются с критериями тревожно-депрессивных расстройств поведения [2-5].
О наличии активации гипоталамо-гипофизарно-адреналовой системы свидетельствует факт увеличения содержания кортикостерона через 24 часа после завершения повторных стрессорных эпизодов (с 21,61 ± 4,30 нмоль/л в контроле (п = 8) до 25,61 ± 5,31, в опытной (и = 8) группе, Р = 0,015 WW). Это может быть обусловлено гипоталамической гиперпродукцией кортиколиберина, который рассматривается как медиатор стрессогенной тре-
Проблемы здравоохранения
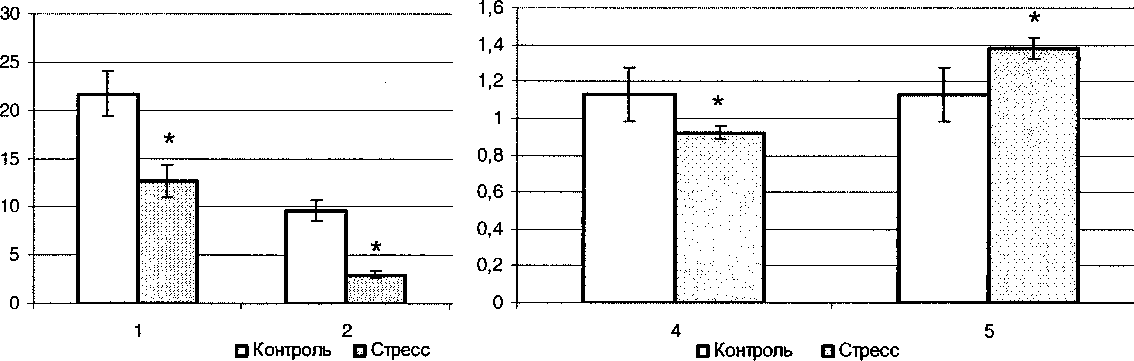
Влияние повторных четырехкратных иммобилизаций на поведенческую активность крыс в актографе «открытое поле»: стрессогенные сдвиги локомоции (1), исследовательской активности (2); стрессогенные сдвиги груминга (4) и анксиогенной дефекации (5); * - р < 0,05 в сравнении с контролем
вожности, вызывающий состояние «сверхбодрствования» и центральную активацию симпатико-адреналовой системы. Повышенное в течение длительного времени содержание глюкокортикоидов может повлечь за собой десенситизацию к ним со стороны органов-мишеней. Это предположение подтвердилось в экспериментах, в которых исследовалось действие глюкокортикоидного препарата триамцинолона ацетонида на фоне предварительного анксиогенного стресса.
У животных, получавших ТА без предшествующего иммобилизационного стресса, наблюдалась атрофия вилочковой железы. Это проявлялось в снижении массы органа при одновременном уменьшении значения тимического индекса и количества тимоцитов.
Предварительные иммобилизации отменяли эффекты глюкокортидного препарата по отношению к вилочковой железе. Введение экзогенного глюкокортикоида на фоне стресса приводило к увеличению общего количества тимоцитов и массы тимуса в сравнении с соответствующими показателями группы «триамцинолона ацетонид».
Таким образом, при редко чередующихся иммобилизациях развитие пассивно-тревожного характера поведенческой активности ассоциируется с активацией гипоталамо-гипофизарно-адренало-вой системы и сниженной чувствительностью к глюкокортикоидам.
Наши исследования показали, что десенсити-зация органов-мишений к глюкокортикоидным гормонам при редкочередующихся иммобилизациях сопровождается модифицикацией органотропных эффектов глюкокортикоидного препарата.
Так, в группе «стресс» наблюдалось достоверное увеличение содержания всех категорий молекулярных продуктов ПОЛ в костном мозге и селезенке, в тимусе выявлено статистически значимое увеличение содержания всех категорий молекулярных продуктов ПОЛ в изопропанольной фазе, увеличение первичных продуктов с одновременным снижением вторичных продуктов - в гептановой.
Далее показано, что стрессорные воздействия отразились на глюкокортикоид-зависимой модификации изменений ПОЛ в печени и почках. В обоих случаях четырехкратный иммобилизаци-онный стресс вызывает активацию ПОЛ, выраженность которой уменьшается под действием триамциналона ацетонида и сопряжена со снижением МАО-активности в этих органах.
Одновременно с этим в тимусе отмечено относительное снижение (по сравнению с группой «стресс») всех категорий молекулярных продуктов ПОЛ в изопропанольной фазе и диеновых конъюгатов в гептановой. В костном мозге и селезенке одновременно со снижением уровня нейтрофилов в группе «стресс+ТА» относительно группы «стресс» отмечено статистически значимое снижение всех
Влияние иммобилизационного стресса и триамцинолона ацетонида на некоторые характеристики тимуса
|
Показатель |
Контроль (п=12) |
Стресс (п = 12) |
ТА (п=12) |
Стресс +ТА (п=12) |
|
Масса тимуса (мг) |
240,3 ± 19,0 |
241,5 ±26,4 |
123,8 ± 13,9* |
201,6 ±24,4** |
|
ЯСК(х106) масса тимуса (мг) |
2,75±0,29 |
3,22±0,28 |
2,07±0,3 |
4,53±0,51** |
|
Количество тимоцитов (х106) |
692,9± 105,9 |
767,5±105 |
263,2±58* |
898,7±163** |
Примечание. * - статистически значимые различия от показателей контрольной группы. ** - между группами «ТА» и «стресс + ТА». Статистическая обработка проведена с использованием критериев Манна-Уитни, Вальда-Вольфовица, Колмогорова-Смирнова и точного критерия Фишера; различия считали достоверными при р < 0,05.
Цейликман В.Э., Козочкин Д.А., Синицкий А.И.
категорий молекулярных продуктов липоперок-сидации (см. таблицу).
Таким образом, введение триамцинолона ацетонида после завершения редко чередующихся иммобилизаций предотвращает постстрессорную активацию липопероксидации в паренхиматозных и в иммунных органах.
Исследование проведено в рамках реализации ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009—2013 гг.
Список литературы Перекисное окисление липидов во внутренних органах крыс при тревожно-депрессивных расстройствах
- Волчегорский, И.А. Экспериментальное моделирование и лабораторная оценка адаптационных реакций организма/И.А. Волчегорский, И.И. Долгушин, О.Л. Колесников, В.Э. Цейликман. -Челябинск, 2000. -167 с.
- Гольдберг, Е.Д. Методы культуры тканей в гематологии/Е.Д. Голъдберг, A.M. Дыгай, В.П. Шахов. -Томск: Изд-во Томского ун-та, 1992. -278 с.
- Депрессия в неврологической практике/A.M. Вейн, Т.Г. Вознесенская, В.Л. Голубев и др. -М.: Медицина, 1992.
- Зубарева, О.В. Психические расстройства при травматическом стрессе/О.В. Зубарева, Н.М. Епифанова, И.Ю. Клюквин//VII междисциплинарная конференция по биологической психиатрии «Стресс и поведение». -М., 2003. -С. 52-54.
- Способ определения содержания нитрит-ионов как конечного метаболита оксида азота II / Р.Дж. Фланаган, Р.А. Брейтуэйт, С.С. Браун и др. // Основы аналитической токсикологии // Всемирная организация здравоохранения. - Женева, 1997. -С. 7.


