Перестройка микроциркуляторного кровотока на различных камерах сердца после хирургической коррекции аортального стеноза
Автор: Окунева Галина Николаевна, Клинкова Ася Станиславовна, Булатецкая Людмила Михайловна, Железнев Сергей Иванович, Семенов Игорь Иванович, Шматов Дмитрий Викторович, Богачев-Прокофьев Александр Владимирович, Астапов Дмитрий Александрович
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Приобретенные пороки сердца
Статья в выпуске: 4 т.12, 2008 года.
Бесплатный доступ
Интраоперационное исследование было сосредоточено на микроциркуляторном кровотоке (МКК) у 56 больных с аортальным стенозом III-IV стадии. СМК измеряли в зависимости от изменений микроциркуляции с помощью компьютерного допплеровского лазерного флоуметра BLF-21 (Transonic System Inc., США) при обследовании правого и левого отделов сердца до и после операции. Сонографические данные позволили определить градиент давления между аортой и левым желудочком, а также размеры последнего. В зависимости от степени послеоперационного изменения МЦК все пациенты были разделены на 3 группы: в 1-ю группу вошли пациенты с равномерной МЦК, наблюдаемой во всех камерах сердца, во 2-ю группу — с градиентом МЦР между предсердиями и желудочками, в 3-ю группу — с низкой МЦР в левых отделов сердца и сохраняющимся градиентом МЦК между предсердиями и желудочками сердца, что сопровождалось развитием осложнений (аритмии) в 54% случаев в раннем послеоперационном периоде. Также в этой группе наблюдалось снижение фракции выброса левого желудочка (40,5±3,2%).
Микроциркуляторный кровоток, лазерно-допплеровская флоуметрия, аортальный стеноз, фракция выброса
Короткий адрес: https://sciup.org/142233481
IDR: 142233481
Текст научной статьи Перестройка микроциркуляторного кровотока на различных камерах сердца после хирургической коррекции аортального стеноза
На фоне аортального порока (АП), где присутствует повышенная нагрузка на левый желудочек (ДЖ) и развивается гипертрофия миокарда ДЖ, возникают нарушения микроциркуляции и снижение коронарного вазодилататорного резерва [4, 14]. В ряде случаев дилатация и систолическая дисфункция ДЖ является отрицательным прогностическим фактором для больных с аортальным стенозом [14].
В случае выраженной гипертрофии ДЖ с поражением коронарных артерий больным с АП выполняется аутокоронарное шунтирование в сочетании с коррекцией АП [6]. Снижение числа резистивных сосудов на единицу массы миокарда приводит к снижению вазодилататорного резерва и ишемическим проявлениям. Развивается стенокардия напряжения или даже инфаркт миокарда на фоне нормальных коронарных артерий [9, 10]. Помимо периваскулярной компрессии при гипертрофии ДЖ нарушается и диастолическая перфузия, что значительно ухудшает микроциркуляторную функцию.
В то же время все чаще в мировой литературе встречается актуальная на сегодня проблема снижения сократительной способности миокарда при аортальном стенозе. Многими авторами оценивались результаты протезирования аортального клапана у пациентов с выраженным снижением сократительной способности миокарда. Было выявлено, что использование бескаркасных биопротезов показало хорошие результаты: повышение фракции выброса, регресс массы миокарда, уменьшение объема левого желудочка, удовлетворительную площадь эффективного отверстия. Проанализировав данные больных с чистым аортальным стенозом и сниженной сократительной способностью миокарда, авторы пришли к заключению, что у данной категории больных скомпроментиро-ван только ранний послеоперационный период, при этом достоверной разницы динамики сокра тительной способности миокарда у пациентов с различными типами протезов не получено [3].
В результате коррекции аортального порока устраняется препятствие оттоку крови из ДЖ и таким образом происходит снижение постнагрузки на миокард ДЖ, что влечет за собой снижение потребности сердечной мышцы в кислороде и, соответственно, перестройку мик-роциркуляторного русла. В дальнейшем в результате регрессии массы ДЖ происходит нормализация отношения размера коронарных артерий к массе ДЖ [11, 14]. Однако возникает вопрос, как и насколько быстро изменяется микроциркуляция в ДЖ и других отделах сердца после хирургической коррекции порока? Всегда ли происходит нормализация кровотока после операции?
В наших ранее опубликованных работах анализировались результаты интраоперационного определения МЦК в разных участках сердца и на стенках магистральных сосудов у пациентов с АП до и после коррекции порока [4]. В известной нам литературе не приводятся данные по интраоперационному изучению перестройки микроциркуляторного русла до и после замены аортального клапана у пациентов с аортальным стенозом. Целью настоящего исследования стала оценка перестройки микроциркуляторного русла (МЦК) различных камер сердца после коррекции порока у пациентов с аортальным стенозом.
МАТЕРИАЛ И МЕТОДЫ
Обследовано 56 пациентов до и после хирургической коррекции порока, средний возраст 54,2±1,2 года, с AC III—IV ст., ХСН 2А-Б ст., из них 12 пациентов (21%) имели ИБС, СН 3 ФК. Большинство пациентов общей группы составляли мужчины - 46 чел., 82%, женщины - 18%. У всех пациентов выявлен концентрический тип гипертрофии левого желудочка. Исследуемым пациентам в аортальную позицию в 75% были имплантированы механические протезы (Микс, МедИнж, Sorin-Bicarbon) и в 25% - биологические протезы.
МЦК определялся с помощью метода ЛДФ на BLF-21 «Transonic System Inc» (США) в комплексе с персональным компьютером. Записи МЦК производились во время операции поверхностным датчиком типа «R» (rite angle) диаметром 15 мм в течение 20 с на каждом исследуемом участке с последующим расчетом средней величины МЦК (мл/(100 г- мин).
На фоне стабильной гемодинамики и стандартного анестезиологического обеспечения фиксировались исходные показатели МЦК перед хирургической коррекцией порока с эпикарда каждой камеры сердца: центральная часть левого и правого предсердий (ЯП, ПП), переднебоковая поверхность левого желудочка (ЛЖпп), а также область верхушки левого желудочка (ЛЖв), передняя поверхность правого желудочка (ПЖ) и после устранения порока и восстановления гемодинамики (ЛГИ, ПП1, ЛЖпп1, ЛЖв1, ПЖ1). Одновременно с измерением МЦК регистрировались основные показатели центральной гемодинамики: АДС, АДД, АДср. и ЧСС, рассчитывалось двойное произведение (ДП): ЧССхАДср.
Для оценки степени гипертрофии левого желудочка (ГЛЖ) у всех пациентов по данным эхографии анализировались размеры и объемы ЛЖ: конечный диастолический размер (КДР), см, конечный систолический размер (КСР), см, конечный диастолический объем (КДО), мл, конечный систолический объем (КСО), мл, а также толщина межжелудочковой перегородки ТМЖП, см, и задней стенки ЛЖ (ТЗСЛЖ) до коррекции порока, а также после его коррекции - КДР1, КСР1, КДО1, КСО1, ТМЖП1, ТЗСЛЖ1.
Анализировался систолический градиент давления на аортальном клапане до и после коррекции порока при снятии нагрузки на ЛЖ и давление в ЛА до операции, а также размеры правого и левого предсердий до и после операции. Для определения величины ГЛЖ рассчитывалась масса миокарда левого желудочка (ММЛЖ), г, по формуле Reicheck и R. Devereux и затем ее отнесенная к площади поверхности тела величина индекса массы миокарда левого желудочка (ИММЛЖ) [15]. При ГЛЖ, по данным этих авторов, величины ИММЛЖ превышают 118 г/м2 у мужчин и 104 г/м2 у женщин. Относительная толщина миокарда определялась по формуле: ОТМ = 2 ТЗСЛЖ/КДР [2].
РЕЗУЛЬТАТЫ
По результатам перестройки МЦК после коррекции порока было выделено 3 группы пациентов (рисунок). Первую группу (14 чел., 25%) составили пациенты, у которых происходило равномерное распределение МЦК по всем камерам сердца после коррекции порока: средние показатели разницы МЦК между камерами сердца были минимальными - до 6 мл/100 г/мин (табл. 1). В этой группе происходило умеренное снижение повышенного МЦК, при этом, по данным УЗИ, после операции происходило снижение повышенной ФВ ЛЖ. Вторую группу составили пациенты (32 чел., 57%), у которых после операции происходило частичное выравнивание МЦК с сохранением градиента между предсердиями и желудочками: средние показатели разницы МЦК между ПП1 и ПЖ1, а также ЛГИ и ЛЖпп1 составили 12,9 и 9,2 мл/100 г/мин, соответственно. После операции МЦК по ЛЖпп1 и ЛЖв1 в этой группе практически не отличался между собой (табл. 2). В 3-ю груп-
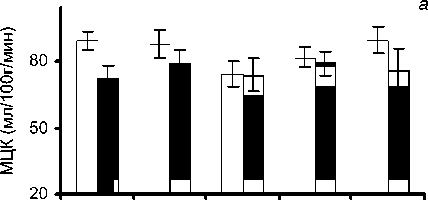
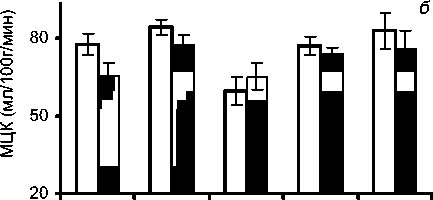
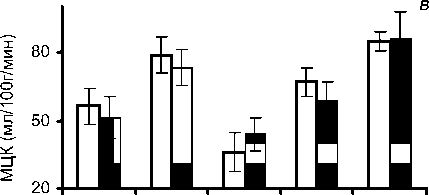
ПП ПЖ ЛП ЛЖпп ЛЖв
□ до/оп Ипосле/оп
Перестройка МЦК после коррекции аортального порока у пациентов группы: а - первой; б - второй; в - третьей.
Таблица 1
Показатели МЦК отделов сердца у пациентов группы 1
|
До операции |
После операции |
А МЦК (МЦК после операции - МЦК до операции) |
||||||||
|
Показатели |
п |
М |
±т |
У |
п |
М |
±т |
У |
||
|
ПП, мл/(минх 100 г) |
13 |
86,4 |
5,0 |
18,1 |
12 |
71,3 |
5,2 |
18,3 |
-15,1 |
р=0,05 |
|
ПЖ, мл/(минх 100 г) |
14 |
88,4 |
6,1 |
23,1 |
13 |
77,1 |
6,1 |
22,1 |
-11,3 |
р>0,05 |
|
ЛП, мл/(минх 100 г) |
11 |
74,4 |
5,6 |
18,6 |
11 |
74,1 |
7,2 |
23,9 |
-0,3 |
р>0,05 |
|
ЛЖ передняя пов., мл/(минх 100 г) |
14 |
82,2 |
4,4 |
16,5 |
13 |
77,3 |
5,2 |
18,8 |
-4,9 |
р>0,05 |
|
ЛЖ обл. верхушки, мл/(минх 100 г) |
6 |
89,8 |
5,0 |
12,4 |
4 |
76,3 |
9,7 |
19,5 |
-13,2 |
р>0,05 |
|
Таблица |
||||||||||
|
Показатели МЦК отделов сердца у пациентов группы 2 |
||||||||||
|
До операции |
После операции |
А МЦК (МЦК после |
||||||||
|
Показатели |
п |
М |
±т |
У |
п |
М |
±т |
У |
ui 1ерации — МЦК ди операции) |
|
|
ПП, мл/(минх 100 г) |
24 |
78,8 |
4,1 |
20,3 |
25 |
65,7 |
4,9 |
24,9 |
-13,1 |
р=0,05 |
|
ПЖ, мл/(минх 100 г) |
32 |
84,2 |
3,1 |
18,0 |
32 |
78,6 |
3,6 |
20,7 |
-5,6 |
р>0,05 |
|
ЛП, мл/(минх 100 г) |
24 |
59,8 |
5,3 |
26,3 |
23 |
65,2 |
5,1 |
24,8 |
5,4 |
р>0,05 |
|
ЛЖ передняя пов., мл/(минх 100 г) |
30 |
76,4 |
3,9 |
21,3 |
31 |
74,4 |
2,7 |
15,3 |
-2 |
р>0,05 |
|
ЛЖобл. верхушки, мл/(минх 100 г) |
9 |
82,7 |
7,1 |
21,4 |
7 |
76,0 |
7,3 |
19,4 |
-6,7 |
р>0,05 |
|
Таблица 3 |
||||||||||
|
Показатели МЦК отделов сердца у пациентов группы 3 |
||||||||||
|
До операции |
После операции |
А МЦК (МЦК после |
||||||||
|
Показатели |
п |
М |
±т |
У |
п |
М |
±т |
У |
ui 1ерации — МЦК ди операции) |
|
|
ПП, мл/(минх 100 г) |
11 |
56,34 |
7,8 |
26 |
10 |
51,3 |
9,3 |
29,6 |
-5 |
р>0,05 |
|
ПЖ, мл/(минх 100 г) |
11 |
78,9 |
7,7 |
25,6 |
10 |
73,4 |
7,7 |
24,5 |
-5,5 |
р>0,05 |
|
ЛП, мл/(минх 100 г) |
9 |
36,2 |
8,4 |
25,2 |
8 |
43,9 |
7,2 |
20,6 |
7,7 |
р>0,05 |
|
ЛЖ передняя пов., мл/(минх 100 г) |
9 |
66,8 |
6,2 |
18,6 |
8 |
58,3 |
8,4 |
23,9 |
-8,5 |
р>0,05 |
|
ЛЖ обл. верхушки, мл/(минх 100 г) |
3 |
85,0 |
4,0 |
7,0 |
3 |
86,1 |
11,6 |
20,2 |
-1,1 |
р>0,05 |
пу (11 чел., 19%) были включены пациенты с выраженным градиентом МЦК по предсердиям и желудочкам сердца: средние показатели разницы МЦК между ПП1 и ПЖ1 - 22,1 мл/100 г/ мин, а максимальный градиент по левым отделам сердца наблюдался между ЛГИ и ЛЖв1, который составил 42,2 мл/100 г/мин. В этой группе отмечены наиболее низкие показатели МЦК по ЛГИ и ЛЖпп1 по сравнению с 1 -й и 2-й группам, а также выявлен градиент по МЦК между ЛЖпп1 и ЛЖв1 - 27,8 мл/100 г/мин (табл. 3).
Таким образом, в 1-й группе сразу же после коррекции порока происходило снижение повышенного МЦК, что позволяет говорить о его нормализации по всем отделам сердца (табл. 1). В этой группе, по данным ЭхоКГ, отмечено снижение повышенной ФВ ЛЖ с 74,4±2,8 до 66,0± ±6,2%. Во 2-й группе больных после операции наблюдалось выравнивание МЦК по желудочкам и предсердиям. Это соответствовало умеренному повышению ФВ от 58±1,4 до 63±1,8% в ближайшие сроки после операции. Однако микроциркуляторный кровоток оставался более низким по предсердиям по сравнению с желудочками сердца. Таким образом, в этом случае можно констатировать частичное восстановление МЦК (табл. 2). В 3-й группе больных после коррекции порока сохранялся градиент по МЦК от 43,9±7,2 мл/100 г/мин по ЛГИ до 86,1±11,6 мл/100 г/мин по ЛЖв1 (табл. 3). При этом оставался низким МЦК по предсердиям и ЛЖпп1, а также была сниженной ФВ ЛЖ, что соответствовало сохранению увеличенных размеров и объемов камер сердца.
Корреляционный анализ показателей мик-роциркуляторного кровотока ЛЖ выявил следующие значимые корреляционные связи (р<0,05): обратная корреляционная связь МЦК по передней поверхности ЛЖ до коррекции порока и показателей, характеризующих размеры ЛЖ: КДР (г=-0,30) и КСР (г=-0,33), т.е. чем больше размеры левого желудочка, тем меньше МЦК по ЛЖ. После операции данные корреляционные связи исчезали. Выявлены прямые корреляционные связи МЦК по ЛЖпп до коррекции порока с МЦК других отделов сердца: ПП (г=0,48), ПЖ (г=0,54), ЛП (г=0,43) и ЛЖв (г=0,59) с сохранением их после коррекции порока, где после операции прямая корреляционная связь между ЛЖпп1 и ЛП1 увеличилась (г=0,50).
Сравнительный анализ трех групп показал, что наиболее выраженный микроциркуляторный градиент между предсердиями и желудочками сердца наблюдался в 3-й группе. В этой же группе выявлен наиболее низкий микроциркуляторный кровоток после коррекции порока по всем камерам сердца кроме ЛЖв1, где МЦК по ЛП1 и ЛЖпп1 достоверно был ниже, чем во 2-й и 3-й группах (р<0,05). В 3-й группе до операции отмечена сниженная ФВ ЛЖ. После коррекции порока наряду с более низким МЦК по левым камерам сердца по сравнению с другими группами отмечены наиболее высокие размеры и объемы ЛЖ (р<0,001): КДР1, КСР1, КДО1, КСО1, а также размеры ЛП1, которые уменьшались, по данным УЗИ, уже спустя неделю после операции, но оставались достоверно выше, чем в 1-й и 2-й группах.
После операции систолический градиент ЛЖ/Ao в трех группах практически не отличался между собой, также как ТМЖП и ТЗСЛЖ. После коррекции порока в 1-й и во 2-й группах МЦК на верхушке ЛЖ снижался с 89 и 82 до 76,0±7,3 мл/100 г/мин, а в 3-й группе оставался повышенным - 86,1 ±11,6 мл/100 г/мин (табл. 1-3).
Особо следует отметить изменение МЦК по ЛП, где он до и после коррекции порока был наиболее низким в 3-й группе, по сравнению с 1-й и 2-й. После коррекции порока МЦК по ЛП в 1-й группе не менялся, так как кровоток соответствовал нормальным значениям (табл. 1). Во 2-й группе МЦК по ЛП умеренно повышался с 59,8±5,3 до 65,2±5,1 мл/100 г/мин (табл. 2). В 3-й группе МЦК по ЛП исходно был сниженным - 36,2±8,4 мл/100 г/мин и после операции повышался - 43,9±7,2 мл/100 г/мин, оставаясь при этом на низком уровне. Снижение МЦК по ЛП в 3-й группе до коррекции порока, возможно, обусловлено гипертензией малого круга кровообращения. Так, давление в легочной артерии до операции у пациентов этой группы в среднем составило 45,2±5,0 мм рт. ст., что достоверно выше, чем во 2-й группе. Наряду с этим на фоне повышенной нагрузки размеры ЛП в этой группе до операции были достоверно выше, чем в двух других группах. Таким образом, уменьшение функциональной нагрузки камер сердца после коррекции порока приводит к перераспределению МЦК (табл. 1-3).
По данным центральной гемодинамики (АДС, АДД, АДср., ДП), после операции отмечались достоверно более низкие показатели ДП и ЧСС в 3-й группе (р<0,05) по сравнению с другими двумя группами, что свидетельствует о более низкой функциональной нагрузке на ЛЖ в этой группе. Уже через 7-10 дней после операции аортального протезирования происходило уменьшение размеров и объемов ЛЖ, а также ТЗСЛЖ, ТМЖП, размеров левого и правого предсердий во всех трех группах. При этом как до, так и после коррекции порока размеры и объемы камер сердца оставались более высокими в 3-й группе пациентов по сравнению с 1-й и 2-й группами, где отмечена сниженная ФВ ЛЖ.
После аортального протезирования систолический градиент давления между ЛЖ и аортой значительно снижался по всем трем группам. Следует также отметить, что размеры ТЗСЛЖ и МЖП оставались без изменений после операции во всех трех группах, так как для регрессии гипертрофии требуется продолжительный временной интервал. Однако перестройка мик-роциркуляторного русла по камерам сердца происходит сразу же после коррекции порока.
ОБСУЖДЕНИЕ
По литературным данным, известно, что у больных с аортальным стенозом происходит нарушение коронарного кровотока на уровне микроциркуляции [4, 5, 13]. Причины этих нарушений сводятся к следующему: 1. Из-за повышенной нагрузки на левый желудочек в результате выраженного аортального стеноза в миокарде происходит изменение метаболизма и ультраструктуры кардиомиоцитов, приводящее к компенсаторной гипертрофии миокарда ЛЖ [1, 10]. 2. При аортальном стенозе отмечено сужение просвета сосудов коронарного русла, уменьшение количества капилляров на единицу площади миокарда, что свидетельствует о неблагоприятном состоянии микроцирку-ляторного русла миокарда, что подтверждалось данными МЦК в 3-й группе [7, 9]. Повышенная экстраваскулярная компрессия и сниженное время диастолической перфузии, возможно, являются главными механизмами для снижения миокардиального кровотока и коронарного ва-зодилататорного резерва [12]. 3. Гипертрофия мышечной массы левого желудочка приводит к увеличению потребности миокарда в кислороде. В то же время в результате повышенной нагрузки на левый желудочек и снижения количества капилляров на единицу площади миокарда происходит нарушение соотношения между доставкой кислорода и потребностью в нем миокарда ЛЖ. Все эти факторы приводят к снижению энергетического обеспечения миокарда, что сопровождается нарушением МЦК и, как следствие, снижением ФВ ЛЖ [8].
Полученные результаты могут быть объяснены следующим образом: в 1-й группе с наибольшим систолическим градиентом ЛЖ/Ao и выраженной гипертрофией ЛЖ компенсаторно увеличивается МЦК до операции по ЛЖпп -82,2±4,4 мл/100 г/мин, что соответствует повышению ФВ ЛЖ - 74,4±1,7% в ответ на повышенную постнагрузку. После коррекции порока и восстановления нормальной функции ЛЖ наблюдается нормализация МЦК: исчезают градиенты по МЦК между всеми отделами сердца и снижается МЦК по ЛЖ1 до 76,4±3,8 мл/ 100 г/мин. Это соответствует снижению повышенной ФВ ЛЖ до 66,0±2,0% и уменьшению размеров, объемов камер сердца, по данным ЭхоКГ, в раннем послеоперационном периоде. В этой группе в раннем послеоперационном периоде были выявлены осложнения в виде нарушения ритма у трех пациентов (21%).
Во 2-й группе в результате развития аортального порока возникают микроциркуляторные градиенты между разными отделами сердца от 59,8±5,3 по ЛП до 84,2±3,1 мл/100 г/мин по ПЖ, где после операции наблюдается только частичное восстановление МЦК по предсердиям и желудочкам сердца, однако между ними остается градиент порядка 9-13 мл/100 г/мин. Эхографические данные этой группы в раннем послеоперационном периоде существенно не отличаются от 1-й группы. Во 2-й группе со стороны ранних послеоперационных осложнений у 10 пациентов (31%) были выявлены нарушения ритма по типу пароксизмальных фибрилляций предсердий, где особо следует отметить пациентку, перенесшую периоперационный инфаркт миокарда с острым нарушением коронарного кровообращения передней поверхности левого желудочка, которое сопровождалось выраженным снижением МЦК после коррекции порока по ЛГИ (35,8 мл/100 г/мин) и по передней поверхности ЛЖ1 (43,4 мл/100 г/мин).
В 3-й группе до коррекции порока нарушен МЦК по ЛП - 36,2±8,4 мл/100 г/мин со снижением ФВ ЛЖ до 40,5±0,9%. До операции эхографически здесь отмечались достоверно наиболее высокие показатели размеров и объемов всех отделов сердца (р<0,05) по сравнению с другими группами. После операции в данной группе сохранялся сниженный МЦК по ЛП1 и происходило снижение МЦК по ЛЖпп1 с наличием выраженного микроциркуляторного градиента по камерам сердца от 22,1 до 42,2 мл/100 г/мин. Поданным эхографии, в ближайшие сроки после операции это характеризовалось достоверно более высокими размерами и объемами левых отделов сердца и сниженной ФВ ЛЖ до 49%. В этой группе в раннем послеоперационном периоде было выявлено наибольшее количество осложнений - у 6 пациентов (54%) в виде нарушения ритма и сердечной недостаточности с сохранением сниженной ФВ ЛЖ.
На основании полученных нами результатов мы можем выделить 3 типа перестройки микроциркуляторного кровотока после коррекции порока. Первый тип характеризуется восстановлением МЦК после коррекции порока по всем отделам сердца. При 2-м типе в послеоперационном периоде наблюдается частичное восстановление МЦК с сохранением градиента между предсердиями и желудочками. При 3-м типе наблюдаются выраженные нарушения микроциркуляции как до, так и после операции. Анализ ранних послеоперационных осложнений в 3-й группе в 54% случаев выявил нарушения сердечной деятельности: развитие мерцательной аритмии и сердечной недостаточности. Таким образом, по данным изучения МЦК у больных с аортальным пороком мы можем прогнозировать развитие ранних послеоперационных осложнений.
ВЫВОДЫ
-
1. Уменьшение функциональной нагрузки камер сердца после коррекции порока приводит к перераспределению микроциркуляторного кровотока. По результатам его перестройки после операции было выделено 3 группы пациентов: в 1-й группе сразу же после коррекции порока нормализовался МЦК по всем отделам сердца, что позволяет говорить о снижении повышенного МЦК после операции, 2-я группа -пациенты с градиентом МЦК по предсердиям и желудочкам сердца, в этом случае можно констатировать частичное восстановление МЦК, 3-я группа - пациенты с наиболее выраженным градиентом МЦК по всем отделам сердца и сниженным по ЛЖ после коррекции порока.
-
2. Значительное снижение МЦК по ЯП в 3-й группе до и после коррекции порока, возможно, обусловлено гипертензией малого круга кровообращения. Так, давление в легочной артерии до операции у пациентов этой группы в среднем составило 45,2±5 мм рт. ст. После коррекции порока МЦК по ЯП в 1-й группе не менялся, так как кровоток соответствовал нормальным значениям. Во 2-й и особенно в 3-й группе МЦК по ЯП исходно был сниженным и после операции отмечалась тенденция к его повышению.
-
3. В раннем послеоперационном периоде в 1 -й группе были выявлены осложнения в виде нарушения ритма у 21% пациентов, во 2-й группе у 31% пациентов были выявлены нарушения ритма в виде пароксизмальных фибрилляций предсердий, в 3-й группе пациентов со сниженным после коррекции порока МЦК по левым отделам сердца возникало наибольшее количество осложнений (54%) в виде мерцательной аритмии, сердечной недостаточности с подключением ЭКС и сохранялась сниженная ФВ ЛЖ. Таким образом, по данным перестройки МЦК после коррекции порока можно прогнозировать возникновение осложнений сердечной деятельности в раннем послеоперационном периоде.
Список литературы Перестройка микроциркуляторного кровотока на различных камерах сердца после хирургической коррекции аортального стеноза
- Архипова Г.Ф., Часовских Г.Г., Кириченко В.М. и др. Метаболическая и морфологическая характеристика компенсаторных изменений миокарда при приобретенных и аортальных пороках. Новосибирск, 1985. С. 98-104.
- Баллюзек М.Ф., Шпилькина Н.А. // Регионарное кровообращение и микроциркуляция. 2003. Т. 2, № 10. С. 50-53.
- EDN: LACWLX
- Джангулян Н.Г. // Врач-аспирант. 2005. № 2. С. 151-156.
- EDN: HVZISF
- Окунева Г.Н., Булатецкая Л.М., Клинкова А.С. и др. // Ангиология и сосудистая хирургия (приложение). II Всероссийская конференция с международным участием. 2006. С. 22-23.
- Окунева Г.Н., Караськов A.M., Власов Ю.А. и др. // Регионарное кровообращение и микроциркуляция. 2006. № 3 (19). С. 25-33.
- EDN: JZFWIZ


