Перфузионная компьютерная томография в дифференциальной диагностике участков легочной консолидации поствоспалительной и злокачественной этиологии у пациентов, перенесших COVID-19-ассоциированную пневмонию
Автор: Хафизов М.М., Байков Д.Э., Ахмадеева Л.Р.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.40, 2025 года.
Бесплатный доступ
Введение. Пандемия COVID-19 обусловила рост числа пациентов с персистирующими легочными изменениями, у которых в течение длительного времени сохраняются зоны легочной консолидации. При этом стандартная компьютерная томография (КТ), оставаясь ведущим методом диагностики, обладает ограниченной возможностью в дифференциации доброкачественных и злокачественных процессов, так как их рентгенологические признаки часто неспецифичны. В последнее время в связи с доступностью новых технологий в лучевой диагностике появилась возможность оценить состояние регионарного кровотока в различных органах и тканях путем проведения специальных (перфузионных) исследований с помощью КТ и магнитно-резонансной томографии. Цель исследования: определить диагностическую значимость таких количественных параметров перфузионной КТ, как скорость кровотока (blood flow, BF), объем кровотока (blood volume, BV), проницаемость сосудов (permeability solution, PS), среднее время прохождения контрастного вещества (mean transit time, MTT), время до пикового накопления контрастного вещества (time to peak, TTP) в дифференциации поствоспалительных и злокачественных участков легочной консолидации у пациентов, перенесших COVID-19-ассоциированную пневмонию. Материал и методы. В ретроспективное когортное исследование включена группа пациентов (n = 41) в возрасте от 18 до 75 лет, имеющих в анамнезе COVID-19-ассоциированную пневмонию, подтвержденную положительными результатами ПЦР-теста, с сохраняющимися клиническими проявлениями постковидного синдрома спустя 12 нед. после выписки из стационара. На этапе углубленной диспансеризации всем пациентам выполнена КТ органов грудной клетки, при которой были выявлены участки консолидации легочной паренхимы размером более 1 см, не поддающиеся однозначной дифференциальной диагностике между поствоспалительными и неопластическими изменениями по данным нативной и контрастной КТ. Перфузионная КТ выполнялась по низкодозному протоколу (100 кВ, 200 мА) на 128-срезовом компьютерном томографе GE Optima CT660 с внутривенным введением йодсодержащего контраста в объеме 50–60 мл, со скоростью введения 4,0 мл/с. Толщина среза составляла 5 мм при длительности сканирования 45–50 с. Результаты. Выявлены статистически значимые различия показателей проницаемости сосудистой стенки и времени до пикового накопления контрастного вещества в участках консолидации неопластического и поствоспалительного характера: PS – 13,54 (5,71; 66,01) мл/100 г/мин; TTP – 11,57 (7,19; 15,71) с против 5,30 (1,90; 10,63) мл/100 г/мин; 32,55 (15,83; 38,28) с соответственно. Логистический регрессионный анализ подтвердил высокую диагностическую эффективность модели, включающей ковариаты PS и TTP: площадь под ROC-кривой (AUC) – 87,5%, чувствительность – 80%, специфичность – 81,3%. Показатель TTP продемонстрировал наибольший вклад в дифференциацию изменений: p = 0,004; отношение шансов (ОШ) = 0,888; 95% доверительный интервал (ДИ) ОШ (0,81989; 0,96254), тогда как PS имел умеренную значимость: p = 0,075; ОШ = 1,057; 95% ДИ ОШ (0,99445; 1,12421). Заключение. Количественные показатели проницаемости сосудов и времени достижения пика контрастирования обладают статистически значимой диагностической ценностью по сравнению с другими показателями, такими как скорость и объем кровотока, среднее время прохождения контрастного вещества, и их повышение может выступать в качестве предикторов характера легочной консолидации.
Перфузионная компьютерная томография, дифференциальная диагностика участков легочной консолидации, злокачественные образования легких
Короткий адрес: https://sciup.org/149149302
IDR: 149149302 | УДК: 616.98:578.834.1]-036.21+616.24-002.2-006.6]-073.756.8-052 | DOI: 10.29001/2073-8552-2025-40-3-131-139
Текст научной статьи Перфузионная компьютерная томография в дифференциальной диагностике участков легочной консолидации поствоспалительной и злокачественной этиологии у пациентов, перенесших COVID-19-ассоциированную пневмонию
Пандемия COVID-19, вызванная вирусом SARS-CoV-2, и массовое применение компьютерной томографии (КТ) в оценке состояния легочной паренхимы привели к обнаружению значительного количества пациентов с выявленными и длительно сохраняющимися участками легочной консолидации после перенесенной пневмонии. Согласно исследованию, посвященному последующей визуализации после госпитализации по поводу SARS-CoV-2, MERS или гриппозной пневмонии с медианой наблюдения 3 мес., в котором анализировалось 60 серий компьютерных томограмм органов грудной клетки, доля воспалительных осложнений составила 50% (зоны «матового стекла» или консолидация) во время наблюдения. Фиброзные последствия (ретикулярные изменения, нарушение архитектоники паренхимы легких, утолщение междольковых перегородок, тракционные бронхоэктазы или зоны «сотового легкого») оценивались в 29% [1]. В исследовании D. Caruso и соавт. (2021) при 6-месячном наблюдении 118 пациентов на КТ органов грудной клетки лишь у 28% отсутствовали какие-либо изменения в легких, у 72% имелись фиброзоподобные изменения, у 42% – зоны «матового стекла», а зоны консолидации наблюдались у 2% пациентов [2].
Согласно данным КТ, существует несколько вариантов поражения легких при COVID-19, одним из которых является уменьшение объема поражения с нарастанием консолидации и формированием типичной картины организующейся пневмонии. Стандартная КТ высокого разрешения, являясь золотым стандартом в первичной диагностике патологий легочной ткани, демонстрирует высокую чувствительность в обнаружении очаговых изменений (например, очагов, инфильтратов, участков консолидации). Однако ее специфичность в дифференциальной диагностике доброкачественных и злокачественных процессов остается ограниченной. Это связано с тем, что визуализируемые рентгенологические признаки (размер, форма, плотность, структура и контуры) могут наблюдаться в разных нозологиях. Как показало исследование Z. Zheng и соавт. (2012), рентгенологические данные о фокальной организующей пневмонии неспецифичны, и эту форму организующей пневмонии трудно дифференцировать от рака легкого [3]. Также некоторые аденокарциномы на ранних стадиях рентгенологически могут проявляться в виде участков пониженной пневматизации по типу «матового стекла» [4]. Стандартный подход в таких ситуациях подразумевает динамическое наблюдение и инвазивную биопсию, что приводит к увеличению сроков диагностического процесса и сопряжено с риском осложнений, таких как кровотечение или пневмоторакс, что ограничивает ее широкое применение [7].
Кроме того, пневмония, выступая ключевым клиническим маркером COVID-19, стала основанием для широкого внедрения КТ в диагностическую практику, что привело к частому выявлению сопутствующих патологий, характеристики которых не всегда позволяют однозначно отличить воспалительные процессы от опухолевых. Подобные диагностические сложности обусловлены сходством некоторых рентгенологических признаков при этих состояниях, особенно в случаях одновременного наличия нескольких патологических изменений [5, 6]. Для преодоления этих ограничений применяются дополнительные методы: контрастное усиление для оценки васкуляризации очага, динамическое наблюдение.
В последние годы КТ-перфузия широко используется в клинической практике и способна предоставить не только морфологические характеристики, но и более подробную функциональную или метаболическую информацию для диагностики и дифференциации поражений легких [8]. В этом контексте перфузионная КТ является новым инструментом визуализации, который предоставляет как качественную, так и количественную информацию об ангиогенезе опухоли [9]. Однако имеющиеся публикации по данной теме немногочисленны, а изученные показатели в основном сосредоточены на критериях, оценивающих макрогемодинамику (объем и скорость кровотока), что в большей степени характеризует состояния окклюзии / стеноза магистральных артерий, и не всегда способны точно характеризовать состояние патологического неоангиогенеза при новообразованиях. Также не определена диагностическая ценность тех или иных перфузионных параметров, а выявленные результаты имеют широкий диапазон значений. Повышение диагностической ценности метода требует расширения спектра анализируемых параметров, способных оценить структурные и функциональные особенности микроциркуляторного русла, определение их информативности. Это позволит точнее дифференцировать природу патологических изменений, особенно в случаях, когда традиционные методы визуализации оказываются неспецифичными, сократить сроки диагностики и скорректировать последующую тактику ведения данных пациентов.
Цель исследования: оценка диагностической значимости количественных параметров перфузионной КТ в дифференциации поствоспалительных и злокачественных участков легочной консолидации у пациентов, перенесших COVID-19-ассоциированную пневмонию, с последующей верификацией результатов методами гистопатологического анализа.
Материал и методы
В ретроспективном когортном исследовании перфузионная КТ была выполнена 41 пациенту в возрасте от 18 до 75 лет, у которых в анамнезе имелась COVID-19-ас-социированная пневмония, подтвержденная положительными результатами ПЦР-теста, с длительностью госпитализации в остром периоде от 14 до 28 сут, с применением респираторной поддержки (40,8% – кислородотерапия, 18,3% – искусственная вентиляция легких), сохраняющимися клиническими проявлениями постковидного синдрома (одышка, гипоксия, кашель) спустя 12 нед. после выписки из стационара (табл. 1). Клинический материал был набран в период с июня 2021 г. по декабрь 2023 г.
Критерии включения: наличие у пациентов персистирующих участков легочной консолидации, согласно данным КТ; отсутствие динамики через 3 мес.; отсутствие противопоказаний для введения йодсодержащих водорастворимых рентгеноконтрастных препаратов; предоставление пациентами письменного информированного согласия на выполнение исследования; возраст участников мужского и женского пола старше 18 лет на момент подписания информированного согласия (верхняя возрастная граница не установлена).
Критерии невключения: возраст пациентов моложе 18 лет; наличие у пациентов участков легочной консолидации диаметром менее 1 см; отказ пациентов предоставить письменное информированное согласие; ненадлежащее качество полученных КТ-изображений (неинформатив-ность перфузионных карт ввиду наличия выраженных двигательных артефактов; наличие металлоконструкций, создающих массивные радиальные артефакты); наличие у пациентов аллергической реакции на йодсодержащие контрастные препараты, тяжелой легочно-артериальной гипертензии, симптомов острой респираторной инфекции, пороков сердца, сопровождающихся сбросом крови справа налево; наличие тромбоэмболии легочной артерии, поражения легких при системных заболеваниях соединительной ткани; обострение сопутствующих заболеваний. В исследование также не вошли пациенты женского пола с беременностью, подозревающие, либо планирующие беременность.
Исследования проводились на 128-срезовом компьютерном томографе GE Optima CT660. На начальном этапе выполнялось нативное сканирование грудной клетки в режиме пониженной лучевой нагрузки с параметрами: напряжение – 100 кВ, сила тока – 200 мА, ширина среза 1,25 мм, коллимация – 4 × 5 мм, скорость перемещения стола – 25 мм за 0,5 с на один оборот трубки. Пациент располагался на спине с руками, поднятыми над головой. Границы исследования определялись на топограммах от яремной вырезки до легочных синусов. У каждого пациента анализировался один участок консолидации. При наличии множественных изменений выбирался участок наибольших размеров. Анализировались характеристики участков консолидации: локализация, размеры, структура, плотность, состояние окружающих тканей и плевры.
На втором этапе проводилась перфузионная КТ с внутривенным болюсным введением йодсодержащего контраста в объеме 50 мл с концентрацией активного вещества 370 мг/мл или 60 мл с концентрацией активного вещества 350 мг/мл, со скоростью введения 4,0 мл/с. Для снижения лучевой нагрузки использовались модифицированные параметры трубки (100 кВ, 200 мА) с применением итеративных реконструкций. Толщина среза составляла 5 мм при длительности серии 45–50 с, эффективная доза облучения – 8,2 ± 1,9 мЗв. Во время процедуры пациент сохранял неподвижное положение на спине с фиксацией рук, что минимизировало артефакты. Для уменьшения влияния дыхания рекомендовалось поверхностное дыхание без глубоких вдохов.
Визуальная обработка данных осуществлялась в приложении CT Perfusion 4D (Advantage Workstation). Выделялись две эллипсовидные зоны интереса (1 см в диаметре): в крупной артерии и патологическом очаге с акцентом на наиболее активные участки при его гетерогенности. После построения перфузионных карт анализировались следующие показатели:
-
• скорость кровотока (blood flow, BF, мл/100 г/мин) – показатель скорости, с которой определенный объем крови проходит через единицу массы легочной ткани за единицу времени;
-
• объем кровотока (blood volume, BV, мл/100 г) – показатель объема крови, проходящего в единице массы ткани;
-
• проницаемость сосудов (PS, мл/100 г/мин) – коэффициент проницаемости сосудов, отражающий общую диффузию через эндотелий капилляров;
-
• cреднее время транзита крови (MTT, с) – среднее время, за которое кровь проходит по сосудистому руслу выбранной зоны интереса;
-
• время до пика (time to peak, TTP, с) – время, необходимое для достижения наибольшей концентрации контрастного вещества в тканях.
Верификация данных перфузионной КТ осуществлялась путем сравнения с гистологическим заключением, полученным после трансторакальной трепанобиопсии, хирургических вмешательств на легких и браш-биопсии при проведении бронхоскопии.
Статистическая обработка данных была проведена в пакетах программ STATISTICA 12.0 и JAMOVI 2.6.17. Количественные показатели были представлены медианой и межквартильным интервалом, Me (Q1; Q3) . Для оцен-
Таблица 1 . Клинические характеристики пациентов, вошедших в исследование
Table 1 . Clinical characteristics of patients included in the study
|
Возраст, лет |
Респираторная поддержка |
||
|
Не применялась |
Искусственная вентиляция легких |
Кислородотерапия |
|
|
18–44 |
67,7% |
0% |
33,3% |
|
45–59 |
46,2% |
15,3% |
38,5% |
|
60–75 |
32,0% |
24% |
44% |
Таблица 2 . Распределение обследуемых пациентов по нозологии патологических процессов в легких
Table 2 . Distribution of patients by nosological classification of pathological lung processes
|
Нозологическая форма |
Количество участков консолидации |
|
|
Объемные образования |
||
|
Аденокарцинома |
9 |
|
|
Плоскоклеточный рак |
6 |
|
|
Мелкоклеточный рак |
8 |
|
|
Метастазы |
2 |
|
|
Итого |
25 |
|
|
Поствоспалительные изменения |
||
|
Пневмосклероз |
5 |
|
|
Пневмофиброз |
11 |
|
|
Итого |
16 |
|
Таблица 3 . Значения количественных показателей перфузии в участках консолидации поствоспалительного и неопластического характера
Table 3 . Quantitative perfusion values in areas of post-inflammatory and neoplastic consolidation
|
Показатели КТ-перфузии |
Участки консолидации поствоспалительного характера |
Участки консолидации неопластического характера |
р-value |
|
BF, мл/100 г/мин |
97,6 (54,3; 177,5) |
100 (73,9; 162,2) |
0,702 |
|
BV, мл/100 г |
4,39 (3,85; 10,95) |
4,3 (2,47; 8,68) |
0,748 |
|
MTT, с |
3,01 (2,58; 5,07) |
3,54 (2,24; 6,10) |
0,640 |
|
PS, мл/100г/мин |
5,30 (1,90; 10,63) |
13,54 (5,71; 66,01) |
0,007 |
|
TTP, с |
32,55 (15,83; 38,28) |
11,57 (7,19; 15,71) |
0,0004 |
Примечание: BF (blood flow) – скорость кровотока, BV (blood volume) – объем кровотока, PS (permeability solution) – проницаемость сосудов, MTT (mean transit time) – среднее время прохождения контрастного вещества, TTP (time to peak) время до пикового накопления контрастного вещества.
ки значимости различий количественных показателей в 2 независимых группах был применен критерий Манна – Уитни. Критический уровень значимости при проверке статистических гипотез ( р ) составлял 0,05. Для оценки диагностического потенциала перфузионной КТ в дифференциальной диагностике участков легочной консолидации поствоспалительной и злокачественной этиологии построена модель логистической регрессии, проведен ее ROC-анализ.
Результаты
Количество мужчин составило 61% (n = 25) от общего числа пациентов, средний возраст пациентов – 59,4 года. Основными жалобами обследуемых пациентов (n = 41) являлись: длительный продуктивный кашель (84,2%), одышка при умеренной физической нагрузке (76,7%), повышенная утомляемость (68,3%), периодический субфебрилитет (22,5%). Все пациенты прошли углубленную диспансеризацию, где им выполнялась КТ органов грудной клетки, при которой были выявлены участки консолидации легочной паренхимы размерами более 1 см, не поддающиеся дифференциальной диагностике между поствоспалительными и неопластическими изменениями, по данным нативной и контрастной КТ. Средние размеры зон консолидации у обследуемых пациентов варьировались от 2 до 4 см в минимальном поперечном размере, в то время как максимальные размеры достигали 8–10 см, что наиболее часто встречалось у пациентов с тяжелой формой перенесенного заболевания, а также у пациентов старших возрастных групп. После выполнения перфузионной КТ с внутривенным болюсным введением йодсодержащего контрастного вещества и сопоставления с результатами гистологического исследования (табл. 2) был проведен сравнительный анализ параметров КТ-перфузии у пациентов с зонами легочной консолидации поствоспалительного и неопластического характера (табл. 3).
Участки консолидации неопластического характера представлены аденокарциномой, плоскоклеточным и мелкоклеточным раком, а также легочными метастазами светлоклеточного рака почки, а участки консолидации поствоспалительного характера – участками пневмофиброза.
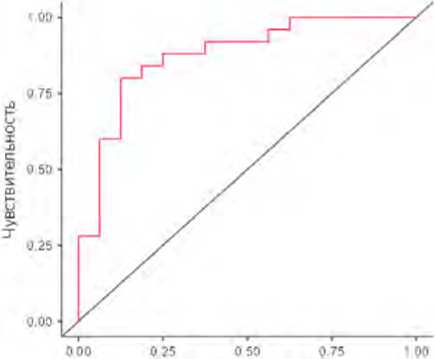
Представленные данные КТ-перфузии статистически значимо различаются в параметрах микроциркуляции между поствоспалительными и неопластическими зонами легочной консолидации у пациентов, перенесших атипичную пневмонию. Для оценки значимости влияния показателей PS и TTP на характер участков легочной консолидации поствоспалительной и злокачественной этиологии при перфузионной КТ построена модель логистической регрессии, проведен ее ROC-анализ (рис. 1). Статистическая значимость модели в целом составила р = 0,00004; коэффициент псевдодетерминации – R²N = 0,53. Предикторы PS и TTP неколлинеарны. Значения коэффициентов модели приведены в таблице 4.
Прогностические характеристики модели были следующими: точность – 80,5%, специфичность – 81,3%, чув-
Таблица 4 . Коэффициенты модели логистической регрессии, отношения шансов и их 95% доверительные интервалы
Table 4 . Logistic regression model coefficients, OR and 95% CI OR
|
Предиктор |
Вес |
SE |
Z |
p |
Отношение шансов |
95% доверительный интервал Нижняя граница Верхняя граница |
|
Константа |
1,8230 |
0,84825 |
2,14919 |
0,0316194 |
6,19074 |
1,17411 32,64201 |
|
PS |
0,0557 |
0,03129 |
1,78197 |
0,0747546 |
1,05734 |
0,99445 1,12421 |
|
TTP |
–0,118 |
0,04092 |
–2,8930 |
0,0038164 |
0,88836 |
0,81989 0,96254 |
Примечание: PS (permeability solution) – проницаемость сосудов, TTP (time to peak) – время до пикового накопления контрастного вещества.
1 - Специфичность
Рис. 1. ROC-кривая модели логистической регрессии результатов перфузионной компьютерной томографии легких в дифференциации поствоспалительных и неопластических изменений в легких
Fig. 1. ROC-curve of the logistic regression model of pulmonary perfusion CT in differentiating post-inflammatory and neoplastic changes in the lungs
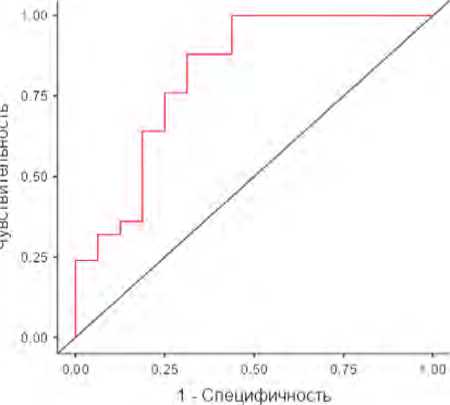
Рис. 2. ROC-кривая однофакторной модели логистической регрессии показателя TTP при перфузионной компьютерной томографии легких в дифференциации поствоспалительных и неопластических изменений в легких
Fig. 2. ROC curve of the single-factor logistic regression model for assessing the TTP parameter in pulmonary CT perfusion to differentiate between post-inflammatory and neoplastic lung changes
ствительность – 80,0%, AUC – 87,5%.
В силу высокой мультиколлинеарности набора таких параметров перфузионной КТ, как BF, BV, PS, MTT и TTP, включать их все в модель логистической регрессии было бы некорректным, хотя формально это повысило бы прогностические и информационные метрики модели. Статистически значимых различий в показателях BF и MTT не выявлено. Это ограничивает диагностическую ценность данных параметров для дифференциации участков легочной консолидации.
Для отдельной оценки чувствительности и специфичности самого информативного в дифференциальной диагностике участков легочной консолидации поствоспалительной и злокачественной этиологии показателя TTP также построена модель логистической регрессии, проведен ее ROC-анализ (рис. 2).
Согласно результатам ROC-анализа, показатель TTP обладает хорошей диагностической эффективностью в дифференциации злокачественных и поствоспалительных изменений, о чем свидетельствуют AUC – 0,8175, чувствительность – 72%, специфичность – 75%. Таким образом, анализ изменений показателей TTP и PS обеспечивает дифференциально-диагностическое качество КТ-перфузии.
На рисунке 3 представлены перфузионные карты участков консолидации поствоспалительного характера с низкими показателями PS и высокими значениями TTP. На рисунке 4 продемонстрировано злокачественное образование с характерным повышением PS и сокращени- ем TTP.
Обсуждение
Показатели проницаемости сосудов (PS) и времени до пика контрастирования (TTP) оказались наиболее информативными для разграничения неопластических и поствоспалительных изменений. Медиана PS в злокачественных очагах составила 13,54 мл / 100 г/мин против 5,30 мл / 100 г/мин при поствоспалительных изменениях ( p = 0,007), а TTP – 11,57 с против 32,55 с соответственно ( p = 0,0004). Статистически значимое увеличение медианы PS в неопластических участках по сравнению с поствоспалительными согласуется с известными особенностями опухолевого ангиогенеза и патофизиологией воспаления. Высокая проницаемость сосудов в участках консолидации неопластического характера может быть обусловлена патологическим неоангиогенезом и нарушением целостности эндотелия, что характерно для злокачественных процессов. Широкий межквартильный интервал показателя проницаемости сосудов при злокачественных образованиях ( Q1 = 5,71; Q3 = 66,01) может отражать гетерогенность опухолей, включая различия в степени васкуляризации и наличие некротических зон [10]. С другой стороны, эта гетерогенность опухолей создает статистически значимую неоднородность данных показателя PS. Уменьшение медианы ТТР в неопластических участках по сравнению с поствоспалительными отражает ускоренное накопление контрастного вещества в опухолевой ткани. Это может быть связано с повышенной перфузи-
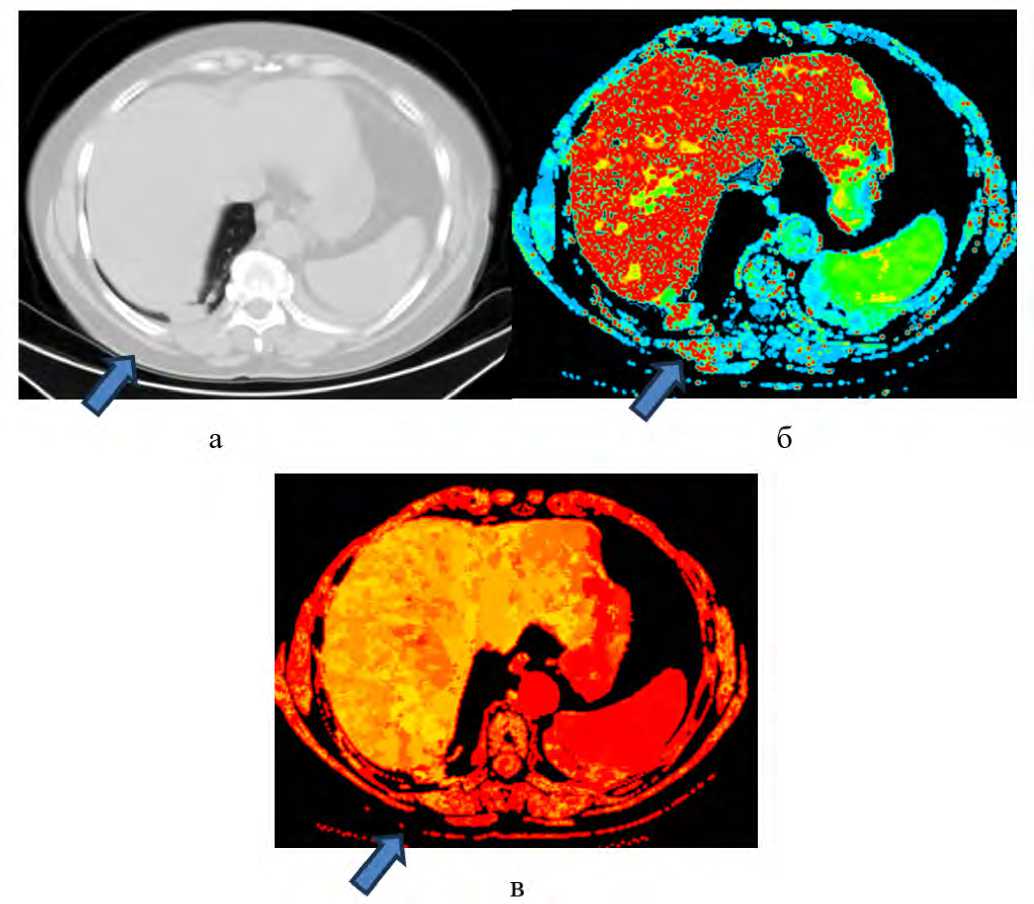
Рис. 3. Аксиальные КТ-изображения органов грудной клетки, участок консолидации поствоспалительного характера в S10 нижней доли правого легкого: а – нативная компьютерная томография, б – цветовая перфузионная карта показателя проницаемости сосудов, в – цветовая перфузионная карта показателя времени до пикового накопления контрастного вещества
Fig. 3. Axial CT images of the chest demonstrating a post-inflammatory consolidation in segment S10 of the right lower lung lobe: а – non-contrast CT, б – color perfusion map of vascular permeability, в – color perfusion map of time to peak contrast enhancement
ей и артериовенозным шунтированием, типичным для злокачественных новообразований. Результаты исследования согласуются с данными, полученными в работе Н.И. Сергеевой и соавт., в которой выявлено, что временные показатели (TTP) играют ключевую роль, в то время как скорость (BF) и объем кровотока (BV) требуют комплексной интерпретации в сочетании с проницаемостью (PS) и данными нативной / контрастной КТ [12]. Кроме того, в исследовании также указана необходимость накопления клинических наблюдений для формирования более четких критериев, особенно в контексте гетерогенности опухолевых процессов и вариабельности физиологических условий, что ограничивает однозначную интерпретацию отдельных параметров. Это подтверждает важность мультимодального подхода и дальнейших исследований для оптимизации алгоритмов диагностики.
Таким образом, несмотря на преимущества КТ в диагностике вирусных пневмоний, рентгенологические признаки COVID-19 могут совпадать с проявлениями других инфекционных, аутоиммунных и онкологических заболеваний. Особую сложность представляет дифференциальная диагностика участков консолидации при нативном КТ, так как их рентгенологические характеристики могут быть схожи с объемными образованиями, что затрудняет интерпретацию. В основе неопластических процессов лежит опухолевый неоангиогенез, приводящий к изменениям сосудов и их повышенной проницаемости [11]. Использование методов, определяющих характер накопления контраста в зонах интереса, позволяет определить природу легочной консолидации. К таким методам относится перфузионная КТ легких. Перфузионная КТ демонстрирует высокий потенциал в расширении возможностей традиционной диагностики за счет детального анализа кровоснабжения тканей. Это особенно актуально в условиях, когда рентгенологические признаки различных заболеваний могут быть визуально схожи. Перфузи-
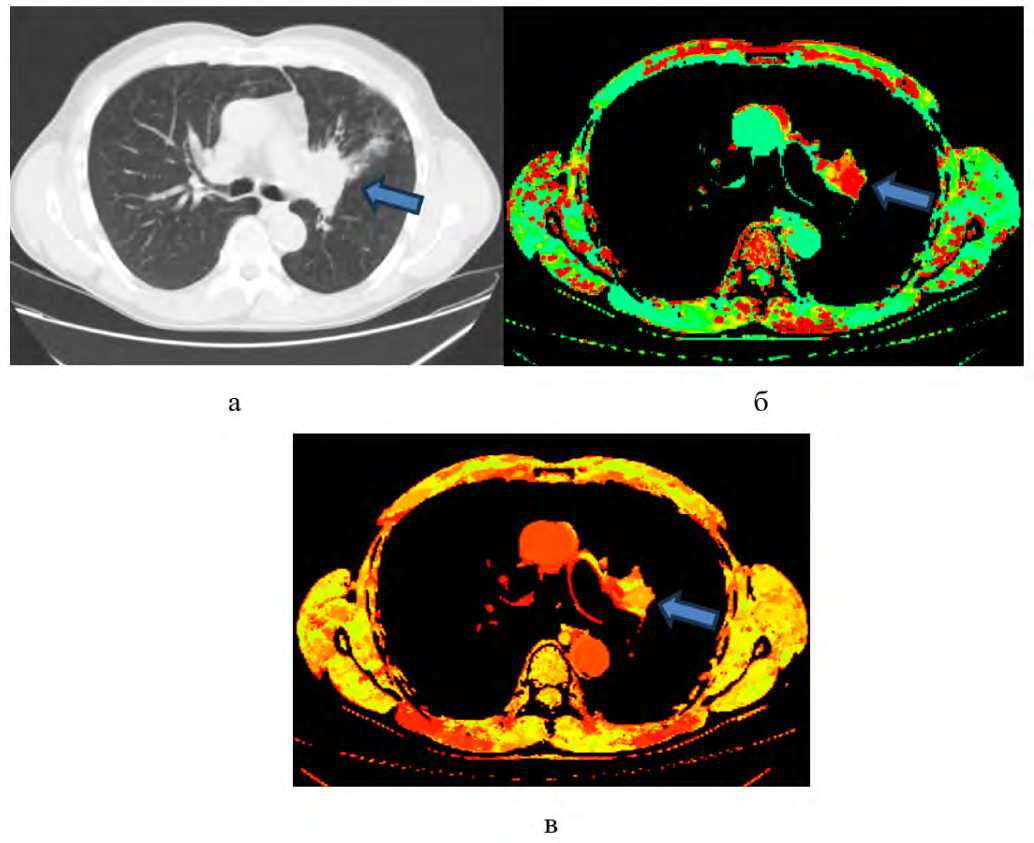
Рис. 4. Аксиальные КТ-изображения органов грудной клетки, участок консолидации злокачественного характера в S3 верхней доли левого легкого: а – нативная компьютерная томография, б – цветовая перфузионная карта показателя проницаемости сосудов, в – цветовая перфузионная карта показателя времени до пикового накопления контрастного вещества
Fig. 4. Axial CT images of the chest demonstrating a malignant consolidation in segment S3 of the left upper lung lobe: а – non-contrast CT, б – color perfusion map of vascular permeability, в – color perfusion map of time to peak contrast enhancement
онная КТ позволяет выявить не только морфологические изменения, но и функциональные аспекты кровоснабжения, что является важным для эффективной диагностики. Обобщенные данные свидетельствуют о том, что рак легкого имеет более высокую перфузию и проницаемость, чем доброкачественные поражения [8]. В работе K. Kundu и соавт. (2024) также продемонстрировано, что значения, полученные при КТ-перфузии, могут быть использованы для дифференциации доброкачественных и злокачественных очаговых поражений паренхимы легких [7]. Данное исследование подтверждает высокую эффективность перфузионной КТ в определении природы легочной консолидации, выявлении неопластических изменений на основании характеристик кровотока.
Несмотря на общую эффективность метода, были установлены случаи, когда высокие показатели перфузии не всегда однозначно указывали на злокачественность процесса, что подчеркивает необходимость комплексного подхода к диагностике. Результаты исследования демонстрируют наличие характерных особенностей кровоснабжения при различных гистологических формах рака лег- ких, что может рассматриваться как дополнительный диагностический маркер. Особое значение придается внедрению КТ-перфузии в стандартные алгоритмы обследования пациентов с легочной патологией как дополнительного инструмента в сложных случаях, требующих анализа микроциркуляторных характеристик тканей для уточнения диагноза. Полученные данные обосновывают целесообразность расширения применения этой методики в клинической практике, прежде всего, при выявлении объемных образований или получении противоречивых результатов лучевой диагностики.
Ограничениями проведенного исследования являются малое количество обследованных пациентов и высокая неоднородность данных. Так, критерий Манна – Уитни выявил статистически значимые различия показателя PS в группах с неопластическими и поствоспалительными изменениями только благодаря значительному повышению этого показателя всего у трех из 25 пациентов в группе со злокачественными изменениями в легких.
Заключение
Проведенное исследование подтвердило, что перфузионная КТ является эффективным инструментом дифференциальной диагностики злокачественных и поствоспалительных изменений легких у пациентов после перенесенной COVID-19-ассоциированной пневмонии. Ключевыми диагностическими параметрами стали время до пика контрастирования и проницаемость сосудов, отражающие особенности опухолевой микроциркуляции. Несмотря на ограниченную выборку ( n = 41) и гетерогенность данных, результаты демонстрируют потенциал метода для снижения потребности в инвазивных проце-


