Перфузионная сцинтиграфия легких в диагностике тромбоэмболии дистальных ветвей легочной артерии у больных с имплантированными электрокардиостимуляторами
Автор: Кривоногов Н.Г., Васильченко Е.Е., Антонченко И.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4-1 т.25, 2010 года.
Бесплатный доступ
Цель работы: оценка возможностей перфузионной сцинтиграфии легких в диагностике тромбоэмболии мелких ветвей легочной артерии у больных с нарушениями возбудимости и проводимости и ЭКС. Обследовано 154 пациента (93 женщины, 61 мужчина) в возрасте 56,3±2,1 лет. Пациенты были распределены на две группы: I (основная) - 76 пациентов с имплантированными ЭКС и II (группа сравнения) - 78 пациентов, не требовавших электротерапии. У пациентов с апикальной ЭКС при средней вероятности ТЭЛА (по клинической оценке) для подтверждения диагноза необходимо дополнительно проводить перфузионную сцинтиграфию легких. При неопределенной (промежуточной) вероятности ТЭЛА (по радиологическим критериям) для исключения данного вида осложнения необходимо повторное сцинтиграфическое исследование перфузии легких после курса гепаринотерапии. Течение тромбоэмболии мелких ветвей легочной артерии у пациентов с имплантированными электрокардиостимуляторами носит немассивный хронический рецидивирующий характер с поражением, как правило, 4-5 и 8-9 бронхолегочных сегментов.
Тромбоэмболия ветвей легочной артерии, перфузионная сцинтиграфия легких, электрокардиостимуляция
Короткий адрес: https://sciup.org/14919292
IDR: 14919292 | УДК: 616-079.2
Текст научной статьи Перфузионная сцинтиграфия легких в диагностике тромбоэмболии дистальных ветвей легочной артерии у больных с имплантированными электрокардиостимуляторами
Тромбоэмболия легочной артерии (ТЭЛА) является одним из наиболее грозных осложнений электростиму-ляционного лечения больных с нарушениями ритма и проводимости сердца, а проблема своевременной диагностики этого состояния остается актуальной [7]. Литературные данные свидетельствуют о том, что апикальная электрокардиостимуляция (ЭКС) в 15% сопровождается развитием ТЭЛА, имеющей, как правило, латентную форму, поскольку эмболизации подвергаются мелкие ветви a. pulmonalis [8]. Это создает определенные трудности в ранней диагностике тромбоэмболии легочной артерии и зачастую предопределяет неверную тактику лечения таких пациентов [9].
Перспективным методом своевременной диагностики тромбоэмболии мелких ветвей легочной артерии у больных с имплантированными ЭКС можно считать перфузионную сцинтиграфию легких, которая является неинвазивной, высокоинформативной и необременительной для пациента. Однако работы такого плана остаются единичными [5].
Цель исследования: оценка возможностей перфузионной сцинтиграфии легких в диагностике тромбоэмболии мелких ветвей легочной артерии у больных с нарушениями возбудимости и проводимости и ЭКС, проводимой из верхушки правого желудочка.
Материал и методы
В исследование были включены 154 пациента (93 женщины, 61 мужчина) в возрасте 56,3±2,1 лет. Клиническую оценку вероятности ТЭЛА проводили по методике, основанной на диагностических правилах Wells с соавт. [4]. При этом лица с низкой вероятностью ТЭЛА из ис- следования исключались. Пациенты были распределены на две группы: I (основная) – 76 пациентов с имплантированными ЭКС и II (группа сравнения) – 78 пациентов, не требовавших электротерапии. Причинами имплантации ЭКС служили: атриовентрикулярная блокада – 29, синдром слабости синусового узла I типа – 15 и II типа (синдром тахи-бради) у 32 человек.
По клинико-демографическим показателям исследуемые группы пациентов были сопоставимы. По клинической оценке высокая вероятность ТЭЛА в основной группе наблюдалась у 17 пациентов, в группе сравнения – у 16; средняя вероятность ТЭЛА наблюдалась у 62 пациентов первой группы и у 59 – второй.
Перфузионную сцинтиграфию легких проводили по общепринятой методике [5]. Инъекцию радиофармпрепарата (РФП) осуществляли в ортостатическом положении пациента, в качестве РФП использовали 99mТс-”Мак-ротех” (“Диамед”, Россия) активностью 2,5 МБк/кг. Исследования проводили на гамма-камере “Omega-500” (“Technicare”, США-Германия). Для регистрации и обработки изображений использовали компьютерную систему “Сцинти” НПО “Гелмос” (Россия). В оценке результатов сцинтиграмм использовали критерии PIOPED [6] и сопоставляли с рентгенологическими данными.
Для описательной статистики применяли программы: “Microsoft Excel” и “Statistica for Windows” с вычисл е нием средних величин и стандартной ошибки средней ( X±m ). Проверку статистических гипотез проводили с использованием непараметрических критериев Вилкоксона, Манна–Уитни.
Результаты и обсуждение
Результаты проведенных исследований показали, что при высокой (по клиническим данным) вероятности ТЭЛА у пациентов как первой, так и второй групп положительные результаты сцинтиграфических исследований (наличие характерных для ТЭЛА дефектов перфузии) не различались и наблюдались у 15 пациентов первой группы и 13 – второй (p>0,05). При средней вероятности ТЭЛА положительные результаты перфузионной сцинтиграфии легких у больных основной группы превышали (p=0,0273) показатели группы сравнения более чем в 1,5
Таблица 1
Результаты перфузионной сцинтиграфии легких и клинической оценки вероятности ТЭЛА
|
Сцинтиграфическая вероятность ТЭЛА (по системе PIOPED) |
Вероятность ТЭЛА по клинической оценке |
|||
|
Высокая |
Средняя |
|||
|
I группа (n=17) |
II группа (n=16) |
I группа(n=59) |
II группа (n=62) |
|
|
Низкая |
0 |
2 |
7 |
11 |
|
Промежуточная |
2 p=0,0422 |
1 |
13 |
11 |
|
Высокая |
15 |
13 |
23 p=0,0273 |
12 |
раза (табл. 1). При этом следует обратить внимание, что сцинтиграфическое исследование позволило исключить диагноз тромбоэмболии у 28 больных и, наоборот, перевести 23 пациента первой и 12 больных второй групп из разряда средней вероятности ТЭЛА в разряд высокой.
Анализ пульмоносцинтиграмм у пациентов сравни-маемых групп позволил выявить существенные различия в локализации зон легочной эмболизации (рис. 1, 2). Так, у больных I (основной) группы зоны легочной аперфу-зии визуализировались, преимущественно, в 4–5 и 8–9 бронхолегочных сегментах. При этом примерно в 30% случаев признаки тромбоэмболии находили только в бассейне левой легочной артерии. Нарушения легочной перфузии у пациентов данной группы носили хронически рецидивирующий характер, о чем свидетельствовало то, что наряду с областями аперфузии на сцинтиграммах выявлялись бронхолегочные сегменты с признаками неполного восстановления капиллярного кровотока. О том же говорило изменение локализации гипоперфузируе-мых сегментов при повторных исследованиях.
У пациентов II группы нам не удалось выявить какой-либо закономерности в сегментарной топографии дефектов легочной перфузии. Однако эмболия ветвей левой a. pulmonalis встречалась заметно чаще. В целом, количество гипоперфузируемых бронхолегочных сегментов у больных этой группы было в 1,6 раза меньше по сравнению с основной выборкой (рис. 1, 2).
Выявленные нами отличия позволяют предполагать, что механизм развития ТЭЛА у пациентов с искусственными водителями ритма отличается от “классического”. Скорее всего, меньшая тяжесть нарушения перфузии бронхолегочных сегментов связана с размерами эмбо- лов, а характерная их локализация – с особенностями анатомического строения артериальной системы легких. Дело в том, что кровоснабжение 4–5 правых и 8–9 левых бронхолегочных сегментов осуществляется из крупных ветвей легочных артерий, анатомически являющихся прямым “продолжением” основной сосудистой магистрали [3]. Если предположить, что источник эмболизации находился в подключичной и (или) верхней полой вене (где чаще образуются большие тромбы), то можно было бы ожидать развития более обширного и тяжелого поражения сосудистого русла легких. Следовательно, более логичной выглядит гипотеза о кардиальном происхождении источника ТЭЛА при электротерапии.
Результаты проведенных комплексных исследований не позволили с высокой вероятностью диагностировать ТЭЛА у 27 пациентов, и по радиологическим критериям они были отнесены в промежуточную (неопределенную) группу. Как известно, в таких случаях рекомендуется проведение дополнительных исследований, из которых мы выбрали диагностику ex juvantibus – оценка достоверности предполагаемого диагноза ТЭЛА по динамике легочной перфузии в ответ на проведение гепаринотерапии. Контрольную сцинтиграфию легких проводили на 5–6-е сутки от начала лечения антикоагулянтом. При этом уменьшение дефектов перфузии легких на 10% и более принималось нами в качестве положительного результата теста [1, 2].
Результаты повторных сцинтиграфических исследований представлены в таблице 2.
Как следует из таблицы 2, у большинства пациентов сравниваемых групп контрольные сцинтиграммы легких характеризовались положительной динамикой, которая,
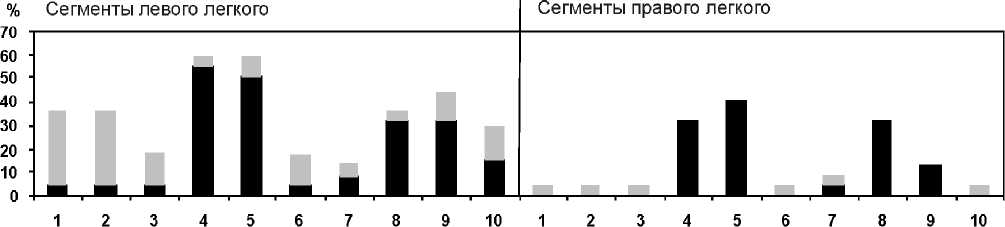
Рис. 1. Частота аперфузии (черным цветом) и гипоперфузии (серым цветом) бронхолегочных сегментов легких у пациентов I группы (%)
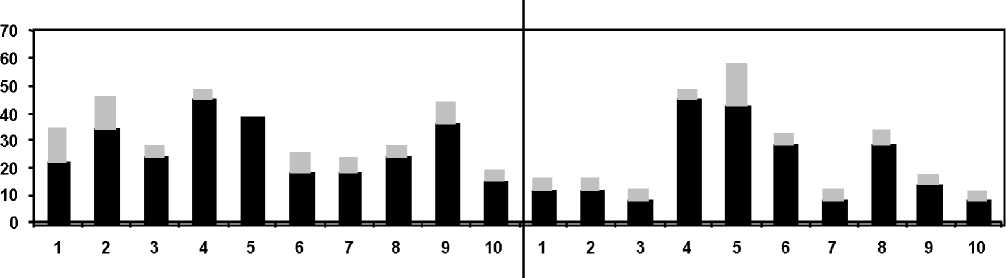
Рис. 2. Частота аперфузии (черным цветом) и гипоперфузии (серым цветом) бронхолегочных сегментов легких у пациентов II группы (%)
по нашему мнению, является Таблица 2
дополнительным критерием в пользу предполагаемой тромбоэмболии ветвей легочной артерии у данной категории больных. При этом у пациентов основной группы обнаруженные изменения статистически значимо отличались от соответствующей динамики в конт-
Динамика перфузии легких у больных на фоне гепаринотерапии (n,%)
|
Контрольная сцинтиграфия легких |
I группа (n=15) |
II группа (n=12) |
||
|
n |
% |
n |
% |
|
|
Уменьшение объема дефектов легочной перфузии на 10% и более |
14 |
93,3 |
7 |
58,3 p=0,0071 |
|
Без положительной динамики |
1 |
6,7 |
5 |
41,7 p=0,0383 |
роле.
Отсутствие изменений ле гочной перфузии при контрольной сцинтиграфии позволяло нам перевести данных пациентов в группу с низкой вероятностью ТЭЛА или исключить указанный диагноз.
Таким образом, результаты проведенных исследований показали:
-
1. У пациентов с апикальной ЭКС при средней вероятности ТЭЛА (по клинической оценке) для подтверждения диагноза необходимо дополнительно проводить перфузионную сцинтиграфию легких.
-
2. При неопределенной (промежуточной) вероятности ТЭЛА (по радиологическим критериям) для исключения данного вида осложнения необходимо повторное сцинтиграфическое исследование перфузии легких после курса гепаринотерапии. Увеличение перфузии легких при этом на 10% и более свидетельствует в пользу тромбоэмболии мелких ветвей легочной артерии.
-
3. Течение тромбоэмболии мелких ветвей легочной артерии у пациентов с имплантированными электрокардиостимуляторами носит немассивный хронический рецидивирующий характер с поражением, как правило, 4–5 и 8–9 бронхолегочных сегментов.
Список литературы Перфузионная сцинтиграфия легких в диагностике тромбоэмболии дистальных ветвей легочной артерии у больных с имплантированными электрокардиостимуляторами
- Кривоногов Н.Г., Лишманов Ю.Б., Завадовский К.В. и др. «Способ дифференциальной диагностики острых инфекционных заболеваний легких и тромбоэмболий мелких ветвей легочной артерии». Решение о выдаче патента на изобретение № 2005141714/14 (046469) от 30.12.2005 г.
- Лишманов Ю.Б., Кривоногов Н.Г., Агеева Т.С. и др. Сцинтиграфическая характеристика нарушений легочной вентиляции и перфузии у пациентов с внебольничными пневмониями//Сибирский медицинский журнал. -2008. -Т. 23, № 1 (выпуск 2). -С. 11-15.
- Уэйр Е.К., Ривс Дж.Т. Физиология и патофизиология легочных сосудов: пер. с англ. -М.: Медицина, 1995. -672 с.
- Arnason T., Wells P.S., Forster A.J. Appropriateness of diagnostic strategies for evaluating suspected venous thromboembolism//Thromb Haemost. -2007, Feb. -No. 97 (2). -P. 195-201.
- Bajc M., Neilly J.B., Miniati M. et al. EANM guidelines for ventilation/perfusion scintigraphy: Part 1. Pulmonary imaging with ventilation/perfusion single photon emission tomography//Eur J Nucl Med Mol Imaging. -2009, Aug. -No. 36 (8). -1356-1370.
- Gottschalk A, Sostman H.D., Coleman R.E. et al. Ventilation-perfusion scintigraphy in the PIOPED study. Part II. Evaluation of the scintigraphic criteria and interpretations//J. Nucl. Med. -1993, Jul. -No. 34 (7). -P. 1119-1126.
- Karavidas A., Lazaros G., Matsakas E. et al. Early pacemaker lead thrombosis leading to massive pulmonary embolism//Echocardiography. -2004, Jul. -No. 21 (5). -P. 429-432.
- Rooden van C.J., Molhoek S.G., Rosendaal F.R. Incidence and Risk Factors of Early Venous Thrombosis Associated with Permanent Pacemaker Leads//J. Cardiovasc. Electrophysiol. -2004, Nov. -No. 15 (11). -P. 1258-1262.
- Torbicki A., Perrier A., Stavros K. et al. Guidelines on the diagnosis and management of acute pulmonary embolism//J. Ital. Cardiol (Rome). -2009, May. -No. 10 (5). -P. 303-347.


