Пермиксон: место препарата в патогенетической терапии ДГПЖ
Автор: Сивков А.В., Синюхин В.Н.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Андрология
Статья в выпуске: 4, 2017 года.
Бесплатный доступ
Доброкачественная гиперплазия предстательной железы (ДГПЖ) является распространенным заболеванием среди мужчин пожилого возраста, которое сильно влияет на их качество жизни, вызывая симптомы со стороны нижних мочевых путей. В настоящее время выявлено несколько факторов риска развития ДГПЖ, которые включают: возраст, генетическую предрасположенность, изменение гормонального фона, наличие воспалительного процесса в предстательной железе (ПЖ), повышение содержания в ней факторов роста клеток, а также образ жизни. В настоящее время для лечения этого заболевания, как правило, применяют α1-адреноблокаторы, М-холинолитики, ингибиторы 5a-редуктазы и фосфодиэстеразы-5. Все эти соединения обладают профилем побочных эффектов, заставляющих многих пациентов искать альтернативные методы лечения и использовать лекарства, полученные из растений. Пермиксон - это гексановый липидостероловый экстракт Serenoa repens, состоящий из смеси свободных и эстерифицированных длинноцепочечных жирных кислот, полипренов и фитостеролов. Он обладает специфичностью и селективностью по отношению к ПЖ, а благодаря большому количеству ингредиентов, имеет широкий спектр биологической активности по отношению к этому органу. Основными направлениями действия Пермиксона являются его антиандрогенные (ингибирование активности 5α-редуктазы), проапоптотические, антипролиферативные и противовоспалительные свойства. Однако, в отличие от других ингибиторов 5α-редуктазы, Пермиксон не влияет на выработку простатспецифического антигена. Более того, препарат не вызывает побочных эффектов, которые, как известно, бывают при использовании синтетических лекарственных средств. Систематический обзор литературы и наши собственные результаты показывают, что по сравнению с плацебо, Пермиксон уменьшает симптомы со стороны нижних мочевых путей, вызванные ДГПЖ и улучшает процесс выделения мочи. Этот препарат обладает эффективностью, сравнимой с α1-адрено-блокаторами и короткими курсами ингибиторов 5α-редуктазы. Препарат хорошо переносится и не оказывает негативного влияния на сексуальную функцию.
Доброкачественная гиперплазия предстательной железы, лечение медикаментозное, пермиксон
Короткий адрес: https://sciup.org/142213092
IDR: 142213092
Текст научной статьи Пермиксон: место препарата в патогенетической терапии ДГПЖ
В последнее время появилось большое число исследований, показывающих, что ДГПЖ – это имму-новоспалительное заболевание. При этом, в ткани ПЖ обнаруживают воспалительные инфильтраты, содержащие лимфоциты и макрофаги, количество которых коррелирует с объемом ДГПЖ. Они секретируют факторы роста, вклю- экспериментальная и клиническая урология № 4 2 0 17 чая фактор роста фибробластов (FGF), цитокины: интерлейкин-1 (IL-1), интерлейкин-6 (IL-6), фактор некроза опухоли-α (TNF-α). Также наблюдают повышенную активность Т-клеток и аутоиммунные реакции, которые способствуют пролиферации стромальных и эпителиальных клеток. Было показано, что повышенное содержание в ткани при ДГПЖ провоспалительных цитокинов и цитокинов семейства IL-17 A, E, F и их рецепторов, сопровождает повышение содержания клеток воспаления и сосудов с экспрессией CD 31+, а также провоспалительных хе-мокинов: MCP-1/CCL2 (фактор хемотаксиса моноцитов), IP-10/CXCL10 (индуцируемый гамма-интерферо-ном белок), MIF (фактор ингибирующий миграцию макрофагов) [10]. Провоспалительные цитокины повышают активность циклооксигеназы-2 (COX-2) и вызывают образование простагландинов и окиси азота, что стимулирует пролиферативные процессы в ПЖ и вызывает ее отечность. Ряд авторов считают, что активные формы кислорода приводят к повреждению ткани ПЖ, так как после завершения процесса трансляции вызывают модификацию структуры ДНК и ее клеток, что может привести к ма-лигнизации процесса [11,12].
экспериментальная и клиническая урология № 4 2 0 17
В НИИ урологии в 1999 году проанализированы результаты лечения 48 больных ДГПЖ, которые получали Пермиксон по 160 мг дважды в день в течение 12 месяцев. Было отмечено уменьшение выраженности симптомов по шкале I-PSS с 14,35 до 10,61 балла (-26,1%) через 6 месяцев и до 10,42 (- 27,4%) через 12 месяцев лечения. В те же периоды времени средний показатель Q max увеличился с 10,62 до 12,60 мл/сек (+18,7%) и до 12,73 мл/сек (+19,9%) соответственно. Индекс качества жизни QOL через 6 месяцев наблюдения снизился с 3,49 до 2,60 баллов (-25,3%), достигнув к концу года 2,49 (-28,7%). Также было зарегистрировано небольшое уменьшение среднего объема предстательной железы: на 11,8% через 6 месяцев и 15,6% через 12 месяцев. Показатель ПСА не изменялся в течение всего периода лечения. Изучение эффективности Пермиксона у больных с различными исходными значениями IPSS и Q max дало нам возможность сделать заключение о том, что препарат наиболее результативен у пациентов с умеренной выраженностью симптомов ДГПЖ (IPSS < 18) и умеренными уродинамическими нарушениями (Q max > 10 мл/сек) [45].
Большое клиническое значение имеют данные уродинамиче-ских исследований, характеризующие влияние Пермиксона на состояние мочевого пузыря и степень ин-фравезикальной обструкции. На основании анализа данных комплексного уродинамического обследования больных ДГПЖ получавших, Пермиксон, был сделан вывод о том, что препарат оказывает позитивное влияние на функциональное состояние мочевого пузыря и уменьшает степень инфравезикаль-ной обструкции. Вместе с тем, ни в одном случае полностью устранить проявления обструкции не удалось [47].
Особый интерес представляют работы, в которых сравнивали эффективность и безопасность Пер- миксона с плацебо и другими лекарственными средствами. Результаты 7 плацебо-контролируемых исследований, в которых приняло участие в общей сложности 559 человек, обобщены в 1996 году G. Plosker и R. Brogden [48]. В 3-х наиболее значимых из них, где участвовало 410 больных ДГПЖ, пациенты были разделены на две практически равные группы: принимавшие Пер-миксон (320 мг/сут) и плацебо. В этих исследованиях продолжительностью от одного до трех месяцев достоверно продемонстрирована клиническая эффективность препарата по сравнению с плацебо. При этом частота ночных мочеиспусканий уменьшилась на 33-46%, дневная поллакиурия – на 11-20%, a Qmax увеличилась на 29-50%, что было существенно выше, чем в группе плацебо, где аналогичные показатели составили 15-18%, 1-3% и 5-9% соответственно.
В трех других опубликованных исследованиях продолжительностью 1-2 месяца с участием 79 больных, на фоне приема Пермиксона было отмечено уменьшение ноктурии на 50-74%, снижение частоты дневных мочеиспусканий на 29-43% и рост Q max на 26-43%, тогда как в группе плацебо эти же показатели были равны 13-39%, 8-29% и 2-19%. Лишь в одном из 7 опубликованных исследований авторы не выявили существенных различий между изучаемыми признаками.
В ряде наблюдений Пермиксон выступил в качестве эффективного средства устранения дизурии. В исследовании J. Descotes и соавт., проведенном на 176 больных ДГПЖ, показано, что в течение одного месяца дизурия уменьшилась у 31% из получавших Пермиксон (320 мг/сут) по сравнению с 16% – в группе плацебо (р<0,05) [49]. Подобные же результаты были получены в другом исследовании, охватившем 146 пациентов [50].
Предметом ряда исследований стало изучение влияния Пермик-сона на объем остаточной мочи.
При этом, на фоне применения препарата уменьшение V res относительно первоначальных значений составило 15-50% и было статистически значимым, по сравнению с группой плацебо, где наблюдали не только снижение, но и увеличение этого показателя [50,51].
Таким образом, большинство проведенных плацебо-контролируе-мых исследований Пермиксона достоверно продемонстрировали клиническую эффективность лечения, которая проявляется выраженным уменьшением симптомов заболевания и улучшением уродинамиче-ских показателей.
Описание клинических результатов применения Пермиксона было бы неполным без рассмотрения материалов его исследования в сравнении с другими лекарственными препаратами. Особенно интересны данные, касающиеся финастерида и α1-адреноблокаторов.
Показательно широкомасштабное исследование J.С. Carraro и соавт., в ходе которого в течение 6 месяцев двойным слепым методом сравнивали эффективность и безопасность Пермиксона и финастерида. Для участия в исследовании было рандомизировано 1098 мужчин с ДГПЖ, отобранных в 87 урологических центрах 9 европейских стран. Анализ клинических результатов проведен у 1069 пациентов, из которых 536 получали Пермиксон (320 мг/сут) и 533 – финастерид (5 мг/сут). Данная работа – одно из самых крупных сравнительных исследований этих двух препаратов у пациентов с ДГПЖ [52]. Основными критериями сравнения в этом исследовании были: динамика симптомов по шкале IPSS, изменение Qmax, a также показателей качества жизни и сексуальной функции. Через 6 мес. лечения отмечено уменьшение симптомов по шкале I-PSS с 15,7 ± 5,7 до 9,5 ± 5,5 баллов (-39%) в группе финастерида и с 15,7 ± 5,9 до 9,9 ± 5,4 баллов (-37%) среди пациентов, получавших Пермиксон (р<0,001)
(рис. 4). Симптоматическое улучшение уже через 6 недель превысило 20% в обеих группах. Кроме того, более 50% больных в каждой из групп к моменту окончания лечения отметили улучшение качества жизни (QOL), динамика показателя которого составила -38% у принимавших Пермиксон и 41% – у получавших финастерид. Различия итоговых значений IPSS и QOL в обеих группах, при сравнении их между собой оказались статистически недостоверными.
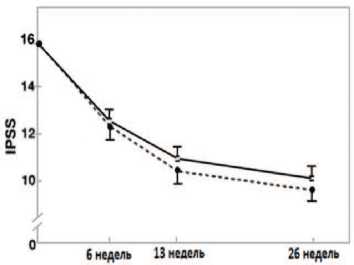
Рис. 4. Общая средняя оценка по шкале IPSS у мужчин с ДГПЖ, получающих препарат Пер-миксон в дозе 320 мг (белые квадраты) или финастерид в дозе 5 мг (черные ромбы) (± 95% доверительный интервал) [53]
Половая функция по результатам анкетирования не претерпела существенных изменений на фоне терапии Пермиксоном, а у пациентов, лечившихся финастеридом, было выявлено ее некоторое ухудшение.
В обеих группах отмечено улучшение уродинамических показателей. При этом, Qmax увеличилась с 10,6 ± 2,8 до 13,3 ± 6,7 мл/с (+25%) через 6 месяцев лечения Пермиксо-ном и с 10,8 ± 3,1 до 14,0 ± 7,4 мл/с (+30%) в группе финастерида (р<0,001): улучшение оказалось несколько более выраженным у пациентов, принимавших финастерид (р<0,05). Наибольший эффект обоих препаратов наблюдали у больных с выраженной симптоматикой (IPSS > 18) и относительно сохранным мочеиспусканием (Qmax > 10 мл/с), число которых в результате лечения сократилось практически на 80% за счет перехода больных в группы с менее выраженными клиническими проявлениями. В результате применения как Пермиксона, так и финастерида, произошло незначительное, но статистически достоверное (р<0,001) уменьшение объема ПЖ. В первом случае оно составило 6%, а во втором – 18%, что свидетельствует об отсутствии четкой корреляции между ослаблением симптоматики и изменением объема железы.
В ходе описываемого сравнительного исследования была изучена зависимость результатов лечения Пермиксоном от объема ПЖ. Оказалось, что клиническая эффективность Пермиксона не зависит от исходного объема железы. Было также отмечено значительное (на 41%) снижение уровня ПСА в группе финастерида (р<0,001), тогда как у принимавших Пермиксон этот показатель существенно не изменился (+3%). Указанное различие является статистически значимым.
Таким образом, описанное исследование продемонстрировало, что Пермиксон и финастерид одинаково эффективно воздействуют на симптомы ДГПЖ, качество жизни и уро-динамические показатели, при статистических различиях в динамике уровней ПСА и влиянии на половую функцию в пользу Пермиксона.
Представляют интерес сравнительные исследования Пермиксона и α1-адреноблокаторов. Так, M. Grasso и соавт. изучили результаты приме-
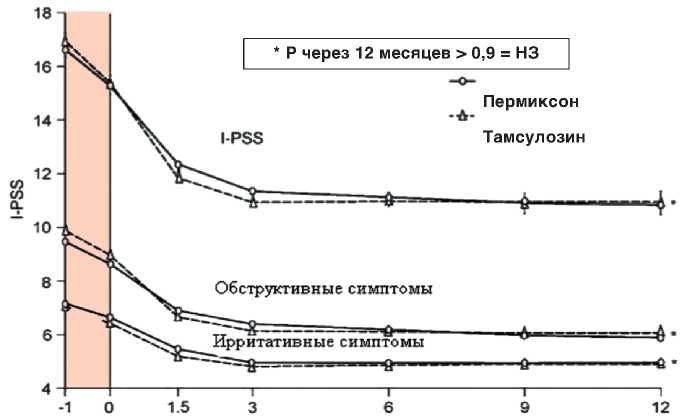
Рис. 5 Изменение среднего профиля оценки Пермиксона и Тамсулозина по шкале I-PSS с течением времени [55]
нения Пермиксона (320 мг/сут) у 31 больного и альфузозина (2,5 мг 3 раза в день) у 32 пациентов с ДГПЖ в течение 3 недель лечения. Эффективность препаратов оценивали с использованием шкалы Boyarsky и критерия Q max . В результате лечения уменьшение симптомов составило 27% в первой группе и 39% во второй (р<0,01). Увеличение Qmax также было, в целом, достоверным, но более выраженным во второй группе (+51%) по сравнению с первой (+27%), хотя различия между ними и не были статистически столь значимыми [53].
В 2002 году в 11 странах Европы было проведено 12-месячное двойное слепое рандомизированное сравнительное исследование Пер-миксона и тамсулозина (PERMAL), которое включило 811 больных ДГПЖ с оценкой СНМП по шкале I-PSS ≥10 баллов. После 4-недельного вводного периода 704 пациента были случайным образом распределены в группы тамсулозина (0,4 мг/сут; n=354) и Пермиксона (320 мг/сут; n=350). В начале исследования и периодически в течение года у пациентов проводили оценку по шкале IPSS, шкале качества жизни – QOL и измеряли Qmax. Через 12 месяцев в каждой группе лечения показатели IPSS снизились на 4,4 балла, какие-либо различия в улучшении ирритативных или об- экспериментальная и клиническая урология № 4 2 0 17 структивных симптомов отсутствовали (рис. 5). Повышение показателя Qmax было сопоставимо в обеих группах: 1,8 мл/с – для препарата Пермиксон, 1,9 мл/с – для тамсуло-зина. Уровень ПСА оставался неизменным на фоне небольшого снижения объема ПЖ у пациентов, принимавших Пермиксон. Оба препарата продемонстрировали хорошую переносимость, однако в группе тамсулозина чаще наблюдали нарушения эякуляции. Это исследование показало, что эффективность применения Пермиксона и тамсуло-зина при лечении СНМП у мужчин с ДГПЖ на протяжении 12 месяцев практически одинакова, с преимуществом безопасности растительного препарата [54].
В другой работе эта же группа авторов дополнительно проанализировала результаты лечения 124 больных с выраженными проявлениями СНМП (IPSS>19), получавших тамсулозин (n=59) и Пермик-сон (n=65). Через 12 месяцев общий показатель IPSS снизился в группе тамсулозина на 5,8, а в группе Пер-миксона – на 7,8 баллов, что составило, соответственно, 25% и 35,2% от исходного уровня. Оказалось, что чем выше были исходные показатели IPSS в группе Пермиксона, тем больше они снижались в процессе терапии. В этой группе улучшение наступало через 3 месяца после начала лечения и оставалось на том же уровне весь период наблюдения. В группе тамсулозина Q max увеличилась на 1,7 мл/сек, а в группе Пермиксона – на 1,2 мл/сек. Объем ПЖ снизился при приеме тамсулозина на 0,9 см3, а при приеме Пермиксона – на 2,2 см3. Таким образом, Пермиксон (320 мг/сут) и тамзулосин (0,4 мг/сут), принимаемые в течение 12 месяцев, вызывают сопоставимое улучшение симптомов и показателей мочеиспускания у пациентов с выраженными СНМП/ДГПЖ [55]. Похожие результаты были получены и в ходе сравнения Пермиксона с празозином [56].
Принципиальные выводы о клинической эффективности Пер-миксона были сделаны по итогам метаанализа, представленного P. Boyle и соавт. в 2004 году [57]. В работе были обобщены материалы 12 основных плацебо-контролируемых и сравнительных исследований Пер-миксона, включавших результаты лечения 2794 больных ДГПЖ. С высокой степенью статистической достоверности авторам удалось продемонстрировать: лечение Пермик-соном приводит к увеличению Q max дополнительно на 1,87±0,55 мл/сек по сравнению с плацебо (р<0,001); терапия Пермиксоном уменьшает частоту ночных мочеиспускании на 0,55± 0,10 по сравнению с плацебо (р<0,001).
Таким образом, сегодня можно с уверенностью констатировать, что клиническая эффективность Пер-миксона по отношению к плацебо статистически доказана.
Важнейшей характеристикой любого лекарственного средства является его переносимость. Данные клинических испытаний Пермик-сона у пациентов с ДГПЖ, получавших его в дозе по 160 мг дважды в день (320 мг/сут), свидетельствуют, что препарат легко переносится большинством (94,4%) пациентов. Только у 2-3% мужчин, принявших участие в двух широкомасштабных несравнительных исследованиях (1092 человека), наблюдали какие-либо побочные эффекты. В основном, это были незначительные жалобы на нарушение функции желудочно-кишечного тракта (тошнота), которые исчезали самостоятельно при приеме препарата во время еды. Ни у одного из пациентов терапия не была прервана в связи с каким-либо осложнением [42,43].
В ходе описанного выше международного мультицентрового двойного слепого рандомизированного сравнительного исследования эффективности и безопасности Пер-миксона и финастерида, не отмечено значимых различий их перено- симости. Жалобы на боль в животе, диарею, запор, тошноту были наиболее часты среди нежелательных явлений и характерны в равной мере как для Пермиксона, так и для финастерида. Отрицательного влияния Пермиксона на половую функцию не зарегистрировано, а снижение либидо и половой потенции чаще ассоциировали с финастеридом [52].
Более того, как показали G. D'Ottavio и соавт. при изучении влияния 3-месячного курса терапии Пермиксоном (320 мг/сут) на фертильность у мужчин относительно молодого возраста (средний возраст 36 лет) с сохраненной эякуляцией, в течение 12 месяцев наблюдения ни по одному из параметров (объем эякулята, концентрация и подвижность сперматозоидов) не отмечено каких-либо значимых отклонений. У этих больных отсутствовали побочные эффекты и не было зарегистрировано по сравнению с исходными данными существенных изменений лабораторных параметров крови. Пермиксон не влиял на либидо, половую потенцию и не вызывал гинекомастии [58]. Приведенные данные являются основанием для расширения показаний к применению препарата у лиц молодого возраста и у больных, страдающих хроническим простатитом.
Клинически важны исследования по лечению хронического простатита (ХП) ЭППП в сочетании с антибактериальными препаратами. Так, V. Magri и соавт. наблюдали в течение 6 недель 137 больных, которым для лечения ХП был назначен ципрофлоксацин, альфузозин и ЭППП. Ремиссию заболевания наблюдали у 94% больных, стойкий эффект сохранялся в течение 30 месяцев наблюдения [59].
В отдельном исследовании K. Stamatiou и N. Pierris разделили 56 больных ХП на 2 группы. Первая – в течение 15 дней получала прулифлоксацин в дозе 600 мг, больные второй группы в течение 8 недель дополнительно принимали
ЭППП. У больных, получавших ЭППП, по сравнению с пациентами первой группы наблюдали полное исчезновение болевого синдрома, СНМП и статистически недостоверную эрадикацию всех возбудителей [60].
-
G. Busetto c cоавт. провели исследование на 210 больных с бактериальным простатитом, половина которых принимала только пру-лифлоксацин в дозе 600 мг в течение 21 дня, а другой группе пациентов дополнительно был назначен ЭППП в дозе 320 мг/сут, Lactobacillus Sporogenes (200 мг) и арбутин (100 мг). Оказалось, что через два месяца наблюдения у больных первой группы биологический рецидив заболевания составил 27,6%, а второй – 7,8%. У больных второй группы, согласно опроснику NIH-CPSI, через 6 месяцев после окончания терапии была меньшая выраженность СНМП. Этот показатель в первой группе был 13,25, а второй – лишь 3,67 балла [61]. Таким образом, комбинация антибактериальной терапии с ЭППП, к которым относится и Пермиксон, улучшает течение и симптоматику ХП и снижает вероятность рецидива заболевания.
Особый интерес вызывает опубликованный в 2016 году G. Novara и соавт. систематический обзор и метаанализ всех рандомизированных клинических исследований (РКИ) применения Пермиксона при ДГПЖ и СНМП с использованием баз данных Medline, Scopus и Web of Science. Авторами выполнен поиск по термину «Serenoa repens» во всех рубриках. Отбору подлежали только РКИ, в которых изучали эффективность и безопасность препарата Пермиксон при лечении СНМП/ ДГПЖ. В рамках систематического поиска было выделено 12 РКИ: в 7 исследованиях сравнивали препарат Пермиксон и плацебо; в 2 исследованиях сравнивали Пермиксон и тамсулозин; в 2 исследованиях Пер-миксон в комбинации с тамсулози-ном сравнивали, соответственно, с плацебо в комбинации с тамсуло- зином и с тамсулозином в виде монотерапии; еще в 1 исследовании провели сравнительную оценку препаратов Пермиксон и финастерида.
Оказалось, что в сравнении с плацебо Пермиксон значительно более эффективно сокращал частоту ночных мочеиспусканий (взвешенная разность средних значений – WMD – 0,31; p = 0,03) и увеличивал максимальную скорость потока мочи (Q max ; WMD 3,37; p<0,0001). Для препарата Пермик-сон и плацебо были получены сопоставимые показатели общей частоты нежелательных явлений (отношение шансов – ОШ 1,12; p=0,92) и выбывания из исследования (ОШ 1,52; p= 0,60).
Пермиксон продемонстрировал аналогичную эффективность в сравнении с тамсулозином, применяемым в виде монотерапии и финастеридом, применяемым в виде краткосрочной терапии, с точки зрения улучшения балла по шкале IPSS (WMD 1,15; 95% доверительный интервал – ДИ 1,11–3,40; p=0,32) и показателей Q max (WMD 0,16; 95% ДИ 0,60–0,28; p=0,48). В сравнении с монотерапией тамсулозином комбинация Пермиксона и тамсулозина показала более высокую эффективность с точки зрения улучшения СНМП (WMD 0,31; 95% ДИ 0,13– 0,48; p<0,01), но не показателей Q max (WMD 0,10; 95% ДИ -0,02–0,21; p=0,10). Препарат Пермиксон продемонстрировал благоприятный профиль безопасности, оказав крайне ограниченное влияние на нарушение эякуляции в сравнении с тамсулозином (0,5% и 4%, соответственно, p=0,007) и снижение либидо и потенции, в сравнении с краткосрочной терапией финастеридом (2,2% и 1,5% в сравнении с 3% и 2,8%, соответственно).
Был сделан вывод, что препарат Пермиксон сокращал частоту ночных мочеиспусканий и улучшал показатели Qmax в сравнении с плацебо, а также не уступал по эффективности тамсулозину и краткосрочной терапии финастеридом с точки зрения улучшения СНМП. Более того, он продемонстрировал благоприятный профиль безопасности, оказав весьма ограниченное влияние на сексуальную функцию, показатели которой в значительной степени зависят от всех лекарственных препаратов, используемых для лечения СНМП/ДГПЖ. Кроме того, авторы считают, что исследования, в которых выражают сомнение об эффективности экстрактов плодов пальмы ползучей при лечении СНМП/ДГПЖ, не распространяются на препарат Пермиксон [62].
ЗАКЛЮЧЕНИЕ
Пермиксон является эффективным и безопасным средством патогенетической терапии ДГПЖ, воздействующим на ряд факторов развития и прогрессирования этого заболевания. Он обладает тройным действием на предстательную железу: антиандрогенным, противовоспалительным и антипролифе-ративным. Вместе с тем, мы считаем, что о патогенетическом действии препарата можно говорить лишь с позиций его длительного применения, с учетом времени, необходимого для клинической реализации эффекта ингибирования 5α-редуктазы. При проведении коротких курсов терапии Пермиксо-ном на первый план, вероятно, выступает его противовоспалительное и противоотечное действие. В многочисленных исследованиях отмечено статистически достоверное воздействие препарата на симптомы и клинические проявления ДГПЖ в сравнении с плацебо и другими лекарственными средствами.
Способность влиять на патогенез ДГПЖ на нескольких уровнях определяет место препарата Пер-миксон и позволяет выделить группы больных, предпочтительные для такого лечения:
-
1. Больные с умеренной выраженностью симптомов заболевания (IPSS < 18) и уродинамических нарушений (Q max >10 мл/с). Им может
-
2. Больные с манифестной симптоматикой (IPSS >18) и умеренной выраженностью уродинамиче-ских нарушений (Q max >10 мл/с). Если через 3-6 месяцев лечения препаратом Пермиксон не наступило существенного симптоматического улучшения, необходимо рассмотреть вопрос об изменении проводимой медикаментозной терапии;
-
3. Больные гиперплазией предстательной железы в сочетании с хроническим простатитом. Терапия препаратом Пермиксон возможна в
-
4. Больные относительно молодого возраста с сохранной половой функцией и клиническими признаками хронического простатита. Использование препарата Пер-миксон в качестве элемента комбинированной медикаментозной терапии, в первую очередь совместно с α1-адреноблокаторами и антибиотиками, позволяет улучшить результаты лечения.
экспериментальная и клиническая урология № 4 2 0 17 быть рекомендована длительная (многомесячная) терапия препаратом Пермиксон с целью предотвращения дальнейшего прогрессирования симптомов ДГПЖ, с оценкой результатов лечения через 1012 мес.;
Резюме:
Доброкачественная гиперплазия предстательной железы (ДГПЖ) является распространенным заболеванием среди мужчин пожилого возраста, которое сильно влияет на их качество жизни, вызывая симптомы со стороны нижних мочевых путей. В настоящее время выявлено несколько факторов риска развития ДГПЖ, которые включают: возраст, генетическую предрасположенность, изменение гормонального фона, наличие воспалительного процесса в предстательной железе (ПЖ), повышение содержания в ней факторов роста клеток, а также образ жизни. В настоящее время для лечения этого заболевания, как правило, применяют α1-адреноблокаторы, М-холиноли-тики, ингибиторы 5α-редуктазы и фосфодиэстеразы-5. Все эти соединения обладают профилем побочных эффектов, заставляющих многих пациентов искать альтернативные методы лечения и использовать лекарства, полученные из растений.
Пермиксон – это гексановый липидостероловый экстракт Serenoa repens, состоящий из смеси свободных и эстерифици-рованных длинноцепочечных жирных кислот, полипренов и фитостеролов. Он обладает специфичностью и селективностью по
Список литературы Пермиксон: место препарата в патогенетической терапии ДГПЖ
- Mobley D, Feibus A, Baum N. Benign prostatic hyperplasia and urinary symptoms: Evaluation and treatment. Postgrad Med 2015; 127: 301-307 DOI: 10.1080/00325481.2015.1018799
- Konwar R, Chattopadhyay N, Bid HK. Genetic polymorphism and pathogenesis of benign prostatic hyperplasia. BJU Int 2008; 102: 536-544 DOI: 10.1111/j.1464-410X.2008.07667.x
- Zeegers MP, Kiemeney LA, Nieder AM, Ostrer H. How strong is the association between CAG and GGN repeat length polymorphisms in the androgen receptor gene and prostate cancer risk? Cancer Epidemiol Biomarkers Prev 2004; 13: 1765-1771.
- Kramer G, Steiner GE, Handisurya A, Stix U, Haitel A, Knerer B, et al. Increased expression of lymphocyte-derived cytokines in benign hyperplastic Prostate tissue, identification of the producing cell types, and effect of differentially expressed cytokines on stromal cell proliferation. Prostate 2002;52(1):43-58. D0I:10.1002/pros.10084
- Park T, Choi JY. Efficacy and safety of dutasteride for the treatment of symptomatic benign prostatic hyperplasia (BPH): a systematic review and meta-analysis. World J Urol 2014; 32: 1093-1105 DOI: 10.1007/s00345-014-1258-9
- Bartsch G, Rittmaster RS, Klocker H. Dihydrotestosterone and the concept of 5alpha-reductase inhibition in human benign prostatic hyperplasia. World J Urol 2002;19: 413-425.
- Gu X, Na R, Huang T, Wang L, Tao S, Tian L, et al. SRD5A1 and SRD5A2 are associated with treatment for benign prostatic hyperplasia with the combination of 5а-reductase inhibitors and а-adrenergic receptor antagonists J Urol 2013;190(2):615-619 DOI: 10.1016/j.juro.2013.03.024
- Ryl A, Rotter I, Grzywacz A, Malecka I, Skonieczna-Zydecka K, Grzesiak K, et al. Molecular Analysis of the SRD5A1 and SRD5A2 Genes in Patients with Benign Prostatic Hyperplasia with Regard to Metabolic Parameters and Selected Hormone Levels. Int J Environ Res Public Health 2017;14(11): 1318-1322 DOI: 10.3390/ijerph14111318
- Hennenberg M1, Stief CG, Gratzke C. Prostatic а1-adrenoceptors: new concepts of function, regulation, and intracellular signaling. Neurourol Urodyn 2014;33(7):1074-1085 DOI: 10.1002/nau.22467
- Latil A, Petrissans MT, Roquet J, Robert G, de la Taille A. Effects of Hexanic extract of Serenoa Repens (Permixon® 160 mg) on Inflammation Biomarkers in The Treatment of Lower Urinary Tract Symptoms Related to benign Prostatic Hyperplasia. Prostate 2015;75:1857-1867 DOI: 10.1002/pros.23059
- Sciarra A, Mariotti G, Salciccia S, Autran Gomez A, Monti S, Toscano V, et al. Prostate growth and inflammation. J Steroid Biochem Mol Biol 2008; 108: 254-260 DOI: 10.1016/j.jsbmb.2007.09.013
- Naber KG, Weidner W. Chronic prostatitisan infectious disease? J Antimicrob Chemother 2000; 46:157-161
- Wang Z, Olumi AF. Diabetes, growth hormone-insulin-like growth factor pathways and asso-ciation to benign prostatic hyperplasia. Differentiation 2011; 82:261-271 DOI: 10.1016/j.diff.2011.04.004
- Van Asseldonk B, Barkin J, Elterman DS. Medical therapy for benign prostatic hyperplasia: a review. Can J Urol 2015;22(Suppl 1):7-17.
- Kahokehr A, Vather R, Nixon A, Hill AG. Non-steroidal antiinflammatory drugs for lower urinary tract symptoms in benign prostatic hyperplasia: systematic review and meta-analysis of randomized controlled trials. BJU Int 2013;111(2): 304-311 DOI: 10.1111/j.1464-410X.2012.11559.x
- Minciullo PL, Inferrera A, Navarra M, Calapai G, Magno C, Gangemi S.Oxidative Stress in Benign.Prostatic Hyperplasia:A Systematic Review. Urol Int 2015;94:249-254 DOI: 10.1159/000366210
- Cornu JN, Cussenot O, Haab F, Lukacs B. A widespread population study of actual medical management of lower urinary tract symptoms related to benign prostatic hyperplasia across Europe and beyond official clinical guidelines. Eur Urol 2010; 58:450-6. doi:10.1016/j.eururo.2010.05.045
- Lukacs B, Cornu JN, Aout M, Tessier N, Hodée C, Haab F, et al. Management of lower urinary tract symptoms related to benign prostatic hyperplasia in real-life practice in France: a comprehensive population study. Eur Uro 2013;64:493-501 DOI: 10.1016/j.eururo.2013.02.026
- Scaglione F, Lucini V, Pannacci M, Dugnani S, Leone C. Comparison of the potency of 10 different brands of Serenoa repens extracts. Eur Rev Med Pharmacol Sci 2012;16:569-574.
- Bayne CW, Donnelly F, Ross M, Habib FK. Serenoa repens (Permixon): a 5alpha-reductase types I and II inhibitor-new evidence in a coculture model of BPH. Prostate 1999;40:232-241.
- Chevalier G, Benard P, Cousse H, Bengone T. Distribution study of radioactivity in rats after oral administration of the lipido/sterolic extract of Serenoa repens (Permixon) supplemented with -lauric acid, -oleic acid or -beta-sitosterol. Eur J Drug Metab Pharmacokinet 1997;22:73-83.
- Di Silverio F, Monti S, Sciarra A, Varasano PA, Martini C, Lanzara S, et al. Effects of long-term treatment with Serenoa repens (Permixon) on the concentrations and regional distribution of androgens and epidermal growth factor in benign prostatic hyperplasia 1998; Prostate 37:77-83.
- Habib FK, Ross M, Ho CK, Lyons V, Chapman K. Serenoa repens (Permixon) inhibits the 5alpha-reductase activity of human prostate cancer cell lines without interfering with PSA expression. Int J Cancer 2005;114:190-194 DOI: 10.1002/ijc.20701
- Dreikorn K, Lowe F, Borkowski A. Other medical therapies. In: Chatelain C, Denis L, Foo KT, Khoury S, McConnell J. Benign prostatic hyperplasia. Plymouth, UK: Health Publica-tions; 2001. p. 481-511.
- Ravenna L, Di Silverio F, Russo MA, Salvatori L, Morgante E, Morrone S, et al. Effects of the lipidosterolic extract of Serenoa repens (Permixon) on human prostatic cell lines. Prostate 1996;29(4):219-30.
- Van Coppenolle F, Le Bourhis X, Carpentier F, Delaby G, Cousse H, Raynaud JP, et al. Pharmacological effects of the lipidosterolic extract of Serenoa repens (Permixon) on rat Prostate hyperplasia induced by hyperprolactinemia: comparison with finasteride. Prostate 2000;43(1):49-58
- Vacher, P., Prevarskaya, N., Skyrma, R., Audy, M.C.,Vacher, A.M., Odessa, M.F. et al. The lipidosterolic extract from Serenoa repens interferes with prolactin receptor signal transduction. JBiomed Sci 1995;2(4):357-365.
- Paubert-Braquet M, Mencia Huerta JM, Cousse H, Braquet P. Effect of the lipidic lipidosterolic extract of Serenoa repens (Permixon) on the ionophore A23187-stimulated production of leukotriene B4 (LTB4) from human polymorphonuclear neutrophils. Prostaglandins LeukotEssent Fatty Acids 1997;57:299-304.
- Vela Navarrete R, Garcia Cardoso JV, Barat A, Manzarbeitia F, Lopez Farre A. BPH and in-flammation: pharmacological effects of Permixon on histological and molecular inflammatory markers.Results of a doubleblind pilot clinical assay. Eur Urol 2003;44:549-55
- Di Silverio F, Gentile V, De Matteis A, et al. Distribution of inflammation, premalignant le-sions, incidental carcinoma in histologically confirmed benign prostatic hyperplasia: a retrospective analysis. Eur Urol 2003;43:164-75.
- Steiner GE, Newman ME, Paikl D, Stix U, Memaran-Dagda N, Lee C, Marberger MJ. Expression and function of proinflammatory inter leukin IL-17 and IL-17 receptor in normal, benign hyperplastic, and malignant Prostate. Prostate 2003; 56:171-182. DOI: 10.1002/pros.10238
- Кудрявцев Ю.В., Сивков А.В., Разумов С.В., Медведев А.А., Кочетов С.А. Морфологические изменения в ткани предстательной железы больных с доброкачественной гиперплазией предстательной железы при лечении пермиксоном. Урология 2004;(5):10-11
- Sirab N, Robert G, Fasolo V,Descazeaud A, Vacherot F, de la Taille, et al. Lipidosterolic extract of Serenoa repens modulates the expression of inflammation related-genes in benign prostatic hyperplasia epithelial and stromal cells. Int J Mol Sci 2013; 14:14301-14320. doi: 10.3390/ijms140714301
- De la Taille A.Therapeutic Approach: The Importance of сontrolling Prostatic Inflammation. Eur Urol Suppl 2013; 12(5): 116-122 DOI: 10.1016/j.eursup.2013.08.003
- Latil A, Pétrissans MT, Rouquet J, de la Taille A. Effects of hexanic extract of Serenoa repens (Permixon® 160 mg) on inflammation biomarkers in the treatment of lower urinary tract symptoms related to benign prostatic hyperplasia. Prostate 2015;75(16):1857-1867 DOI: 10.1002/pros.23059
- Kyprianou N, Tu H, Jacobs SC. Apoptotic versus proliferative activities in human benign prostatic hyperplasia. Hum Pathol 1996;27: 668-675.
- Bayne CW, Ross M, Donnelly F, Habib FK. The selectivity and specificity of the actions of the lipido-sterolic extract of Serenoa repens (Permixon) on the prostate. J Urol 2000;164:876-881.
- Vacherot F, Azzouz M, Gil-Diez-De-Medina S, Colombel M, De La Taille A, Lefrère Belda MA, et al. Induction of apoptosis and inhibition of cell proliferation by the lipido-sterolic extract of Serenoa repens (LSESr, Permixon in benign prostatic hyperplasia). Prostate 2000;45:259-266.
- Vela-Navarrete R, Escribano-Burgos M, Farre AL, Garcia-Cardoso J, Manzarbeitia F, Carras-co C. Serenoa repens treatment modifies bax/bcl-2 index expression and caspase-3 activity in prostatic tissue from patients with benign prostatic hyperplasia. J Urol 2005;173:507-510 DOI: 10.1097/01.ju.0000150533.94952.25
- Dathe G, Schmid H. Phytotherapie der benignen Prostata hyperplasie (BPH) mit Extractum Serenoa repens (Permixon®). Urologie 1991;31:220-223
- Stepanov VN, Siniakova LA, Sarrazin B, Raynaud JP. Efficacy and tolerability of the lipidos-terolic extract of Serenoa repens (Permixon®) in benign prostatic hyperplasia: a double-blind com-parative study of two dosage regimens. Adv Ther 1999;16:231-241.
- Authié, D., Cauquil, J. Appréciation de l’efficacité de Permixon® en pratique quotidienne. C R Ther Pharmacol Clin 1987; 56:4-13.
- Foroutan F. Wirksamkeit und Vertraglichkeit von Permixon® bei einem grosseren Patienten-kollektiv (592 Patienten) unter Praxisbedingungen. J Urol Urogynakol 1997;2:17-21.
- Лопаткин Н.А, Пытель Ю.А., Сивков А.В., Винаров А.З., Гориловский Л.М., Медведев А.А. Результаты долгосрочного применения Пермиксона® у больных с симптомами нарушения функции нижних мочевых путей, обусловленными доброкачественной гиперплазией предстательной железы. Урология 2004; (2):3-7
- Сивков А.В. Пермиксон: механизм действия, клиническая эффективность и место в ле-чении ДГПЖ. В кн.: Доброкачественная гиперплазия предстательной железы. , М.: 1999, С. 117-133.
- Аляев Ю.Г., Винаров А.З., Локшин К.Л., Спивак Л.Г. Пятилетний опыт лечения пермиксоном (Serenoa repens, "Pierre Fabre Medicament") больных гиперплазией простаты. Урология 2002;(1):23-25.
- Винаров А.З. Медикаментозное лечение больных гиперплазией предстательной железы: Автореф. дис.. докт. мед. наук. М.: 1999. 40 с.
- Plosker G.L. and Brogden R.N. Serenoa repens (Permixon®). A review of its pharmacology and therapeutic efficacy in benign prostatic hyperplasia. Drugs Aging 1996;9:379-395.
- Descotes JL, Rambeaud JJ, Deschaseaux P, Faure G. Placebo-controlled evaluation of the effi-cacy and tolerability of Permixon® in benign prostatic hyperperplasia after exclusion of placebo responders. Clin Drug Invest 1995;9:291-297.
- Cukier J, Ducassou J, Le Guillou M,, Leriche A, Lobel B, Toubol J. Permixon versus place-bo, resultats d'une étude multicentrique. Comptes Rend Ther Pharmacol Clin 1985; 4:15-21
- Champault G, Patel JC, Bonnard AM. A double-blind trial of an extract of the plant Serenoa repens in benign prostatic hyperplasia. Br J Clin Pharmac 1984; 18: 461-462.
- Carraro JC, Raynaud JP, Koch G, Chisholm GD, Di Silverio F, Teillac P, et al. Comparison of phytotherapy (Permixon®) with finasteride in the treatment of benign Prostate hyperplasia: a ran-domized international study of 1,098 patients. Prostate 1996; 29: 231-240.
- Grasso M, Montesano A, Buonaguidi A, Castelli M, Lania C, Rigatti P, et al, Comparative ef-fects of alfuzosin versus Serenoa repens in the treatment of symptomatic benign prostatic hyper-plasia. Arch Esp de Urol 1995;48:97-103.
- Debruyne F, Koch G, Boyle P, Da Silva FC, Gillenwater JG, Hamdy FC, et al. Comparison of a phytotherapeutic agent (Permixon) with an alpha-blocker (Tamsulosin) in the treatment of benign prostatic hyperplasia: a 1-year randomized international study. Eur Urol. 2002;41(5):497-506.
- Debruyne F, Boyle P, Da Silva FC, Gillenwater JG, Hamdy FC, Perrin P, et al. Evaluation of the clinical benefit of Permixon® and Tamsulosin® in severe BPH Patients -PERMAL Study Subset Analysis. Eur Urol 2004; 45:773-780 DOI: 10.1016/j.eururo.2004.01.015
- Adriazola Semino M, Lozano Ortega JL, Garcia Cobo E, Tejada Banez E, Romero Rodriguez F. Symptomatic treatment of benign prostatic hypertrophy. Comparative study of prazosin and Serenoa repens. Arch Esp Urol 1992;45:211-213
- Boyle P, Robertson C, Lowe F, Roehrborn C. Updated meta-analysis of clinical trials of Serenoa repens extract in the treatment of symptomatic benign prostatic hyperplasia. BJU Int 2004;93:751-756 DOI: 10.1111/j.1464-410X.2003.04735.x
- D’Ottavio G, Lagana A, Zappavigna D. Changes in seminal parameters after long-term treat-ment with Serenoa repens. Urologia 1987;54:616-621.
- Magri V, Trinchieri A, Pozzi G, Restelli A, Garlaschi MC, Torresani E, et al. Efficacy of repeated cycles of combination therapy for the eradication of infecting organisms in chronic bacte-rial prostatitis. Int J Antimicrob Agents. 2007; 29: 549-556. doi: 0.1016/j.ijantimicag.2006.09.027
- Stamatiou K, Pierris N. Serenoa repens extract additionally to quinolones in the treatment of chronic bacterial prostatitis. The preliminary results of a long term observational study. Arch Ital Urol Androl 2013; 85,(4):190-196 DOI: 10.4081/aiua.2013.4.190
- Busetto GM, Giovannone R, Ferro M, Tricarico S, Del Giudice F, Matei DV, et al. Chronic bacterial prostatitis: efficacy of shortlasting antibiotic therapy with prulifloxacin (Unidrox®) in association with saw palmetto extract, lactobacillus sporogens and arbutin (Lactorepens®). BMC Urology 2014;14:53 DOI: 10.1186/1471-2490-14-53
- Novara G, Giannarini G, Alcaraz A, Co 'zar-Olmo JM, Descazeaud A, Montorsi F, et al. Efficacy and Safety of Hexanic Lipidosterolic Extract of Serenoa repens (Permixon) in the Treatment of Lower Urinary Tract Symptoms Due to Benign Prostatic Hyperplasia: Systematic Review and Metaanalysis of Randomized Controlled Trials. Bur Urol Focus 2016;2(5): 553-554 DOI: 10.1016/j.euf.2016.04.002


