Персонализированное 3D-моделирование артериального русла для выполнения сосудисто-ориентированной расширенной лимфодиссекции при колоректальном раке
Автор: Ефетов С.К., Рычкова А.К., Хлусов Д.И., Секачева М.И., Хоробрых Т.В.
Журнал: Московский хирургический журнал @mossj
Рубрика: Онкология
Статья в выпуске: 2 (88), 2024 года.
Бесплатный доступ
Введение. В хирургическом лечении колоректального рака лимфодиссекция имеет ключевое значение.Цель исследования. Определить преимущества персонализированного 3D-моделирования мезентериальных сосудов для выполнения сосудисто-ориентированной расширенной лимфодиссекции при колоректальном раке.Материалы и методы. Пациентам с верифицированной аденокарциномой ободочной или прямой кишки проводилось построение 3D-моделей сосудистого русла брыжейки. На предоперационном этапе оценивались типы строения верхней брыжеечной артерии (ВБА) и нижней брыжеечной артерии (НБА). Было проведено сравнение времени операции и количества удаленных лимфоузлов между группами с применением 3D-КТ и без применения 3D-КТ.Результаты. В исследование включены 146 пациентов с колоректальным раком. Строение НБА по типу Е1 было выявлено у 28 (41,1 %) пациентов, Е2 у 3 (4,4 %), Е3 у 6 (8,8 %), К-тип у 11 (16,2 %), а Н-тип у 20 (29,5%). Для ВБА наличие правой ободочной артерии зафиксировано в 5 (22,7 %) случаях. Средняя ободочная артерия отсутствовала у одного пациента (5,5 %). Средняя продолжительность операции значительно не различалась в группах с 3D-КТ и без 3D-КТ. Количество удаленных лимфоузлов было больше в группах, где применялось 3D-КТ (26±13 и 19±7, p value = 0.00139 для рака левой половины, и 41±26 и 17±5, p value function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
3d-моделирование, колоректальный рак, лимфодиссекция, нижняя брыжеечная артерия, верхняя брыжеечная артерия
Короткий адрес: https://sciup.org/142241732
IDR: 142241732 | УДК: 617-089 | DOI: 10.17238/2072-3180-2024-2-52-61
Текст научной статьи Персонализированное 3D-моделирование артериального русла для выполнения сосудисто-ориентированной расширенной лимфодиссекции при колоректальном раке
Сосудисто-ориентированная лимфодиссекция предполагает выполнение операции с использованием четких анатомических ориентиров, которыми выступают ветви брыжеечных сосудов и/или их основание. Данные об индивидуальном строении артерий и вен пациента позволяют также применять сосудосберегающую методику, при которой, несмотря на расширенную лимфодиссекцию, становится возможным сохранить кровоснабжение кишки вне границ резекции удаляемого участка кишки с опухолью. Такая технология осуществима благодаря приему скелетизации – методике выделения сосудов из окружающей жировой клетчатки до адвентициального слоя нижней брыжеечной артерии (НБА) или верхней брыжеечной артерии (ВБА). Однако строение мезентериальных сосудов очень вариативно, а техника сосудисто-ориентированной лимфодиссекции отличается в зависимости от типа строения артерий. Для уменьшения поисковых и тракционных движений хирургов во время операции, важно еще на дооперационном этапе определить строение сосудов. На основании КТ-исследований с внутривенным контрастированием возможно построить 3D-реконструкции сосудов, изучение которых позволяет с высокой точностью идентифицировать строение артерий и вен каждого пациента в предоперационном периоде.
Материалы и методы
Исследование носит одноцентровой проспективный обсервационный характер. В исследование включены пациенты с аденокарциномой ободочной или прямой кишки, которым выполнялась компьютерная томография органов брюшной полости с внутривенным контрастированием в предоперационном периоде. Также критерием включения пациентов в исследование являлось запланированное резекционное вмешательство с сосудисто-ориентированной расширенной лимфодиссекцией с радикальными намерениями.
Из вошедших в исследование 146 пациентов из клиники факультетской хирургии № 2 им. Г.И. Лукомского Сеченовского университета, 90 пациентам рутинно проводилось построение трехмерных реконструкций сосудистого русла. Остальным 56 пациентам предоперационное моделирование сосудистого русла не выполнялось. В соответствии с этим критерием было сформировано две группы для изучения результатов лечения.
Каждому пациенту была произведена компьютерная томография органов брюшной полости (КТ ОБП) c внутривенным усилением в виде неионного мономерного йодсодержащего контрастного вещества препаратом Омнипак с содержанием 350 мг/мл йода (в форме йогексола) на компьютерном томографе Aquillion One (Toshiba, Япония). При планировании сосудисто-ориентированной лимфодиссекции на предоперационном этапе у пациентов из группы с 3D с помощью трехмерных реконструкций выполнялось персонализированное изучение строения брыжеечных сосудов. В построении трехмерной модели и изучении сосудистой анатомии одного пациента принимали участие два хирурга. Снимки КТ ОБП проанализированы с помощью программ Osirix Dicom Viewer (Pixmeo SARL, Женева, Швейцария) и Horos (GNU Lesser General Public License, Version 3). Для получения трехмерных изображений высокой точности использовалось приложение Volume Rendering 3D (трехмерное преобразование изображений) с целью определения сосудистой анатомии.
В зависимости от расположения опухоли изучалось строение верхних или нижних брыжеечных сосудов на построенных 3D-реконструкциях. Оценивались следующие параметры для бассейна нижней брыжеечной артерии: расстояние от основания НБА до отхождения левой ободочной артерии (ЛОА); тип ветвления НБА по предложенной ранее классификации [1]; расположение ЛОА относительно нижней брыжеечной вены (НБВ); наличие дополнительных сосудов.
Для бассейна верхней брыжеечной артерии изучалось: расстояние от основания средней ободочной артерии (СОА) до подвздошно-ободочной артерии (ПОА); наличие правой ободочной артерии (ПрОА); отсутствие СОА; расположение ПОА относительно верхней брыжеечной вены (ВБВ).
Информация, полученная при изучении сосудов на 3D-моделях в предоперационном периоде, вносилась хирургами в соответствующие бумажные формы. На них были отражены варианты строения ветвей НБА или ВБА, тип взаиморасположения артерии и вены, расстояния интересующих промежутков. Во время оперативного вмешательства, после выполнения этапа скелетизации сосудистого русла, производилась оценка соответствия строения сосудов с полученными ранее данными. В каждом случае проводилась фотофиксация сосудов до их пересечения.
Для статистической обработки данных производился подгрупповой анализ в соответствии с локализацией опухолевого процесса и использованием 3D-реконструкций на доопера-ционном этапе:
– группа А: рак нисходящей ободочной, сигмовидной или прямой кишки с построением 3D-моделей анатомии сосудов НБА на дооперационном этапе;
– группа Б: рак нисходящей ободочной, сигмовидной или прямой кишки без построения 3D-моделей анатомии сосудов НБА;
– группа В: рак слепой и восходящей ободочной кишки с построением 3D-моделей анатомии сосудов ВБА на доопера-ционном этапе;
– группа Г: рак слепой и восходящей ободочной кишки без построения 3D-моделей анатомии сосудов ВБА.
Было проведено сравнение продолжительности оперативного вмешательства и количества удаленных лимфоузлов между группами А и Б, а также между группами В и Г соответственно.
Соответствие изученных хирургами предоперационных трехмерных реконструкций сосудов с интраоперационными данными оценивали с помощью коэффициента внутриклассовой корреляции. Чувствительность и специфичность совпадения результатов подтверждена коэффициентом tau-b Кендалла, где 1 – полное совпадение. Для сравнения интраоперационных результатов и количества удаленных лимфоузлов между двумя группами использовался критерий Манна-Уитни для независимых выборок, p < 0,005.
Результаты
В период с мая 2022 по май 2023 г. было прооперировано 146 пациентов, из которых 44 пациента с локализацией опухоли в правых отделах и 102 пациента с локализацией опухоли в левых отделах ободочной кишки. Исследованные группы статистически значимо не отличались по полу, возрасту и частоте встречаемости стадий заболевания (табл.1).
Результаты дооперационного исследования мезентериальных сосудов с помощью 3D-моделей показали, что Е1-тип строения НБА встречается чаще всего, а правая ободочная артерия присутствует у малого количества пациентов (табл. 2).
Примеры построения 3D-реконструкций сосудов и соответствующие им интраоперационные снимки представлены на рисунках 1 и 2.
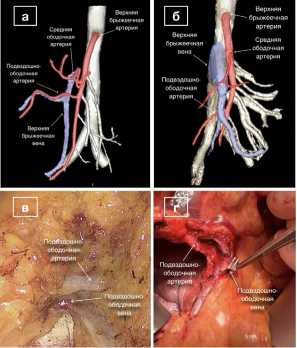
Рис. 1. Строение ВБА на 3D-реконструкциях и соответствующие интраоперационные фотографии: а, в – ВБВ располагается позади подвздошно-ободочной артерии, правая ободочная артерия отсутствует; б, г – ВБВ располагается спереди от подвздошно-ободочной артерии, правая ободочная артерия отсутствует
Fig. 1. Anatomy of the SMA on 3D-reconstructions and corresponding intraoperative images: a, c – SMV is located behind the ileocolic artery, the right colic artery is absent; b, d – SMV is located in front of the ileocolic artery, right colic artery is absent
Таблица 1
Сравнительная характеристика групп
Comparative characteristics of groups
Table 1
|
Характеристики пациентов/ Patient characteristics |
Показатель/ Indicator |
||
|
3D-КТ на дооперационном этапе (n=90)/ 3D-CT at preoperative stage |
Без 3D-КТ на дооперационном этапе (n=56)/ Without 3D-CT at preoperative stage |
p value |
|
|
Пол (Мужской/Женский)/ Gender (Male/Female) |
54/36 |
29/27 |
0,949* |
|
Возраст/ Age |
63±11 |
65±12 |
0,487** |
|
Опухоль правой половины ободочной кишки/левой половины ободочной и прямой кишки/ Tumor of the right colon/left colon and rectum |
22/68 |
22/34 |
0,573** |
|
Стадии по TNM для рака правой половины ободочной кишки n (%)/ TNM stages of cancer of the right colon n (%) |
|||
|
I–II |
7 (31,8) |
6 (27,2) |
0,472*** |
|
III |
13 (59,0) |
11 (50,0) |
0,488*** |
|
IV |
2 (9,2) |
5 (22,8) |
0,488*** |
|
Стадии по TNM для рака левой половины ободочной и прямой кишки n (%)/ TNM stages of cancer of the left colon and rectum n (%) |
|||
|
I–II |
14 (20,6) |
6 (17,6) |
0,484*** |
|
III |
45 (66,2) |
14 (41,2) |
0,496*** |
|
IV |
9 (13,2) |
14 (41,2) |
0,488*** |
*p – value рассчитан с помощью t-критерия Стьюдента для независимых величин;
**p – value рассчитан с помощью хи-квадрата для категориальных переменных;
***p – value рассчитан с помощью критерия Манна-Уитни
Таблица 2
Данные о строении сосудов, полученные при изучении 3D-реконструкций
Vessel’s anatomy data, obtained from the examination of 3D-reconstructions
Table 2
|
Исследуемая характеристика/ Examined characteristics |
n |
% |
|
Тип нижней брыжеечной артерии/ Inferior mesenteric artery type |
||
|
Е1-тип E1-type |
28 |
41,1 |
|
Е2-тип E2-type |
3 |
4,4 |
|
Е3-тип E3-type |
6 |
8,8 |
Продолжение Таблицы 2
|
К-тип K-type |
11 |
16,2 |
|
Н-тип H-type |
20 |
29,5 |
|
Взаиморасположение артерии и вены/ Artery-vein relationship |
||
|
Левая ободочная артерия вентрально относительно нижней брыжеечной артерии/ Left colic artery ventrally to the inferior mesenteric vein |
48 |
70,6 |
|
Левая ободочная артерия дорсально относительно нижней брыжеечной вены/ Left colic artery dorsally to the inferior mesenteric vein |
20 |
29,4 |
|
Наличие добавочных сосудов/ Presence of accessory vessels |
||
|
Добавочная почечная артерия Accessory renal artery |
3 |
4,4 |
|
Тип верхней брыжеечной артерии/ Superior mesenteric artery type |
||
|
Наличие правой ободочной артерии/ Presence of the right colic artery |
5 |
22,7 |
|
Отсутствие средней ободочной артерии Absence of the middle colic artery |
1 |
5,5 |
|
Взаиморасположение артерии и вены/ Artery-vein relationship |
||
|
Подвздошно-ободочная артерия вентрально относительно верхней брыжееной вены/ Ileocolic artery ventrally to the superior mesenteric vein |
9 |
40,9 |
|
Подвздошно-ободочная артерия дорсально относительно верхней брыжееной вены/ Ileocolic artery dorsally to the superior mesenteric vein |
13 |
59,1 |
|
Правая ободочная артерия вентрально относительно верхней брыжеечной вены/ Right colic artery ventrally to the superior mesenteric vein |
3 |
60,0 |
|
Правая ободочная артерия дорсально относительно верхней брыжеечной вены/ Right colic artery dorsally to the superior mesenteric vein |
2 |
40,0 |
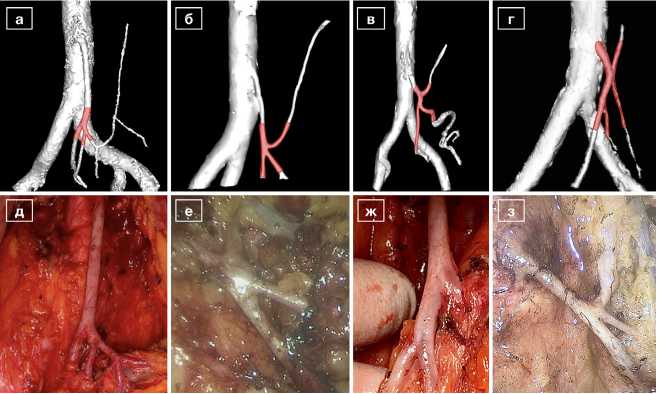
Рис. 2. Типы строения НБА на 3D-реконструкциях и соответствующие интраоперационные фотографии: а, д – Н-тип; б, е – К-тип; в, ж – Е1-тип; г, з – Е2-тип
Fig. 2. Anatomy types of the IMA on 3D-reconstructions and corresponding intraoperative images: a, e – H-type; b, f – K-type; c, g – E1-type; d, h – E2-type
Среднее значение расстояния от основания НБА до ЛОА составило 4,1 ± 0,67 см. При локализации опухоли в правых отделах ободочной кишки были выполнены измерения расстояния между СОА и ПОА, среднее значение которого составило 3,8 ± 0,59 см. Полученные измерения были использованы хирургом для определения расстояния, на протяжении которого следовало скелетизировать артерию до отхождения первой сосудистой ветви, для выполнения сосудисто-ориентированной лимфодиссекции.
Было также выявлено и впоследствии подтверждено интраоперационно наличие у трех пациентов добавочной почечной артерии: левой (n=2) (рис. 3.) и правой (n=1).
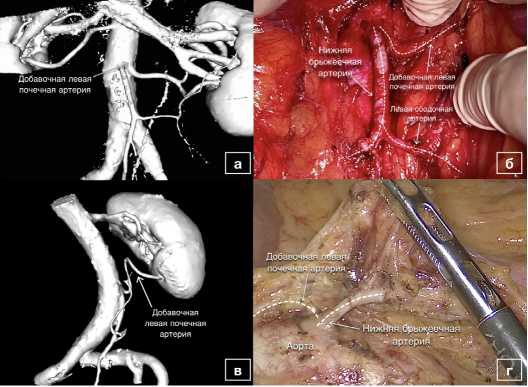
Рис. 3. Наличие добавочной почечной артерии вблизи основания НБА на 3D-реконструкциях и на соответствующих интраоперационных изображениях:
а, в – 3D-модель наблюдения с добавочной левой почечной артерией;
б, г – интраоперационный снимок при лапароскопическом доступе
Fig. 3. Presence of the accessory renal artery near the root of the
IMA on 3D-reconstructions and on the corresponding intraoperative images: a, c – 3D-model of the left accessory renal artery; b, d – intraoperative image at laparoscopic approach
Внутриклассовый коэффициент корреляции показал высокий уровень соответствия предоперационных 3D-реконструкций сосудов, интерпретируемых хирургами, с интраоперационными данными (ICС = 0,97; p < 0,001). Коэффициент корреляции при этом был оценен с помощью критерия tau-b Кендалла. Он показал высокую степень соответствия результатов, полученных при построении предоперационных 3D-реконструкций русла ВБА и НБА, с интраоперационными данными (CC = 0,795; p < 0,001). Всего был 1 случай несоответствия при изучении трехмерных моделей ВБА и 3 случая несоответствия для НБА. Случаи несоответствия наблюдались при ошибочной интерпретации трехмерных изображений хирургами, которые могли быть связаны с низким качеством проведенных предоперационных исследований.
Как показали представленные нами данные, средняя продолжительность оперативного вмешательства по поводу рака левой половины ободочной и прямой кишки значительно не различалась (табл. 3.) в группах с применением 3D-КТ сосудов НБА и без применения 3D-КТ (260±92 и 247±78, p value = 0.36317). То же самое можно сказать и про время операции с расположением опухоли в правой половине ободочной кишки (245±88 и 226±48, p value = 0.32636). Однако при изучении препаратов на прижизненном патолого-анатомическом исследовании были получены статистически значимые результаты, где количество удаленных лимфатических узлов было больше в группах, где проводилось изучение трехмерных реконструкций сосудов (26±13 и 19±7, p value = 0.001 для рака левой половины, и 41±26 и 17±5, p value <0.001 для рака правой половины соответственно).
Решение о конверсии доступа в нижнесрединную лапаротомию было принято в 3-х случаях: 1 случай в группе Б, 1 случай в группе Г, и 1 случай в группе А, в связи с техническими трудностями, обусловленными выраженным висцеральным ожирением, приведшем к невозможности адекватно визуализировать мобилизацию прямой кишки.
Обсуждение
Применение 3D-КТ ангиографии на дооперационном этапе при хирургическом лечении колоректального рака отражено в более ранних работах по поводу изучения вариативной анатомии НБА [2] и ВБА [3]. Посредством построения 3D-реконструкций возможно выявление различных вариаций расположения сосудов с целью стандартизации их анатомии, что представляет значимость при правосторонних локализациях опухоли ободочной кишки, так как правая ободочная артерия может отсутствовать [4]. В нашем исследовании правая ободочная артерия была обнаружена лишь у 5 пациентов из 22 с правосторонней локализацией опухоли. В данных публикациях также зафиксировано, что верхняя брыжеечная вена чаще располагается спереди от подвздошно-ободочной артерии. Мы получили похожие результаты, где вена располагалась спереди от подвздошноободочной артерии в 59,1 % случаев.
Наши результаты показывают, что 3D-КТ можно применить в клинической практике для улучшения хирургического лечения колоректального рака. Рутинное изучение трехмерных моделей сосудистого русла в нашем случае привело к улучшению качества лимфодиссекции, а именно, увеличению количества лимфоузлов в препарате. Отсутствие разницы в длительности оперативных вмешательств между группами с применением 3D-КТ и без применения 3D-КТ может быть связано с высоким уровнем хирургических навыков у хирургов, выполняющих операции. Наши данные включают в себя персонализированное изучение русла ВБА и НБА, измерение межсосудистых расстояний, идентификацию добавочных сосудов при планировании дальнейшей лимфодиссекции, а также оценку степени соответствия полученных результатов с интраопера- ционными данными, что в совокупности в литературе еще не было отражено.
Таблица 3
Интра- и постоперационные результаты
Intra- and postoperative results
Table 3
|
Характеристика/ Characteristics |
Группа А (3D-КТ)/ Group A (3D-CT) |
Группа Б (без 3D-КТ)/ Group B (without 3D-CT) |
p value |
Группа В (3D-КТ)/ Group C (3D-CT) |
Группа Г (без 3D-КТ)/ Group D (without 3D-CT) |
p value |
|
Среднее время операции (мин)/ Mean operation time (min) |
260±92 |
247±78 |
0.36317 |
245±88 |
226±48 |
0.32636 |
|
Среднее количество удаленных лимфоузлов/ Mean number of harvested lymph nodes |
26±13 |
19±7 |
0.00139 |
41±26 |
17±5 |
<0.00001 |
|
Несостоятельность анастомоза/ Anastomosis failure |
1 |
1 |
0 |
0 |
Впервые использование анатомических трехмерных моделей упоминается еще в 1978 году [5], когда C. Alberti предложил идею воспроизведения пластиковых трехмерных срезов, отсканированных с помощью КТ исследования. В то время не было доступных систем быстрого прототипирования (RP) и 3D-печати, однако фрезерование было возможно.
Одним из прообразов применения трехмерных реконструкций был способ коррозионного литья, который применялся на трупном материале. С его помощью удалось изучить калибр, длину и положение желудочно-ободочного ствола Генле [6]. С тех пор трехмерные реконструкции стали активно использоваться в медицине, а первое применение данного метода на практике было зафиксировано в челюстно-лицевой хирургии и ортопедической стоматологии [7], тогда как в хирургии брюшной полости технологии 3D-реконструкций начали применяться значительно позже [8].
Сейчас, для того чтобы построить трехмерную модель, необходимо выполнение компьютерной томографии с внутривенным контрастированием, на основе которой и выполняется реконструкция посредством различных программ (zioM900 Version2, ZIO software; Hyper Accuracy 3D, MEDICS; AquariusNET thin-client viewer, TeraRecon).
Хирургам в повседневной практике приходится иметь дело с вариативной, порой редкой анатомией, что подчеркнул в своем исследовании T. Sueda [9], где при построении трехмерной реконструкции была выявлена редкая венозная мальформация – шунт Ретциуса от НБВ к нижней полой вене у пациента с раком прямой кишки. В дальнейшем была выполнена лапароскопическая передняя резекция прямой кишки с пересечением шунта и НБА. Определение такой анатомической аберрации необходимо до проведения оперативного вмешательства, так как позволяет предупредить непреднамеренное повреждение сосуда.
В литературе описаны и другие особенности мезентериального русла, которые встречались у пациентов с колоректальным раком, такие как: аневризма ВБВ, связанная с желудочно-ободочным стволом Генле, а также отхождение нижней брыжеечной артерии от верхней брыжеечной [10–11]. Среди проанализированных 3D-КТ исследований 90 пациентов в нашем случае были обнаружены следующие особенности мезентериального русла: 3 добавочные почечные артерии у трех разных пациентов, а также отсутствие средней ободочной артерии у одного пациента.
Определение строения сосудистого русла особенно важно, когда опухоль располагается в селезеночном изгибе ободочной кишки. В такой ситуации при планировании Д3 лимфодис-секции необходимо ориентироваться как на НБА, так и на ВБА, т.е. осуществлять двунаправленную лимфодиссекцию. Bjarte в своей публикации от 2022 года с помощью построения 3D-моделей брыжеечных сосудов измерил разницу в уровне отхождения СОА и НБА, называя данный параметр «брыжеечной межартериальной лестницей» [12]. По мнению авторов на это следует ориентироваться при резекции селезеночного изгиба и выполнении лимфодиссекции для уменьшения поисковых и тракционных движений во избежание повреждения брыжейки тонкой кишки.
Идентификация сосудов более успешна, когда хирурги используют трехмерные реконструкции сосудов в качестве «карты» во время оперативного вмешательства [13]. При этом, как показано в исследовании, значительно снижается частота интраоперационных кровотечений, связанных с диссекцион-ными маневрами, а также сокращается продолжительность оперативного вмешательства.
Точность построения 3D-изображений и 3D-печатных моделей продемонстрирована на примере бассейна ВБА и ВБВ с измерениями межсосудистых расстояний на дооперационном и интраоперационном этапах по поводу рака правых отделов ободочной кишки. Оценивались соответствия размеров ВБА и ВБВ между 3D-изображениями, 3D-стереолитографическими печатными моделями и интраоперационными измерениями. Измерения показали соответствие артериальных расстояний с трехмерными изображениями и печатными моделями. Однако при сравнении межвенозных расстояний не удалось определить соответствия, что по мнению авторов отражает изменчивый характер вен in situ [14].
Заключение
Метод дооперационного 3D-КТ моделирования мезентериального русла улучшает интраоперационную навигацию благодаря высокоточному определению строения ВБА и НБА, идентификации добавочных сосудов, реальному представлению о межсосудистых расстояниях. Также это позволяет улучшить качество выполняемой лимфодис-секции, повышая количество удаленных лимфатических узлов в препарате.
Список литературы Персонализированное 3D-моделирование артериального русла для выполнения сосудисто-ориентированной расширенной лимфодиссекции при колоректальном раке
- Царьков П.В., Ефетов С.К., Зубайраева А.А., Пузаков К.Б., Оганян Н.В. Роль хирурга в определении анатомии нижней брыжеечной артерии по данным компьютерной томографии при лечении колоректального рака. Хирургия. Журнал им. Н.И. Пирогова, 2022 № (9). С. 40-49. https://doi.org/10.17116/hirurgia202209140
- Murono K., Kawai K., Kazama S., Ishihara S., Yamaguchi H., Sunami E., Kitayama J., Watanabe T. Anatomy of the Inferior Mesenteric Artery Evaluated Using 3-Dimensional CT Angiography. Diseases of the Colon & Rectum, 2015, № 58(2), рp. 214-219. https://doi.org/10.1097/DCR.0000000000000285
- Wu C., Ye K., Wu Y., Chen Q., Xu J., Lin J., Kang W. Variations in right colic vascular anatomy observed during laparoscopic right colectomy. World J Surg Oncol., 2019, Jan 12; № 17(1), рр. 16. https://doi.org/10.1186/s12957-019-1561-4
- Miyamoto R., Tadano S.., Sano N, Inagawa S., Adachi S., Yamamoto M. The impact of three-dimensional reconstruction on laparoscopic-assisted surgery for right-sided colon cancer. Wideochir Inne Tech Maloinwazyjne, 2017, Sep; № 12(3), рр. 251-256. https://doi.org/10.5114/wiitm.2017.67996
- Alberti C., Three-dimensional CT and structure models. British Journal of Radiology, 1980, Volume 53, № 627, рр. 261-262. https://doi.org/10.1259/0007-1285-53-627-261-b
- Ignjatovic D., Stimec B., Finjord T. et al. Venous anatomy of the right colon: three-dimensional topographic mapping of the gastrocolic trunk of Henle. Tech Coloproctol, 2004, Mar; № 8(1), рр. 19-22. https://doi.org/10.1007/s10151-004-0045-9
- Hemmy D.C., Zonneveld F.W., Lobregt S., Fukuta K. A decade of clinical three-dimensional imaging: a review. Part I. Historical development. Invest Radiol., 1994, Apr; № 29(4), рр. 489-496. https://doi.org/10.1097/00004424-199404000-00019
- Shuhaiber J.H. Augmented reality in surgery. Arch Surg., 2004, Feb; № 139(2), рр. 170-174. https://doi.org/10.1001/archsurg.139.2.170
- Sueda T., Tei M., Furukawa H., Matsumura T., Koga C., Wakasugi M., Miyagaki H., Kawabata R., Shimizu J., Okada A., Hasegawa J. Surgical treatment of rectal cancer with a Retzius shunt: a case report. Surg Case Rep., 2019, Feb 18; № 5(1), рр. 25. https://doi.org/10.1186/s40792-019-0583-z
- Kiil S., Stimec B.V., Spasojevic M., Fasel J.H., Ignjatovic D. 3D for D3: Role of Imaging for Right Colectomy in a Case with Congenital Superior Mesenteric Vein Aneurysm and Co-Existing Anomalous Irrigation. Chirurgia, 2013, № 108(2), рр. 256-258
- Korai T., Okita K., Nishidate T., Okuya K., Akizuki E., Sato Y., Hamabe A., Kyuno D., Ishii M., Miura R., Imamura M., Nagayama M., Murakami T., Nobuoka T., Ito T., Takemasa I. Laparoscopic low anterior resection for rectal cancer wherein the inferior mesenteric artery arose from the superior mesenteric artery: a case report. Surg Case Rep., 2021, Aug 11; № 7(1), рр. 179. https://doi.org/10.1186/s40792-021-01254-z
- Andersen B.T., Stimec B.V., Kazaryan A.M., Rancinger P., Edwin B., Ignjatovic D. Re-interpreting mesenteric vascular anatomy on 3D virtual and/or physical models, part II: anatomy of relevance to surgeons operating splenic flexure cancer. Surg Endosc., 2022, Dec; № 36(12), рр. 9136-9145. https://doi.org/10.1007/s00464-022-09394-5
- Mari F.S., Nigri G., Pancaldi A., De Cecco C.N., Gasparrini M., Dall’Oglio A., Pindozzi F., Laghi A., Brescia A. Role of CT angiography with three-dimensional reconstruction of mesenteric vessels in laparoscopic colorectal resections: a randomized controlled trial. Surg Endosc., 2013, Jun; № 27(6), рр. 2058-2067. https://doi.org/10.1007/s00464-012-2710-9
- Luzon J.A., Andersen B.T., Stimec B.V., Fasel J.H.D., Bakka A.O., Kazaryan A.M., Ignjatovic D. Implementation of 3D printed superior mesenteric vascular models for surgical planning and/or navigation in right colectomy with extended D3 mesenterectomy: comparison of virtual and physical models to the anatomy found at surgery. Surg Endosc., 2019, Feb; № 33(2), рр. 567-575. https://doi.org/10.1007/s00464-018-6332-8


