Перспективный фотосенсибилизатор для антимикробной фотодинамической терапии
Автор: Страховская Марина Глебовна, Беленикина Наталья Серафимовна, Никитина Валентина Васильевна, Коваленко Светлана Юрьевна, Коваленко Илья Борисович, Аверьянов Александр Вячеславович, Рубин Андрей Борисович, Галочкина Татьяна Владимировна
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 1 (13), 2013 года.
Бесплатный доступ
Показана высокая антимикробная активность и широкий спектр действия фотосенсибилизатора из класса поликатионных металлофталоцианинов. Установлено, что эффективная фотодинамическая инактивация бактерий в присутствии фотосенсибилизатора поликатионной природы определяется его электростатическим связыванием с отрицательно заряженными структурами клеточных стенок бактерий. Полученные результаты обсуждаются с точки зрения перспектив применения антимикробной фотодинамической терапии в медицинской практике.
Фотосенсибилизатор, активные формы кислорода, антимикробная фотодинамическая терапия
Короткий адрес: https://sciup.org/14338444
IDR: 14338444
Текст научной статьи Перспективный фотосенсибилизатор для антимикробной фотодинамической терапии
Фотодинамическая инактивация микроорганизмов, в основе которой лежат цитотоксические свойства активных форм кислорода (АФК), генерируемых красителями-фотосенсибилизаторами в фотовозбужденном состоянии, открыта более ста лет назад. Однако лишь в последние два десятилетия исследования в этой области получили активное развитие, что обусловлено ростом антибиотикорезистент-ности и необходимостью разработки альтерна- тивных способов борьбы с возбудителями инфекционных заболеваний. В отличие от антибиотиков, каждый из которых специфически воздействует на определенную мишень в микробной клетке: клеточную стенку, цитоплазматическую мембрану, репликацию ДНК, транскрипцию или трансляцию белков, АФК вызывают неспецифическое повреждение всех клеточных компонентов, потенциально подверженных окислительным реакциям [1]. Множе- ственный характер окислительной деструкции микробных клеток-мишеней затрудняет выработку устойчивости к последующим циклам фотодинамических воздействий.
Фундаментальное различие в чувствительности грамположительных и грамотрицатель-ных бактерий к фотосенсибилизации связывают с принципиальными различиями в строении клеточных стенок этих двух групп бактерий [2]. Общепринято, что важнейшей структурой, отвечающей за общую устойчивость грамотрица-тельных бактерий к различным внешним агентам (антибиотикам, детергентам, красителям), является наружная мембрана, входящая в состав клеточной стенки. В основе наружной мембраны лежит двухслойная асимметричная структура, внешний слой которой состоит преимущественно из липополисахаридов (ЛПС, 2-3,5 х 10 6 молекул/клетку), которые занимают около 75% площади поверхности клетки, и встроенных между ЛПС белковых комплексов [3]. Суммарный отрицательный заряд ЛПС связан с высоким содержанием отрицательно заряженных групп в центральной части этих макромолекул – остатками фосфорной кислоты в D-глюкозамине липида А и/или гептозах кора, карбоксильными группами остатков 3-де-зокси-D-манно-октулозоновой кислоты (КДО) и кислых сахаров кора (галактозы, глюкуроновой кислоты). У грамотрицательных бактерий существуют пути модификации ЛПС, приводящие к уменьшению плотности отрицательных зарядов на поверхности клеток [4]: присоединение положительно заряженных групп (фосфо-этаноламина, аминоарабинозы, глюкозамина) к липиду А и гептозам кора, а также дефосфорилирование этих компонентов ЛПС.
Повышение чувствительности грамотрица-тельных бактерий к фотосенсибилизации имеет место при их дополнительной обработке заряженными поликатионными соединениями [5]. Под воздействием поликатионов происходит высвобождение ЛПС, дезинтеграция наружной мембраны и увеличение ее проницаемости для красителей. Поликатион может быть также использован как наноноситель антибактериальных препаратов, повышающий избирательность их действия за счет электростатического взаимодействия с клеточной стенкой бактерий. Подобные подходы лежат в основе сенсибилизации бактерий с помощью полимиксина, а также использования конъюгатов анионных красителей с полилизином для повышения их фотобактерицидной активности. В то же время и сами молекулы красителей одновременно с ядром – генератором активных форм кислорода, могут нести положительно заряженные заместители, повышающие эффективность взаимодействия фотосенсибилизатора с бактериальной клеткой-мишенью. К таким фотосенсибилизаторам относятся поликатионные фталоцианины, с высокой эффективностью генерирующие синглетный кислород и показавшие высокую эффективность на бактериальной биолюминесцентной тест-системе [6, 7]. В настоящей работе мы приводим данные по антимикробной активности одного из наиболее перспективных соединений – октакатионного фталоцианина цинка.
Материалы и методы исследования
Объектами исследования служили: эталонные штаммы грамположительных бактерий Staphylococcus aureus ATCC 25923 и Streptococcus pyogenes 151 БГСА, а также грамот-рицательных бактерий Escherichia coli ATCC 25922, Pseudomonas aeruginosa ATCC 27853, Campylobacter jejuni NCTC 11635, Helicobacter pylori NCTC 11639, Salmonella enteritidis 1742; клинические изоляты бактерий, среди которых имелись возбудители инфекций кожи и слизистых, и раневых инфекций ( S. aureus, S. pyogenes, E. coli, P. aeruginosa ); виды, вызывающие поражения слизистых желудочно-кишечного тракта ( C. jejuni, H. pylori, S. enteritidis, E. сoli, Serratia marcescens, Proteus mirabilis ). Для культивирования бактерий применяли соответствующие среды: Columbia Agar с добавлением 5% (об/об) или 10% (об/об) бараньей крови, Columbia Agar с добавлением 7% (об/об) лизированной лошадиной крови и Trypcase Soya Agar ("bioMerieux", Франция). Бактерии выращивали в течение суток в термостате при 37°С. Микроаэрофильные штаммы C. jejuni и H. pylori выращивали в анаэ-ростатах в среде с 5% кислорода в течение 4-х суток при 37°С. Материал агаровых культур суспендировали в растворе для инфузий, содержащем 0,9% хлорида натрия, до показателя мутности 1,0 McF с использованием денситометра "Densimat" ("bioMerieux", Франция).
Облучение проводили с использованием источника холодного белого света ЭКОМП (50 мВт/см2) или светодиодного источника красного света с максимумом испускания 684 нм и интенсивностью излучения на уровне образца 20 мВт/см2.
Для определения количества красителя окта-кис(холинил)-фталоцианина цинка, связавшегося в процессе инкубации с бактериальными клетками, раствор красителя в 0,9% NaCl или суспензию бактерий (108 КОЕ/мл) в 0,9% NaCl с той же концентрацией красителя инкубировали при комнатной температуре и пропускали через фильтры с диаметром пор 0,2 мкм ("Sarstedt", Австрия). Количество связавшегося красителя рассчитывали по разнице поглощения фильтратов, учитывая, что для используемого красителя молярный коэффициент поглощения в максимуме ε 683=190000 М-1 см-1.
Поверхностный дзета-потенциал бактериальных клеток измеряли на приборе Zetasizer Nano Z (Malvern Instruments Ltd).
Каждый эксперимент проводили не менее трех-пяти раз. Данные представлены в виде средних значений исследуемых величин ± стандартное отклонение.
В работе использовали реактивы фирмы Sigma (Сент-Луис, США), а также фотосенсибилизатор октакис(холинил)-фталоцианин цинка, синтезированный в ФГУП ГНЦ «НИО-ПИК».
Результаты и обсуждение
При исследовании спектра антимикробной активности октакис(холинил)-фталоцианина цинка были определены минимальные подавляющие рост микроорганизмов концентрации препарата (МПК90) эталонных и клинических штаммов грамположительных и грамотрица-тельных бактерий. МПК90 для клинических видов грамположительных бактерий составляла 0,25-0,30 мкг/мл, а для эталонных штаммов – менее 0,25 мкг/мл при дозе облучения красным светом 5 Дж/см2 (табл.).
Октакис(холинил)-фталоцианин цинк проявлял высокую фотодинамическую активность также в отношении грамотрицательных бактерий, хотя и меньшую по сравнению с грампо-ложительными штаммами. МПК90 в зависимости от вида грамотрицательных бактерий колебалась в достаточно широких пределах – 0,4-2,5 мкг/мл (табл.). Наиболее низкая активность фотосенсибилизатора выявлена в отношении Klebsiella spp. и Proteus mirabilis (МПК90 2,1-2,5 мкг/мл).
Таким образом, антимикробная фотодинамическая активность октакис-(холинил)фта-лоцианина цинка проявляется в отношении различных видов бактерий, в том числе клини- ческих штаммов грамотрицательных бактерий и MRSA штамма золотистого стафилококка. Полученные данные позволяют считать, что данный фотосенсибилизатор имеет широкий спектр антимикробной активности и перспективен для АФДТ различных бактериальных заражений. Однако при этом обнаружена значительная гетерогенность бактериальных штаммов в отношении чувствительности к фотодинамической инактивации, которая наблюдалась как между штаммами одного вида (эталонный штамм АТСС 25922 и клинический изолят E. coli), так и между различными видами (табл., рис. 1).
Известно, что среди различных штаммов бактерий имеется значительная гетерогенность строения олигосахаридов липида А и
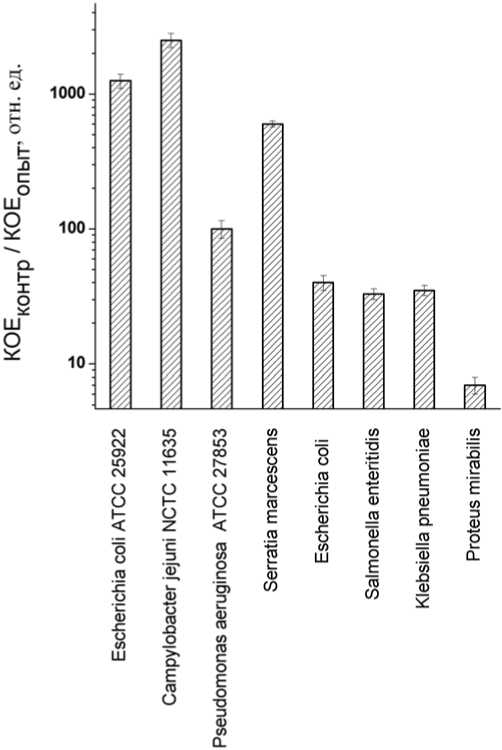
Рис. 1. Эффективность фотодинамической инактивации по тесту уменьшения колониеобразующей способности (КОЕконтр/КОЕопыт) различных штаммов бактерий после 10 мин инкубации суспензий с исходной плотностью108 КОЕ/мл в 0,9% NaCl с 1 мкМ октакис(холинил)-фталоцианина цинка и облучения белым светом в дозе 9 Дж/см2.
Таблица
Активность in vitro октакис(холинил)-фталоцианина цинка
(минимальная подавляющая рост концентрация МПК90, мкг/мл) в отношении различных штаммов бактерий при облучении дозой красного света 684 нм 5 Дж/см2
Повышенное сродство октакатионного фталоцианинового фотосенсибилизатора к клеткам S. marcescens является, очевидно, следстви-
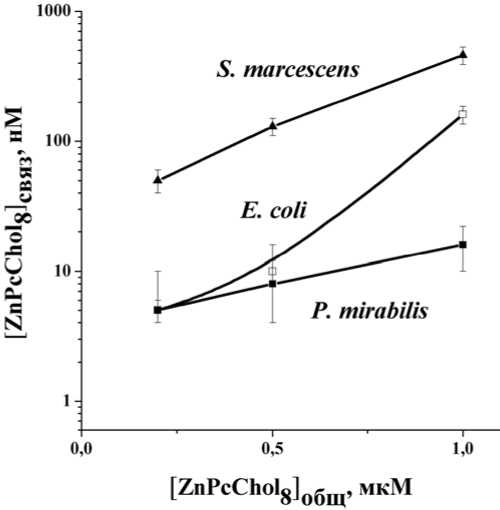
Рис. 2. Связывание октакис(холинил)-фталоцианина цинка клетками различных видов бактерий (108 КОЕ/мл в 0,9% NaCl). Количество связанного красителя [ZnPcChol8]связ рассчитано по разнице поглощения красителя (ε683 = 190000 М-1см-1) в фильтратах его бесклеточных растворов – [ZnPcChol8]общ и клеточных суспензий после 10 мин инкубации – [ZnPcChol8]своб ем отсутствия положительно заряженных заместителей в ЛПС этого вида. Напротив, показано, что липид А ЛПС S. marcescens содержит два глюкозаминовых остатка, каждый из которых фосфорилирован, т.е. несет отрицательный заряд.
Таким образом, катионные фотосенсибилизаторы более эффективно взаимодействуют с бактериальными клетками, ЛПС которых несут большее количество отрицательно заряженных групп. Из рис. 3 видно, что при связывании октакатионного фталоцианина с клетками E.coli происходит нейтрализация отрицательного заряда клеток. Таким образом, механизмом, обеспечивающим связывание катионных фотосенсибилизаторов микробными клетками, является электростатическое взаимодействие положительно заряженных заместителей в молекулах фотосенсибилизатора с отрицательно заряженными центрами связывания на клеточных стенках.
Заключение
Ключевыми параметрами, определяющими, какие из клеточных компонентов или метаболических процессов будут повреждены или инактивированы в процессе АФДТ, а также общую эффективность поражения бактериальных клеток, являются сродство фотосенсибилизатора к клеткам-мишеням и кинетика его захвата с прокрашиванием клеточного объема. Это, в свою очередь, зависит от заряда молекул фотосенсибилизатора. Условием эффективной прямой фотодинамической инактивации является тесная ассоциация фотосенсибилизатора с биологической мишенью, что следует из малого (10-50 нм) диффузионного радиуса синглетного кислорода в биологической среде [1, 5]. Цитоплазматическая мембрана бактерий отделена от внешней среды клеточной стенкой толщиной от 10 до 80 нм в зависимости от видовой принадлежности. Отрицательный заряд клеточных стенок бактерий обусловливает электростатическое связывание с ними катионных соединений. Фотобактерицидная активность октакис(холинил)-фталоцианина цинка определяется наличием восьми катионных заместителей на периферии молекулы.
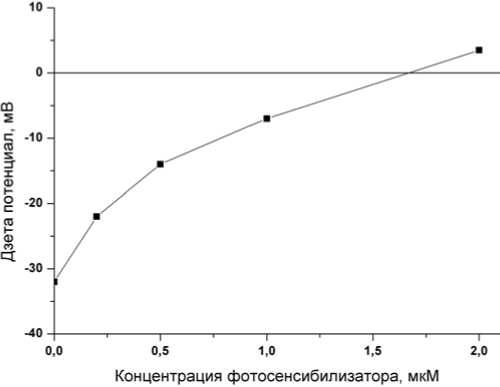
Рис. 3. Нейтрализация поверхностного заряда (дзета-потенциала) клеток Escherichia coli возрастающими концентрациями фотосенсибилизатора октакис(холинил)-фталоцианина цинка.
В заключение отметим, что фотодинамическая инактивация микроорганизмов может являться перспективным методом терапии инфекций, вызванных полирезистентными бактериальными штаммами, а также применяться в целях фотообеззараживания различных предметов и сред медицинского назначения.
Список литературы Перспективный фотосенсибилизатор для антимикробной фотодинамической терапии
- Jori G., Brown S.B. Photosensitized inactivation of microorganisms. Photochem Photobiol Sci 2004; 3: 403-405.
- Nitzan Y., Gutterman M., Malik Z., et al. Inactivation of gram-negative bacteria by photosensitized porphyrins. Photochem Photobiol 1992; 55: 89-96.
- Raetz C.R., Ulevitch R.J., Wright S.D., et al. Gram-negative endotoxin: an extraordinary lipid with profound effects on eukaryotic signal transduction. FASEB J 1991; 5: 2652-60.
- Raetz C.R., Reynolds C.M., Trent M.S. et al. Lipid A modification systems in gram-negative bacteria. Annu Rev Biochem 2007; 76: 295-329.
- Hamblin M.R., Hasan T. Photodynamic therapy: a new antimicrobial approach to infectious disease? Photochem Photobiol Sci 2004; 3: 436-450.
- Макаров Д.А., Кузнецова Н.А., Страховская М.Г. и др. Поликатионные фталоцианины цинка и алюминия: синтез, влияние степени замещения на физико-химические свойства и фотодинамическую активность в водной среде. Журнал физической химии 2009; 6: 1183-1190.
- Kuznetsova N.A., Yuzhakova O.A., Strakhovskaya M.G., et al. New heterogeneous photosensitizers with phthalocyanine molecules covalently linked to aminopropyl silica gel. Journal of Porphyrins and Phthalocyanines 2011; 15: 718-726.


