Перспективный штамм 14-3 Pseudomonas chlororaphis для микробиологической защиты сои от фузариоза
Автор: Курилова Д.А., Маслиенко Л.В.
Рубрика: Защита растений и иммунология
Статья в выпуске: 3 (167), 2016 года.
Бесплатный доступ
С целью создания эффективного бактериального микробиопрепарата проведён ступенчатый скрининг коллекционных бактериальных штаммов родов Pseudomonas и Bacillus из коллекции лаборатории биометода ВНИИМК к патогенному изоляту возбудителя фузариоза Fusarium sporotrichioides Sherb. В результате отобран наиболее эффективный бактериальный штамм-продуцент микробиопрепарата 14-3 Pseudomonas chlororaphis. Установлена высокая биологическая эффективность штамма 14-3 P. chlororaphis на фоне искусственного заражения возбудителем фузариоза в лабораторных условиях методом агаровых блоков (52,2 %) ив почве (20,3 %), а также в поле на мелкоделяночных опытах (25,7 %). Доказано ростостимулирующее влияние штамма 14-3 на проростки сои: увеличение длины корня на 17,5 % и массы корня - на 13,3 %. Изучен механизм действия бактерии-антагониста в отношении фитопатогенного гриба F. sporotrichioides, который заключается в синтезе антибиотических веществ, разрушающих мицелий патогена на 7-10-е сутки. Максимальное количество антифунгальных веществ в супернатанте жидкой культуры штамма 14-3 образуется через 72-96 ч культивирования. Разработаны элементы технологии производства и применения опытного образца бактериального микробиопрепарата на основе штамма-продуцента 14-3 P. chlororaphis, согласно которым глубинное культивирование следует осуществлять в течение 72 ч на пептон-дрожжевой питательной среде, Чапека или Кинга В при температуре 25-30 °С, кислотность среды должна быть в пределах 5-10, в качестве источников углеродного питания можно использовать глюкозу, сахарозу, глицерин или мелассу, азотного питания - дрожжевой экстракт или пептон; норма расхода для обработки семян сои составляет 2,0 л/т.
Фузариоз, соя, антагонизм, бактерии, штамм, микробиопрепарат, скрининг, механизм взаимодействия, антибиотическая активность, периодическое культивирование
Короткий адрес: https://sciup.org/142151320
IDR: 142151320 | УДК: 632.937:633.853.52
Текст научной статьи Перспективный штамм 14-3 Pseudomonas chlororaphis для микробиологической защиты сои от фузариоза
Введение . Фузариоз является одной из наиболее вредоносных болезней сои. Существует несколько типов проявления этой болезни: гибель точки роста, пятнистость листьев, загнивание бобов и семян, но наиболее распространёнными являются гниль корней и трахеомикозное увядание растений. Проявления фузариоза зависят от физиологического состояния растений, степени их устойчивости, инфекционной нагрузки, специфической физиологической активности возбудителя (быстрота роста, образования токсинов, ферментов и т. д.) [1– 4].
Наиболее интересным подходом в борьбе с фузариозными заболеваниями растений является использование живых культур микроорганизмов [5]. Важную роль в борьбе с фузариозом играют бактерии, которые имеют ряд преимуществ перед грибными антагонистами благодаря быстрому размножению, высокой воспроизводимости популяции в ризосфере и устойчивости к фунгицидам [6]. Многие бактерии продуцируют антибиотики, подавляющие или замедляющие рост и развитие фитопатогенов [7; 8]. Также доказано ростостимулирующее влияние бактерий на растения благодаря способности синтезировать ауксины, цитокинины и гиббереллиноподобные вещества [9– 11].
Грамотное и своевременное применение микробиологических средств защиты растений на фоне высокой агротехники может значительно улучшить фитосани-тарную обстановку в посевах и существенно увеличить урожай, поскольку микробиопрепараты обладают специфичностью и сложными механизмами действия на растения и других членов агроценозов, способны решить проблему резистентности популяций фитопатогенов к пестицидам. Поэтому разработка эффективного и экологически безопасного бактериального микробиологического препарата для снижения вредоносности фузариоза сои является актуальной.
Материалы и методы . Объектом исследований служили: штаммы бактерий - антагонистов возбудителей болезней масличных культур, тест - культура возбудителя фузариоза сои Fusarium sporotrichioides Sherb. , опытные образцы микробиопрепаратов, районированные сорта сои.
Активные штаммы антагонистов фитопатогенов наращивали на подобранных питательных средах. Титр лабораторных образцов микробиопрепаратов во всех опытах определяли методом Коха [12]. Защитный эффект жидких культур (ЖК) и водных суспензий (ВС) штаммов-антагонистов для прорастающего семени сои и подбор оптимальных норм их применения определяли на фоне искусственного заражения семян сои F. sporotrichioides Sherb в лабораторных условиях во влажной камере методом агаровых блоков при 25 °С [13]. Контроль – семена без обработки биопрепаратами без внесения инфекции и с инфекцией. Биологическую эффективность штаммов-антагонистов на фоне искусственного заражения почвы фузариозом проводили в вегетационных сосудах, содержащих смесь почвы и песка (в соотношении 3:1), в каждый рядок вносили по 5,0 г инокулюма. После внесения патогена осуществляли высев семян сои (5 штук в рядок), обработанных ЖК и ВС штаммов-антагонистов. Опыт проводили при температуре +25 °С. Для определения эффективности обработки семян сои опытными образцами микробиопрепаратов в полевых условиях против фу-зариоза, посев мелкоделяночных опытов осуществляли 4-рядной селекционной сеялкой СКС-6А с междурядьями 70 см. Густота стояния 250–300 тыс. раст./га. Площадь делянки 14 м2, повторность 3-кратная. Учёты поражения сои фуза- риозом проводили по разработанной нами шкале [14].
Биологическую эффективность опытных образцов микробиопрепаратов определяли по формуле [15]:
C = 1 О О •х (а - b ) а , где C - биологическая эффективность, %;
a - количество больных растений в контроле;
b - количество больных растений в варианте.
Механизм взаимодействия бактериального штамма - антагониста с возбудителем фузариоза сои изучали модифицированным методом двойных культур [16]. Наблюдения за развитием патогена и антагониста проводили ежедневно с помощью светового микроскопа.
Результаты и обсуждение . С целью создания эффективного бактериального микробиопрепарата нами ранее было протестировано 26 бактериальных штаммов - антагонистов фитопатогенов, представленных родами Pseudomonas и Bacillus , из коллекции лаборатории биометода ВНИИМК. На первом этапе скрининга бактерий с антагонистическим действием к возбудителю фузариоза сои F. sporotrichioides Sherb. при двух температурных режимах 25 и 10 ºС наибольшую эффективность показали три штамма: 12 -2 Pseudomonas sp. , 14-3 P. chlororaphis и Б -5 B. licheniformis [17].
Следующий этап скрининга заключался в изучении влияния указанных перспективных бактериальных штаммов-антагонистов возбудителей фузариоза на культуру сои. Исследования показали, что тестируемые штаммы не оказывают негативного влияния на всхожесть семян и не вызывают увядания проростков. Более того, отмечено ростостимулирующее влияние перспективных штаммов-антагонистов на проростки, в особенности на длину и массу корня. Максимальное увеличение длины корня наблюдалось у штамма 14-3 P. chlororaphis (на 17,5 %), максимальное увеличение мас- сы корня - у 12-2 Pseudomonas sp. (на 20,0 %) и 14-3 P. chlororaphis (на 13,3 %). Влияние штаммов-антагонистов на длину и массу стебля также отмечено, но в меньшей степени [18].
Определение защитного эффекта перспективных штаммов - антагонистов на прорастающие семена сои, а также отработку оптимальных норм расхода опытных образцов микробиопрепаратов проводили в условиях влажной камеры . Испытывались нормы расхода от 0,5 до 3,0 л/т (табл . 1).
Таблица 1
Биологическая эффективность обработки семян сои сорта Ника опытными образцами микробиопрепаратов на фоне искусственного заражения в лабораторных условиях
|
Вариант |
Норма расхода, л/т |
Поражено фузарио-зом, % |
Биологиче ская эффективность, % |
|
Контроль без инфекции |
- |
37,3 |
- |
|
Контроль + инфекция |
- |
58,6 |
- |
|
ТМТД, эталон, ВСК |
6,0 |
20,0 |
65,9 |
|
12-2 Pseudomonas sp ., ЖК |
0,5 |
41,4 |
29,9 |
|
1,0 |
20,0 |
65,9 |
|
|
2,0 |
54,7 |
6,6 |
|
|
14-3 P. chlororaphis , ЖК |
1,0 |
29,4 |
49,8 |
|
2,0 |
28,0 |
52,2 |
|
|
3,0 |
46,7 |
20,3 |
|
|
Б-5 B. licheniformis , ЖК |
1,0 |
36,0 |
38,6 |
|
2,0 |
32,0 |
45,4 |
|
|
3,0 |
30,7 |
47,6 |
Примечание: ВСК - водно-суспензионный кон центрат, ЖК - жидкая культура
На фоне поражения фузариозом в контроле 58,6 % максимальная биологическая эффективность установлена у штаммов 12-2 Pseudomonas sp. с нормой расхода 1,0 л/т (65,9 %), 14-3 P. chloro-raphis с нормой расхода 2,0 л/т (52,2 %) и Б-5 B. licheniformis с нормой расхода 3,0 л/т (47,6 %). Данные нормы расхода опытных образцов микробиорепаратов признаны оптимальными и использовались во всех последующих опытах.
Следующим этапом вторичного скрининга было определение эффективности опытных образцов микробиопрепаратов на фоне искусственного заражения семян сои возбудителем фузариоза в почве в лабораторных условиях. Биологическая эффективность испытываемых штаммов-продуцентов, на жёстком фоне поражения фузариозом в контроле 78,7 %, составила от 1,8 до 20,3 % при биологической эффективности химического эталона ТМТД, ВСК - 13,6 %. Максимальную биологическую эффективность проявил штамм 14-3 P. chlororaphis - 20,3 % (табл. 2).
Таблица 2
Биологическая эффективность обработки семян сои сорта Славия опытными образцами микробиопрепаратов на фоне искусственного заражения почвы
|
Вариант |
Титр, КОЕ/мл |
Норма расхода, л/т |
Поражено проростков, % |
Биологи-ческая эффек-тив-ность, % |
|
Контроль без инфекции |
- |
- |
7,8 |
- |
|
Контроль с инфекцией |
- |
- |
78,7 |
- |
|
Эталон ТМТД, ВСК |
- |
6,0 |
68,0 |
13,6 |
|
12-2 Pseudomonas sp., ЖК |
7,4 х 1012 |
1,0 |
73,3 |
6,9 |
|
14-3 P . chlororaphis, ЖК |
5,8 х 1012 |
2,0 |
62,7 |
20,3 |
|
Б-5 B. licheniformis , ЖК |
3,0 х 1010 |
3,0 |
77,3 |
1,8 |
Примечание: ВСК - водно-суспензионный концентрат, ЖК - жидкая культура
Следующим этапом скрининга стало испытание штаммов-продуцентов на естественном фоне заражения возбудителем фузариоза в полевых условиях на мелко-деляночных опытах (табл. 3).
На фоне поражения сои фузариозом в контроле 49,1 % максимальная биологическая эффективность отмечена при обработке семян опытными образцами микробиопрепаратов на основе штаммов 14-3 P chlororaphis (25,7 %) и 12-2 Pseudomonas sp. (23,4 %) при эффективности химического эталона ТМТД 10,8 %. Существенный сохранённый урожай полу- чен в вариантах со штаммами 14-3 P. chlororaphis и Б-5 B. licheniformis (0,15 т/га).
Таблица 3
Биологическая эффективность обработки семян сои сорта Альба опытными партиями микробиопрепаратов против фузариоза в полевых условиях
|
Вариант |
Норма расхода, л/т |
Поражено фуза-рио-зом (2 + 3 балла), % |
Биоло-гичес-кая эффек-тив-ность, % |
Урожай-ность, т/га |
Сохранён-ный урожай, т/га |
|
Контроль, б/о |
- |
49,1 |
- |
1,64 |
- |
|
ТМТД, ВСК, эталон |
6,0 |
43,8 |
10,8 |
1,77 |
0,13 |
|
12-2 Pseudomonas sp. , ЖК |
1,0 |
37,6 |
23,4 |
1,70 |
0,06 |
|
14-3 P. chlo-roraphis, ЖК |
2,0 |
36,5 |
25,7 |
1,79 |
0,15 |
|
Б-5 B. licheni-formis , ЖК |
3,0 |
48,1 |
2,0 |
1,79 |
0,15 |
|
НСР 05 |
0,13 |
Примечание: ВСК - водно-суспензионный концентрат, ЖК - жидкая культура
Объединив весь спектр полученных в результате ступечатого скрининга данных, наиболее эффективным признан штамм 14-3 Pseudomonas chlororaphis , обеспечивающий защиту семян и проростков сои на жёстком фоне искусственного заражения возбудителем фузариоза во влажной камере и в почве, а также в полевых условиях, активно колонизирующий корень, одновременно оказывающий ростостимулирующее влияние на культуру сои [17; 19].
Разработка эффективных микробиопрепаратов для защиты растений от болезней предполагает изучение механизмов взаимодействия штаммов-продуцентов с патогенами. При изучении взаимодействия штамма-продуцента микробиопрепарата 14-3 P. chlororaphis с возбудителем фузариоза сои F. sporotri-chioides морфологические изменения мицелия патогена отмечены на пятые сутки совместной инкубации: задержка в росте мицелия патогена по сравнению с контролем. На седьмые сутки патоген в контроле занял всю площадь питательной среды, тогда как в варианте с антагонистом только 50 %, при этом диаметр антибиотической зоны составил 28 мм. Вблизи зоны наблюдалось угнетение, частичный лизис и морфологические изменения мицелия патогенного гриба. К десятым суткам совместного культивирования диаметр антибиотической зоны несколько уменьшился и составил 26 мм, оставшись неизменным (рис. 1).

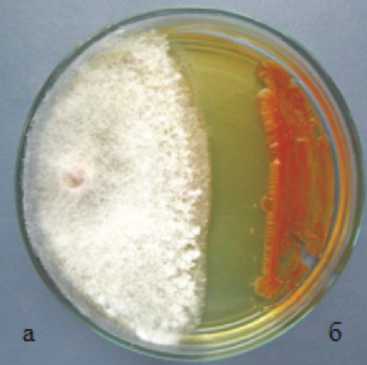
Рисунок 1 – Влияние штамма 14-3 P. chlororaphis на возбудителя фузариоза сои F. sporotrichioides на десятые сутки инкубации (ориг.):
1 – чистая культура патогенного гриба;
2 – патогенный изолят возбудителя фузариоза (а) + бактериальный штамм антагониста (б)
При микроскопировании мицелия патогена на пятые сутки совместной инкубации наблюдалось нехарактерное интенсивное ветвление гиф (рис . 2.1). Кроме того, в отличие от контроля (рис . 2.2), где субстратный мицелий имел прямонаправленный рост, в варианте с антагонистом, ранее нормально сформированные гифы патогена изменяли направление своего роста в стороны. Большая часть свежеобразованных гиф патогена вместо продвижения вперёд по субстрату тянулась вверх, активно формируя воздушную часть мицелия. Также отмечена задержка удлинения апикальных гиф, которые истончались к концу и отличались меньшим диаметром.
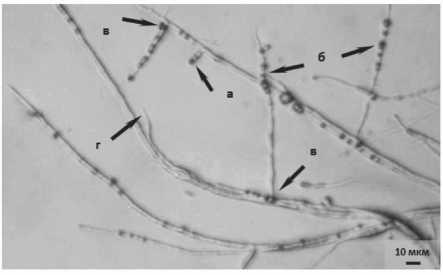
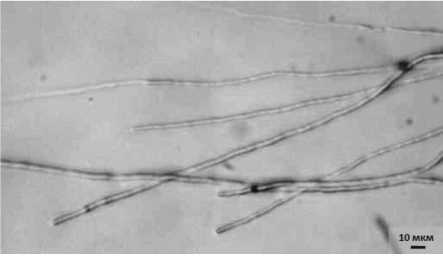
Рисунок 2 – Мицелий возбудителя фуза-риоза сои F. sporotrichioides на пятые сутки инкубации (ориг.):
1 – совместно с антагонистом 14-3 P. chlororaphis :
а – задержка удлинения апикальных гиф;
б – интенсивное ветвление гиф;
в – изменение направления роста; г – истончение апикальных гиф; 2 – без антагониста (контроль)
На седьмые сутки совместной инкубации отмечалась агрегация мицелия пато- гена в тяжи – плотные и однородные сплетения гиф. Более того, отдельные тяжи скручивались в огромные бесформенные узлы (рис. 3.1). При этом в контрольном варианте наблюдался нормальный рост и развитие мицелия гриба (рис. 3.2).
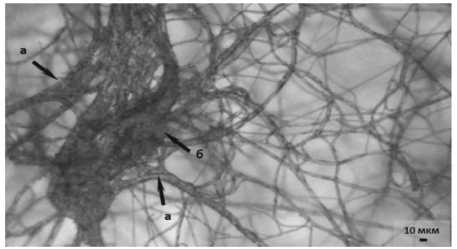
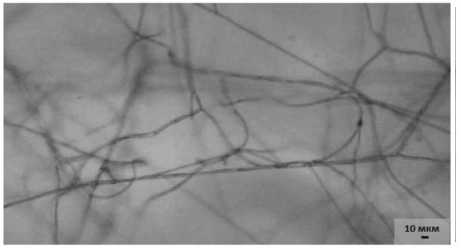
Рисунок 3 – Мицелий возбудителя фуза-риоза сои F. sporotrichioides на седьмые сутки инкубации (ориг.):
1 – совместно с антагонистом 14-3 P. chlororaphis : а – агрегация мицелия патогена в тяжи; б – сплетение тяжей в узел;
2 – без антагониста (контроль)
К десятым суткам совместного культивирования вблизи антибиотической зоны наблюдалась деградация мицелия патогена. Отдельные гифы патогена в тяжах разрывались, вследствие чего происходил распад узлов и гибель мицелия (рис . 4.1).
На пятнадцатые сутки культивирования вблизи зоны взаимодействия деградация и гибель мицелия патогена усугублялась .
Таким образом, нами установлено, что исследуемый бактериальный штамм 14-3 P. chlororaphis обладает фунгистатиче-ским антибиотическим антагонизмом, то есть способен выделять антибиотические вещества, под воздействием которых происходит ингибирование роста колонии патогена с образованием между ними пустой, «стерильной» зоны .
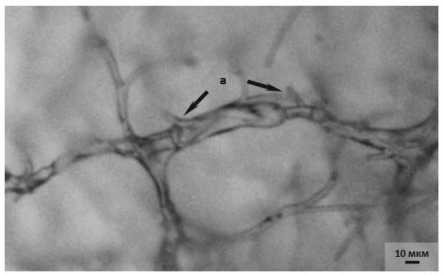
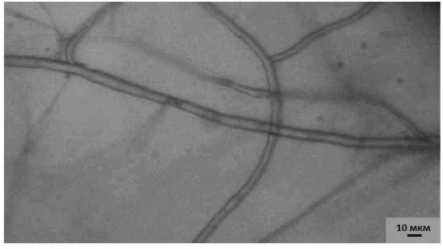
Рисунок 4 – Мицелий возбудителя фуза-риоза F. sporotrichioides на десятые сутки культивирования (ориг.):
1 – совместно с антагонистом 14-3 P. chlororaphis : а – разрыв отдельных гиф патогена; 2 – контроль (без антагониста)
Антибиотическую активность штамма - продуцента микробиопрепарата 14 -3 P. chlororaphis к возбудителю фузариоза F. sporotrichioides определяли в зависимости от срока периодического культивирования штамма на жидкой среде Кинга В методом диффузии в агар. Установлено, что максимальная антибиотическая активность штамма 14 - 3 к возбудителю фузарио-за сои отмечена на третьи сутки периодического культивирования. Действие антифунгальных веществ фильтрата жидкой культуры штамма - антагониста при культивировании в течение 8–48 ч активно преодолевалось патогеном уже к третьим суткам инкубации. Максимальная концентрация антибиотических веществ, оказывающих стойкое сдерживающее действие на патоген, образовалась в культуральной жидкости штамма через 72–96 ч культивирования и сохранялась неизменной до конца эксперимента (рис . 5) [19].

Рисунок 5 – Ингибирование роста патогенного изолята возбудителя фузариоза в зависимости от срока периодического культивирования бактериального штамма - антагониста 14 -3 P. chlororaphis на 15 - е сутки инкубации:
а – контроль ( F. sporotrichioides ) без добавления ЖК штамма 14-3; б – тест-объект + ЖК штамма 14-3 при культивировании в течение 72 ч;
в – тест-объект + ЖК штамма 14-3 при культивировании в течение 96 ч
Для производства эффективного микробиопрепарата необходимо получение культуры с высокой плотностью микробных клеток в сочетании с максимальной концентрацией антифунгальных веществ. С этой целью изучали физиологические признаки перспективного штамма 1 4-3 P. chlo-roraphis : оптимальные питательные среды, источники углеродного и азотного питания, температуру культивирования и кислотность среды. В результате исследований установлено, что при производстве микробиопрепарата на основе бактериального штамма 14 -3 P. chlororaphis глубинное культивирование следует осуществлять на пептон - дрожжевой питательной среде, Чапека или Кинга В при температуре 25– 30 оС, кислотность среды должна быть в пределах 5–10, в качестве источников углеродного питания можно использовать глюкозу, сахарозу, глицерин или мелассу, азотного питания – дрожжевой экстракт или пептон [19].
Выводы. В результате ступенчатого скрининга отобран перспективный бактериальный штамм-продуцент микробио- препарата 14-3 P. chlororaphis, обеспечивающий эффективную защиту семян и проростков сои на жёстком фоне искусственного заражения возбудителем фуза-риоза, а также на естественном фоне поражения в полевых условиях, обладающий ростостимулирующим влиянием на проростки сои. Изучен механизм действия штамма-продуцента 14-3 P. chloro-raphis в отношении фитопатогенного гриба F. sporotrichioides, который заключается в синтезе антибиотических веществ, разрушающих мицелий патогена на 7–10 сутки. Разработаны элементы технологии производства и применения лабораторного образца бактериального микробиопрепарата на основе штамма-продуцента 14-3 P. chlororaphis.
Список литературы Перспективный штамм 14-3 Pseudomonas chlororaphis для микробиологической защиты сои от фузариоза
- Соя: биология и технология возделывания/Под ред. В.Ф. Баранова, В.М. Лукомца. -Краснодар: Изд-во «Советская Кубань», 2005. -433 с.
- Билай В.И., Гвоздяк Р.И., Скрипаль И.Г. . Микроорганизмы -возбудители болезней. -Киев: Наукова думка, 1988. -552 с.
- Подкина Д.В., Котлярова И.А. Использование комбинированных инфекционных фонов при оценке устойчивости сои к корневой гнили//Научн.-тех. бюл. ВНИИМК. -1988. -№ 3. -С. 25-27.
- Заостровных В.И., Дубовицкая Л.К. Вредные организмы сои и система фитосанитарной оптимизации её посевов/Под ред. В.А. Чулкиной. -Новосибирск, 2003. -528 с.
- Калько Г.В. Биологические обоснование создания биопрепаратов, эффективных в отношении фузариозных заболеваний сельскохозяйственных культур: автореф. дис.. канд. биол. наук/Калько Галина Валентиновна. -СПб., 1996. -22 с.
- Захаренко, В.А., Павлюшин В.А., Воронин К.Е. Биоценетическая регуляция - основа биологической защиты растений в агроэкосистемах//Теоретические основы разработки биологических средств защиты растений, новые отселектированные формы полезных организмов, технологии изготовления биологических средств защиты растений и их применение. -М., 2004. -С. 4-31.
- Hebbar P., Berge O., Heulin T. Bacterial antagonists of sunflower (Helianthus annus L.) fungal pathogens//Plant and soil. -1991. -Vol. 133. -P. 131 -140.
- Thomashow L.S., Weller D.M. Role of a phenazine antibiotic from Pseudomonas fluorescens in biological control of Gaeumannomyces graminis var. triticilli//Bacterid. -1988. -Vol. 170. -P. 3499-3508.
- Raaijmakers J.M., Vlami M., de Souza J.T. Antibiotic production by bacterial biocontrol agents//Antonie van Leeuwenhoek. -2002. -Vol. 81. -№ l-4. -P. 537-547.
- Боронин А.М. Ризосферные бактерии рода Pseudomonas, способствующие росту и развитию растений//Соросовский образовательный журнал. -1998. -№ 10. -С. 25-31.
- Боронин А.М., Кочетков В.В. Биологические препараты на основе псевдомонад//АГРО XXI. -2000. -№ 3. -С. 3-5.
- Нетрусов Ф.И., Егорова М.А., Захарчук Л.М. . Практикум по микробиологии. -М.: Издательский центр «Академия», 2005. -608 с.
- Зайчук В.Ф. Об устойчивости подсолнечника к гнилям//Масличные культуры. -1983. -№ 1. -С. 16-17.
- Курилова Д.А. Вредоносность фузариоза сои в зависимости от степени поражения растений//Масличные культуры: Науч.-тех. бюл. ВНИИМК. -2010. -Вып. 2 (144-145). -С. 84-89.
- Груздев Г.С. Практикум по химической защите. -М.: Колос, 1983. -230 с.
- Егоров Н.С. Выделение микробов-антагонистов и биологические методы учета их антибиотической активности. -М.: Изд-во Моск. ун-та, 1957. -78 с.
- Маслиенко Л.В., Курилова Д.А., Асатурова А.М. . Первичный скрининг штаммов грибов и бактерий-антагонистов к возбудителю фузариоза сои//Масличные культуры: Науч. -тех. бюл. ВНИИМК. -2009. -Вып. № 1 (140). -С. 114-119.
- Маслиенко Л.В., Курилова Д.А., Асатурова А.М. Влияние лабораторных образцов биопрепаратов на основе перспективных штаммов-антагонистов фитопатогенов на проростки сои//Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2010. -Вып. 1 (142-143). -С. 104-108.
- Маслиенко Л.В., Курилова Д.А. Разработка микробиологического метода снижения вредоносности фузариоза на сое//Масличные культуры: Науч. -тех. бюл. ВНИИМК. -2012. -Вып. 2 (151-152). -С. 167-183.


