Перспективы использования бевацизумаба при НЭО. Клинический случай
Автор: Емельянова Галина Сергеевна, Орел Н.Ф., Горбунова Вера Андреевна, Коломейцева Алина Андреевна, Кузнецова Анна Алексеевна, Кузьминов А.Е., Феденко Александр Александрович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 6 т.16, 2017 года.
Бесплатный доступ
Диссеминированные высокодифференцированные нейроэндокринные опухоли (НЭО) характеризуются слабой чувствительностью к химиотерапии, и для лечения этих больных в основном применяют биотерапию и таргетные препараты. Стандарты 2-й и последующих линий лечения до настоящего времени не разработаны. Таргетный препарат бевацизумаб из группы VEGFR блокаторов активно изучается при высокодифференцированных НЭО. Для высокодифференцированных НЭО показано, что повышение экспрессии VEGF связано с метастазированием и уменьшением выживаемости без прогрессирования.
Нейроэндокринные опухоли, бевацизумаб
Короткий адрес: https://sciup.org/140254001
IDR: 140254001 | УДК: 616-006.48-08:615.32. | DOI: 10.21294/1814-4861-2017-16-6-100-104
Текст научной статьи Перспективы использования бевацизумаба при НЭО. Клинический случай
Нейроэндокринные опухоли (НЭО) представляют собой гетерогенную группу новообразований, которые могут встречаться в любом органе. Наиболее часто поражается желудочно-кишечный тракт, на втором месте – бронхопульмональные карциноиды. Заболеваемость НЭО ЖКТ и поджелудочной железы составляет 2–3 случая на 100 000 населения в год. За последние 20 лет в мире отмечен рост заболеваемости НЭО всех локализаций. Наиболее эффективным для этой группы больных является хирургическое лечение. Однако достаточно часто на момент установления диагноза выявляется диссеминированный процесс, что связано с различными симптомами, характерными для других заболеваний и затрудняющими своевременную диагностику. Выбор лекарственного лечения зависит от степени дифференцировки опухоли (высокодифференцированные НЭО – G1, G2 и низкодифференцированные – G3), а также от наличия какого-либо гормонального синдрома (карциноидный, АКТГ и др.). При гормонально активных опухолях показаны аналоги соматостатина
(октреотид и ланреотид), которые в определенных дозах также обладают антипролиферативным действием и используются в лечении высокодифференцированных НЭО.
Диссеминированные высокодифференцированные нейроэндокринные опухоли характеризуются слабой чувствительностью к химиотерапии, и для лечения этих больных в основном применяют биотерапию (пролонгированные аналоги соматостатина и α-интерфероны) и таргетные препараты (эверолимус при всех локализациях, сунитиниб при НЭО поджелудочной железы). Стандарты 2-й и последующих линий лечения до настоящего времени не разработаны. При низкодифференцированных нейроэндокринных опухолях методом выбора является цитотоксическая терапия, которая также используется при НЭО G2 (при Ki67 более 10 %) и при большой опухолевой нагрузке.
Таргетный препарат бевацизумаб из группы VEGFR блокаторов активно изучается при высокодифференцированных НЭО. Для высокодифференцированных НЭО показано, что повышение
экспрессии VEGF связано с метастазированием и уменьшением выживаемости без прогрессирования [1]. В некоторых исследованиях было показано, что использование комбинации с бевацизумабом увеличивает как выживаемость без прогрессирования, так и общую выживаемость, а также позволяет достичь длительной стабилизации процесса с контролем карциноидного синдрома [2–4].
Berruty et al. [5] применяли бевацизумаб при НЭО в комбинации с капецитабином (в метроном-ном режиме) и октреотидом. Частичный эффект достигнут у 17,8 % больных, медиана выживаемости без прогрессирования составила 14,9 мес, общая выживаемость не достигнута. Отмечена хорошая переносимость. В другом исследовании Mitry et al. [6] изучали эффективность и переносимость бевацизумаба в комбинации с капецитабином у 49 больных высокодифференцированными НЭО ЖКТ (Ki67 <15 %), не получавших до этого химиотерапию. Бевацизумаб вводился в дозе 7,5 мг/кг 1 раз в 3 нед, капецитабин – 1000 мг/м2 2 раза в день, в 1–14-й дни, интервал 21 день, в течение 6–24 мес. Медиана ВБП составила 23,4 мес, ЧЭ – 18 %, стабилизация – 70 %, 2-летняя выживаемость без прогрессирования – 85 %. Профиль токсичности был благоприятным, из побочных явлений III–IV ст. отмечены: гипертония (31 %), диарея (14 %) и ладонно-подошвенный синдром (10 %). J. Yao et al. в рандомизированном исследовании изучали эффективность бевацизумаба в сочетании с октреотидом по сравнению с α-интерфероном в сочетании с октреотидом при НЭО. Частота объективных ответов у больных, получавших бевацизумаб, составила 18 %. При назначении интерферона объективных ответов получено не было, лучшая ВБП в течение 18 нед лечения в группе бевацизумаба составила 95 %, в группе интерферона – 68 % [4].
При постоянном оптимально подобранном лечении 5-летняя выживаемость при НЭО в странах Восточной Европы (без России) составляет 38 %, медиана выживаемости – 3,3 года, в странах Северной Европы 5-летняя выживаемость – 60 %, медиана выживаемости – 9,2 года [7]. В России такие данные отсутствуют.
Приводим пример длительного применения бевацизумаба в сочетании с аналогами соматостатина у больной с диссеминированной НЭО тонкой кишки с длительным анамнезом лекарственного лечения.
Клинический случай
Пациентка М., 59 лет, с 2004 г. наблюдалась по месту жительства по поводу объемного образования в правой доле печени, которое расценивалось как гемангиома. В январе 2007 г. по данным КТ отмечено значительное увеличение размеров опухоли, в связи с чем направлена для дообследования в РОНЦ им. Н.Н. Блохина, где для уточнения диагноза 05.06.2007 выполнена лапаротомия.
Интраоперационно выявлена опухоль в стенке тонкой кишки по брыжеечному краю, размерами 1,5×3 см, опухолевый узел в брыжейке тонкой кишки, диаметром до 5 см, а также в печени в проекции 5 – 8 – 7 сегментов – очаг размером до 15 см, в 3-м сегменте по диафрагмальной поверхности – до 1,5 см. Выполнена операция в объеме резекции подвздошной кишки, удаления очага в брыжейке тонкой кишки, правосторонней геми-гепатэктомии, атипичной резекции 3-го сегмента печени. По результатам иммуногистохимического исследования установлен диагноз: высокодифференцированная нейроэндокринная опухоль, Ki67 – 12 % (в метастазах в печени Ki67 – 8 %) (G2) с умеренно позитивным статусом рецепторов соматостатина 2А типа. Больная находилась под динамическим наблюдением в течение 2 лет без признаков прогрессирования заболевания.
В июне 2009 г. стали определяться очаговые образования гиперэхогенной структуры в левой доле печени: в S4 – 0,6 и 0,9 см; в S4–3 – 2,9×2,2 см; в S3 – 1,0 см; в S2 – 0,9 и 0,8 см. Начата химиотерапия по схеме Араноза (Арабинопиранозилметил нитрозомочевина) – 500 мг/м2 в 1–2-й день + Ка-пецитабин – 2000 мг/м2 в сутки, в 2–15-й день + аналоги соматостатина – 20 мг, 1 раз в 28 дней. С июля по сентябрь 2009 г. проведено 4 курса I линии полихимиотерапии (ПХТ) с положительной динамикой в рамках стабилизации. В связи с отсутствием препарата с октября 2009 г. пациентка получила 3 курса ПХТ по схеме XELOX (Араноза заменена на Оксалиплатин) со стабилизацией опухолевого процесса. Суммарно было проведено 7 курсов I линии ПХТ, после чего продолжена терапия аналогами соматостатина.
В апреле 2010 г. отмечено прогрессирование заболевания, по поводу чего пациентка получила 1 курс ПХТ по схеме Иринотекан + Темозоломид и 3 курса монохимиотерапии темозоломидом (в связи с токсичностью Иринотекан в дальнейшем не использовался), осложнившиеся тромбоцитопенией IV ст. После восстановления показателей крови с октября 2010 г., в течение 9 мес получала а-интерферон – 3 млн Ед 3 раза в нед, на фоне лечения аналогами соматостатина. Терапия интерфероном была завершена в июле 2011 г. в связи с неудовлетворительной переносимостью (астения III ст.). Проводилась терапия аналогами соматостатина по 30 мг 1 раз в 28 дней. В июле 2012 г. прогрессирование болезни – рост метастазов в печени (ВБП – 27 мес). С июля 2012 г. принимала эверолимус по 10 мг в день на фоне терапии аналогами соматостатина в дозе 30 мг. На 3-й нед приема развился стоматит II ст., лечение приостанавливалось на 1 нед. В дальнейшем продолжала прием эверолимуса по 10 мг через день. На фоне приема препарата в мае 2013 г. развился острый цистит, потребовавший госпитализации и приема антибиотиков. Прием эверолимуса был
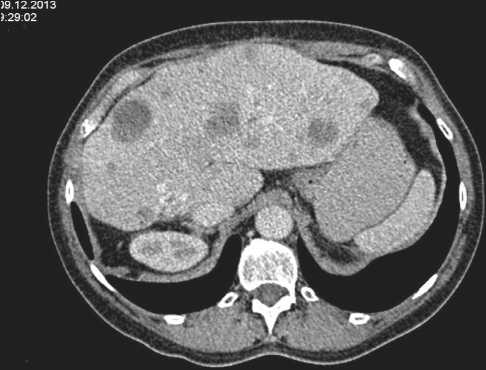
Рис. 1. КТ органов брюшной полости, декабрь 2013 г.
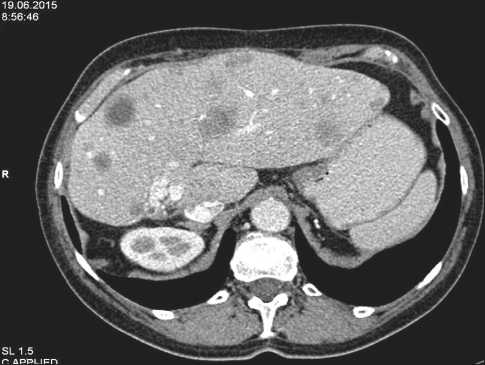
Рис. 2. КТ органов брюшной полости, июнь 2015 г.
приостановлен на 3 нед. Максимальный достигнутый эффект – стабилизация (ВБП – 17 мес).
В декабре 2013 г. по данным КТ органов брюшной полости зарегистрировано прогрессирование заболевания (рис. 1): множественные метастазы в обеих долях печени увеличились в размерах, так, наиболее крупные очаги: в S4 – с 2,8 см до 3,3 см в диаметре, на границе S2 и S4 – с 2,4 см до 3,0 см в диаметре, по передней поверхности S3 – с 1,7 см до 2,0 см. Другие множественные метастазы в печени также увеличились в размерах.
Отмечен рост уровня хромогранина А в крови до 84,2 Ед/л (ранее – 48,3 Ед/л, при норме до 18 Ед/л). Назначена IV линия лечения – темозоломид в метрономном режиме по 100 мг ежедневно + бевацизумаб 7,5 мг/кг каждые 3 нед. Лечение переносила с явлениями тошноты I–II ст. После 5 мес лечения по данным УЗИ – положительная динамика в рамках стабилизации, в анализах крови – снижение уровня хромогранина А до 76,8 Ед/л. При обследовании в июне 2015 г. – признаков прогрессирования опухолевого процесса не выявлено (рис. 2).
Стабилизация сохранялась в течение 22 мес до октября 2015 г., когда по данным КТ отмечен рост очагов в печени. Назначена реиндукция 1 линии: Араноза –500 мг/м2, в 1–3-й день, внутривенно струйно; продолжены Бевацизумаб 7,5 мг/ кг каждые 3 нед и аналоги соматостатина 40 мг 1 раз в 28 дней. Первый курс осложнился развитием тромбоцитопении IV ст., очередной курс ПХТ был отложен на 4 нед. Последующие 2–6-й курсы ПХТ проведены с редукцией дозы Аранозы на 25 % – до 375 мг/м2. Лечение переносила с гематологической токсичностью I ст. (тромбоцитопения – I ст., анемия – I ст.). При контрольном обследовании после 3-го и 6-го курсов ПХТ — стабилизация опухолевого процесса. С мая 2016 г. по настоящее время проводится поддерживающая терапия бевацизумабом 7,5 мг/кг и аналогами соматостатина в дозе 40 мг 1 раз в 28 дней (ВБП – 18 мес).
Заключение
Бевацизумаб в настоящее время не входит в рекомендации по лечению НЭО. Необходимость выбора оптимальных комбинаций, которые могут использоваться при всех локализациях высокодифференцированных НЭО, делает актуальным проведение дальнейших клинических исследований по изучению бевацизумаба в лечении этих больных.
Список литературы Перспективы использования бевацизумаба при НЭО. Клинический случай
- Zhang J., Jia Z., Li Q., Wang L., Rashid A., Zhu Z., Evans D.B., Vauthey J.N., Xie K., Yao J.C. Elevated expression of vascular endothelial growth factor correlates with increased angiogenesis and decreased progression-free survival among patients with low-grade neuroendocrine tumors. Cancer. 2007 Apr 15; 109 (8): 14708-86.
- Koumarianou A., Kaltsas G. Bevacizumab Plus Temozolomide: A Novel Treatment Option for Advanced Neuroendocrine Tumors? J Clin Oncol. 2013 Mar 1; 31 (7): 975-6. DOI: 10.1200/JCO.2012.45.7523
- Chan J.A., Stuart K., Earle C.C., Clark J.W., Bhargava P., Miksad R., Blaszkowsky L., Enzinger P.C., Meyerhardt J.A., Zheng H., Fuchs C.S., Kulke M.H. Prospective study of bevacizumab plus temozolomide in patients with advanced neuroendocrine tumors. J Clin Oncol. 2012 Aug 20; 30 (24): 2963-8. DOI: 10.1200/JCO.2011.40.3147
- Yao J.C., Phan A., Hoff P.M., Chen H.X., Charnsangavej C., Yeung S.C., Hess K., Ng C., Abbruzzese J.L., Ajani J.A. Targeting vascular endothelial growth factor in advanced carcinoid tumor: a random assignment phase II study of depot octreotide with bevacizumab and pegylated interferon alpha-2b. J Clin Oncol. 2008 Mar 10; 26 (8): 1316-23. DOI: 10.1200/JCO.2007.13.6374
- Berruti A., Fazio N., Ferrero A., Brizzi M.P., Volante M., Nobili E., Tozzi L., Bodei L., Torta M., D'Avolio A., Priola A.M., Birocco N., Amoroso V., Biasco G., Papotti M., Dogliotti L. Bevacizumab plus octreotide and metronomic capecitabine in patients with metastatic well-to-moderately differentiated neuroendocrine tumors: the xelbevoct study. BMC Cancer. 2014 Mar 14; 14: 184. DOI: 10.1186/1471-2407-14-184
- Mitry E., Walter T., Baudin E., Kurtz J.E., Ruszniewski P., Dominguez-Tinajero S., Bengrine-Lefevre L., Cadiot G., Dromain C., Farace F., Rougier P., Ducreux M. Bevacizumab plus capecitabine in patients with progressive advanced well-differentiated neuroendocrine tumors of the gastro-intestinal (GI-NETs) tract (BETTER trial)-a phase II non-randomised trial. Eur J Cancer. 2014 Dec; 50 (18): 3107-15. DOI: 10.1016/j.ejca.2014.10.001
- Abstracts of the 13th Annual ENETS Сonference for the Diagnosis and Treatment of Neuroendocrine Tumor Disease. 2016 March 9-11; Barcelona, Spain.


