Перспективы применения жидких отходов производства кальцинированной соды в качестве хладоносителя на основе тройной системы CaCl2-K2Cr2O7-H2O
Автор: Плотникова С.Е., Перегудов Ю.С., Горбунова Е.М., Нифталиев С.И.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Химическая технология
Статья в выпуске: 3 (85), 2020 года.
Бесплатный доступ
В настоящее время актуальной проблемой является вторичное использование дистиллерной жидкости - отхода производства кальцинированной соды, который представляет собой водный раствор, содержащей около 10 % хлорида кальция и небольшое количество других солей. Предлагается применение раствора на основе дистиллерной жидкости в качестве хладоносителя в системе теплообмена при производстве соды. Введение в систему бихромата калия создает ингибирующий эффект и предотвращает коррозию труб. Для изучения фазовых равновесий в системе СaCl2 - К2Сr2О7 - H2O построены диаграммы состояния при температурах 20, 3 и -7?С. С понижением температуры гомогенная область заметно уменьшается и смещается к оси СaCl2 - H2O. Эвтектическая точка ограничена очень узкой областью, в которой массовая доля бихромата калия не превышает 3 %. Методом Скрайнемакерса установлено, что в области с содержанием хлорида кальция менее 40 % кристаллизуется бихромат калия. Для области, примыкающей к вершине хлорида кальция, установить состав твердой фазы и границы ее кристаллизации по методу Скрайнемакерса невозможно. Это связано с тем, что бинарная система СaCl2 - К2Сr2О7 является тройной взаимной системой K+,Ca2+Cl-,Сr2О72-. В этой области предполагается образование твердых растворов или соединений на основе бинарной системы К2Сr2О7 - СаСr2О7. Для интервала температур от -7 ºС до 50 ºС предложен состав хладоносителя: 3 % K2Cr2O7 - 10,2 % CaCl2 - 86,8 % H2O. В области температуры от 20 ºС до 60 ºС состав раствора: 6 % K2Cr2O7 - 10% CaCl2 - 84 % H2O.
Дистиллерная жидкость, хладоноситель, диаграммы состояния, кальцинированная сода, отходы производства
Короткий адрес: https://sciup.org/140250972
IDR: 140250972 | УДК: 661.333.36 | DOI: 10.20914/2310-1202-2020-3-233-238
Текст научной статьи Перспективы применения жидких отходов производства кальцинированной соды в качестве хладоносителя на основе тройной системы CaCl2-K2Cr2O7-H2O
Кальцинированная сода – один из важнейших продуктов химической промышленности, имеющий обширные области применения и большие объемы производства. На каждую тонну соды, получаемой по аммиачному методу, образуется до 9 м3 дистиллерной жидкости, содержащей около 10–10,5% СаС12 и 5% NaCl и около 0,2% других примесей (карбоната и сульфата кальция, гашеной извести, песка) [1]. Также в ней содержится карбонат и гидроксид магния, примеси хлорида аммония и глинистых соединений.
This is an open access article distributed under the terms of the Creative Commons Attribution 4.0 International License
Несмотря на то, что в настоящее время применяются различные способы переработки и утилизации дистиллерной жидкости [1–4], ввиду большого количества образующихся отходов значительная часть ее направляется в накопители, а затем сбрасывается в водоемы, что приводит к их загрязнению и засаливанию [3].
Исследована система CaCl 2 – SrCl 2 – H 2 O при 288,15 К и получена фазовая диаграмма, которая использована для компьютерного моделирования рассола [5].
Основной задачей повышения экологической безопасности производства соды, особенно острой при возрастающих объемах производства, является разработка нового способа переработки и использования дистиллерной жидкости.
При производстве соды широко применяется система теплообмена, позволяющая сэкономить энергию на нагрев или охлаждение, необходимые для создания оптимального режима технологических процессов. В большинстве случаев рабочей жидкостью в системе служит вода. В настоящее время большое внимание уделяется эффективному и бережному использованию водных ресурсов. В связи с этим предлагается замена хладоносителя – воды на водный раствор на основе дистиллерной жидкости. Хладоноситель – промежуточное вещество, предназначенное для отвода теплоты от охлаждаемых объектов и передачи ее рабочему веществу (хладагенту) холодильной машины [6].
Для использования дистиллерной жидкости в системе теплообмена необходимо решить проблему коррозионной устойчивости материала труб теплопроводов, так как ионы Сl– являются агрессивными активаторами коррозии [7]. Решить эту проблему можно с помощью добавления различных ингибиторов коррозии.
Широко известно применение бихромата калия или натрия в качестве ингибиторов коррозии сталей и алюминия в воде и пассиваторов при обработке нержавеющих сталей [8].
Изучение фазовых равновесий в трехкомпонентной системе СaCl 2 – К 2 Сr 2 О 7 – H 2 O и разработка на ее основе хладоносителя, обладающего высокой теплопроводностью и инертностью по отношению к металлам, является целью исследования.
Материалы и методы
Для построения диаграммы тройной системы применяли метод Скрейнемакерса. Рассчитывали и готовили смеси трех компонентов, состоящие из кристаллов и насыщенных растворов. Растворы термостатировали в течении суток при температуре 20 ºС для установления равновесия, аналитическими методами определяли составы насыщенного раствора и твердой фазы, полученных из исходной смеси.
По точкам, соответствующим составам жидкой фазы и остатка, строили лучи [9]. Положение фигуративной точки твердой фазы на диаграмме растворимости определяется пересечением двух или нескольких лучей. Соединительные прямые между остатками и жидкой фазой пересекаются в пределах чертежа только тогда, когда твердые фазы имеют двойной или тройной состав. Если же твердая фаза отвечает составу одного из компонентов, фигуративная точка ее будет находиться в вершине, соответствующей этому компоненту.
Брали две пробы жидкой фазы, отличающихся друг от друга по составу, но находящихся в равновесии с одной и той же предполагаемой твердой фазой, пробу остатков, максимально отжатых от раствора, взвешивали пробы, растворяли в мерной колбе на 50 см3 и определяли концентрацию ионов Ca2+ и ионов Cl-. По данным титрования рассчитывали массовые доли компонентов в пробе.
Для определения содержания Ca2+ в пробе использовали способ комплексонометрического титрования. К 10 см3 раствора добавляли 2 см3 аммиачного буфера (рН=8÷10), эриохром черный Т и титровали раствором ЭДТА с молярной концентрацией эквивалента 0,01 моль/дм3. Окраска раствора в конечной точке титрования изменялась с красной на голубую.
Содержание ионов хлора определяли мерку-рометрическим методом. Пробу объемом 10 см3 помещали в коническую колбу, доводили объем до 100 см3 дистиллированной водой. До начала титрования создавали кислую среду (pH 2,5) азотной кислотой, фиксируя ее значение, введением кислотно-основного индикатора бромфенолового синего, затем добавляли индикатор дифенилкарбазид и титровали раствором нитрата ртути (II) с молярной концентрацией эквивалента 0,02 моль/дм3 до изменения цвета от лимонножелтого до сине-сиреневого [10].
Для определения концентрации окрашенных растворов широко используется фотометрический метод [11, 12]. Концентрацию бихромат-иона рассчитывали по значению оптической плотности. Сначала измеряли оптическую плотность стандартного раствора при различных длинах волн. По спектру выбирали оптимальную длину волны, которой соответствует максимальное значение оптической плотности. Для построения градуировочного графика готовили серию растворов и проводили измерения при определенной длине волны λ (400 нм) (рисунок 1).
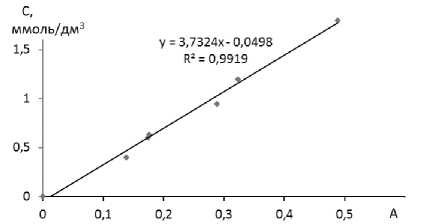
Рисунок 1. Зависимость молярной концентрации ионов Сr 2 О 7 2 – от оптической плотности А
Figure 1. Dependence of the molar concentration of Cr 2 O 7 2 – from the optical density of A
Фотометрировали исследуемые растворы и подставляли значения в уравнение линейной зависимости молярной концентрации С от оптической плотности А.
Результаты и обсуждения
По полученным данным рассчитывали содержание солей в масс. % в жидкой и твердой фазе (таблица 1). Строили ноды, соединяющие точку исходной смеси компонентов, жидкой и твердой фазы (рисунок 2). Три точки одной ноды должны лежать на одной прямой и быть направлены к точке, имеющей состав твердой фазы.
Таблица 1.
Состав исходной смеси компонентов, равновесной жидкой и твердой фаз
Table 1.
The composition of the initial mixture of components, equilibrium liquid and solid phases
|
Массовые доли в исходной смеси, % Mass fraction in the initial mixture,% |
CD cd fa cd cd e |
Масса пробы для анализа, г Sample mass for analysis, g |
Объем ЭДТА, см3 EDTA volume, cm3 |
Объем Нg(NO 3 ) 2 , см3 Volume Нg(NO 3 ) 2 , cm3 |
Оптическая плотность Optical density |
Массовая доля компонентов, % Mass fraction of components,% |
||||
|
СaCl 2 |
К 2 Сr 2 О 7 |
H 2 O |
СaCl 2 |
К 2 Сr 2 О 7 |
H 2 O |
|||||
|
40,00 |
10,00 |
50,00 |
ж |
0,14 |
16,7 |
8,5 |
0,108 |
33,25 |
4,82 |
61,93 |
|
40,00 |
10,00 |
50,00 |
т |
0,021 |
1 |
0,5 |
0,342 |
13,21 |
92,84 |
-6,06 |
|
32,00 |
8,00 |
60,00 |
ж |
0,171 |
20,5 |
10,3 |
0,102 |
33,25 |
3,68 |
63,07 |
|
32,00 |
8,00 |
60,00 |
т |
0,011 |
0,1 |
0,05 |
0,176 |
2,25 |
94,47 |
3,28 |
|
20,00 |
30,00 |
50,00 |
ж |
0,19 |
17,3 |
8,8 |
0,189 |
25,30 |
5,84 |
68,86 |
|
20,00 |
30,00 |
50,00 |
т |
0,035 |
0,6 |
0,3 |
0,56 |
4,13 |
89,70 |
6,17 |
|
12,00 |
18,00 |
70,00 |
ж |
0,161 |
7,7 |
3,9 |
0,245 |
13,20 |
8,80 |
78,00 |
|
12,00 |
18,00 |
70,00 |
т |
0,021 |
0,2 |
0,1 |
0,348 |
2,31 |
94,72 |
2,97 |
Соединительные прямые между кристаллами и жидкой фазой пересекаются в пределах чертежа только тогда, когда твердые фазы имеют двойной или тройной состав. Для нод, изображенных на рисунке 2, твердая фаза отвечает составу одного из компонентов – бихромату калия, фигуративная точка находится в вершине, соответствующей этому компоненту.
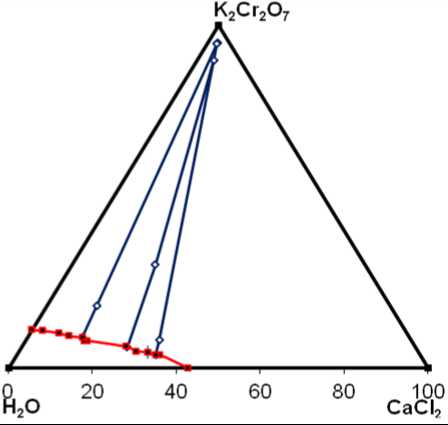
Рисунок 2. Диаграмма состояния системы СaCl 2 –
К 2 Сr 2 О 7 – H 2 O при 20 ºС
Figure 2. Диаграмма состояния системы СaCl 2 –
К 2 Сr 2 О 7 – H 2 O при 20 ºС
Бихромат калия кристаллизуется в верхней части треугольника составов, примыкающей к Н 2 О, где массовая доля хлорида кальция не превышает 40%. Для области, примыкающей к вершине хлорида кальция, линейность нод нарушается. Установить состав твердой фазы и границы ее кристаллизации по методу Скрайнемакерса невозможно. Это связано с тем, что бинарная система СaCl 2 – К 2 Сr 2 О 7 является тройной взаимной системой K+, Ca2+||Cl-, Сr 2 О 7 2- и в ней возможно образование солей СаСr 2 О 7 , КCl, а также двойных соединений. Из литературных источников известно, что в системе КCl – СаСl 2 существует двойная соль КCl∙СаСl 2 [13,14]. Высокое содержание бихро-мат-иона в твердой фазе говорит о возможности образования твердых растворов или двойных соединений на основе системы СaСr 2 О 7 – К 2 Сr 2 О 7 .
Для изучения поведения системы в области низких температур исследования также проводили при +3 и -7 ºС. Эксперимент проводили по той же методике, увеличив время достижения равновесия до 5 суток. На рисунке 3 изображены изотермы системы СaCl 2 – К 2 Сr 2 О 7 – H 2 O при температуре 3 ºС и -7 ºС.
С понижением температуры гомогенная область заметно уменьшается. В области с содержанием хлорида кальция менее 40% наблюдается образование твердой фазы в виде бихромата калия.
Состав твердой фазы, кристаллизующийся в области с содержанием хлорида кальция более 40% не установлен. Возможно образование кристаллогидрата CaCl 2 · 6H 2 O, (около состава 50,7% – CaCl 2 –49,3% H 2 O) образование двойной соли КCl∙CaCl 2 , твердых растворов и двойных солей на основе K 2 Cr 2 O 7 и CaCr 2 O 7 .
K2Cr2O7
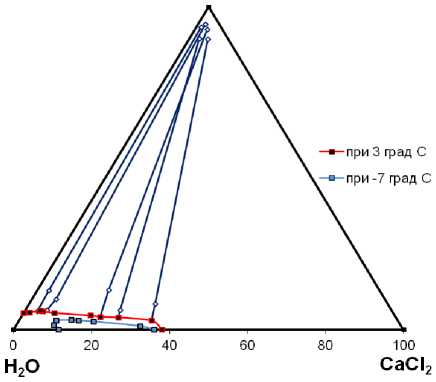
Рисунок 3. Диаграмма состояния системы СaCl 2 – К 2 Сr 2 О 7 – H 2 O при температуре 3 ºС и -7 ºС
Figure 3. Diagram of the state of the CaCl 2 – К 2 Сr 2 О 7 – H 2 O system at a temperature of 3 ºС and -7 ºС
При -7 ºС область жидкой фазы очень мала и прилегает к оси H 2 O – CaCl 2 . Для некоторых растворов наблюдалось образование двух твердых фаз, одна из которых по составу была ближе к воде, а другая содержала ион бихромата. Все твердые фазы, кристаллизующиеся из растворов, имели оранжевый цвет и высокое содержание бихромат – иона. Твердая фаза в изученной области может состоять из бихромата калия, соединений или твердых растворов на основе бихроматов калия – кальция. Очевидно, что эвтектическая точка ограничена очень узкой областью, в которой содержание бихромата калия не превышает 3%.
Из результатов проведенного исследования можно сделать вывод, что хладоносители на основе системы СaCl2 – К2Сr2О7 – H2O могут применяться в ограниченном интервале температур. Известно, что при содержании в системе 3% бихромата калия коррозионная активность ионов Cl– значительно уменьшается [15]. Содержание хлорида кальция в дистиллерной жидкости 10,5%. При добавлении 3% бихромата калия, массовая доля хлорида кальция изменяется, и раствор имеет состав 3% K2Cr2O7 – 10,2% CaCl2–86,8% H2 O температурный интервал, в котором можно применять такой раствор, ограничен как нижним значением -7 ºС (в противном случае возможно образование осадка в трубах), так и верхней границей в области 40–50 ºС. При повышении температуры содержание бихромата калия должно быть выше в 2–3 раза, чтобы сохранялось его ингибирующее действие [15].
Для повышенной области температуры (от 20 ºС до 60 ºС) массовая доля K 2 Cr 2 O 7 6% и состав раствора – хладоносителя: 6% K 2 Cr 2 O 7 – 10% CaCl 2 –84% H 2 O.
Заключение
Изучены фазовые равновесия в системе СaCl 2 – К 2 Сr 2 О 7 – H 2 O при 20 ºС, 3 ºС и -7 ºС. С понижением температуры гомогенная область на диаграмме состояния заметно уменьшается. В области с содержанием хлорида кальция меньше 40% происходит высаливание бихромата калия. Твердая фаза в области, прилегающей к хлориду кальция, вероятно представляет собой твердые растворы на основе бихроматов калия – кальция. Эвтектическая точка ограничена очень узкой областью, в которой содержание бихромата калия не превышает 3%.
Анализ диаграмм состояния показывает, что хладоносители на основе системы СaCl 2 – К 2 Сr 2 О 7 – H 2 O могут применяться в определенном интервале температур. Установлены составы хладоносителя на основе дистиллерной жидкости с антикоррозионными свойствами для систем теплообмена в производстве кальцинированной соды.
Список литературы Перспективы применения жидких отходов производства кальцинированной соды в качестве хладоносителя на основе тройной системы CaCl2-K2Cr2O7-H2O
- Быковский Н.А., Курбангалеева Л.Р., Даминев Р.Р. Переработка дистиллерной жидкости с получением товарных продуктов // Фундаментальные исследования. 2012. № 6-1. С. 209-213. URL: http://fundamental-research.ru/ru/article/view? id=29967
- Пат. № 2647931, RU, B09B 3/00, F23G 5/027. Способ переработки твердых отходов производства кальцинированной соды аммиачным методом / Р.Н. Загидуллин, заявитель Государственное автономное научное учреждение "Институт прикладных исследований" Академии наук Республики Башкортостан. № 2015151158; Заявл. 27.11.2015; Опубл. 21.03.2018, Бюл. № 9.
- Пат. № 2476386, RU, С02F 9/06, C01D 7/18. Способ переработки дистиллерной жидкости аммиачно-содового производства / Н.А. Быковский, заявитель Уфимский государственный нефтяной технический университет. № 2011138179/05; Заявл. 16.09.2011; Опубл. 27.02.2013, Бюл. № 6.
- Калинина Е.В., Рудакова Л.В. Снижение токсичных свойств шламов содового производства с последующей их утилизацией // Известия Томского политехнического университета. Инжиниринг георесурсов. 2018. Т. 329. № 6. С. 85-96.
- Li D, Meng L, Guo Y, Deng T, Yang L Chemical engineering process simulation of brines using phase diagram and Pitzer model of the system CaCl2-SrCl2-H2O // Fluid Phase Equilibria. 2019. № 484. Р. 232-238. DOI: 10.1016/j.fluid.2018.11.034
- Quang D.V., Dindi A., Zahra M.R.M.A. The Utilization of CO2, Alkaline Solid Waste, and Desalination Reject Brine in Soda Ash Production // CO2 Separation, Puri?cation and Conversion to Chemicals and Fuels. 2019. P. 153-184.
- Kurbangaleeva M.H. Studying the Effect of High Molecular Flocculants on Separation of Distillation Suspension-the Main Waste of Soda Ash Production // IOP Conference Series: Earth and Environmental Science. 2019. V. 272. №. 2. P. 022022.
- Ramsey J, McCreery R. Raman microscopy of chromate interactions with corroding aluminum alloy 2024T3 // Corrosion Science. 2004. № 46(7). Р. 1729-1739.
- DOI: 10.1016/j.corsci.2003.10.010
- Елсуков А.В., Мазунин С.А., Басов В.Н. Изучение фазовых равновесий в системе KCl - NH4Cl - H2O при 25 °С оптимизированным методом сечений // Современные проблемы науки и образования. 2012. № 3.
- Go?ub A., Piekutin J. The Use of Sorbents in Removal of Selected Cations from Wastewater After Soda Ash Production // Multidisciplinary Digital Publishing Institute Proceedings. 2019. V. 16. №. 1. P. 31.
- Кулиев К.А., Плотникова С.Е. Горбунова Е.М, Таранова А.Н. Смешаннолигандные комплексы мeди (II) с дитиолфенолами и гетероциклическими диаминами // Вестник ВГУИТ. 2017. Т. 79. № 1. С. 248-256.
- DOI: 10.20914/2310-1202-2017-1-248-256
- Kuliev K.A., Gorbunova E.M., Plotnikova S.E. Еxtractive spectrophotometric determination of iron(III)using 2, 6dithiol4methylphenol and aminophenols // Journal of Advanced Applied Scientific Research. 2017. V. 1. Р. 2454-3225.
- Wu Y. et al. Soda Ash Production with Low Energy Consumption Using Proton Cycled Membrane Electrolysis // Industrial & Engineering Chemistry Research. 2019. V. 58. №. 8. P. 3450-3458.
- Han H, Li D, Guo L. Prediction of solubilities for the salt-water system CaCl2-KCl-H2O at 348.15 К // Advanced Materials Research. 2014. V. 1044-1045. P. 83-87.
- DOI: 10.4028/www.scientific.net/AMR.1044-1045.83
- Семенова И.В., Хорошилова А.Н., Флорианович Г.М. Коррозия и защита от коррозии. Москва: Физматлит, 2010. 416 с.


