Первичная иммунная тромбоцитопеническая пурпура: подходы к терапии согласно новым клиническим рекомендациям Американской гематологической ассоциации и Международного консенсусного доклада
Автор: Бессмельцев С.С.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Передовая статья
Статья в выпуске: 2 т.16, 2020 года.
Бесплатный доступ
Несмотря на наличие многочисленных публикаций по диагностике и лечению иммунной тромбоцитопенической пурпуры (ИТП), пробелы в знаниях сохраняются, и актуальное экспертное мнение и опыт играют ключевую роль. В статье представлена обновленная версия рекомендаций американского гематологического общества и международного консенсуса, опубликованных в 2019 году. В состав группы экспертов вошли специалисты со всего мира. Были проанализированы и оценены результаты исследований, а также сформулированы консенсусные рекомендации, основанные на новых данных. Группа экспертов обсудила рекомендации, касающиеся ведения ИТП у пациентов с впервые диагностированным, персистирующим и хроническим течением заболевания, рефрактерным к терапии первой линии. Методы ведения включали: наблюдение, кортикостероиды, внутривенный иммуноглобулин, анти-D иммуноглобулин, ритуксимаб, спленэктомию и агонисты рецепторов тромбопоэтина. В целом предпочтение отдавалось стратегиям, позволяющим избежать побочных эффектов лекарственных препаратов. Большое внимание было уделено совместному принятию решений. Эксперты уделяют большое внимание второй линии терапии. В рекомендациях приоритет отдается агонистам рецепторов тромбопоэтина (рТПО), как лечению второй линии, а ритуксимаб считается препаратом третьей линии, предназначенным для пациентов, которые не ответили на агонисты рТПО. Кроме того, спленэктомия напрямую не сравнивается ни с тем, ни с другим методом лечения, а скорее резервируется в первую очередь для пациен тов с длительностью ИТП > 12 месяцев или с крупным кровотечением (ВОЗ III, IV). В статье представлен подробный анализ рекомендаций и комментарии автора
Иммунная тромбоцитопеническая пурпура, кортикостероиды, внутривенные иммуноглобулины, агонисты тромбопоэтиновых рецепторов, спленэктомия, ритуксимаб
Короткий адрес: https://sciup.org/170172540
IDR: 170172540
Текст научной статьи Первичная иммунная тромбоцитопеническая пурпура: подходы к терапии согласно новым клиническим рекомендациям Американской гематологической ассоциации и Международного консенсусного доклада
Первичная иммунная тромбоцитопеническая пурпура (ИТП) (идиопатическая тромбоцитопеническая пурпура, болезнь Верльгофа) — приобретенное аутоиммунное заболевание, характеризующееся изолированной тромбоцитопенией (количество тромбоцитов < 100,0 × 109/л) и наличием/отсутствием геморрагического синдрома различной степени выраженности. Тромбоцитопения развивается в результате ускоренного разрушения и субоптимальной продукции тромбоцитов и сопряжена с риском кровоизлияний,гема-том и серьезных кровотечений,в том числе внутричерепных. Заболеваемость ИТП колеблется от 2 до 5 случаев на 100 000 населения, распространенность — от 4,5 до 20 случаев на 100 000 населения [1, 2]. Симптоматика ИТП известна еще со времен Гиппократа, но только в 1735 г. немецкий врач Пауль Готлиб Верльгоф выделил ее в отдельную нозологическую форму и описал как «болезнь пятнистых геморрагий» у молодых женщин.
В настоящей статье представлены подходы к терапии ИТП у взрослых пациентов согласно новым клиническим рекомендациям международного консенсуса (International Consensus Report) и Американской гематологической ассоциации (ASH), опубликованных в конце 2019 г. [3, 4]. Предыдущие рекомендации были опубликованы в 2010 и 2011 гг. соответственно, т. е. в течение 10 лет накапливались новые данные, проводились клинические исследования, оценка их результатов, и после их обобщения и осмысления мировому научному сообществу представлены обновленные версии 2-х рекомендаций. Важно, что при разработке рекомендаций акцент сделан на совместное принятие экспертами решений.
В обновленных рекомендациях представлены разделы,касающиеся диагностики первич- ной ИТП. Однако основное внимание уделено подходам к лечению этого заболевания.
Эксперты обращают внимание на то,что диагноз ИТП является диагнозом исключения, для установления которого требуется проведение комплексного обследования, исключающего заболевания и состояния иммунной и неиммунной природы,протекающие с тромбоцитопенией, включая наследственную тромбоцитопению и псевдотромбоцитопению. Псевдотромбоцитопения возникает за счет формирования тромбоцитарных агрегатов в мазке при контакте с консервантом. Адгезия тромбоцитов под действием зависимых от этилендиаминтетрауксусной кислоты анти-тромбоцитарных антител — распространенная причина псевдотромбоцитопении.
Основные заболевания и состояния,с которыми следует проводить дифференциальный диагноз первичной ИТП,представлены в таблице 1 .
Весьма важной частью диагностики ИТП является сбор анамнеза (в том числе семейного). Информация о пациенте должна включать в себя кровотечение после операций,стомато-логических вмешательств или травмы,преды-дущие анализы крови, недавние зарубежные поездки и прививки, недавние инфекции, переливания компонентов крови. Наряду с кровоточивостью, слабость рассматривается экспертами как часть симптоматики ИТП.
Необходим осмотр пациента и экспертный просмотр мазков периферической крови. Характерным является изолированная тромбоцитопения (< 100,0 × 109/л), отсутствие морфологических и функциональных аномалий тромбоцитов, патологии лимфоцитов, гранулоцитов и эритроцитов,нормальные показатели гемоглобина, эритроцитов и ретикулоцитов (если не было существенной кровопотери).
Дифференциальный диагноз тромбоцитопений [4, 5]
Таблица 1.
|
Заболевания и другие состояния, протекающие с иммунной тромбоцитопенией |
Инфекции (например, ВИЧ, гепатит B и С, аутоиммунные/иммунодефицитные расстройства, системная красная волчанка или антифосфолипидный синдром, опухоли (например, лимфопролиферативные заболевания) |
|
Болезни печени Спленомегалия |
Цирроз печени, портальная гипертензия |
|
Лекарственные препараты |
Гепарин, алемтузумаб, ингибиторы PD1, вальпроевая кислота, химиотерапия, злоупотребление алкоголем, напитки с хинином (тоник), воздействие токсинов окружающей среды |
|
Заболевания системы крови |
Миелодиспластический синдром, лейкозы, первичный миелофиброз, апластическая анемия, мегалобластная анемия, болезнь Гоше |
|
Недавние переливания крови |
Посттрансфузионная пурпура |
|
Наследственные тромбоцитопении |
TAR-синдром, наследственная амегакариоцитарная тромбоцитопения, лучелоктевой синостоз, синдромы Вискотта-Олдрича и Бернара-Сулье, аномалия Мея-Хегглина, болезнь Виллебранда |
|
Другие состояния, вызывающие развитие тромбоцитопении |
ДВС-синдром, болезнь Мошковица, синдром Фишера-Эванса, гемолитико-уремический синдром, вакцинации, вирусы оспы, краснухи, парвовирус, вирус Эпштейна-Барр, цитомегаловирусная инфекция и др. |
Исследование мазка периферической крови остается важным диагностическим мероприятием при тромбоцитопении,так как правильная и тщательная оценка морфологии клеток всех 3 ростков кроветворения позволяет сузить направление дифференциально-диагностического поиска. Дополнительно можно обнаружить высокую продукцию В-клетками анти-GPIIbIIIa антител и высокий уровень анти-GPIIbIIIa антител к тромбоцитам, а также повышенное содержание молодых тромбоцитов и нормальный или умеренно повышенный уровень эндогенного тромбопоэтина.
Исследование костного мозга не требуется, если нет подозрений на другое заболевание и/или не предполагается лечение [3, 4]. Следует отметить,что ранее у пациентов в возрасте старше 60 лет, с целью исключения миелоди-спластического синдрома, пункция костного мозга была рекомендуемой опцией. В новых рекомендациям международного консенсуса отмечается, что нет строгой необходимости в выполнении пункции грудины у пациентов старше 60 лет. Исключение составляют па-циенты,у которых выявляются изменения в периферической крови (количественные, морфологические). Это представляется совершенно обоснованным, особенно в тех случаях, когда принято решение не прибегать к медикаментозному лечению, направленному на повышение числа тромбоцитов или когда качестве лечения выбрано применение высоких доз внутривенного иммуноглобулина.
При типичной презентации ИТП вероятность «пропустить» миелодиспластический синдром, острый лейкоз или другую опухоль практически сводится к нулю. Однако при атипичной клинической картине заболевания (например, потеря в весе, лимфаденопатия, боли в костях, гепатоспленомегалия) костномозговая пункция необходима. Исследование костного мозга показано в случае рецидива ИТП,отсутствия ответа на первичное лечение, перед спленэктомией. В таких ситуациях идеальным является выполнение пункции костного мозга, трепанобиопсии, проточной цитометрии и цитогенетического исследования (уровень доказательности IIb-IV).
Всем взрослым пациентам показано исследование на ВИЧ, антитела к вирусам гепатита В и С. Количественное определение иммуноглобулинов (IgG, IgA и IgM) в крови следует измерять у взрослых (уровень доказательности IV) для исключения иммунодефицитного синдрома или перед началом терапии внутривенными иммуноглобулинами. Иммунная тромбоцитопения может быть как первичной, так и вторичной, обусловленной другими заболеваниями (системная красная волчанка, антифосфолипидный синдром, лимфопролиферативные заболевания, хронические болезни печени, болезни накопления, тяжелый дефицит витамина В12 и фолиевой кислоты) [4, 5, 6, 7]. В связи с этим предлагаются дополнительные тесты, в частности, определение специфических антител к гликопротеинам тромбоцитов. Однако данное исследование не является обязательным, оно может быть полезным только в трудных случаях, общая диагностическая ценность этого теста невысокая. Антифосфолипидные антитела, включая антитела к кардиолипину и волчаночный антикоагулянт, необходимы только в тех случаях, когда есть клинические признаки антифосфолипидного синдрома (тромбозы, невынашивание беременности). Антинуклеарные антитела выявляются у 33 % взрослых пациентов с ИТП и могут рассматриваться в качестве предиктора хронизации ИТП (уровень доказательности IIb, III). Кроме того, обнаружение антинуклеарных антител у пациентов перед спленэктомией повышает риск тромбозов после спленэктомии [8].
Макроцитоз и гиперсегментированность нейтрофилов позволяет заподозрить недостаточность витамина В12 или фолиевой кислоты. Тест на гормоны щитовидной железы (антитела к тиреоглобулину, свободный Т4, ТТГ) является необходимым, так как тромбоцитопения бывает при гипотиреозе. Уровень тромбопоэтина у пациентов с ИТП чаще всего остается нормальным, поэтому его определение не рекомендуется.
В рекомендациях дан ряд определений, которые имеют важное практическое значение [3]. • Зависимость от кортикостероидов : непрерывный прием преднизолона > 5 мг/сут или частые циклы кортикостероидов для поддержания количества тромбоцитов ≥ 30 × 109/л и/или профилактики кровотечений.
-
• Длительный ответ : количество тромбоцитов ≥ 30 × 109/л и, по крайней мере, удвоение исходного количества тромбоцитов в течение 6 мес.
-
• Ранний ответ : количество тромбоцитов ≥ 30 × 109/л и, по крайней мере, удвоение исходного количества тромбоцитов в течение 1 недели.
-
• Первичный ответ : количество тромбоцитов ≥ 30 × 109/л и, по крайней мере, удвоение исходного количества тромбоцитов в течение 1 мес.
-
• Ремиссия : количество тромбоцитов > 100 × 109/л в течение 12 мес.
-
• Выраженное кровотечение : кровотечение III или IV степени по классификации ВОЗ или другим классификациям, позволяющим оценить тяжесть кровотечения (например, тяжелые кровотечения по Buchanan, большие кровотечения по Bolton-Maggs и Moong, ≥ II ст. по IBLS), или опасное для жизни кровотечение, или внутримозговое кровоизлияние.
-
• Незначительное кровотечение : любое кровотечение, не отвечающее вышеуказанным критериям
Первичная иммунная тромбоцитопеническая пурпура классифицируется по продолжительности заболевания: впервые выявленная (0–3,0 мес., часто регистрируются спонтанные ремиссии), персистирующая (от 3,0 до 12 мес.,спонтанные ремиссии встречаются реже), хроническая (>12 мес., спонтанные ремиссии встречаются редко). Диагноз ИТП формулируется как «Иммунная тромбоцитопения впервые выявленная, персистирующая или хроническая», степень тяжести определяется выраженностью геморрагического синдрома.
Лечение пациентов с ИТП должно быть строго индивидуализированным. Факторами, влияющими на решение врача, являются: распространенность и тяжесть кровотечений, пол и возраст пациента, сопутствующая патология, предрасполагающая к кровотечениям, осложнения специфической терапии, активность и образ жизни пациента,толерантность к побочным эффектам лекарственных препаратов, необходимость хирургических и других вмешательств с риском кровотечения, доступность медицинской помощи, ожидания пациента, потребность пациента в других лекарственных препаратах (частности, нестероидные противовоспалительные препараты и антикоагулянты/ антиагреганты), которые могут создавать риск кровотечения [3, 4].
В качестве первой линии терапии ИТП, как и ранее, рекомендуются кортикостероиды и внутривенные (в/в) иммуноглобулины. Кортикостероиды — стандартная терапия первой линии,которые не имеют относительных противопоказаний (класс рекомендаций A, уровень убедительности доказательств III).
Основной вопрос,в отношении пациентов с впервые выявленной ИТП — стоит ли вообще предпринимать попытки лечения, направленного на повышение числа тромбоцитов,или достаточно внимательного наблюдения и готовности назначить лечение при появлении предвестников жизнеугрожающего кровоте- чения? Мы хорошо знаем, что показаниями к лечению ИТП являются: геморрагический синдром;геморрагический синдром с тромбоцитопенией менее 30,0 × 109/л; тромбоцитопения менее 10–20,0 × 109/л. Чёткой корреляции между уровнем тромбоцитов и риском развития кровотечений нет. Но при уровне тромбоцитов 50 × 109/л и менее риск спонтанных настораживающих кровотечений увеличивается. Собственно,на риске развития кровотечений различной степени тяжести строятся общие подходы к терапии.
Что же нового в рекомендациях?
В обновленных рекомендациях ASH и международного консенсусного доклада обращается внимание на необходимость четкого определения показаний к началу терапии. Так, экспертам ASH было задано несколько вопросов, после совместного обсуждения которых, с учетом результатов исследований за истекший период, ими были сформулированы рекомендации к началу терапии пациентов с ИТП [3].
Вопрос 1а
— Следует ли назначать кортикостероиды взрослым пациентам с впервые выявленной ИТП при уровне тромбоцитов < 30 × 109/л без клинических симптомов или с минимальными проявлениями кровоточивости (кожа, слизистые)? Или достаточно наблюдения?
Рекомендация 1а
— Взрослым пациентам с впервые выявленной ИТП и количеством тромбоцитов < 30 × 109/л, протекающей бессимптомно или с незначительными геморрагическими проявлениями, необходимо назначить кортикостероиды.
Таким образом, при количестве тромбоцитов менее 30,0 × 109/л, даже при отсутствии геморрагического синдрома, показана терапия. Однако может существовать множество пациентов внутри этой группы, для которых достаточным является наблюдение (например, пациенты с уровнем тромбоцитов 20–30,0 × 109/л, образ жизни которых сопряжен с минимальной травмоопасностью). Поэтому крайне важен учет факторов риска — тяжесть тромбоцитопении (нет сомнений в том,что при уровне тромбоцитов менее 10–20,0 × 109/л необходимо срочно начинать лечение), сопутствующие заболевания, применение антикоагулянтов или антитромбоцитарных препаратов, предстоящие оперативные вмешательства или иные процедуры, возраст пациента. В нескольких крупных 8
исследованиях было установлено, что у пациентов, ведущих активный образ жизни, пациентов в возрасте > 60 лет, при уровне тромбоцитов 20–30 × 109/л, увеличивается риск кровотечений, тромбозов и смерти, а также у пациентов с сопутствующей патологией и принимающих антикоагулянты [9–11]. Таким пациентам, даже при отсутствии геморрагического синдрома, показано лечение. Между тем уровень тромбоцитов 20–30 × 109/л у пациентов 20–60 лет может служить основанием для тщательного наблюдения без лечения в отсутствие факторов риска (вероятность травм, оперативных вмешательств, инфекций).
Вопрос 1b
— Следует ли назначать кортикостероиды взрослым пациентам с впервые выявленной ИТП при уровне тромбоцитов ≥ 30 × 109/л без клинических симптомов или с минимальными проявлениями кровоточивости (кожа, слизистые)? Или достаточно наблюдения?
Рекомендация 1b
— Взрослых пациентов с впервые выявленной ИТП и количеством тромбоцитов ≥ 30 × 109/л, протекающей бессимптомно или с незначительными геморрагическими проявлениями (слизистые оболочки), рекомендуется наблюдать.
В то же время для пациентов при количестве тромбоцитов на нижнем уровне этого критерия (30 × 109/л), с сопутствующими заболеваниями, принимающих антикоагулянты или анти-агреганты,или планируемых на проведение инвазивных процедур, а также для пожилых пациентов (> 60 лет), лечение кортикостероидами может быть уместным.
Вопрос 2а
— Можно ли лечить взрослых пациентов с ИТП с уровнем тромбоцитов < 20 × 109/л без клинических симптомов или с минимальными проявлениями кровоточивости (кожа, слизистые) амбулаторно? Или обязательна госпитализация?
Рекомендация 2а
— Пациентов с впервые выявленной ИТП и количеством тромбоцитов < 20 × 109/л, которая протекают бессимптомно или имеется незначительная кровоточивость кожи и слизистых оболочек, следует госпитализировать для проведения терапии.
Это важная рекомендация. При уровне тромбоцитов < 20 × 109/л у врача не должно быть со- мнений, больной подлежит госпитализации. Но речь идет о впервые установленном диагнозе, т. е. завершился диагностический поиск, сомнений в диагнозе нет;надо начинать лечение. В то же время,пациентов с ранее установленным диагнозом,при бессимптомном течении заболевания или при незначительной кровоточивости, можно лечить амбулаторно. Такие пациенты должны находиться под тщательным наблюдением гематолога. Однако пациентов с социальными проблемами, при отсутствии уверенности в диагнозе, сопутствующих заболеваниях с риском кровотечения, значимых кровотечениях из слизистых, необходимо госпитализировать. Следует учитывать также диапазон количества тромбоцитов (от 0 до 20 × 109/л).
Важно подчеркнуть, что критическим для развития опасных для жизни геморрагических проявлений является содержание тромбоцитов ниже 10,0 × 109/л. Пациенты с такой тромбоцитопенией нуждаются в безотлагательной госпитализации и терапии,независимо от степени тяжести геморрагий.
Вопрос 2b
— Можно ли лечить взрослых пациентов с ИТП с уровнем тромбоцитов ≥ 20 × 109/л без клинических симптомов или с минимальными проявлениями кровоточивости (кожа, слизистые) амбулаторно? Или обязательна госпитализация?
Рекомендация 2b
— Более оправдано амбулаторное лечение.
Но эксперты и в этом случае обращают внимание на то,что пациентов с социальными проблемами, при отсутствии уверенности в диагнозе, сопутствующих заболеваниях с риском кровотечения, значимых кровотечениях из слизистых оболочек, целесообразнее госпитализировать. Следует учитывать также диапазон количества тромбоцитов (от 20 × 109/л до 150 × 109/л). Пациенты, не поступившие в больницу, должны находиться под тщательным наблюдением гематолога.
Таким образом, исходя из вышеизложенных рекомендаций,решение о госпитализации больного ИТП и начале терапии необходимо принимать на основании тяжести геморрагического синдрома, уровня тромбоцитов, анализа индивидуальных факторов риска кровотечения, возможности постоянно наблюдать пациента и надежно контролировать его поведение.
Вопрос 3
— Взрослым пациентам с впервые выявленной ИТП следует проводить короткий (≤ 6 недель) или пролонгированный (> 6 недель основной курс плюс отмена) курс терапии преднизолоном?
Рекомендация 3
— Не рекомендуется длительный курс лечения. Оправдана короткая первоначальная терапия (≤ 6 недель). Основной курс лечения преднизолоном не более 3 недель. При достижении целевого уровня тромбоцитов (≥ 50 × 109/л) следует начинать снижение дозы препарата до полной отмены к 6 неделе. Если нет ответа в течение 2 недель, рекомендуется снижение дозы и отмена в течение 1 недели. Более длительные курсы глюкокортикоидов приносят больше вреда, чем пользы и категорически не рекомендуются для применения в клинической практике.
Для пациента необходимо составить график лечения с указанием того, как долго и в каких дозах следует принимать стероидные гормо-ны,и каким образом должно проводиться постепенное снижение дозы до полной отмены. Быстрое снижение дозы в течение недели целесообразнее проводить под контролем врача.
Вопрос 4
— Пациентам с впервые выявленной ИТП, следует назначить преднизолон (0,5–2 0 мг/кг/ день) или дексаметазон (40 мг/день)? Какой из этих препаратов эффективнее?
Рекомендация 4
— Можно использовать любой вариант (либо преднизолон 0, 5–2,0 мг/кг, либо дексаметазон 40 мг 4 дня). Но, если более важным является быстрый ответ на лечение со стороны количества тромбоцитов,чем опасения по поводу потенциальных побочных эффектов высоких доз дексаметазона (плохая переносимость пожилыми пациентами), тогда предпочтительнее назначить дексаметазон.
Следует помнить, что стандартный режим терапии преднизолоном является наименее эффективным в отношении быстроты достижения целевого уровня тромбоцитов и сопряжен с риском развития синдрома экзогенного ги-перкортицизма. Высокодозный режим терапии дексаметазоном позволяет максимально быстро, в течение 24 часов, достигать безопасного уровня тромбоцитов (наиболее существенный прирост количества тромбоцитов на дексаметазон наблюдается к 7 дню) и вследствие короткой длительности терапии не сопряжен с риском выраженного синдрома экзогенного гиперкортицизма. Однако в целом результативность лечения сопоставима. Нет разницы в частоте тромбоцитарного ответа по состоянию на 1 мес.,сопоставимы длительность ответа и частота развития кровотечений. Отсутствуют сравнительные исследования по влиянию различных препаратов кортикостероидов на качество жизни больных.
Вопрос 5
— Целесообразно ли в качестве инициальной терапии взрослым пациентам с впервые выявленной ИТП назначать комбинацию ритук-симаба с кортикостероидами или достаточно использовать только кортикостероиды?
Рекомендация 5
— В качестве первичной терапии рекомендуется только монотерапия кортикостероидами. Нет необходимости использовать комбинацию двух препаратов.
В то же время,если достижение ремиссии более важно, чем возможные нежелательные явления ритуксимаба, то может быть использована комбинация ритуксимаба с кортикостероидами. Так, в исследовании Bussel J. et al. была использована комбинация ритуксимаба с 3 циклами дексаметазона, что обеспечило эффективность аналогичную спленэктомии у женщин с иммунной тромбоцитопенией и пациентов с длительностью ИТП до 2 лет. Показатель 5-летней продолжительности ответа составил 44 % [12]. Однако эксперты, проанализировав все основные исследования по использованию кортикостероидов в монорежиме и в сочетании с ритуксимабом,обращают внимание на очень низкую степень доказательств такого лечебного подхода, существенного увеличения стоимости комбинированной терапии. Поэтому, исходя из соображений реальной клинической практики, эксперты отдали предпочтение кортикостероидам. Безусловно, важное примечание. Такую комбинацию, скорее всего, можно использовать на более поздних этапах терапии.
Аналогичны рекомендации экспертов Международного консенсуса по первоначальной терапии ИТП [4]. Стандартная терапия первой линии — кортикостероиды: преднизолон 1 мг/кг (максимум 80 мг) в течение 2 недель (максимум 3 недели до достижения целевого уровня тромбоцитов) или дексаметазон 40 мг 4 дня (до 3 циклов). Высокие дозы метилпреднизолона (1 г в/в 1–7 день) также могут использоваться в 1 линии терапии, вызывая до 80 % ответов. Однако ответ кратковременный и требует поддерживающей терапии пероральными кортикостероидами. Преимуществ метилпреднизолона над преднизолоном или дексаметазоном не установлено [4]. Эксперты считают, что лечение должно быть строго индивидуальным по отношению к пациенту и фазе заболевания с минимальными побочными эффектами. Лечение должно предотвращать эпизоды тяжелых кровотечений.
Риск кровотечения, подчеркивают эксперты, редко связан с каким-либо определенным пороговым количеством тромбоцитов, однако он увеличивается при уровне тромбоцитов < 20 × 109/л [4]. Лечение редко показано пациентам с количеством тромбоцитов > 20 × 109/л. Здесь мы видим как будто противоречие с рекомендациями ASH, в которых четко обозначено показание к началу терапии при уровне тромбоцитов < 30 × 109/л, даже без клинических симптомов. В то же время, эксперты предлагают провести тщательный анализ индивидуальных факторов риска. Пациенты 20–60 лет с уровнем тромбоцитов 20–30 × 109/л, не имеющие факторов риска, могут находиться лишь под тщательным наблюдением [3]. Выявление таких факторов риска,как геморрагический синдром, дисфункция тромбоцитов, другие известные или неизвестные дефекты гемостаза или травма являются основанием к началу терапии [4]. Не стоит стремиться к нормализации уровня тромбоцитов. Целесообразно поддерживать уровень тромбоцитов от 20 до 30 × 109/л для бессимптомных пациентов. В зависимости от ответа на лечение следует выбирать наиболее подходящие дополнительные методы лечения, минимизировать побочные эффекты лечения и отбирать пациентов для дальнейшего лечения по мере необходимости. Лечение должно существенно улучшить качество жизни больных. Следует обращать внимание на жалобы пациентов на усталость, как важный симптом активности болезни.
Эксперты Международного консенсуса также считают, что при достижении ответа на преднизолон (содержание тромбоцитов > 50 × 109/л), его дозу рекомендуется постепенно снижать, вплоть до полной отмены к 6-й неделе (максимум к 8-й), даже если одновременно будут снижаться тромбоциты. Если за 2 недели ответа не получено, необходимо приступить к снижению дозы преднизолона с отменой к 3-й неделе. Рекомендуется избегать длительных курсов терапии кортикостероидами, хотя отдельные больные могут удерживать ответ в результате приема небольших доз кортикостероидов (≤ 5 мг/сут). Выбор данного способа назначения кортикостероидов должен быть обоснованным и индивидуальным.
Если кортикостероиды противопоказаны, то в качестве первой линии терапии следует использовать либо в/в иммуноглобулины, либо анти-D иммуноглобулины. Эксперты ASH внутривенные иммуноглобулины рекомендуют вводить однократно в дозе 1 г/кг;эта доза может быть повторена при необходимости. Если требуется быстрое увеличение количества тромбоцитов, то могут использоваться в/в иммуноглобулины, в том числе, в комплексе с кортикостероидами [3].
Эксперты Международного консенсуса рекомендуют пациентам, не ответившим на терапию преднизолоном, имеющим противопоказания к кортикостероидам или с тяжелыми кровотечениями, высоким риском кровотечений, перед планируемым оперативным вмешательством два режима введения в/в иммуноглобулинов: 1 г/кг 1 или 2 последовательных дня или 0,4 г/кг в течение 5 дней или анти-D иммуноглобулин (50–75 мкг/кг однократно) [4].
Важно отметить, что для внутривенных иммуноглобулинов типичным является начало подъема числа тромбоцитов уже на следующий день после первого введения,что делает такое лечение методом выбора при необходимости быстрого достижения безопасного числа тромбоцитов. В связи с этим плановое систематическое применение внутривенных иммуноглобулинов для лечения ИТП не рекомендуется и их применение целесообразно зарезервировать для таких ситуаций, когда они являются наиболее эффективной терапией, например, перед оперативными вмешательствами, в том числе перед спленэктомией, удалением зуба или в случае травмы.
Основными побочными эффектами внутривенных иммуноглобулинов являются инфузионные реакции в виде головной боли,ознобов и повышения температуры,редкие случаи асептического менингита. Существует риск тромбозов, вызванный резким повышением вязкости крови или по причине сопутствующей (сердечной) патологии и склонности больных ИТП к тромботическим осложнениям. Редким осложнением является развитие острого внутрисосудистого гемолиза, обусловленного присутствием изогемагглютининов α и, реже, β. Описано развитие нейтропении после внутривенного введения иммуноглобулинов у пациентов с ИТП, возможно, за счет усиления агрегации лейкоцитов и апоптоза нейтрофилов под действием в/в иммуноглобулина.
Что касается анти-D иммуноглобулина, то не следует забывать, что он эффективен только у резус-положительных и неспленэктомиро-ванных пациентов. При использовании стандартного режима лечения (50 мкг/кг) подъем тромбоцитов достигается медленнее,чем при введении в/в иммуноглобулинов, но количество ремиссий сходно. Повышенные дозы анти-D иммуноглобулина (75 мкг/кг) позволяют достичь практически такого же темпа подъема тромбоцитов, как и при лечении в/в иммуноглобулинами. В Российской Федерации препаратов анти-D иммуноглобулина, зарегистрированных для внутривенного введения нет.
Агонисты тромбопоэтиновых рецепторов и ритуксимаб эксперты Международного консенсуса не рекомендуют применять в 1 линии терапии ИТП.
Практическое значение имеют рекомендации таргетного количества тромбоцитов для пациентов с ИТП при выполнении хирургических и других медицинских вмешательств [4]. Как видно из таблицы 2 , при проведении малых оперативных вмешательств и спленэктомии, достаточным является уровень тромбоцитов ≥ 50 × 109/л, а больших — ≥ 80 × 109/л. Естественные роды нормально протекают при количестве тромбоцитов ≥ 50 × 109/л. Если пациенту показана антикоагулянтная терапия, то при уровне тромбоцитов ≥ 30–50 × 109, он может принимать в полных дозах один дезагрегант или один антикоагулянт (1 антитромбоци-тарный препарат, варфарин или таргетный оральный антикоагулянт). При необходимости проведения двойной терапии (2 дезагреганта или 1 дезагрегант + варфарин) уровень тромбоцитов должен быть в пределах 50–70 × 109/л.
Таблица 2.
Таргетное количество тромбоцитов для пациентов с ИТП при выполнении хирургических и других медицинских вмешательств [4]
|
Тип вмешательства |
Тромбоциты, × 109/л |
|
Профилактическая стоматология (чистка зубов) |
≥ 20 до 30 × 109 |
|
Простое удаление зуба |
≥ 30 × 109 |
|
Сложное удаление зуба |
≥ 50 × 109 |
|
Региональная дентальная анестезия |
≥ 30 × 109 |
|
Малые оперативные вмешательства |
≥ 50 × 109 |
|
Большие операции |
≥ 80 × 109 |
|
Спленэктомия |
≥ 50 × 109 |
|
Естественные роды |
≥ 50 × 109 |
|
Один антиагрегантный препарат или антикоагулянт |
≥ 30 до 50 × 109 |
|
Двойная антиагрегантная или антикоагулянтная терапия |
≥ 50 до 70 × 109 |
При жизнеугрожающих кровотечениях, для быстрого увеличения количества тромбоцитов (ближайшие 24 часа), рекомендуется использовать комбинацию внутривенных кортикостероидов с внутривенными иммуноглобулинами (класс рекомендаций A, уровень убедительности доказательств III). Кортикостероиды и внутривенные иммуноглобулины подавляют способность иммунной системы удалять тромбоциты, покрытые антителами, поэтому при их одновременном использовании эффективность гораздо выше. При крайне тяжелых кровотечениях, в частности, при внутричерепных кровоизлияниях, возможно применение концентратов тромбоцитов. По результатам одного ретроспективного анализа, совместное назначение концентратов тромбоцитов и внутривенных иммуноглобулинов привело к быстрой остановке кровотечения, существенному приросту количества тромбоцитов с минимальными побочными эффектами [13]. В тех ситуациях, когда нет ответа на кортикостероиды, внутривенные иммуноглобулины и трансфузии концентратов тромбоцитов, могут быть успешно использованы агонисты рецепторов тромбопоэтина (рТПО). Дополнительные лечебные опции включают анти-D иммуноглобулин, винкристин, винбластин, антифибринолитики (транексамовая кислота, ε-аминокапроновая кислота)в комбинации с препаратами первоначальной терапии и, в редких случаях, спленэктомию.
Следующий вопрос № 6, который был поставлен перед экспертами ASH [3]:
— Показаны ли взрослым пациентам с ИТП длительностью ≥ 3 мес., зависимым от кортикостероидов или не ответившим на кортико- стероиды, агонисты рецепторов тромбопо-этина?
Рекомендация 6
— Да, взрослым пациентам с ИТП длительностью ≥ 3 мес.,зависимым от кортикостероидов или не ответившим на кортикостероиды,по-казано назначение агонистов рецепторов тром-бопоэтина (элтромбопаг или ромиплостим).
Обновленные рекомендации международного консенсуса аналогичны. Агонисты рТПО (ромиплостим, аватромбопаг, элтромбопаг) — предпочтительный метод 2-й линии терапии, у пациентов с ИТП,не ответивших на кортикостероиды и внутривенные иммуноглобулины (класс рекомендаций A, уровень убедительности доказательств II).
Именно с этими препаратами сегодня связаны все самые оптимистические надежды в лечении пациентов с ИТП. Действие агонистов рТПО основано на принципиально ином механизме, а именно стимуляции мегакари-оцитопоэза посредством воздействия на рецепторы тромбопоэтина. Они увеличивают продукцию тромбоцитов и компенсируют их повышенное разрушение, изменяют активность Т- и В-регуляторных лимфоцитов с восстановлением иммунной толерантности. Длительный ответ, наблюдаемый на агонисты рТПО, — результат восстановления иммунных клеточных популяций. Агонисты рТПО применяются не только во 2-й, но и в последующих линиях терапии, т. е. у больных после спленэктомии, при рефрактерных формах. Начиная с 2004 г. проводились многочисленные клинические рандомизированные исследования по оценке эффективности и безопасности агонистов рТПО. Назначение агонистов рТПО сопровождалось восстановлением числа тромбоцитов у большинства пациентов с устойчивостью к стандартным методам лечения. Эти препараты зарекомендовали себя у значительной части больных, потерявших ответ на кортикостероиды или с рецидивом после спленэк-томии,что позволяло длительно и безопасно поддерживать целевой уровень тромбоцитов.
Чем это можно объяснить?Одним из объяснений может быть то, что агонисты рТПО, в отличие от иммуносупрессивного воздействия кортикостероидов и спленэктомии, обладают иммуномодулирующим действием. Они способны моделировать биологический эффект эндогенного тромбопоэтина. Ромиплостим и элтромбопаг отличаются по региону взаимодействия с рецептором тромбопоэтина. Так, ромиплостим связывается с тромбопоэтиновым рецептором,а элтромбопаг с трансмембранным доменом тромбопоэтинового рецептора. Возможно, именно этим можно объяснить отсутствие между ними перекрестной резистентности — в случае неэффективности одного из препаратов переключение на терапию другим препаратом приводило к быстрому достижению устойчивого ответа.
Агонисты рТПО обеспечивают высокую частоту ответа ( > 60 %) как у неспленэкто-мированных,так и у спленэктомированных пациентов с ИТП. Ответ сохраняется до 6–8 лет.
Рекомендуемая начальная доза ромипло-стима 1,0 мкг/кг (может достигать 3,0 мкг/кг) подкожно 1 раз в неделю с постепенным увеличением до 10 мкг/кг (максимальная доза к 10 неделе терапии)под контролем уровня тромбоцитов (целевой уровень 50 × 109/л). По результатам основных исследований, средняя еженедельная доза препарата, способная поддерживать целевой уровень тромбоцитов, составила 3–5 мкг/кг. Если количество тромбоцитов не достигает целевого уровня после 4недель применения еженедельной дозы роми-плостима, равной 10 мкг/кг, его рекомендуется отменить. В случае субоптимального тромбоцитарного ответа можно использовать низкие дозы ромиплостима (3–5 мкг/кг) в сочетании с преднизолоном. Если ответ потерян, следует провести тестирование на выявление антител к ромиплостиму.
Анализ исследований результативности применения ромиплостима свидетельствует о том,что его эффективность не зависит от возраста. Однако отмечается,что у пациентов в возрасте ≥ 65 лет показатель тромбоцитарного ответа умеренно пре- вышал таковой в возрасте < 65 лет [14]. Время до достижения тромбоцитарного ответа было короче при назначении дозы роми-плостима 3 мкг/кг, чем 1 мкг/кг (1 неделя vs. 2 недель) [15]. Ответы оставались стабильными в течение ≥ 3 недель у 82 % больных без изменения дозы,а у пациентов с тромбоцитарным ответом > 50 × 109/л — у 92 % (уровень убедительности доказательств III). Предиктором ответа считается также низкий уровень эндогенного тромбопоэтина.
D. B. Cines et al. [16] опубликован анализ 13 завершенных клинических исследований оценки эффективности ромиплостима у взрослых пациентов с иммунной тромбоцитопенией, наблюдавшихся в период с 2002 по 2014год (5 контролируемых исследований: одно — II фазы, четыре — III фазы, 5 исследований с одной группой, 2 открытых, 1 исследование посвящено оценке состояния костного мозга). В исследования были включены > 1000 пациентов, которые получали ромиплостим (основная группа) или плацебо, или стандартное лечение (контрольная группа). Кроме того выделены 2 подгруппы (1 подгруппа — 395 спленэктомированных, 2 подгруппа — 716 не-спленэктомированных пациентов), сопоставимых по возрасту и полу. Спленэктомированные пациенты имели большую продолжительность иммунной тромбоцитопении, чем пациенты с сохраненной селезенкой (медиана 8,7 и 1,6 лет) и более низкое количество тромбоцитов (медиана 14 × 109/л и 19,3 × 109/л соответственно у спленэктомированных и неспле-нэктомированных). Согласно объединенному анализу, эффективность ромиплостима была гораздо выше, чем результаты лечения в группе контроля. Причем тромбоцитарный ответ (целевой уровень тромбоцитов ≥ 50 × 109/л) регистрировался в обеих подгруппах, однако среди спленэктомированных пациентов он составил 82 %, а неспленэктомированных — 91 % (р < 0,001) (уровень убедительности доказательств Ib-III). Стабильный тромбоцитарный ответ сохранялся в течение 9–12 недель в обеих подгруппах больных. Авторы обращают внимание на то, что медиана количества тромбоцитов поддерживалась в рамках целевого диапазона (50–200 × 109/л) вне зависимости от наличия в анамнезе спленэктомии. На фоне терапии ромиплостимом в обеих подгруппах удалось уменьшить дозы или полностью отказаться от иммуносупрессивной терапии, включая глюкокортикостероиды, азатиоприн и даназол.
В целом безопасность применения ромипло-стима у пациентов,перенесших спленэктомию, и с сохраненной селезенкой сопоставима. Однако использование средств экстренной терапии, частота геморрагических нежелательных явлений и инфекций чаще наблюдались у больных с удаленной селезенкой. И еще два немаловажных факта. Подъем уровня тромбоцитов до целевого уровня у спленэктомированных больных регистрировался к 4 неделе, а у не-спленэктомированных — к 3 неделе, средняя доза ромиплостима составила 3 и 2 мкг/кг соответственно [16, 17].
Таким образом, ромиплостим эффективен у пациентов с ИТП, как до, так и после спленэктомии. Однако назначение ромиплостима больным,не ответившим на первичную терапию, т. е. в качестве 2 линии, более обосно-ванно,чем применение его в рецидиве после спленэктомии.
Элтромбопаг назначается по 25 или 50 мг/сут, максимальная доза 75 мг/сут внутрь каждые 24часа. Суточная доза снижается при количестве тромбоцитов > 200 × 109/л. У пациентов без нарушения функции печени и лиц азиатского происхождения начальная доза может быть 75 мг/сут. Если после 4 недель терапии тромбоцитарный ответ на максимальную дозу элтромбопага не получен, рекомендуется его отмена.
В литературе описано успешное применение элтромбопага у больных с впервые выявленной и персистирующей ИТП. Различий в ответе не было,хотя при впервые выявленной ИТП тромбоцитарный ответ составил 93,3 %, полных ремиссий — 86,7 %, в то время как при персистирующей — 83,3 % и 80 % соответственно [18]. Эффективность элтромбопага при хронической ИТП продемонстрирована в работе Cheng G. et al. [19]. В исследование было включено 196 взрослых ранее леченых пациентов с уровнем тромбоцитов < 30 × 109/л, которые были разделены на 2 группы. В 1 группе пациенты получали стандартную терапию+элтромбопаг 50 мг/сут, во 2-й — стандартную терапию+плацебо в течение 6 мес. Тромбоцитарный ответ в 1 группе больных составил 79 %, во 2-й — 28 %. У 18 и 40 % больных (соответственно) потребовался переход на терапию спасения. По данным Brynes R. K. et al. (исследование EXTEND), на фоне применения элтромбопага,количество тромбоцитов к 2-й неделе достигало ≥ 50 × 109/л и сохранялось в течение всего периода лечения (медиана 2, 37 года). Ответ достигнут у 85,8 % пациентов, а у 52 % — стойкий (≥ 25 недель). Низкое количество тромбоцитов ( < 15 × 109/л), более ранняя терапия и/или спленэктомия приводили к снижению ответа. По результатам других исследовательских групп, при стартовой дозе элтромбопага 50 мг/сут, частота ответа варьировала от 50 до 88,8 % [20]. Были сообщения о том,что медиана тромбоцитарного ответа на элтромбопаг составляет 75,2 % на 15 мес. терапии,однако через 2 недели после отмены препарата уровень тромбоцитов возвращался к исходным значениям [21]. Более низкое количество ответов наблюдалось среди пациентов, перенесших спленэктомию.
Перед экспертами был поставлен вопрос — какой препарат предпочтительнее элтромбопаг или ромиплостим?При подготовке рекомендаций были проанализированы все системные обзоры и клинические исследования по оценке эффективности ромиплостима и элтромбо-пага. Прямых сопоставлений эффективности препаратов найдено не было. Эксперты ссылаются на 2 системных анализа непрямого сравнения эффективности препаратов (роми-плостим vs. плацебо, элтромбопаг vs. плацебо). Наиболее показательны результаты одного непрямого сравнения, растянутого по времени наблюдения за пациентами. Первичные результаты были опубликованы Cooper K. L. et al. в 2012 г., а завершенного — в 2014 г. [22, 23]. Оценивался общий тромбоцитарный ответ и его длительность. Как видно из таблицы 3 , в группах пациентов,получавших ромипло-стим или элтромбопаг как общий ответ, так и стойкий тромбоцитарный ответ были гораздо выше, чем среди больных, получавших плацебо. Что касается эффективности двух агонистов тромбопоэтиновых рецепторов, то на фоне применения ромиплостима выявлено достоверное преимущество в достижении общего тромбоцитарного ответа по сравнению с элтромбопагом. Так, при первичном анализе общий ответ составил 83 % среди пациентов, получавших ромиплостим и 57 % — элтромбо-паг [22]. Различия сохранялись при наблюдении за больными в течение 2 лет (83 % и 67 % соответственно) (таблица 3) .
Эффективность ромиплостима и элтромбопага при ИТП: результаты непрямого сравнения
Таблица 3.
|
Показатели |
Ромиплостим |
Плацебо |
Элтромбопаг |
Плацебо |
|
Пациенты, n |
83 |
42 |
135 |
62 |
|
Общий ответ, n/ % |
69 (83) |
3 (7) |
77 (57) |
7 (11) |
|
ОШ и 95 % ДИ |
0,11 (0, 02–0,66) [p = 0, 01] |
|||
|
Стойкий ответ, n/ % |
41 (49) |
1 (2) |
57 (42) |
4 (6) |
|
ОШ и 95 % ДИ |
0, 15 (0, 01–1, 88) [P = 0, 08] |
|||
|
Cooper K. L., Fitzgerald P., Dillingham K. et al., 2012 [14] |
||||
|
Пациенты, n |
83 |
42 |
135 |
62 |
|
Общий ответ, n/ % |
69 (83) |
3 (7) |
91 (67) |
8 (13) |
|
ОШ и 95 % ДИ |
0,15 (0,02–0,84) |
|||
|
Стойкий ответ, n/ % |
41 (49) |
1 (2) |
63 (47) |
4 (6) |
|
ОШ и 95 % ДИ |
0,20 (0,01–2,13) |
|||
|
Cooper K, Matcham J, Helme K, Akehurst R., 2014 [15] |
||||
Примечание . ОШ — отношение шансов и95 % ; ДИ —95 % доверительный интервал.
Однако не получено достоверных различий в исследуемых группах по продолжительности тромбоцитарного ответа (отношение шансов 0,2, 95 % ДИ 0,01–2,13) [23].
Не было обнаружено никаких различий в исходах ответа, частоте кровотечений и времени прекращения или уменьшения дозы кортикостероидов. Агонисты тромбопоэтиновых рецепторов (ромиплостим, элтромбопаг) улучшают качество жизни у пациентов, которые отвечают на лечение, снижают утомляемость. Полученные данные позволяют сделать заключение об отсутствии различий в эффективности ро-миплостима и элтромбопага.
При выборе препарата (элтромбопаг или ромиплостим?) необходимо учитывать индивидуальные предпочтения пациента — либо еженедельные подкожные инъекции (роми-плостим), либо ежедневное использование перорального препарата (элтромбопаг принимается внутрь каждые 24часа за 2 часа до или через 2 часа после приема пищи). Важно обратить внимание на то, что между приемами элтромбопага и других лекарственных препаратов и продуктов, содержащих витамины, поливалентные катионы (железо, кальций, алюминий, магний, селен, цинк), антацидов, молочных продуктов,интервал должен составлять не менее 4ч.
Пациент также должен знать, что возможно самостоятельное введение ромиплостима при стабильном уровне тромбоцитов в диапазоне от 50,0 × 109/л до 200,0 × 109/л и стабильной дозе препарата в течение 1 месяца. Диетические ограничения для пищевых продуктов и поливалентных катионов,таких как кальций, при применении элтромбопага могут быть обременительными для пациентов и поэтому могут повлиять на его решение.
В Российской Федерации оба препарата применяются в терапии ИТП уже в течение нескольких лет, врачам хорошо известны их основные характеристики и возможные нежелательные явления. Как видно из таблицы 4 , на фоне применения ромиплостима и элтром-бопага наблюдаемые нежелательные явления во многом сходны. Вызывало беспокойство увеличение ретикулинового фиброза (при длительном применении описан и фокальный коллагеновый) в костном мозге, однако риск развития клинически значимого фиброза костного мозга оказался крайне мал [24, 25]. Фиброз костного мозга был зарегистрирован у 6,9 % больных, получавших ромиплостим, и у 3,8 % — элтромбопаг, но больные продолжали лечение,а после завершения терапии наблюдалось его обратное развитие [14, 26].
Исследования костного мозга не являются обязательными до начала терапии агонистами рТПО, но необходим регулярный контроль показателей крови. Биопсия костного мозга должна быть выполнена,если нет ответа на лечение в течение ожидаемого срока или если появляются сомнения в диагнозе.
На фоне терапии агонистами рТПО описывают флуктуацию уровня тромбоцитов. На сегодняшний день стандартного определения этого осложнения нет. Но, вероятно, флуктуацию уровня тромбоцитов можно определить
как снижение их количества < 30 × 109/л или, наоборот, повышение > 400 × 109/л каждые 2 недели в течение месяца,или подъем до уровня > 200 × 109/л в течение недели при отсутствии дополнительной сопроводительной терапии.
Таблица 4.
Основные нежелательные явления ромиплостима и элтромбопага
|
Ромиплостим |
Элтромбопаг |
|
Головная боль — 31 % |
Головная боль — 26 % |
|
Тошнота, диарея, боли в животе — 24 % |
Тошнота, диарея, боли в животе — 14 % |
|
Инфекции назофарингеальные и верхних дыхательных путей — 21 % |
Инфекции назофарингеальные и верхних дыхательных путей — 23 % |
|
Артериальные или венозные тромбозы — 6 % |
Артериальные или венозные тромбозы — 6% |
|
Фиброз костного мозга (увеличение образования ретикулина) — 6,9 % |
Фиброз костного мозга (увеличение образования ретикулина) — 3,8 % |
|
Слабость, утомляемость — 24 % Боль в суставах — 20 % |
Повышение активности АЛТ и АСТ — < 15 %, билирубина — 4 % (у 3 % причина отмены) |
|
Покраснение, боль в месте инъекции, гематома в месте инъекции, дерматит |
Катаракта, кровоизлияние в конъюнктиву |
|
Петехиальная сыпь — 17 % |
Повышает биодоступность статинов, усиливает действие опиоидных анальгетиков, НПВС |
|
Флуктуация уровня тромбоцитов |
Флуктуация уровня тромбоцитов |
Но есть и различия по нежелательным явлениям. Так, элтромбопаг оказывает ге-патотоксическое действие, поэтому требуется осторожность при применении его у пациентов с заболеваниями печени. При умеренных и тяжелых заболеваниях печени элтромбопаг следует применять в начальной дозе 25 мг/сут и под тщательным контролем функциональных тестов печени. Определение активности печеночных трансаминаз (АЛТ, АСТ) и содержания билирубина проводят перед началом лечения, каждые 2 недели во время периода коррекции дозы и ежемесячно после установления постоянной дозы. Элтромбопаг следует отменить, если значение АЛТ превысило верхнюю границу нормы в 3 раза и прогрессирует, или сохраняется в течение 4 недель и более, или сопровождается повышением содержания прямого билирубина, или появляются клинические симптомы заболевания печени,или развивается декомпенсация функции печени. Возобновление терапии элтромбопагом не рекомендуется. Увеличение активности трансаминаз на фоне терапии элтромбопа-гом, безусловно, требует внимания, однако это нежелательное явление было редким, в большинстве случаев умеренным и обратимым и в целом не влияло на эффективность. Описано развитие катаракты и кровоизлияний в конъюнктиву, а также взаимодействие элтромбопага с другими лекарственными препаратами (таблицы 4).
Учитывая отсутствие различий в количестве стабильных тромбоцитарных ответов, отсутствие прямых сравнительных исследований эффективности ромиплостима и элтромбопа-га, в целом сходство нежелательных явлений, а увеличение активности трансаминаз на фоне терапии элтромбопагом в большинстве случаев было умеренным и обратимым,эксперты предлагают основываться на предпочтениях пациента.
В рекомендациях Международного консенсуса представлен аватромбопаг — еще один агонист рТПО, который, как и элтромбопаг, связывается с трансмембранным доменом тромбопоэтинового рецептора. Он стимулирует пролиферацию и дифференцировку мегакариоцитов из клеток-предшественников костного мозга,что приводит к увеличению продукции тромбоцитов. Препарат одобрен
FDA для лечения взрослых больных с хронической ИТП. Назначается внутрь по 20 мг ежедневно под контролем уровня тромбоцитов, максимальная доза 40 мг. Аватромбопаг не взаимодействует с пищей или катионами, как элтромбопаг, и при его использовании нет необходимости контролировать функцию печени. По результатам клинического исследования 2 фазы, 93 % пациентов с хронической ИТП к 7 дню от начала приема аватромбопага в дозе 20 мг достигали целевого уровня тромбоцитов, который сохранялся в течение 6 мес. [27]. В рандомизированном исследовании 3 фазы аватромбопаг в дозе 20 мг/сут применялся в течение 24недель. Тромбоцитарный ответ был получен к 8 дню у 66 % больных и сохранялся > 12 мес. [28].
При обсуждении2 линии терапии, перед экспертами ASH, было поставлено 3 вопроса [3] :
— Взрослым пациентам с ИТП длительностью ≥ 3 мес., которые не ответили на кортикостероиды или являются зависимыми от кортикостероидов, лучше выполнить спленэктомию или назначить агонисты рТПО?
Рекомендация 7
— Можно выбрать любую опцию, т. е. или выполнить спленэктомию,или назначить агонисты рТПО (условная рекомендация, основанная на очень низкой достоверности доказательств). Пациенты, которые считают приоритетом избегание длительного применения лекарственных препаратов, могут предпочесть спленэктомию. Пациенты, которые хотят избежать операции, могут предпочесть агонисты рТПО.
— Следует ли взрослым пациентам с ИТП длительностью ≥ 3 мес., которые не ответили на кортикостероиды или являются кортико-стероид-зависимыми, выполнить спленэктомию или целесообразнее терапия ритуксимабом?
Рекомендация 8
— Эксперты рекомендуют ритуксимаб, а не спленэктомию (условная рекомендация, основанная на очень низкой достоверности доказательств).
В то же время важно,подчеркивают эксперты, мнение пациентов. Тем, которые хотят избежать операции,можно предпочесть назначение ритуксимаба. Пациентам, которые отказываются от лекарственных препаратов и для которых более важен долговременный ответ, следует выполнить спленэктомию.
— Взрослым пациентам с ИТП длительностью ≥ 3 мес., которые не ответили на кортикостероиды или являются кортикостероид-зависимыми, предпочтительнее назначить в качестве второй линии терапии ритуксимаб или агонисты рТПО?
Рекомендация 9
— Взрослым пациентам с ИТП длительностью ≥ 3 мес., которые не ответили на кортикостероиды или являются кортикостероид-за-висимыми, рекомендуется назначить агонисты рТПО, а не ритуксимаб. Ритуксимаб — 3 линия терапии,при отсутствии ответа на агонисты рТПО.
Однако этот вопрос также требует обсуждения с пациентом. Если для пациента более важен долговременный ответ, то следует назначить агонисты рТПО, а если пациент против длительного медикаментозного лечения, то ритуксимаб.
Рекомендации 7–9 являются результатом оценки альтернативных методов лечения ИТП. Каждый из этих методов лечения может быть успешно применен во второй линии терапии и поэтому выбор лечения должен быть персонифицирован и обсужден с пациентом для выяснения его предпочтений. Учитывая крайне малое количество многоцентровых клинических исследований, экспертами были проанализированы результаты одноцентровых исследований по оценке эффективности спленэктомии, ритуксимаба и агонистов рТПО. Важен учет длительности ИТП, частоты эпизодов кровотечения, требующих госпитализации, сопутствующих заболеваний, возраста пациента, медико-социальной поддержки, стоимости и доступности лекарственных препаратов. Немаловажным является безопасность того или иного метода, и это также нужно обсудить с больным.
Выше уже были представлены данные по эффективности агонистов рТПО. Однако нельзя не отметить еще один немаловажный факт. При достижении тромбоцитарного ответа (количество тромбоцитов ≥ 50 × 109/л) и сохранении его в течение 6–12 месяцев без сопутствующей терапии и геморрагий, можно начинать постепенное снижение дозы препаратов. При этом часть пациентов могут отменить терапию, т. е. существует возможность длительного поддержания тромбоцитарного ответа после прекращения терапии агонистами рТПО. Основными показаниями для начала снижения дозы могут выступать следующие — достижение полной ремиссии, достижение гемостатического уровня тромбоцитов и эффективность небольших доз агонистов рТПО. Отмену рекомендуется проводить медленно с постепенным титрованием дозы. Предлагаются различные варианты отмены ромиплостима — постепенное снижение дозы в течение ≥ 3 недель, снижение по 0,5 мкг/кг еженедельно, затем по 0,5 мкг/кг ежемесячно,снижение по 1 мкг/кг каждые 2 недели. Дозу элтромбопага снижают на 10– 20 % каждые 4 недели. Целью является полная отмена препаратов при сохранении стабильного ответа на терапию (уровень тромбоцитов от 50 до 100 × 109/л).
Сохранение ответа после отмены агонистов рецепторов тромбопоэтина у пациентов с хронической ИТП подтверждается результатами многочисленных исследований. Как видно из таблицы 5 , у 15–29 % больных с хронической ИТП ответ после отмены агонистов рТПО сохранялся от 6 до 33 месяцев.
Newland A. et al. [29] опубликованы результаты интервенционного исследования 2 фазы, в котором оценивались тромбоцитарный ответ и частота ремиссии у взрослых пациентов, страдавших ИТП,диагноз которой был установлен за ≤ 6 месяцев до включения в исследование, и которые получали ромиплостим длительностью до 12 месяцев. Начальная доза препарата составила 1 мкг/кг, а затем корректировалась еженедельно до достижения количества тромбоцитов 50–200 × 109 /л. При количестве тромбоцитов ≥ 50 × 109 /л начинался период постепенного снижения дозы препарата до 0 при сохранении целевого уровня тромбоцитов. Согласно полученным результатам, медиана времени до достижения тромбоцитарного ответа составила 2,1 недели, а медиана недельной дозы ромиплостима — 2, 6 мкг/кг. Тромбоцитарный ответ (количество тромбоцитов ≥ 50 × 109/л) достигнут у 93 % пациентов, у 61 % пациентов он сохранялся в течение 11 месяцев. Более важно, что у 32 % пациентов количество тромбоцитов на уровне ≥ 50 × 109/л сохранялось после отмены ромиплостима в течение 24 недель.
Таблица 5.
Длительность ответа после отмены агонистов рецепторов тромбопоэтина у пациентов с хронической ИТП
|
Авторы |
Больные, n |
Отмена агонистов рТПО |
|
|
Длительный ответ, n ( % от всех больных) |
Медиана наблюдения, мес. |
||
|
Newland A. et al. Haematologica 2011; 96:98 |
— |
4 |
29,5 |
|
Ghadaki B. et al. Transfusion 2013; 53:2807 |
31 |
5 (16) |
9,5 |
|
Gonzalez-Lуpez T. et al. Am J Hematol. 2015; 90(3): E40-E43 |
— |
26 (53) |
> 6 |
|
Bussel J. et al. Blood 2013; 122:328 |
— |
27 |
>6 |
|
Stasi R. et al. Blood 2013; 122:1074 |
38 |
11 (29) |
6 |
|
Mahevas M. et al. Br J Haematol 2014; 165:865 |
54 |
8 (15) |
13,5 (6–26) |
|
Crvinek L. et al. Int J Hematol 2015; 102:7 |
46 |
11 (24) |
33 (17–54) |
|
Marshall A. L. et al. Haematologica. 2016; 101(12): e476-e478 |
— |
28 % |
32 |
При невозможности полной отмены агонистов рТПО целью может быть максимальная минимизация дозы препаратов, позволяющей поддерживать количество тромбоцитов > 30–50 × 109/л с минимальными геморрагическими проявлениями и минимальными побочными явлениями.
Таким образом, в качестве второй линии терапии пациентам с ИТП длительностью
≥ 3 мес. (персистирующая или хроническая) следует отдать предпочтение агонистам рТПО, которые позволяют добиться длительного тромбоцитарного ответа с возможностью его сохранения после их отмены.
Немаловажным фактом является эффективность повторного использования агонистов рТПО в случае рецидива ИТП. При этом частота и тяжесть побочных эффектов не увеличивает- ся. Кроме того, получены убедительные доказательства того, что в случаях непереносимости, первоначальной или развившейся резистентности к одному из препаратов — агонистов рецепторов тромбопоэтина, возможна замена одного на другой, т. е. ромиплостим — элтромбопаг или, наоборот, элтромбопаг-ромиплостим. Переключение эффективно у 50–80 % пациентов, что приводит к эрадикации флуктуации уровня тромбоцитов у 54 % пациентов и разрешению нежелательных явлений у всех (уровень доказательности IIb). Когда переключение было вызвано побочными эффектами или предпочтениями пациента, тромбоцитарный ответ составил 100 % (уровень доказательности III).
При подготовке рекомендаций по применению спленэктомии, в связи с отсутствием проспективных исследований, были проанализированы результаты ретроспективных исследований, опубликованных после 2004 г. Спленэктомия — это, как и агонисты рТПО, так и ритуксимаб, один из возможных вариантов 2 линии терапии ИТП.
Если принято решение о выполнении спленэктомии, то, по мнению экспертов, предпочтительна лапароскопическая спленэктомия, которая требует более короткой госпитализации и сопровождается меньшей кровопотерей, а эффективность ее сходна с лапаротомией. Перед операцией количество тромбоцитов должно быть более 50 × 109/л. В то же время, некоторые исследователи успешно проводили лапароскопическую спленэктомию при уровне тромбоцитов < 10 × 109/л [30]. Стероиды, внутривенные иммуноглобулины и агонисты рТПО могут использоваться для повышения уровня тромбоцитов перед оперативным вмешательством. Спленэктомия должна выполняться опытным хирургом, который не пропустит дополнительные доли селезеночной ткани [3, 4]. Общий ответ после выполнения спленэктомии достигает 90 %, хотя эти данные могут быть преувеличены за счет спонтанной ремиссии в ряде случаев [30–32]. Ответ сохраняется в течение 10 лет у 78 % больных [32], однако у 20–30 % больных в течение первых 2 лет развиваются рецидивы [33], а у 19 % больных спленэктомия не эффективна [31].
Следует помнить, что спленэктомии сопровождается развитием осложнений различной степени тяжести (тромбозы, инфекции и др.). В целом частота осложнений,связанных с оперативным вмешательством, составляет 12, 8%. Чаще послеоперационные осложнения и рецидивы встречаются у пациентов в возрасте ≥ 60 лет, у ослабленных пациентов и при выявлении сопутствующей патологии [34]. Поэтому у этой категории больных вряд ли стоит обсуждать этот метод лечения.
Кумулятивная частота тромбозов портальной системы, по данным Boyle S, et al. [35], после спленэктомии составила 1,6 %, а тромбозов глубоких вен и тромбоэмболии легочной артерии — 4,3 %. По результатам другого исследования [36], ежегодная частота тромбозов после спленэктомии составила 2,9 %. Причем пациенты,как в раннем постспленэтомическом периоде (< 90 дней), так и в позднем (≥ 90 дней), имеют высокий риск артериальных и венозных тромбозов. Поэтому всем пациентам в послеоперационном периоде рекомендуется тромбопро-филактика, которая должна проводиться до тех пор, пока количество тромбоцитов не достигнет 30–50 × 109/л. Артериальные и венозные тромбозы с частотой 6,6 % и 10,2 % (соответственно) встречаются в течение 5 лет [37].
Спленэктомия сопряжена с риском развития инфекционных осложнений (пневмония, менингит, септицемия). Этот риск особенно высок среди пациентов,получивших до спленэктомии множество курсов иммуносупрессивной терапии. Наиболее частыми возбудителями являются Streptococcus pneumonia, Neisseria meningitidis, Haemophilius influenzae. Кумулятивная частота сепсиса составила 11,1 %, при этом в ранний послеоперационный период (< 90 дней) — 2,6 % (отношение шансов 3,3 [ДИ 2,4–4,6]), в поздний (≥ 90 дней) — 3,8 % (отношение шансов 1,6 или 3,1 в зависимости от числа коморбидностей). Высокий риск тяжелых инфекций после спленэктомиии сохраняется длительное время (≥ 10 лет). Поэтому пациентам, планируемым на операцию, требуется профилактическая вакцинация за 2 недели до спленэктомии и в течение последующей жизни: поливалентная пневмококковая вакцина к Streptococcus pneumonia подкожно каждые 5 лет;сезонная противогриппозная вакцинация; четырехвалентная комбинированная менингококковая вакцина с ревакцинацией каждые 3–5 лет. Кроме того, показано профилактическое назначение антибиотиков (от 3 до 6 мес. после спленэктомии прием амоксициллина или эритромицина). Более длительный прием показан при высоком риске инфекций (пожилые и ослабленные пациенты), пациентам с плохим ответом на вакцинацию. Риск развития инфекций с течением времени может снизиться, но не исчезает, несмотря на анти-биотикопрофилактику и вакцинацию. Так, примерно, у 4 % больных риск сепсиса существует в течение последующих 30 лет [4, 36].
В когортном исследовании в США, проведенном S. Kristinsson (2014), было установлено, что спленэктомированные пациенты имели повышенный риск развития солидных злокачественных новообразований (пищевод, толстый кишечник, легкие, поджелудочная железа) и гематологических опухолей (лимфомы, множественная миелома, острые и хронические лейкозы).
Существуют ли предикторы ответа на спленэктомию? Ретроспективный анализ различных факторов (возраст, пол, уровень тромбоцитов при диагностике ИТП, антитромбоцитарные антитела,время от первичной диагностики до спленэктомии, ответ на внутривенные иммуноглобулины и кортикостероиды, кинетика тромбоцитов) не выявил предикторов устойчивого ответа на спленэктомию [31, 34, 36]. Хуже результаты в пожилом возрасте (≥ 60 лет). Проведение операции,у этой категории больных, сопровождается достоверным увеличением частоты рецидивов и послеоперационных осложнений. Не следует забывать об ослабленных и имеющих сопутствующие заболевания пациентах, которые также имеют высокий риск ранних рецидивов после выполнения спленэктомии. По мнению Sarpatwary A. et al. [38], в качестве предиктора можно рассматривать выявление селезеночного типа секвестрации. Для этих целей применяют метод сканирования аутологичных тромбоцитов, меченных индием. Однако этот метод не нашел широкого распространения в клинической практике. В то же время при печеночном/смешанном типе секвестрации тромбоцитов результаты спленэктомии хуже.
В отношении спленэктомии эксперты,ос-новываясь на анализе литературных данных и учитывая вероятность развития ремиссии у пациентов с длительностью заболевания < 12 мес., рекомендуют выжидательную тактику (может быть рекомендована ≥ 12–24 мес. от момента диагностики ИТП). Между тем, ри-туксимаб, как выяснилось, более эффективен при ИТП < 12 мес. Поэтому при длительности ИТП > 12 мес. выбор сводится к двум опциям — агонисты рТПО или спленэктомия.
Что касается ритуксимаба, то это тоже возможный вариант 2 линии терапии,он может использоваться и при потере ответа или при 20
неэффективности агонистов рТПО. Ритуксимаб вызывает длительную деплецию пула зрелых В-лимфоцитов, в том числе продуцирующих аутореактивные антитела, что привело к его широкому использованию при аутоиммунных заболеваниях. Ритукcимаб назначается либо в дозе 375 мг/м2 1 раз в неделю, либо 100 мг в/в еженедельно в течение 4недель;эффек-тивность сопоставима,т. е. использование разных схем (доза, время введения) не влияет на эффективность ритуксимаба. Согласно мета-анализу 5 клинических исследований [39, 40], общий ответ на ритуксимаб составил 57 % (полная ремиссия — 38 %, частичная ремиссия — 19 %). У 38 % больных ремиссия сохранялась в течение 1 года, а у 21 % — 5 лет. Как отмечено в рекомендациях [4], ритуксимаб более эффективен у пациентов в возрасте до 40 лет и женщин с длительностью ИТП менее 1 года, т. е. до перехода в хроническую фазу, что наглядно продемонстрировано в исследовании Marangon M. et al. [41]. Пациенты с более короткой продолжительностью заболевания имели значимо более высокую вероятность достижения ответа (р = 0,082); пациенты в возрасте < 40 лет и женщины с большей вероятностью достигали полного ответа (р = 0,025 и р = 0,009 соответственно). На различия в эффективности ритуксимаба у больных, сгруппированных с учетом пола пациентов и длительности ИТП, указывает и Chapin J. et al. [42]. При длительности ИТП < 12 мес у 52,7 % пациентов наблюдались ответы на ритуксимаб + 3 цикла дексаметазона по сравнению с 15,3 % пациентов с длительностью заболевания > 12 мес (р = 0,02). У женщин с длительностью ИТП < 12 месяцев частота длительных ответов составила 78,6 %, у мужчин — 21,2 %. У больных с длительностью ответа на ритуксимаб ≥ 1 года, развитие рецидива, в случае достижения частичной ремиссии, наблюдалось в 53 % случаев, полной ремиссии — 31 % [39].
В другом исследовании, больных с хронической ИТП,не ответивших на кортикостероиды, распределили на 2 группы — спленэктомия или ритуксимаб [42]. Различий в эффективности выявлено не было. Однако частота летальных исходов в группе больных, получавших ритук-симаб,была меньше. У спленэктомированных пациентов на фоне ритуксимаба наблюдалась тенденция к развитию рецидива раньше,чем у пациентов без спленэктомии. Именно такие результаты явились основанием считать ри-туксимаб альтернативой спленэктомии [40, 43].
При 5-летнем наблюдении ремиссия сохранялась у 20–30 % больных. Однако у 40 % больных терапия не эффективна. Не выявлено убедительных предикторов ответа и развития рецидива.
В целом терапия ритуксимабом неплохо переносится. Однако следует помнить об инфузионных реакциях, реактивации HBV, прогрессирующей мультифокальной лейкоэнцефалопатии, кожно-слизистых реакциях, гипогаммаглобулинемии и риске тяжелых инфекций.
В настоящее время ритуксимаб не зарегистрирован для лечения ИТП,однако в исключительных случаях может использоваться по решению врачебной комиссии и при наличии информированного согласия пациента.
Прямых сравнительных клинических исследований эффективности спленэктомии, ритуксимаба и агонистов рТПО не проводилось. Эксперты при обсуждении рекомендаций ориентировались на результаты непрямого сравнения. Установлено, что частота тромбоцитарного ответа на спленэктомию,агонисты рТПО или ритуксимаб, на 1 месяц терапии, составила 86,7 %, 65,7 % и 62,1 % соответственно. Однако длительных ответов на агонисты рТПО было гораздо больше, чем на ритуксимаб (63,2 % vs. 39,4 %). В свою очередь выявлены преимущества спленэктомии перед ритуксимабом, а именно: длительный ответ — 53,0 % и 39,4 %, ремиссия — 68,8 % и 23,5 % соответственно. Однако существенных различий в частоте тяжелых кровотечений в группах больных, леченных с использованием спленэктомии, агонистов рТПО и ритуксимаба выявлено не было (4,6 %, 3,5 % и 2,2 % соответственно) [3]. Исходя из того, что долговременные ответы чаще наблюдаются при использовании спленэктомии и агонистов рТПО, чем ритуксима-ба,эксперты рекомендуют во второй линии терапии применять или спленэктомию или агонисты рТПО. Хотя с учетом длительности заболевания, скорее всего, следует обсуждать следующие показания: ИТП < 12 мес. — агонисты рТПО vs. ритуксимаб; > 12 мес. — агонисты рТПО vs. спленэктомия.
В рекомендациях [3, 4] неоднократно обращается внимание на то, что выбор следует обсуждать с пациентом, объяснив ему суть каждого лечебного подхода и возможные нежелательные явления. Пациенты, которые считают приоритетом избегание длительного применения лекарственных препаратов, могут предпочесть спленэктомию или ритуксимаб. Пациенты, которые хотят избежать операции, могут предпочесть 4-недельный курс лечения ритуксимабом. В то же время ответ непродолжительный, ремиссия сохраняется только у 20–30 % больных. К тому же, как и при спленэктомии, существует риск тяжелых инфекций.
Пациентам,для которых приоритетом является долговременный ответ, следует предложить два метода — спленэктомию или агонисты рТПО. Однако надо обратить внимание на то, что агонисты рТПО вызывают наилучший ответ при их раннем назначении, т. е. до спленэктомии, при отсутствии ответа на 1 линию терапии. Эффективность раннего назначения аТПО-р (до спленэктомии, при переводе с первой линии терапии), вероятно, обеспечивается обратимостью иммунных нарушений. Серьезным недостатком спленэктомии следует признать частоту и тяжесть различных осложне-ний,что является основанием ее выполнения на следующем этапе лечения. Больных необходимо информировать о долгосрочных рисках спленэктомии.
Обсуждая преимущества и недостатки, следует отметить, что все три подхода могут применяться во 2 линии терапии ИТП. Между тем нет сомнений в том,что агонисты рТПО предпочтительнее и ритуксимаба,и спленэктомии. Они не обладают иммуносупрессивным действием,их применение позволяет добиться длительных и стойких ремиссий,а у 20–30 % больных существует возможность выздоровления. Спленэктомия продолжает оставаться разумным вариантом лечения для многих пациентов, в том числе для тех, кто ведет активный образ жизни и хочет освободиться от медикаментозного лечения и контроля, а также для пациентов с фульминантным вариантом ИТП, который плохо реагирует на медикаментозную терапию [44]. Но необходимо учитывать долгосрочные риски инфекционных и тромбоэмболических осложнений. Не существует убедительных показаний к проведению спленэктомии у пациентов с длительностью заболевания менее 12 мес., с хронической, резистентной к терапии ИТП без кровотечения,с легким или умеренным кровотечением (степени 0, I, II по ВОЗ). К показаниям следует отнести тяжелую рефрактерную ИТП, не ответившую на агонисты рТПО и ритуксимаб, в некоторых случаях тяжелые кровотечения (степени III, IV по ВОЗ), требующие быстрого подъема тромбоцитов и поддержания их безопасного уровня.
На сегодняшний день уже не вызывает сомнений тот факт, что наиболее убедительна стратегия последовательного назначения: агонисты рТПО — ритуксимаб — спленэктомия. Весьма интересной в этом плане представляется работа Barbara Skopec at al., опубликованная в 2018 г. [45]. Авторами были смоделированы 3 стратегии 2 линии терапии ИТП, включивших спленэктомию,агонисты рТПО и ритуксимаб (с дексаметазоном и микофенолатом мофети-лом). Причем проведена оценка эффективности шести последовательных подходов к лечению: 1)спленэктомия — ритуксимаб — агонисты рТПО (СРТ), 2) спленэктомия — агонисты рТПО — ритуксимаб (СТР), 3) ритуксимаб — спленэктомия — агонисты рТПО (РСТ), 4) ри-туксимаб — агонисты рТПО — спленэктомия (РТС), 5) агонисты рТПО — спленэктомия — ритуксимаб (ТСР), 6) агонисты рТПО — ри-туксимаб — спленэктомия (ТРС). Пациенты, вошедшие в исследование,были разделены на три категории: 1) ответившие с уровнем тромбоцитов > 50 × 109/л после лечения, который сохранялся в последующем без дальнейшего лечения; 2) ответившие, но количество тромбоцитов выше 50 × 109/л сохранялось только на фоне терапии и уменьшалось (< 30 × 109/л), если лечение прекращалось;3)не ответившие больные,количество тромбоцитов не выше 30 × 109/л,несмотря на лечение. Сформировано 27 групп пациентов, включивших по 3 группы для каждой из трех категорий (3 × 3 × 3).
За пациентами следили на протяжении всей их жизни.
Как видно из таблицы 6 , наибольший срок жизни больных ИТП выявлен при 6-м подходе к лечению «ТРС: агонисты рТПО — ритук-симаб — спленэктомия» — 42,42 года. Самая высокая смертность (обусловленная оперативным вмешательством, тромбозами и постспле-нэктомическим сепсисом) наблюдалась при применении стратегии «СРТ: спленэктомия — ритуксимаб — агонисты рТПО); длительность жизни — 41 57 лет. Неплохо зарекомендовало себя 4-й подход «РТС: ритуксимаб — агонисты рТПО — спленэктомия;срок жизни пациентов — 42,3 года.
По мнению экспертов Международного консенсуса в качестве альтернативы может быть предложен фостаматиниб — селективный низкомолекулярный ингибитор тирозинкиназы селезенки, который был одобрен FDA в 2018 года для лечения взрослых пациентов с хронической ИТП,не ответивших на предыдущее лечение. В двух рандомизированных плацебо контролируемых клинических исследованиях фоста-матиниб назначался пациентам с хронической ИТП,которые не ответили на спленэктомию, агонисты рТПО и/или ритуксимаб. Медиана длительности ИТП составила 8,5 лет. Начальная доза фостаматиниба 100 мг два раза в день (у не ответивших больных доза увеличивалась до 150 мг два раза в день).
Таблица 6.
Срок жизни пациентов с ИТП с учетом изменения последовательности лечебных подходов во 2 линии терапии
|
Стратегия лечения — последовательность лечебных методов |
Срок жизни пациентов с ИТП, лет |
|
СРТ (спленэктомия-ритуксимаб-агонисты рТПО) |
41,57 |
|
СТР (спленэктомия-агонисты рТПО-ритуксимаб) |
41,52 |
|
РСТ (ритуксимаб-спленэктомия-агонисты рТПО) |
42,16 |
|
РТС (ритуксимаб-агонисты рТПО-спленэктомия) |
42,3 |
|
ТСР (агонисты рТПО-спленэктомия-ритуксимаб) |
41,9 |
|
ТРС (агонисты рТПО-ритуксимаб-спленэктомия) |
42,42 |
Общий ответ составил 43 %, но стабильный ответ (тромбоциты ≥ 50 × 109/л в течение 4 из 6 недель) только 18 % против 2 % в группе плацебо (р = 0,0003). Однако время до ответа было коротким и составило в среднем 15 дней. У пациентов, ранее получавших агонисты рТПО, частота стабильного ответа составила 17 %. Наиболее частыми нежелательными явлениями были артериальная гипертензия и диарея [46].
Приблизительно 20 % пациентов не достигают гемостатического количества тромбоцитов после спленэктомии или не отвечают на медикаментозные лечебные препараты. Некоторые пациенты с ИТП не чувствительны или менее чувствительны к рекомендуемым лечебным подходам. Для таких ситуаций существует и другие варианты терапии хронической ИТП. Между тем, следует помнить, что некоторые пациенты могут хорошо переносить тяжелую тромбоцитопению (количество тромбоцитов 10 × 109/л) с вполне удовлетворительным качеством жизни. Они отказываются от дальнейшего лечения, ссылаясь на токсичность лекарственных препаратов, отказываются от спленэктомии. В то же время у других пациентов наблюдается существенное снижение качества жизни, возникают кровотечения различной степени тяжести. В этой ситуации необходимость дальнейшей терапии должна обсуждаться с пациентом, следует учитывать баланс эффективность/токсичность терапии.
Однако вначале необходимо провести повторное тщательное обследование больного для уточнения диагноза. Затем у больных, получивших на предыдущих этапах лечения кортикостероиды, агонисты рТПО, ритукси-маб, спленэктомию, нужно оценить адекватность предшествующей терапии (например, была ли использована полная доза агонистов рТПО?Были ли попытки повторного применения агонистов рТПО?). Оценить риски и преимущества дальнейшего лечения. Если нет ответа на один агонист рТПО, то возможен переход на другой (уровень доказательности IIb, III). Оценить возможность спленэктомии, если она еще не выполнена. У пациентов с рецидивом после первоначального ответа на спленэктомию следует провести исследование с целью выявления добавочных селезенок. У некоторых больных может быть полезным применение ритуксимаба в сочетании с преднизолоном.
В дальнейшем рассмотреть другие методы лечения (например, ММФ, азатиоприн, дап-сон, даназол). Однако эффективность их не имеет надежных доказательств. Результаты исследований представлены в относительно небольших и неоднородных группах пациентов, без учета длительности заболевания, тяжести и предшествующего лечения, которые могут существенно отличаться от применения этих препаратов в клинической практике. Был проведен систематический обзор опубликованных результатов, и эти лекарственные препараты представлены в рекомендациях с краткими данными об эффективности и безопасности. Никаких рекомендаций в отношении их применения не делается, но они могут быть использованы при отсутствии ответа на все рекомендуемые лечебные подходы.
Азатиоприн — иммунодепрессант из группы антиметаболитов. Назначается внутрь в дозе от 50 до 200 мг в день у взрослых и иногда в сочетании с даназолом. До достижения ответа требуется несколько месяцев (51,2–64,2 %). Однако примерно половина пациентов для поддержания ответа нуждается в постоянной терапии. Азатиоприн является одним из немногих препаратов, считающихся «безопасными» при беременности,без увеличения частоты пороков развития плода и безопасными в период лактации. Его основными побочными эффектами являются тошнота,инфекция (9,9 %), нарушения функции печени, нейтропения и анемия.
Циклофосфамид относится к группе цитостатических противоопухолевых лекарственных средств, обладающих алкилирующего типа действием. Обычная пероральная доза для взрослых от 50 до 200 мг в сутки. Частота ответа при ИТП крайне вариабельна (от 10 % и 70 %). Основные побочные эффекты — нейтропения, инфекции (9,9 %), бесплодие, вторичные злокачественные новообразования и геморрагический цистит. С 2005 года не было зарегистрировано никаких исследований этого агента при ИТП [47].
Циклоспорин А — иммуносупрессивное средство. Обычная начальная доза от 3 до 6 мг/кг в сутки, максимальная — 200 мг. Ответ по состоянию на 1 месяц колеблется от 37,8 % до 56,7 %; длительный ответ — от 23,3 % до 44 %. Основные побочные эффекты циклоспорина А включают гиперплазию десен (6,6 %), гипертонию (11,6 %), нефротоксичность (6,7 %) и тошноту [48]. Он не предназначен для использования во время беременности или кормления грудью.
Даназол — синтетический андроген. Обычная пероральная доза 200–800 мг в сутки для взрослых. В клинических исследованиях через 1 месяц лечения даназолом частота ответа от 23,8 % до 57,9 %. Частота долговременных ответов варьировала от 9,5 % до 96 % [49]. Основные нежелательные явления — нарушение функции печени (16,5 %), увеличением веса (8,4 %), акне (4,2 %), сыпь.
Дапсон — препарат из группы сульфонов, назначается перорально в дозе от 50 до 100 мг ежедневно. Частота ответа при ИТП колеблется от 36 до 63 %, а длительность — от 0 % до 55 % [50]. Лечение обычно хорошо переносится, у 11 % пациентов наблюдается тошнота/рвота.
Микофенолата мофетил (ММФ) — иммунодепрессант, ингибитор инозинмонофосфат- дегидрогеназы. Назначается внутрь от 500 до 2000 мг в сутки. Его эффект при ИТП развивается относительно медленно и через 1 неделю ответ ≈ 15 %, но через 1 мес. — примерно, у половины пролеченных пациентов [51]. Между тем,некоторые авторы использовали его во 2 линии терапии хронической ИТП. Так, Cooper N. [52] у пациентов с нормальной иммунной системой назначал ММФ 500 мг дважды в сутки с последующим увеличением до 2 г/сут при переносимости. Автор обращает внимание на выявленное преимущество ММФ перед ри-туксимабом, которое заключается в том, что если лечение ММФ не эффективно, то препарат можно отменить и иммунная система достаточно быстро восстановиться, тогда, как при применении ритуксимаба В-клетки остаются истощенными в течение 6–12 месяцев. К недостаткам ММФ следует отнести отсроченный ответ (4–8 недель). Нежелательные явления включают диарею (6,8 %), нарушения функции печени, нейтропению, анемию и инфекции; при длительном применении наблюдается риск развития злокачественных новообразований и прогрессирующей мультифокальной лейкоэнцефалопатии. С осторожностью следует назначать ММФ пожилым пациентам.
Винка-алкалоиды (винкристин, винбластин). Ответ невысокий (ниже 18 %), который сохраняется лишь у 19 % в течение 3 мес. Эти препараты сопровождаются значительной токсичностью [53]. Почти все пациенты испытывают побочные эффекты,причем наиболее часто встречаются винкристиновая нейропатия (27,8 %) и угнетение костномозгового кроветворения.
Лечение рефрактерной ИТП, безусловно, представляется достаточной сложной проблемой. Тромбоциты у больных рефрактерной ИТП характеризуются повышенным апоптозом и имеют низкую экспрессию к рецепторам адгезии. Термин «рефрактерность» был предложен для пациентов,остающихся в группе риска значительного кровотечения после неудачного предыдущего лечения, включая спленэкто-мию,но эксперты избегают использования этого термина, поскольку многие пациенты, в конечном итоге достигнут гемостатически эффективного количества тромбоцитов.
У таких пациентов возможно также применение комбинированной терапии. Напри-мер,агонисты рТПО + микофенолата мофетил или агонисты рТПО + циклофосфамид [54]. Описано использование комбинированной иммуносупрессивной терапии — азатиоприн 2 мг/кг в сутки, микофенолата мофетил 1–2 г/сут и циклоспорин 2 мг/кг в сутки [55].
Другие методы лечения, которые могут быть использованы в качестве терапии спасения, включают комбинированную химиотерапию, алемтузумаб и трансплантацию гемопоэтических стволовых клеток. Побочные эффекты этих вариантов лечения могут быть серьезными, а данные, подтверждающие их применение, ограничены (рекомендация класса В; уровень доказательности III).
Заключение. Подводя итог принципам лечения взрослых пациентов с ИТП, изложенным в обновленных рекомендациях Американского гематологического общества и Международного консенсуса, следует заключить, что основополагающим является индивидуализированный подход. Важным является учет факторов риска: стадия заболевания, тяжесть тромбоцитопении, распространенность и тяжесть кровотечений, сопутствующие заболевания, применение антикоагулянтов или антитромбоцитарных препаратов, предстоящие оперативные вмешательства или иные процедуры,пол и возраст пациента, образ жизни, ожидания пациента. Анализ этих факторов поможет создать своеобразный портрет больного и позволит врачу принять правильное решение. Современная парадигма лечения взрослых больных ИТП: ранний отказ от кортикостероидов, назначение агонистов рТПО во второй линии,отсроченное выполнение спленэктомии.
Первая линия терапии — преднизолон или дексаметазон. Эффективность их равнозначна, но при необходимости более быстрого повышения числа тромбоцитов целесообразнее назначить дексаметазон. Рекомендовано ограничение использования преднизолона (максимум до 6 недель независимо от результата) и, при отсутствии ответа или выявлении зависимости от кортикостероидов, переход на вторую линию терапии.
Агонисты рТПО рекомендованы в качестве варианта лечения второй линии терапии для взрослых пациентов с ИТП продолжительностью ≥ 3 месяцев, которые не ответили на терапию кортикостероидами. Выбор одного из двух представленных агонистов рТПО (ромипло-стим, элтромбопаг) решается индивидуально.
Ритуксимаб — возможный вариант 2 линии терапии,однако целесообразнее его использовать при неэффективности агонистов рТПО. Необходимо учитывать инфузионные реакции и риск развития тяжелых инфекций. Не рекомендуется при вирусном гепатите В.
Рекомендовано отсрочить выполнение спленэктомии минимум на 12 месяцев. При решении вопроса о необходимости спленэктомии следует учитывать долгосрочные риски инфекционных и тромбоэмболических осложнений.
Рекомендовано учитывать мнение пациента при принятии решения!
Пациенты, которые считают приоритетом избегание длительного применения лекарственных препаратов, могут предпочесть спленэктомию или ритуксимаб. Пациенты, которые хотят избежать операции, могут предпочесть ритуксимаб. Однако для пациентов,которые предпочитают долговременный ответ, предпочтительнее агонисты рТПО, которые позволяют добиться длительных и стойких ремиссий.
Наиболее убедительная стратегия 2 линии терапии, по мнению экспертов, заключается в последовательном назначении: агонисты рецепторов тромбопоэтина — ритуксимаб — спленэктомия. Алгоритм лечения взрослых больных ИТП,согласно новым клиническим рекомендациям Международного консенсуса и алгоритм выбора второй линии терапии для взрослых пациентов с ИТП,согласно новым клиническим рекомендациям ASH-2019 представлен на рисунках 1 и 2 .
Первичная терапия вновь диагностированной ИТП
Кортикостероиды: преднизолон, дексаметазон, метилпреднизолон
Внутривенные иммуноглобулины
Анти-D иммуноглобулин
Последующее лечение
Медикаменты
Сильное доказательство
Ромиплостим, элтромбопаг Аватромбопаг, фостаматиниб ритуксимаб
Менее сильное доказательство
Азатиоприн, циклоспорин А Циклофосфан, даназол Дапсон, микофенолата мефотил, винка алкалоиды
Хирургия
Спленэктомия
Рисунок 1. Алгоритм лечения взрослых больных ИТП, согласно новым клиническим рекомендациям Международного консенсуса.
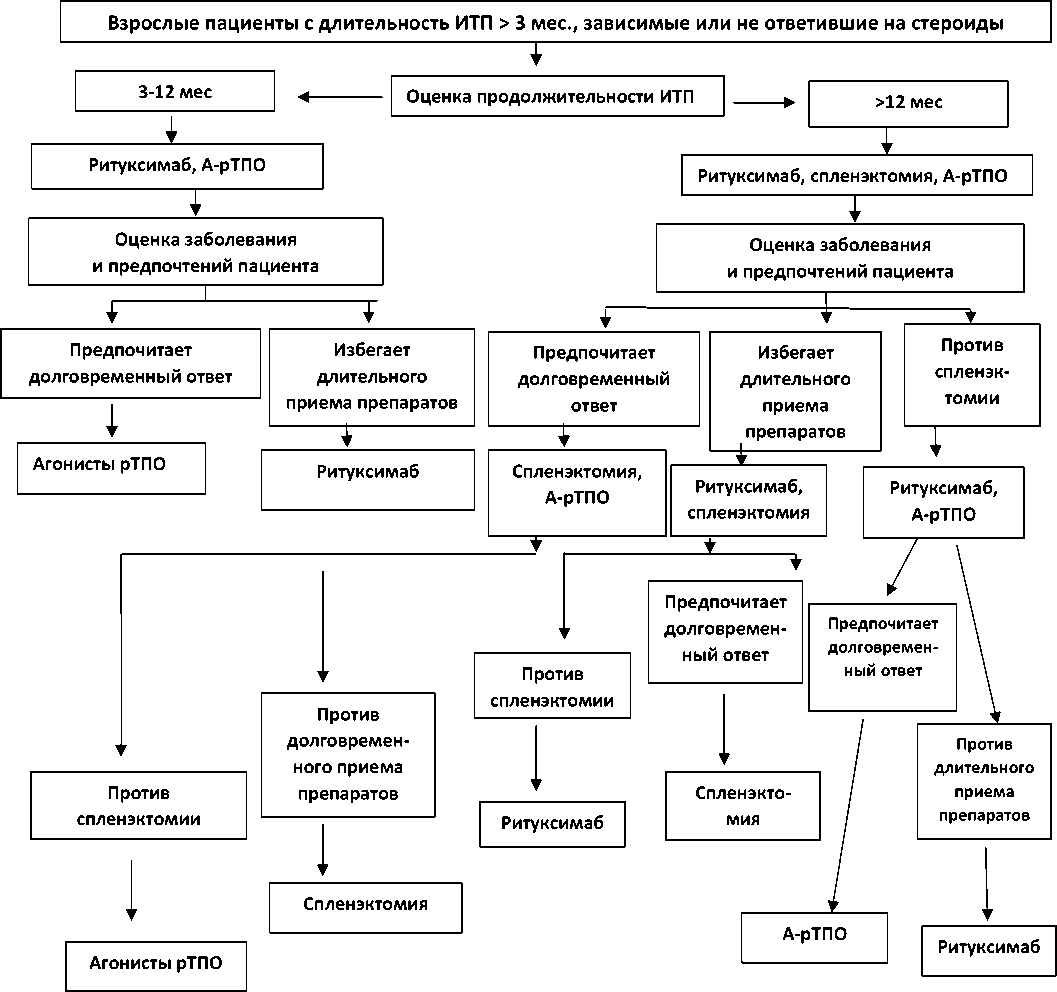
Рисунок 2. Алгоритм выбора второй линии терапии для взрослых пациентов с ИТП, согласно новым клиническим рекомендациям ASH-2019.
Примечание . А-рТПО — агонисты рецепторов тромбопоэтина.
Список литературы Первичная иммунная тромбоцитопеническая пурпура: подходы к терапии согласно новым клиническим рекомендациям Американской гематологической ассоциации и Международного консенсусного доклада
- 1. Abrahamson P. E., Hall S. A., Feudjo-Tepie M. et al. The incidence of idiopathic thrombocytopenic purpura among adults: a population based study and literature review. // Eur J Haematol. — 2009. — Vol. 83, N 2. — P. 83–89.
- Terrell D. R., Beebe L. A., Vesely S. K. et al. The incidence of immune thrombocytopenic purpura in children and adults: a critical review of published reports. // Am J Hematol. — 2010. — Vol. 85, N 3. — P. 174–180.
- Neunert C., Terrell D. R., Arnold D. M. et al. American Society of Hematology 2019 guidelines for immune thrombocytopenia. // Blood advances. — 2019. — Vol. 3, N 23. — 3829–3866.
- Provan D., Arnold D. V., Bussel J. B. et al. Updated International Consensus Report on the investigation and management of primary immune thrombocytopenia. // Blood advances. — 2019. — Vol. 3, N 22. — 3780–3817.
- Бессмельцев С. С. Идиопатическая тромбоцитопеническая пурпура. // Гематология: Новейший спра- вочник / Под общ. ред. К. М. Абдулкадырова. — М.: Изд-во Эксмо; СПб.: Изд-во Сова, 2004. — С. 349–372.
- Mant M. J., Connolly N., Gordon P. A., King E. G. Severe thrombocytopenia probably due to acute folic acid deficiency. // Crit Care Med. — 1979. — Vol. 7, N 7. — P. 297–300.
- Mishra V. A., Harbada R., Sharma A. Vitamin B12 and vitamin D: deficiency an unusual cause of fever, severe hemolytic anemia and thrombocytopenia. // J Family Med Prim Care. — 2015. — Vol. 4, N 1. — P. 145–148.
- Rodeghiero F. A. Critical appraisal of the evidence for the role of splenectomy in adults and children with INH. // Br J. Haematol. — 2018. — Vol. 182, N2. — P. 183–195.
- Cohen Y. C., Djulbegovic B., Shamai-Lubovitz O., Mozes B. The bleeding risk and natural history of idiopathic thrombocytopenic purpura in patients with persistent low platelet counts. // Arch Intern Med. — 2000. — Vol. 160, N 11. — P. 1630–1638.
- Cuker A., Neunert C. E. How I treat refractory immune thrombocytopenia. // Blood. — 2016. — Vol. 128, N 12. — P. 1547–1554.
- Mahevas M., Michel M., Godeau B. How we manage immune thrombocytopenia in the elderly. // Brit J Haematol. — 2016. — Vol. 173, N 6. — P. 844–856.
- Bussel J. B., Lee C. S., Seery C. et al. Rituximab and three dexamethasone cycles provide responses similar to splenectomy and women and those with immune thrombocytopenia of less than two years duration. // Haematologica. — 2014. — Vol. 99, N 7. — 1264–1271.
- Spahr J. E., Rodgers G. M. Treatment of immune-mediated thrombocytopenia purpura with concurrent intravenous immunoglobulin and platelet transfusion: a retrospective review of 40 patients. // Am J Hematol. — 2008. — Vol. 83, N 2. — P. 122–125.
- Michel M., Wasser J., Godeau B. et al. Efficacy and safety of the thrombopoietin receptor agonist romiplostim in patient’s agent ≥ 65 years with immune thrombocytopenia. // Ann Hematol. — 2015. — Vol. 94, N 12. — P. 1973–1980.
- Janssens A., Tarantino M., Bird R. J. et al. Romiplostim treatment in adult with immune thrombocytopenia of varying duration and severity. // Acute Haematol. — 2015. — Vol. 134, N 4. — P. 215–228.
- Cines D. B., Wasser J., Rodeghiero F. et al. Safety and efficacy of Romiplostim in splenectomized and nonsplenectomized patients with primary Immune thrombocytopenia. // Haematologica. — 2017. — Vol. 102, N8. — P. 1342–1351.
- Kuter D. J., Rummel M., Boccia R. et al. Romiplostim or standard of care in patients with immune thrombocytopenia. // N Engl J Med. — 2010. — Vol. 363, N20. — P. 1889–1899.
- Gonzalez-Lopez T. J., Fernandez-Fuertes F., Hernandez-Rivas J. A. et al. Efficacy and safety of eltrombopag in persistent and newly diagnosed ITP in clinical practice. // Int J Heamatol. — 2017. — Vol. 106, N 4. — P. 508–516.
- Cheng G, Saleh MN, Marcher C, et al. Eltrombopag for management of chronic immune thrombocytopenia (RAISE): a 6-month, randomized, phase 3 study. Lancet. — 2011. — Vol. 377, N 9763. — P. 393–402.
- Bussel J. B., Provan D., Shamsi T. et al. Effect of eltrombopag on platelet counts and bleeding during treatment of chronic idiopathic thrombocytopenic purpura: a randomized, double-blind, placebo-controlled trial. // Lancet. — 2009. — Vol. 373, N9664. — P. 641–648.
- Bussel J. B., Saleh M. N., Vasey S. Y. et al. Repeated short-term use of eltrombopag in patients with chronic immune thrombocytopenia (ITP). // Br J Haematol. — 2013. — Vol. 160, N 4. — P. 538–546.
- Cooper K. L., Fitzgerald P., Dillingham K. et al. Romiplostim and eltrombopag for immune thrombocytopenia: methods for indirect comparison. // Int J Technol Assess Health Care. —2012. — Vol. 28, N 3. — P. 249–258.
- Cooper K, Matcham J, Helme K, Akehurst R. Update on romiplostim and eltrombopag indirect comparison. // Int J Technol Assess Health Care. — 2014. — Vol. 30, N 1. — P. 129–130.
- Nplate. Nplate (romiplostim) [summary of product characteristics]. Breda, the Netherlands: Amgen Europe B. V., 2018.
- PROMACTA. PROMACTA (eltrombopag) tablets for oral use; PROMACTA (eltrombopag) for oral suspension. East Hanover, NJ: Novartis Pharmaceuticals Corporation, 2018.
- Wang L, Gao Z, Chen XP, et al. Efficacy and safety of thrombopoietin receptor agonists in patients with primary immune thrombocytopenia: a systematic review and meta-analysis. // Sci Rep. — 2016. — Vol. 6. — P. 39003.
- Bussel J. B., Kuter D. J., Aledort L. M. et al. A randomized trial of avatrombopag, an investigational thrombopoietin-receptor agonist, in persistent and chronic immune thrombocytopenia. // Blood. — 2014. — Vol. 123, N 25. — 3887–3894.
- Jurczak W., Chojnowski K., Mayer G. et al. Phase 3 randomised study avatrombopag a novel thrombopoietin receptor agonist for the treatment of chronic immune thrombocytopenia. // Br J Haematol. — 2018. — Vol. 183, N 3. — P. 479–490.
- Newland A., Godeau B., Priego V. et al. Remission and platelet responses with romiplostim in primary immune thrombocytopenia: final results from a phase 2 study. // Br J Haematol. — 2016. — Vol. 172, N 2. — P. 262–273.
- Chen X., Pen B., Cay Y. et al. Laparoscopic splenectomy for patients with immune thrombocytopenia and very low platelet count: is platelet transfusion necessary? // J Surg Res. — 2011. — Vol. 70, N 2. — P. e225-e232.
- Vianelli N., Galli M., de Vivo A. et al; Gruppo Italiano per lo Studio delle Malattie Ematologiche dell’Adulto. Efficacy and safety of splenectomy in immune thrombocytopenic purpura: long-term results of 402 cases. // Haematologica. — 2005. — Vol. 90, N 1. — P. 72–77.
- Chater C., Terriou L., Duhamel A. et al. Reemergence of splenectomy for ITP second-line treatment? // Ann Surg. — 2016. — Vol. 264, N 5. — P. 772–777.
- McMillan R., Durette C. Long-term outcomes in adults with chronic ITP after splenectomy failure. // Blood. — 2004. — Vol. 104, N 4. — P. 956–960.
- Park Y. H., Yi H. G., Kim C. S. et al. Gyeonggi/Incheon Branch, The Korean Society of Hematology. Clinical outcome and predictive factors in the response to splenectomy in elderly patients with primary immune thrombocytopenia: a multicenter retrospective study. // Acta Haematol. — 2016. — Vol. 135, N3. — P. 162–171.
- Boyle S. et al. Splenectomy and the incidence of venous thromboembolism and sepsis in patients with immune thrombocytopenia. // Blood. — 2013. — Vol. 121. — P. 4782–4790.
- Gonzalez-Porras J. R., Escalante F., Pardal E. et al. Grupo de Trombosis y Hemostasia de Castilla y Leo´ n. Safety and efficacy of splenectomy in over 65-yrsold patients with immune thrombocytopenia. // Eur J Haematol. — 2013. — Vol. 91, N 3. — P. 236–241.
- Ahmed R., Devasia A. J., Viswabandya A. et al. Long-term outcome following splenectomy for chronic and persistent immune thrombocytopenia (ITP) in adults and children: splenectomy in ITP. // Ann Hematol. — 2016. — Vol. 95, N 9. — P. 1429–1434.
- Sarpatwary A., Provan D., Erqou S. et al. Autologous 111 in-labelled platelet sequestration studies in patients with primary immune thrombocytopenia prior to splenectomy: a report from the United Kingdom ITP registry. // Br J Haematol. — 2010. — Vol. 151, N5. — P. 477–487.
- Patel V. L., Mahévas M., Lee S. Y. et al. Outcomes 5 years after response to rituximab therapy in children and adults with immune thrombocytopenia. — Blood. — 2012. — Vol. 119, N 25. — P. 5989–5995.
- Chug S., Darvish-Cazem S., Lim V. et al. Ritiximab is standard of care for treatment of primary immune thrombocytopenia: a systematic review meta-analysis. // Lancet Hematol. — 2015. — Vol. 2, N 2. — P. e75-e81.
- Marangon M., Vianelli N., Palandri F. et al. Rituximab in immune thrombocytopenia: gender, age, and response as predictors of long-term response. // Eur J Haematol. — 2017. — Vol. 98, N 4. — P. 371–377.
- Chapin J., Lee C. S., Zhang H. et al. Gender and duration of disease differentiate responses to rituximab- dexamethasone therapy in adults with immune thrombocytopenia. // Am. J. Hematol. — 2016. — Vol. 91, N 9. — P. 907–911.
- Moulis G., Sailler L., Sommet A. et al. Rituximab versus splenectomy in persistent or chronic adult primary immune thrombocytopenia: an adjusted comparison of mortality and morbidity. // Am J Hematol. — 2014. — Vol. 89, N 1. — P. 41–46.
- Chaturvedi S., Arnold D. M., McCrae K. R. Splenectomy for immune thrombocytopenia: down but not out. // Blood. — 2018. — Vol. 131, N 11. — P. 1172–1182.
- Skopec B., James H. P. Bussel J. B. Medical Decision Analysis: Choosing Second Line Treatment in Adults with Immune Thrombocytopenia (ITP). // Blood. — 2018. — Vol. 132 (Suppl. 1). P. 4986.
- Bussel J., Arnold D. M., Grossbard E. et al. Fostamatinib for the treatment of adult persistent and chronic immune thrombocytopenia: results of two phase 3, randomized, placebo-controlled trials. // Am J Hematol. — 2018. — Vol. 93, N 7. — P. 921–930.
- Li H. Q., Zhang L., Zhao H. et al. Chronic idiopathic thrombocytopenic purpura in adult Chinese patients: a retrospective single-centered analysis of 1791 cases. // Chin Med J (Engl). — 2005. — Vol. 118, N 1. — P. 34–37.
- Choudhary D. R., Naithani R., Mahapatra M., Kumar R., Mishra P., Saxena R. Efficacy of cyclosporine as a single agent therapy in chronic idiopathic thrombocytopenic purpura. // Haematologica. — 2008. — Vol. 93,N 10. — P. e61-e62 (discussion e63).
- Kim S. W., Rice L., McCarthy J. J. Efficacy of danazol with autoimmune thrombocytopenia. // Clin Appl Thromb Hemost. — 1997. — Vol. 3, N 4. — P. 251–255.
- Damodar S., Viswabandya A., George B. et al. Dapsone for chronic idiopathic thrombocytopenic purpura in children and adults — a report on 90 patients. // Eur J Haematol. — 2005. — Vol. 75, N 4. — P. 328–331.
- Hou M., Peng J., Shi Y. et al. Mycophenolate mofetil (MMF) for the treatment of steroid-resistant idiopathic thrombocytopenic purpura. // Eur J Haematol. — 2003. — Vol. 70, N 6. — P. 353–357.
- Cooper N. State of the art — how I manage immune thrombocytopenia. // Br J Haematol. — 2017. — Vol. 177, N 1. — P. 39–54.
- Ahn Y. S., Harrington W. J., Mylvaganam R. et al. Slow infusion of vinca alkaloids in the treatment of idiopathic thrombocytopenic purpura. // Ann Intern Med. — 1984. — Vol. 100, N 2. — P. 192–196.
- Anwer F., Yun S., Nair A. Severe Refractory Immune Thrombocytopenia Successfully Treated with High- Dose Pulse Cyclophosphamide and Eltrombopag // Case Reports in Hematology. — Volume 2015 |Article ID583451 |3 pages | https://doi. org/10.1155/2015/583451
- Arnold D. M., Nazi I., Santos A. et al. Combination immunosuppressant therapy for patients with chronic refractory immune thrombocytopenic purpura // Blood. — 2010. — Vol. 115, N 1. — P. 29–31.


