Первичная malt-лимфома трахеи (клиническое наблюдение)
Автор: Пикин О.В., Телегина Л.В., Капланская И.Б., Кутенева Н.В., Бармин В.В., Семикина Д.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 3 т.21, 2022 года.
Бесплатный доступ
Актуальность. В структуре онкологической заболеваемости респираторной системы опухоли трахеи занимают около 2 %, что составляет 0,1 случая на 100 000 человек в год. По данным мировой лите-ратуры, первичная malt-лимфома трахеи встречается крайне редко, в связи с чем нет четко установ-ленного подхода к лечению этого заболевания. Существует несколько эффективных позиций в выборе терапии. В статье рассматриваются возможности эндоскопического хирургического лечения первичной лимфомы трахеи, в обзоре литературы представлены современные данные об эпидемиологии, этио-патогенезе, клинической картине и тактике лечения. Описание клинического случая. Пациент П., 72 года, обратился в торакальное хирургическое отделение МНИОИ им. П.А. Герцена с жалобами на одышку при умеренной физической нагрузке и сухой кашель. При обследовании диагностирована опухоль верхней трети трахеи, экзофитная форма роста. Стеноз просвета трахеи ii-iii степени. На первом этапе принято решение о выполнении по жизненным показаниям лечебно-диагностической эндоскопической операции - удалении экзофитного компонента опухоли с целью восстановления просвета, ликвидации угрозы возможных осложнений. При гистологическом и иммуногистохимическом исследованиях диагностирована malt-лимфома трахеи. Учитывая индолентный вариант лимфомы, небольшой объем поражения, выполненный объем эндоскопического лечения, возраст пациента и со-путствующую патологию, показаний для проведения системной противоопухолевой терапии не было. Пациенту рекомендовано динамическое наблюдение. В настоящее время пациент наблюдается в МНИОИ им. П.А. Герцена на протяжении 6 мес без признаков рецидива заболевания. Заключение. Данный клинический пример показывает возможности метода эндоскопической хирургии, который по-зволил провести радикальное органосохраняющее лечение у пациента с диагнозом первичной malt-лимфомы трахеи. С учетом экзофитной формы роста опухоли применение метода комбинированного эндоскопического лечения позволило избежать открытой хирургической операции в виде резекции трахеи, что существенно улучшило качество жизни пациента.
Опухоли трахеи, эндоскопическая хирургия, экстранодальная лимфома маргинальной зоны, malt-лимфома, видеобронхоскопия
Короткий адрес: https://sciup.org/140295073
IDR: 140295073 | УДК: 616.231-006.441 | DOI: 10.21294/1814-4861-2022-21-3-151-159
Текст научной статьи Первичная malt-лимфома трахеи (клиническое наблюдение)
В структуре онкологической заболеваемости респираторной системы опухоли трахеи занимают около 2 %, что составляет 0,1 случая на 100 000 человек в год [1]. Наиболее распространенными гистологическими типами рака трахеи являются плоскоклеточная карцинома (45 %), аденокистозная карцинома (16 %) и недифференцированная карцинома (12,8 %) [2]. Также имеют место вторичные опухоли трахеи, возникающие в результате инвазии первичных опухолей, метастатически измененных лимфоузлов или гематогенных метастазов [3]. По данным мировой литературы, первичная MALT-лимфома трахеи встречается крайне редко, в связи с чем нет четко установленного подхода к лечению этого заболевания.
Расширение возможностей эндоскопической диагностики и создание видеоэндоскопов последнего поколения сформировали новое направление в эндоскопии – радикальная или условно-радикальная эндоскопическая хирургия, а совершенствование эндоскопической хирургической техники, создание высокотехнологичной аппаратуры (лазерной, электрохирургической и другой) позволили расширить клинические показания к эндоскопическим операциям как к самостоятельному методу лечения [4].
Местными показаниями к эндоскопическому удалению злокачественных опухолей трахеи и бронхов В.В. Соколов и соавт. (2010) и Л.В. Телегина (2017) считают следующие: 1) экзофитный тип роста опухоли; 2) доступность дистальной границы опухоли через видеоэндоскоп; 3) расположение опухоли в главных, долевых и сегментарных бронхах; 4) наличие ателектаза или обструктивного пневмонита (и/или его угроза); 5) отсутствие
КТ/МРТ признаков перибронхиального опухолевого компонента и увеличенных внутригрудных ЛУ (в случае планируемого радикального удаления опухоли) [4, 5]. При этом эндоскопическая хирургия как метод радикального удаления опухоли позволяет полностью восстановить просвет трахеи или крупного бронха в 100 % наблюдений (n = 60), добиться клинической ремиссии в сроки от 1 года до 27 лет с медианой выживаемости, равной 8,5 лет [5].
В данной статье описывается редкий клинический случай успешного эндоскопического удаления первичной лимфомы трахеи, которая сформировалась из клеток маргинальной зоны, ассоциированной с лимфоидной тканью слизистой оболочки (MALT).
Клиническое наблюдение
Пациент П., 72 года, житель г. Ульяновска, обратился в июне 2021 г. в торакальное хирургическое отделение МНИОИ им. П.А. Герцена с жалобами на одышку при умеренной физической нагрузке и сухой кашель. Из анамнеза: считает себя больным на протяжении последних 5 мес (с января 2021 г), когда начал отмечать признаки дыхательной недостаточности. Пациент-курильщик (стаж – 52 пачко/лет), имеет сопутствующую патологию: гипертоническая болезнь 1 степени, 1 стадии, риск ССО 2; хроническая язва луковицы ДПК, вне обострения.
По данным СКТ органов грудной клетки (31.05.21): в просвете трахеи на уровне С7 по правой стенке на широком основании определяется новообразование размером 14×11×22 мм, суживающее просвет трахеи на 2/3; также имеются КТ-признаки хронического бронхита.
Внутригрудной лимфаденопатии не обнаружено (рис. 1а, б).
По данным видеобронхоскопии (ВБС) от 30.06.21: гортань подвижна, не изменена. На протяжении 2,0 см просвет трахеи свободен. Дистальнее определяется экзофитная опухоль, шаровидной формы, ярко-красного цвета, размерами 2,0×2,0 см, смещающаяся при инструментальной пальпации, суживающая просвет на 2/3. У опухоли имеется широкое основание, приблизительными размерами 1,2×1,0 см, расположенное по передне-правой стенке. В режиме NBI имеются признаки вторичного опухолевого неоангиогенеза – зеленое окрашивание (рис. 1в, г). Дистальная граница опухоли расположена на 5,5 см выше гребня карины. Нижняя треть трахеи не изменена, карина острая, подвижная. Бронхи осмотрены с обеих сторон до V порядка – просветы не сужены, шпоры острые, секрет скудный, слизистого характера. Заключение: опухоль верхней трети трахеи, экзофитная форма роста. Стеноз просвета трахеи II–III степени.
На консилиуме с участием анестезиолога, хирурга, радиолога, химиотерапевта и эндоскописта, в связи с экзофитным характером роста опухоли, угрозой стеноза и/или асфиксии, на первом этапе было принято решение о выполнении по жизненным показаниям лечебно-диагностической эндоскопической операции – удалении экзофитного компонента опухоли с целью восстановления просвета, ликвидации угрозы возможных осложнений и направлении материала на плановое гистологическое исследование.
Эндоскопическая операция – реканализация просвета трахеи выполнена 01.07.21. При ВБС: гортань подвижна, не изменена. На протяжении 2,0 см просвет трахеи свободен. Дистальнее сохраняется экзофитная опухоль, шаровидной формы, ярко-красного цвета, размерами 2,0×2,0 см, смещающаяся при инструментальной пальпации, суживающая просвет трахеи на 2/3. Дистальная граница опухоли расположена на 5,5 см выше гребня карины. Под контролем видеобронхоскопа выполнена эндоскопическая операция: лазерная деструкция при помощи полупроводникового лазера Dornier и тотальная петлевая электроэксцизия опухоли трахеи на гистологическое исследование (рис. 2 а–г). Осложнений при выполнении эндоскопической операции не отмечено.
После удаления опухоли клинически пациент отметил значительное улучшение состояния в виде отсутствия признаков дыхательной недостаточности.
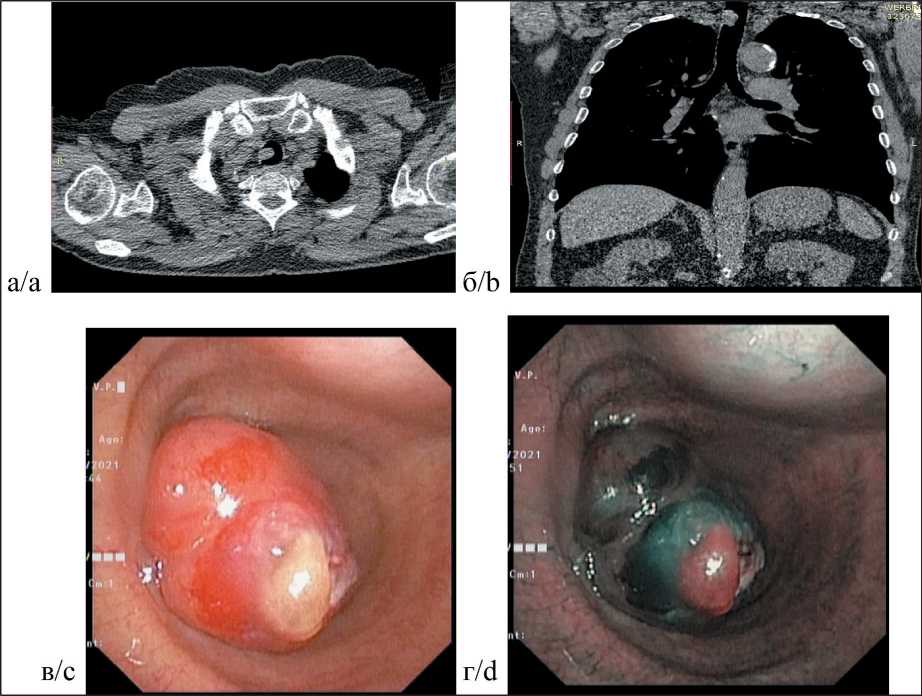
Рис. 1. Диагностика опухоли шейного отдела трахеи у пациента П.:
а – спиральная КТ органов грудной клетки (аксиальная проекция); б – то же (фронтальная проекция); в – экзофитная опухоль (эндофотограмма в белом свете - WLI); г – то же при узкоспектральном исследовании (эндофотограмма в режиме NBI)
Fig. 1. Diagnosis of a tumor of the cervical trachea in patient P.:
a – spiral CT scan of the chest (axial projection); b – spiral CT scan of the chest (frontal projection); c – exophytic tumor (WLI white light endophotogram); d – exophytic tumor (narrow-spectrum study, endophotogram in NBI mode).
По данным планового морфологического исследования (20.07.21): фрагменты слизистой оболочки с покровом из метаплазированного многослойного плоского эпителия с изъязвлением, в субэпителиальной основе определяется разрастание злокачественного мономорфного новообразования из относительно мелких лимфоидных клеток, что может соответствовать лимфоме из мелких клеток (рис. 3а, б).
Для уточнения диагноза проведено иммуногистохимическое исследование: в опухолевых клетках реакция с Pan Cytokeratin, CK7, Chromogranin A, CD20 негативная. Они CD45, CD79a позитивны. В части этих клеток выявляется положительная реакция с Plasma cell. Они BCL2 положительны, CD23, CD5, cyclin D1 негативны. Рассеяны немногочисленные CD3 позитивные Т-лимфоциты. Ki67-положительные клетки немногочисленные, не превышают 7 %. Заключение: картина лимфопролиферативного заболевания. Имеющиеся изменения могут иметь место при лимфоме из клеток маргинальной зоны (рис. 3в).
По данным физикального осмотра, лабораторных, функциональных и инструментальных методов обследования других очагов опухолевого поражения выявлено не было.
Таким образом, пациенту установлен диагноз: экстранодальная B-клеточная лимфома из клеток маргинальной зоны, ассоциированная с лимфоидной тканью слизистой оболочки, с поражением трахеи, I ст. Состояние после эндоскопического хирургического лечения.
Через 2 мес пациенту проведено контрольное обследование. При СКТ (20.08.21): структура стенок, анатомия просветов и проходимость трахеи и бронхов не нарушены; стенки мелких бронхов неравномерно утолщены, уплотнены. В месте ранее визуализируемого образования верхней трети трахеи опухолевой патологии не выявлено (рис. 4а, б). При ВБС (24.08.21): гортань подвижна, не изменена, просвет трахеи на всем протяжении свободен. По правой стенке определяется участок эпителизации слизистой, размерами до 7×8 мм, с признаками начала фиброзно-рубцовых изменений. Опухолевой инфильтрации нет. Патологического вторичного сосудистого рисунка в режиме NBI не выявлено. Заключение: состояние после эндоскопического удаления опухоли трахеи. Положительный
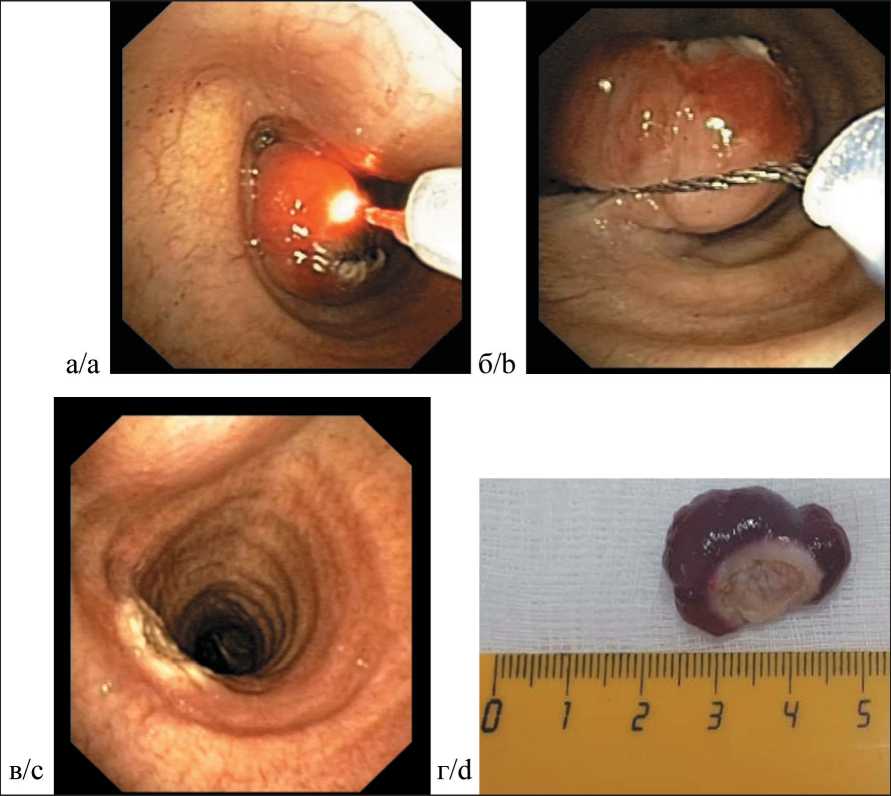
Рис 2. Эндоскопическая операция – реканализация просвета трахеи:
а – лазерная деструкция опухоли; б – петлевая электроэксцизия; в – коагуляционный струп в зоне удаленной «ножки» опухоли (непосредственный результат операции – полное восстановление просвета трахеи); г – удаленная опухоль (макропрепарат) Fig. 2. Endoscopic surgery – recanalization of the lumen of the trachea:
a – laser destruction of the tumor; b – loop electroexcision; c – coagulation eschar in the area of the removed “leg” of the tumor (the immediate result of surgery is the complete restoration of the lumen of the trachea); d – removed tumor (gross specimen)
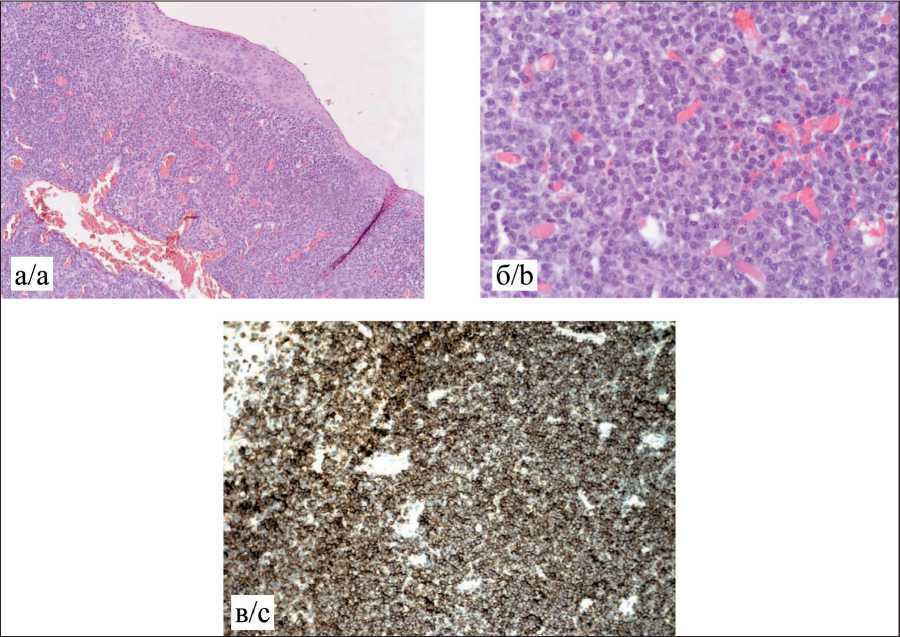
Рис. 3. Гистологическое исследование удаленного препарата – лимфома:
а – микрофото, окраска гематоксилином и эозином, ×10; б – микрофото, окраска гематоксилином и эозином, ×40; в – иммуногистохимическое исследование, ×100
Fig. 3. Histological examination of the resected specimen – lymphoma:
a – microphoto, stained with hematoxylin and eosin, ×10; b – – microphoto, stained with hematoxylin and eosin, ×40; c – immunohistochemical study, ×100
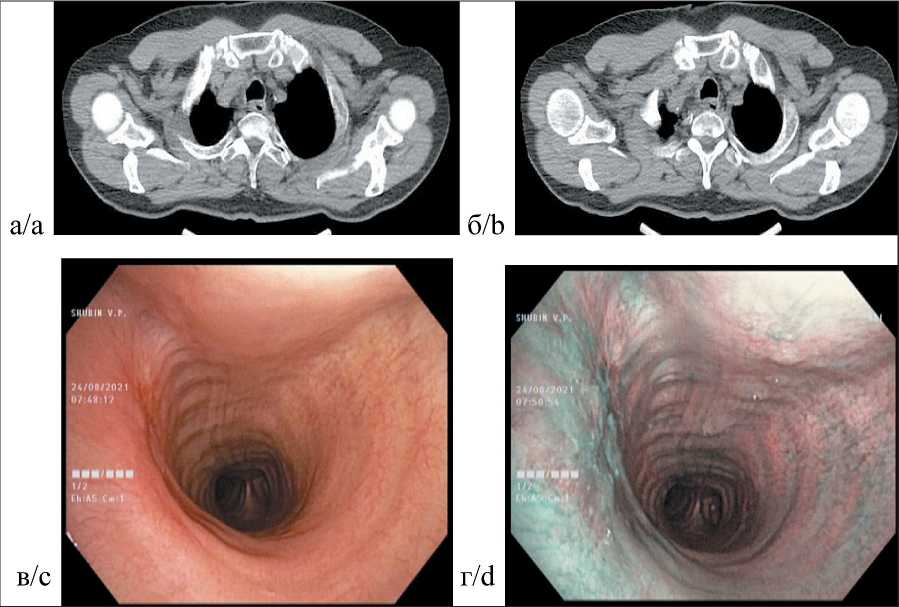
Рис. 4. Результат эндоскопической операции через 2,5 мес:
а – просвет трахеи свободен – проксимальная граница зоны ранее определявшегося опухолевого поражения (спиральная КТ);
б – дистальная граница ранее определявшегося опухолевого поражения (спиральная КТ);
в – эпителизация слизистой в зоне удаленной опухоли, формирование рубца (эндофотограмма в режиме WLӀ); г – отсутствие признаков вторичного неоангиогенеза в зоне формирующегося рубца (эндофотограмма в режиме NBӀ)
Fig. 4. 2.5 months after endoscopic surgery: a – the lumen of the trachea is free – the proximal border of the zone of a previously determined tumor lesion (spiral CT); b – distal border of a previously determined tumor lesion (spiral CT);
c – epithelialization of the mucosa in the area of the removed tumor, scar formation (endophotogram in WLӀ mode); d – no signs of secondary neoangiogenesis in the area of the developing scar (endophotogram in NBӀ mode)
эффект лечения в виде полной резорбции первичной опухоли (рис. 4в, г).
Учитывая индолентный вариант лимфомы, небольшой объем поражения, выполненный объем эндоскопического лечения, возраст пациента и сопутствующую патологию, показаний для проведения системной противоопухолевой терапии не было. Пациенту рекомендовано динамическое наблюдение и консультация гематолога по месту жительства.
Обсуждение
Лимфомы – группа злокачественных опухолевых заболеваний лимфатической системы, преимущественно берущие свое начало из тканей лимфатических узлов, однако в одном из четырех случаев имеет место поражение экстранодаль-ных клеток лимфоидной ткани [6]. В организме содержится большое количество свободной, не заключенной в соединительнотканую капсулу лимфоидной ткани, которая локализуется в стенках желудочно-кишечного, респираторного и урогенитального трактов. Лимфоциты слизистой оболочки выполняют важную иммунологическую функцию путем секреции IgA. Под воздействием длительной антигенной стимуляции В-лимфоцитов возникают патологические клеточные популяции, способные к формированию опухолевого субстрата. Самыми распространенными факторами риска являются курение, хронические и аутоиммунные заболевания, контакт с асбестом [7, 8].
На долю MALT-лимфом с поражением трахеобронхиального дерева приходится менее 0,5 % первичных злокачественных новообразований легких и менее 1 % всех лимфом [9]. Однако среди MALT-лимфом легочные лимфомы встречаются в 19 %. Наиболее частая локализация поражения выявляется на уровне главных и долевых бронхов. Несмотря на это, первичные проявления MALT-лимфомы, поражающей трахею, очень редки, что возможно объяснить меньшей концентрацией лимфоидных клеток в слизистой оболочке трахеи [10].
Подобно другим опухолям трахеи, MALT-лимфомы не имеют специфических симптомов, клинические проявления в основном обусловлены стенозом просвета трахеи. Пациенты предъявляют жалобы на прогрессирующую одышку, кашель, стридорозное дыхание – признаки обструкции центральных дыхательных путей на ⅔ объема и более. Данные симптомы могут ошибочно оценивать как проявление бронхиальной астмы или хронической обструктивной болезни легких, однако терапия бронходилататорами и стероидами не дает клинического эффекта. Примечательно, что кровохарканье, еще один частый симптом первичного злокачественного новообразования трахеи, отсутствует, поскольку слизистая оболочка трахеи в большинстве MALT-лимфом не повреждена [11].
Несмотря на первоначальное мнение о моно-органном поражении, последующие исследования показали, что внегастральные MALT-лимфомы проявляют склонность к диссеминированному распространению почти у 50 % пациентов. Принимая во внимание вялотекущий характер и медленный рост MALT-лимфомы, эти результаты также привели к гипотезе о том, что рецидивы, возникающие вскоре после первоначального диагноза и местного лечения, могли быть синхронными очагами MALT-лимфомы, не обнаруженными до начала терапии [12, 13]. Данный факт следует учитывать при определении стадии заболевания и выборе метода терапии.
Компьютерная томография органов грудной клетки и видеобронхоскопия с биопсией – основные методы диагностики опухолевых заболевания трахеи, однако характер патологического процесса можно установить только путем гистологического исследования с применением иммуногистохимического окрашивания. Морфологически лимфомы типа MALT характеризуются клеточной гетерогенностью неопластических клеток, включая центроцитоподобные клетки, моноцитоидные B-клетки, малые лимфоциты и плазматические клетки. В тканях слизистой оболочки клетки маргинальной зоны обычно инфильтрируют эпителий, образуя лимфоэпителиальные поражения. Хотя считается, что лимфоэпителиальные поражения являются отличительной чертой MALT-лимфомы, они не являются предпосылкой для постановки диагноза. При иммуногистохимическом исследовании клетки MALT-лимфомы экспрессируют монотипный поверхностный Ig, чаще являются IgM-положительными (IgM+), чем IgG+ или IgA+, но не IgD+, и в 40 % случаев экспрессируют цитоплазматические Ig. Опухолевые клетки экспрессируют ассоциированные с B-клетками антигены, такие как CD19, CD20, CD22, CD79a и CD79b, и являются CD5-отрицательными (CD5-), CD43-/CD43+, CD3-, CD23-, CD11c-/CD11c+ и CD10-. Сообщалось об иммунореактивности CD5 в небольшом количестве случаев, возникающих в некоторых экстранодальных участках, особенно в придатках глаза [14].
В связи с отсутствием рандомизированных исследований нет убедительно доказанных данных относительно метода лечения MALT-лимфом трахеи. Существует несколько эффективных позиций касаемо выбора терапии. В литературе присутствуют сообщения об успешном хирургическом лечении локализованных форм MALT с безрецидивными отдаленными результатами [11, 15–18]. Однако использование этой стратегии постепенно сокращается, поскольку послеоперационные осложнения более опасны, чем сама лимфома. Учитывая агрессивность хирургических вмешательств, предпочтение стоит отдать эндоскопическим методам – это эффективный метод устранения обструкции центральных дыхательных путей, который легко переносится пациентами и требует меньшего восстановительного периода [19]. В представленном клиническом наблюдении пациенту проведено эндоскопическое удаление опухоли при помощи полупроводникового лазера Dornier и электропетли с хорошим клиническим эффектом. Также существует стратегия временного стентирования дыхательных путей с последующей химио- и радиотерапией, поскольку это улучшает респираторное состояние пациента до наступления клинического ответа [20].
Одним из вероятных методов консервативного лечения является лучевая терапия, которая доказала свою эффективность при локализованном заболевании, в монорежиме или в комбинации с ПХТ [16, 20–23]. В случае диссеминированного или рефрактерного заболевания варианты системного лечения с химиоиммунотерапией считаются методом выбора. Химиотерапевтические и иммуноонкологические препараты редко использовались как часть лечения первой линии MALT-лимфомы начальной стадии, поскольку местная терапия способна обеспечить длительный безрецидивный период [24]. Однако в настоящее время опубликовано большое количество статей, описывающих успешное лечение ранних стадий MALT-лимфом с помощью химиоиммунотерапии [25–27]. В частности, ритуксимаб показал 70 % ответ при MALT-лимфоме, независимо от локализации опухоли [28]. В некоторых случаях пациенты могут быть оставлены под динамическое наблюдение, при условии бессимптомного течения заболевания. Данный подход может быть предложен для пожилых пациентов или больных с тяжелой сопутствующей патологией [29].
Следует отметить, что лимфомы MALT имеют отличный прогноз с показателями общей 5-летней выживаемости выше 90 % и 10-летней выживае- мости от 75 % до 80 %. Рецидивы могут возникать через несколько лет после лечения, в среднем через 5 лет, с вовлечением того же органа (60 % случаев) или других экстранодальных участков [24]. Также описаны случаи спонтанной регрессии лимфомы после диагностических биопсий [30].
Список литературы Первичная malt-лимфома трахеи (клиническое наблюдение)
- Diaz-Mendoza J., Debiane L., Peralta A.R., Simoff M. Tracheal tumors. Curr Opin Pulm Med. 2019; 25(4): 336-43. doi: 10.1097/ MCP.0000000000000585. PMID: 30973357.
- Urdaneta A.I., Yu J.B., WilsonL.D. Population based cancer registry analysis of primary tracheal carcinoma. Am J Clin Oncol. 2011; 34(1): 32-7. doi: 10.1097/C0C.0b013e3181cae8ab.
- Madariaga M.L., Gaissert H.A. Secondary tracheal tumors: a systematic review. Ann Cardiothorac Surg. 2018; 7(2): 183-96. doi: 10.21037/acs.2018.02.01.
- Соколов В.В., Телегина Л.В., Трахтенберг А.Х., Пикин О.В., Осипова Н.А., Бойко А.В., Франк Г.А., Белоус Т.А. Современные возможности эндобронхиальной хирургии и фотодинамической терапии при злокачественных опухолях трахеи и бронхов. Российский онкологический журнал. 2010; (3): 46-9. [Sokolov V.V., Telegina L.V., Trakhtenberg A.Kh., Pikin O.V., Osipova N.A., Boyko A.V., Frank G.A., Belous T.A. Modern approaches to endobronchial surgery and photody-namic therapy for malignant tumors of the trachea and bronchi. Russian Journal of Oncology. 2010; (3): 46-9. (in Russian)].
- Телегина Л.В. Эндобронхиальная хирургия при стенозирующих злокачественных опухолях трахеи и крупных бронхов. Дис. ... д-ра мед. наук. М., 2017. [TeleginaL.V. Endobronchial surgery for stenosing malignant tumors of the trachea and large bronchi. D.Sc. thesis. Moscow, 2017. (in Russian)].
- Iftikhar H., Siddiqui M.I., Minhas K. MALT lymphoma of the base of the tongue: a rare case entity. BMJ Case Rep. 2016. doi: 10.1136/ bcr-2015-213830.
- Tao X., Xu A. Amphioxus Immunity. Tracing the Origins of Human Immunity; Chapter 2. Basic Knowledge of Immunology; 2016. 15-42.
- Yoon R.G., Kim M.Y., Song J.W., Chae E.J., Choi C.M., Jang S. Primary endobronchial marginal zone B-cell lymphoma of bronchus-associated lymphoid tissue: CT findings in 7 patients. Korean J Radiol. 2013; 14(2): 366-74. doi: 10.3348/kjr.2013.14.2.366.
- Minami D., Ando Ch., Sato K., Moriwaki K., Sugahara F., Na-kasuka T., Iwamoto Yo., Fujiwara K., Shibayama T., Yonei T., Sato T. Multiple Mucosa-associated Lymphoid Tissue Lymphoma of the Trachea. Internal Medicine. 2017; 56(21): 2907-11. doi: 10.2169/internalmedi-cine.8269-16.
- Zinzani P.L., Poletti V., Zompatori M., Tani M., Spaggiari L., Tomassetti S., Broccoli A., Derenzini E., Baccarani M. Bronchus-associated lymphoid tissue lymphomas: an update of a rare extranodal maltoma. Clin Lymphoma Myeloma. 2007; 7(9): 566-72. doi: 10.3816/ clm.2007.n.042.
- Cai C., Jiang R.C., Li Z.B., ChenX.D., HeM.Z., Liu L., Zou X.Y. Two-stage tracheal reconstruction of primary tracheal non-Hodgkin lymphoma with nitinol mesh stent and cervical myocutaneous flap. Ann Thorac Surg. 2008; 85(3): 17-9. doi: 10.1016/j.athoracsur.2007.12.003.
- Raderer M., Wöhrer S., Streubel B., Troch M., Turetschek K., Jäger U., Skrabs C., Gaiger A., Drach J., Puespoek A., Formanek M., Hoffmann M., Hauff W., Chott A. Assessment of disease dissemination in gastric compared with extragastric mucosa-associated lymphoid tissue lymphoma using extensive staging: a single-center experience. J Clin Oncol. 2006; 24(19): 3136-41. doi: 10.1200/JC0.2006.06.0723.
- deBoer J.P., HiddinkR.F., RadererM., AntoniniN., AlemanB.M., Boot H., de Jong D. Dissemination patterns in non-gastric MALT lymphoma. Haematologica. 2008; 93(2): 201-6. doi: 10.3324/haematoU1835.
- Extranodal marginal cell lymphoma of mucosa-associated tissue (MALT lymphoma). In: Swerdlow S.H., Campo E., Harris N.L., Jaffe E.S., Pileri S.A., Stein H., Thiele J., Vardiman J.W. WHO Classification of Tumours of the Haematopoietic and Lymphoid Tissues. Lyon, France: IARC Press, 2008. 214-9.
- Топольницкий Е.Б., Капитонова Д.В., Гарчева А.С., Бородина Ю.А., ДоржиеваЮ.Э., КозловскийВ.В., МальковМ.В. Циркулярная резекция грудного отдела трахеи при MALT-лимфоме у пациентки в возрасте 81 года. Хирургия. Журнал им. Н.И. Пирогова. 2020; (5): 96-9. [Topol'nitskii E.B., KapitanovaD.V., GarchevaA.S, Borodina Yu.A., Dorzhieva Yu.E., Kozlovsky V.V., Malkov M.V. Circular resection of the thoracic trachea for MALT lymphoma in an 81-year-old patient. Pirogov Russian Journal of Surgery. 2020; (5): 96-9. (in Russian)]. doi: 10.17116/ hirurgia202005196.
- Kaplan M.A., Pettit C.L., Zukerberg L.R., Harris N.L. Primary lymphoma of the trachea with morphologic and immunophenotypic characteristics of low-grade B-cell lymphoma of mucosa-associated lymphoid tissue. Am J Surg Pathol. 1992; 16(1): 71-5. doi: 10.1097/00000478199201000-00011.
- Maeda M., Kotake Y., Monden Y., Nakahara K., Kawashima Y., Kitamura H. Primary malignant lymphoma of the trachea. Report of a case successfully treated by primary end-to-end anastomosis after circumferential resection of the trachea. J Thorac Cardiovasc Surg. 1981; 81(6): 835-9.
- Okubo K., Miyamoto N., Komaki C. Primary mucosa-associated lymphoid tissue (MALT) lymphoma of the trachea: a case of surgical resection and long term survival. Thorax. 2005; 60(1): 82-3. doi: 10.1136/ thx.2003.018721.
- Tsurutani J., Kinoshita A., Kaida H., Fujii H., Narasaki F., Fuku-da M., Oka M., Kohno S. Bronchoscopic therapy for mucosa-associated lymphoid tissue lymphoma of the trachea. Intern Med. 1999; 38(3): 276-8. doi: 10.2169/internalmedicine.38.276.
- Ding J., Chen Z., Shi M. Tracheal stenting for primary tracheal mucosa-associated lymphoid tissue lymphoma. Eur J Med Res. 2013; 18(1): 8. doi: 10.1186/2047-783X-18-8.
- Gill M.T., Cotelingam J.D., Lowery-Nordberg M., Nathan C.O. Tracheal non-Hodgkin's lymphoma masquerading as benign granulation tissue: a report of two cases. Ann Otol Rhinol Laryngol. 2010; 119(7): 431-5. doi: 10.1177/000348941011900701.
- Hashemi S.M., Heitbrink M.A., Jiwa M., Boersma W.G. A patient with endobronchial BALT lymphoma successfully treated with radiotherapy. Respir Med. 2007; 101(10): 2227-9. doi: 10.1016/j. rmed.2006.11.028.
- Kawaguchi T., Himeji D., Kawano N., Shimao Y., Marutsuka K. Endobronchial Mucosa-associated Lymphoid Tissue Lymphoma: A Report of Two Cases and a Review of the Literature. Intern Med. 2018; 57(15): 2233-6. doi: 10.2169/internalmedicine.0150-17.
- Raderer M., KiesewetterB., FerreriA.J. Clinicopathologic characteristics and treatment of marginal zone lymphoma of mucosa-associated lymphoid tissue (MALT lymphoma). CA Cancer J Clin. 2016; 66(2): 153-71. doi: 10.3322/caac.21330.
- Magliari M.E., Aquino R.T., Gongalves A.L., Marioni F., Ber-nardi Fdel C., Brasil S., Almeida J.A., Andrade B.J., Chiattone C.S., Lima C.A. Mucosa-associated lymphoid tissue lymphoma of the trachea: case report. Sao Paulo Med J. 2012; 130(2): 126-9. doi: 10.1590/s1516-31802012000200010.
- Hiraishi Y., Iikura M., Kogure Y., Hirashima J., Izumi S., Sugi-yama H. Two tracheal BALT lymphoma patients successfully treated with chemotherapy including rituximab. Respir Investig. 2014; 52(2): 144-6. doi: 10.1016/j.resinv.2013.07.006.
- Mizuno S., Ota S., Tanaka T., Shiomi K., Matsumura T., Kishi-moto N. Primary tracheal malignant lymphoma detected during a regular checkup in an asbestos dust-exposed smoker. Acta Med Okayama. 2014; 68(3): 177-81. doi: 10.18926/AM0/52659.
- Borie R., Wislez M., Antoine M., Copie-Bergman C., Thie-blemont C., Cadranel J. Pulmonary mucosa-associated lymphoid tissue lymphoma revisited. Eur Respir J. 2016; 47(4): 1244-60. doi: 10.1183/13993003.01701-2015.
- Ahn J.H., Chung J.H., Shin K.C., Choi E.Y., Jin H.J., Choi J.H., Lee K.H. Mucosa-associated lymphoid tissue lymphoma of the trachea associated with idiopathic pulmonary fibrosis: A case report and literature review. Medicine (Baltimore). 2018; 97(20): 10727. doi: 10.1097/ MD.0000000000010727.
- Hosoda C., Ishiguro T., Takahashi N., Kamiishi N., Shimizu Y., Ta-kayanagi N. Spontaneous regression of primary endobronchial extranodal marginal zone lymphoma of mucosa-associated lymphoid tissue. Respir Med Case Rep. 2019; 27: 100826. doi: 10.1016/j.rmcr.2019.100826.


