Первичная меланома пищевода. Обзор литературы, клиническое наблюдение
Автор: Киселев Н. М., Бобров Н. В., Кучин Д. М., Торгомян Г. Г., Шкалова Л. В., Фурман М. Г., Загайнов В. Е.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Клиническое наблюдение
Статья в выпуске: 4 т.9, 2019 года.
Бесплатный доступ
Первичная меланома пищевода является редким заболеванием, обладающим агрессивным течением и неблагоприятным прогнозом. В данной статье представлен обзор мировой литературы по данной нозологической форме заболевания, включающий в себя статистику заболеваемости, а также современные принципы диагностики и лечения пациентов с данной патологией и клиническое наблюдение лечения пациента с резектабельной формой заболевания.
Первичная меланома пищевода, рак пищевода, меланома, лечение меланомы, диагностика меланомы, резекция пищевода, эзофагэктомия
Короткий адрес: https://sciup.org/140249283
IDR: 140249283 | DOI: 10.18027/2224-5057-2019-9-4-42-48
Текст научной статьи Первичная меланома пищевода. Обзор литературы, клиническое наблюдение
Первичная меланома пищевода является крайне редко встречающимся заболеванием, составляя 0,1–0,2% от всех злокачественных новообразований пищевода [1,2] и 0,5% от всех форм меланом [3]. Еще реже встречается беспигментный (амеланотический) вариант меланомы, на долю которого приходится 15–20% всех первичных меланом пищевода [4–6].
Первое описание клинического наблюдения первичной меланомы пищевода датируется 1906 года в публикации Baur E. H [7], однако гистологически подтвержденный диагноз впервые был зарегистрирован Garfinkle J.M. и Cahan W.G. лишь в 1952 году. [8]. Дальнейшее изучение данной патологии показало, что источником развития опухоли являются меланобласты слизистой оболочки, следовательно, данный тип опухоли можно отнести к злокачественным неэпителиальным опухолям пищевода. Опухоль, как правило, имеет полиповидную форму со склонностью к экзофитному росту. К 2014 году, по данным Bisceglia et al. и Yamamoto S. et al., было зарегистрировано 369 случаев первичной меланомы пищевода.
При анализе опубликованных клинических наблюдений выявлены следующие закономерности.
Наибольшая частота встречаемости отмечена в группе пациентов в возрасте 60–70 лет, мужчины в 2–2,5 раза больше подвержены данному заболеванию. Преимущественной локализацией является средняя и нижняя треть пищевода, однако также имеются описания меланомы верхней трети пищевода [4,5,9].
Этиологические факторы, предрасполагающие к развитию этой патологии, на сегодняшний день до конца не изучены. У меланомы пищевода и кожи существуют общие сходные мутации, однако спектр специфичных мутаций
позволяет высказывать предположения о принципиальном отличии между этими видами опухолей; провоцирующие возникновение заболевания факторы при разных локализациях меланомы также отличны [10].
Клиническая картина заболевания неспецифична и схожа с другими злокачественными новообразованиями пищевода. Заболевание манифестирует дисфагией, одинофагией, снижением аппетита, потерей веса, болями в эпигастрии и за грудиной, изжогой, желудочно-кишечным кровотечением [5,9,11]. Среднее время от появления первых симптомов до установки окончательного диагноза составляет 3–3,5 месяца [4,5].
По причине отсутствия специфической клинической картины дифференциальная диагностика первичной меланомы с другими опухолевыми заболеваниями пищевода представляет собой сложную задачу [12]. Основным диагностическим методом является эндоскопическое исследование с биопсией и последующим гистологическим исследованием, в ряде случаев дополняемое проведением иммуногистохимического исследования. При эзофагоскопии первичная меланома пищевода чаще всего выглядит как экзофитное полиповидное образование от светло-серого до черного цвета, реже беспигментное; также могут встречаться язвенные формы [9,13,14].
Первичная меланома пищевода представлена преимущественно солитарным образованием, частота мультифокального поражения по данным ряда авторов составляет от 4,7% [15,16] до 12 % [17].
Беспигментный (ахроматический) вариант первичной меланомы пищевода отличается чрезвычайно агрессивным течением заболевания по причине инвазивного роста и склонности к раннему метастазированию. Около 40%
ПЕРВИЧНАЯ МЕЛАНОМА ПИЩЕВОДА. ОБЗОР ЛИТЕРАТУРЫ, КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ пациентов к моменту постановки диагноза имеют отдаленные метастазы. Метастазирование происходит, как правило, лимфогенным и гематогенным путями [9,13,14]. По данным Makuuchi H. et al., у больных с «поверхностной» первичной меланомой метастатическое поражение лимфоузлов регистрируется в 44,3% случаев, при «распространенной меланоме» — в 82,8% [18]. Присутствие отдаленных метастазов описано в таких органах, как печень, легкие, головной мозг, плевра, брюшина, кости и сердце [5,9,19].
С целью определения распространенности опухолевого поражения и постановки топического диагноза рутинно используется КТ с внутривенным контрастированием [4], ряд авторов рекомендуют использование ПЭТ-КТ с 18-ФДГ, которое так же позволяет определить стадию заболевания [11,20,21]. Применение таких инструментальных методов обследования, как МРТ, рентгеноскопия, эндоУЗИ, также является важным для уточнения диагноза [4,5,9,22].
Крайне важным для проведения дифференциальной диагностики первичной меланомы пищевода является выполнение иммуногистохимического исследования [4,5,23,24]. Положительные HMB-45, белок S-100, Vimentin, Melan A, нейроспецифичная енолаза и отрицательные цитокератин, р 63, CEA подтверждают наличие меланомы и исключают карциному [4,5,9]. SOX10 и KBA62 используется в диагностике беспигментных меланом [25]. Имеются сведения, что детекция трансмембранных онкопротеинов KIT и PDGFRA используется для определения первичной меланомы пищевода и дифференцировки ее с первичной меланомой кожи [26]. В своем исследовании Sanlorenzo M. et al. при определении мутационного профиля опухоли отметили высокий процент мутации гена NRAS [27].
Вопросы тактики лечения по причине редкости данной патологии остаются дискутабельными и не стандартизированы. Безусловно, тактику лечения определяют локализация опухоли, стадия заболевания и соматический статус пациента. В настоящее время, по мнению большинства авторов, хирургический метод лечения является методом выбора, объем оперативного вмешательства по причине распространенности процесса наиболее часто представлен эзофагэктомией или субтотальной резекцией пищевода с лимфаденэктомией [28–31].
Стандарты лекарственной противоопухолевой терапии первичной меланомы пищевода отсутствуют ввиду редкости данного заболевания. Применение лучевой, химио- и иммунотерапии в качестве самостоятельных методов лечения оправдано в случае нерезектабельности опухоли, наличии отдаленного метастазирования или противопоказаний к оперативному лечению по соматическому статусу пациента [9,24].
Рядом авторов предоперационная химиолучевая терапия рекомендована для уменьшения объема опухоли и улучшения отдаленных результатов [4,11,32]. Применение ингибиторов контрольных точек иммунного ответа является крайне перспективным и эффективным методом
лечения, который использовался в качестве терапии первой линии меланомы пищевода [9,33]. В исследовании Lu Si и Jun Guo пациенты с нерезектабельными меланомами пищевода, получавшие иммунотерапию ингибиторами PD-1 рецепторов, продемонстрировали увеличение без-рецидивной выживаемости на 12,1 месяцев в сравнении с пациентами, прошедшими химиотерапию (15,6 против 3,5 мес.) [24]. Имеются данные о положительном влиянии применения интерферона α в адьювантном режиме в течение года у пациента с первичной меланомой пищевода и метастатическим поражением легкого после одномоментной эзофагэктомии с лобэктомией [34]. Имеются данные о применении таргетной терапии у пациентов с активными мутациями в специфических локусах таких генов как с-Kit, NRAS, BRAF, однако результаты лечения являются сомнительными [24,35]. В ряде публикаций представлены данные о применении различных схем химиотерапии такими препаратами как 5-фторурацил, дакарбазин, цисплатин, темозоламид, однако степень их эффективности и влияние на отдаленные результаты также весьма спорные [24,36].
Встречаются клинические наблюдения успешного использования фотодинамической терапии, на фоне которой наблюдался полный регресс опухоли, однако через 5 месяцев отмечена прогрессия заболевания в виде появления метастазов в печени и легких, потребовавших начало химиотерапии [14].
Имеются данные о возможном применении эндоскопической резекции при малых опухолях, распространяющихся в пределах слизистой оболочки [37,38], и в паллиативных целях [13,39].
Согласно данным различных авторов, 2-х летняя без-рецидивная выживаемость после радикального лечения первичной опухоли составляет около 40%, а общая выживаемость — около 50–60%. Медиана выживаемости может достигать 34,5 месяцев [23,28,40].
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ
Пациент мужчина 64 лет направлен в онкологическое отделение ФБУЗ ПОМЦ ФМБА России с диагнозом плоскоклеточная карцинома нижней трети пищевода.
Из анамнеза: обследован по поводу жалоб на прогрессирующую дисфагию 2 ст., одинофагию. Вышеуказанные жалобы предъявлял в течение последних 2–3 месяцев. Помимо этого, отмечал снижение массы тела на 8 кг за последние 6 месяцев (ИМТ = 18,3 кг/м2). Других проявлений заболевания не было. Наследственность не отягощена. Табакокурение и злоупотребление алкоголем отрицает.
ПЕРВИЧНАЯ МЕЛАНОМА ПИЩЕВОДА. ОБЗОР ЛИТЕРАТУРЫ, КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ
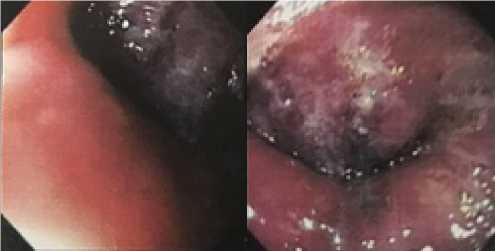
Рисунок 1. Опухоль нижней трети пищевода при эзофагогастродуоденоскопии.
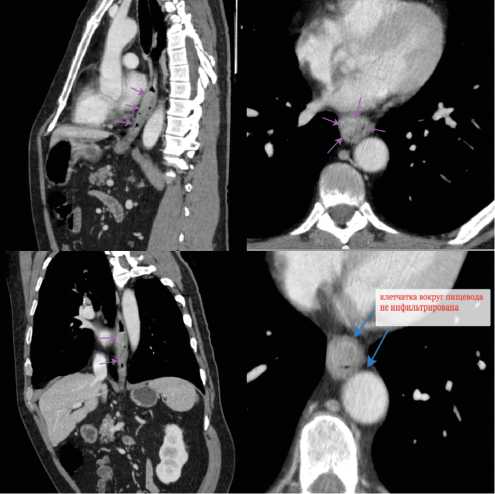
Рисунок 2. Аксиальная, сагиттальная и фронтальная проекции компьютерной томографии органов грудной клетки и органов брюшной полости с внутривенным контрастированием.
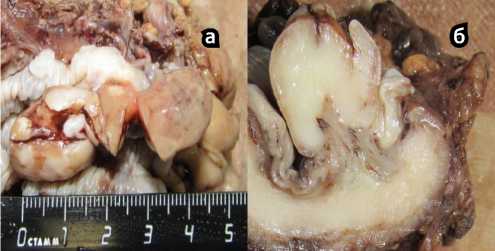
Рисунок 3. Макрофотографии стенки пищевода с опухолью: а — общий вид, б — вид на разрезе.
Оперативных вмешательств не было. Из сопутствующей патологии у пациента длительный коронарный анамнез, в 2009 году проведено стентирование правой коронарной артерии по поводу стенокардии напряжения III ФК. Также у пациента имеется гипертоническая болезнь III ст., cт. 1, риск 3. ECOG статус — 1 балл.
Амбулаторно по эзофагогастродуоденоскопии на 35 см от резцов в нижне-грудном отделе пищевода по передней стенке выявлено опухолевидное образование синюшно-красного цвета, более чем на 2/3 стенозирующее его просвет (рис. 1), выполнена биопсия.
По результатам гистологического исследования биопсийного материала верифицирован плоскоклеточный рак. Пациенту выполнялись компьютерная томография органов грудной клетки и органов брюшной полости с внутривенным контрастированием, в ретрокардиаль-ном сегменте грудного отдела пищевода на протяжении 6,5 см определялось неравномерное утолщение стенки толщиной до 13 мм, данных за поражение других отделов пищевода нет, отмечено супрастенотическое расширение пищевода. Отдаленных метастазов не выявлено (рис. 2).
Пациент консультирован в нашем Центре, назначено дообследование с целью оценки соматического статуса пациента, определения стадии заболевания и дальнейшей тактики лечения в рамках мультидисциплинарного консилиума.
По результатам обследований установлено, что у пациента плоскоклеточная карцинома нижней трети пищевода сТ2N0M0, стадия II A по классификации злокачественных опухолей TNM [42]. Соматический статус по ECOG 1. Физический статус по ASA III.
Необходимо уточнить, что все инструментальные исследования, в том числе гистологическое, были выполнены вне нашего учреждения. Пересмотра гистологических стекол до операции не проводилось, поскольку клинических сомнений в диагнозе не возникало.
На консилиуме принято решение о выполнении оперативного вмешательства в объеме операции типа Ivor-Lewis.
Пациент госпитализирован в онкологическое отделение КБ № 1 ФБУЗ ПОМЦ ФМБА России, подготовлен к плановому оперативному лечению. Выполнена субтотальная резекция пищевода с одномоментной внутриплевральной пластикой желудочным стеблем, лимфаденэктомия 2F из комбинированного лапаротомного и правостороннего торакотомного доступов. Макроскопически опухоль была представлена экзофитным образованием розового цвета, плотной консистенции, диаметром 4 см, соединенным со слизистой пищевода тонкой ножкой. На разрезе ткань образования светло-розового цвета, однородная, растет в пределах стенки пищевода. Слои стенки пищевода на разрезе в области образования дифференцируются (рис. 3).
Послеоперационный период протекал без осложнений и составил 11 койко-дней. При контрольной рентгеноскопии пищеводно-желудочного анастомоза патологических
ПЕРВИЧНАЯ МЕЛАНОМА ПИЩЕВОДА. ОБЗОР ЛИТЕРАТУРЫ, КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ затеков контрастного вещества не выявлено, пищеводно-желудочный анастомоз проходим, контрастирован желудочный стебель, проксимальные петли тонкой кишки не расширены (рис. 4).
При микроскопическом исследовании операционного материала в подслизистом слое стенки пищевода определяется опухолевый узел солидно-альвеолярного строения, из клеток среднего и крупного размера с ядрами овальной, округлой и бобовидной формы с гранулярным хроматином и ободком бледно-эозинофильной цитоплазмы. В ядрах части клеток выявляются четкие эозинофильные ядрышки; в отдельных опухолевых клетках — фигуры атипичных митозов. В опухоли встречаются участки, образованные опухолевыми клетками с веретеновидными ядрами, формирующими волокнистые пучки. Слизистая оболочка пищевода над опухолевым узлом изъязвлена. Опухоль растет в пределах подслизистого слоя, мышечный слой стенки пищевода интактен. За пределами подслизистого опухолевого узла отмечается поверхностное распространение опухоли в пределах базального слоя многослойного плоского эпителия слизистой оболочки пищевода. По отдельным полям зрения в данных участках выявляются клетки с наличием в цитоплазме гранул темно-коричневого пигмента (рис. 5). В границах резекции опухолевого роста не выявлено. В присланных
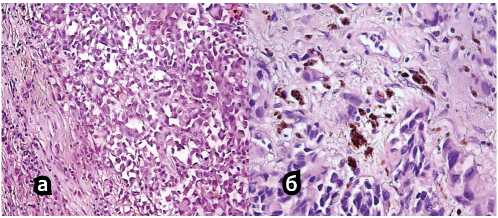
Рисунок 5. Окраска гематоксилином и эозином (а × 200, б × 400)
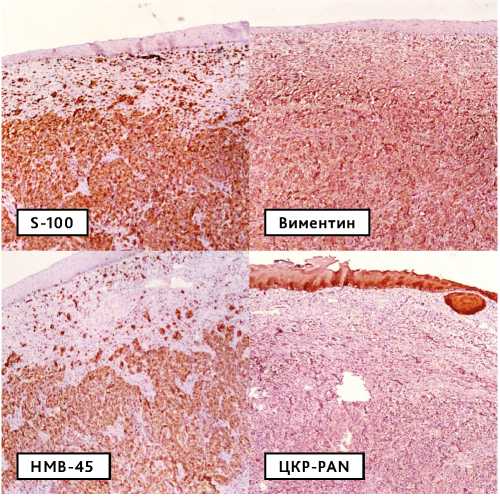
Рисунок 6. Иммуногистохимическое окрашивание, ×100: клетки опухоли ярко экспрессируют S-100, Виментин, HMB-45 и не экспрессируют ЦКР-РАN.
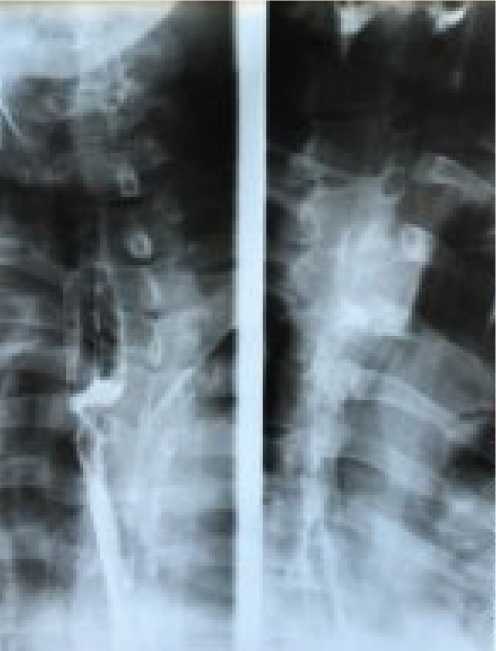
Рисунок 4. Контрольная рентгеноскопия пищеводножелудочного анастомоза на 5-е сутки послеоперационного периода.
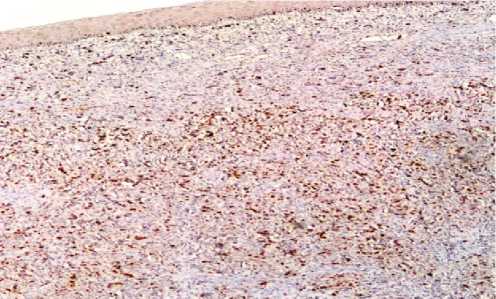
Рисунок 7. Иммуногистохимическое окрашивание, ×100: яркая экспрессия Ki-67 в ядрах до 30% опухолевых клеток.
ПЕРВИЧНАЯ МЕЛАНОМА ПИЩЕВОДА. ОБЗОР ЛИТЕРАТУРЫ, КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ лимфоузлах метастазов опухоли нет. Заключение — первичная меланома пищевода (ICD-O code: 8720/3).
Диагноз подтвержден результатами иммуногистохимического исследования: опухолевые клетки ярко экспрессируют Виментин, S-100, PMEL-17, СD 117 и не экспрессируют ЦКР-РАN, ЦКР 7, ЦКР 5, р 63, CD 34, Десмин, SM-актин (рис. 6). Ki-67 экспрессируется в ядрах до 30% опухолевых клеток (рис. 7).
По результатам молекулярно-генетического исследования опухоли обнаружено увеличение количества копий гена KRAS и не обнаружено мутаций в генах KRAS, NRAS, BRAF, KIT (C-Kit), PDGFRA.
Пациент осмотрен дерматологом, офтальмологом, данных за меланому кожи, глаз не получено. Дополнительно проводилось МРТ головного мозга, ПЭТ-КТ всего тела, другой очаговой патологии не выявлено.
В дальнейшем пациенту не проводили ни химиолуче-вую, ни иммунотерапию. При динамическом наблюдении в течение 14 месяцев данных за рецидив или прогрессирование заболевания нет.
ВЫВОДЫ:
-
1. Первичная меланома пищевода является редким, трудным для диагностики заболеванием, склонным к крайне агрессивному течению.
-
2. Лечение пациентов с данной патологией должно являться прерогативой специализированных центров.
-
3. Выбор оптимальной тактики лечения необходимо проводить в рамках мультидисциплинарного подхода, что позволяет надеяться на улучшение отдаленных результатов лечения.
Список литературы Первичная меланома пищевода. Обзор литературы, клиническое наблюдение
- Alvarez R. U., Funke R. A., Felipe Solis H., et al. Melanoma primario de esofago. Rev Chilena de Cirugia 2009;61:168 - 70.
- Sanchez A. A., Wu T. T., Prieto V. G. et al. Comparison of primary and metastatic malignant melanoma of the esophagus: clinicopathologic review of 10 cases. Arch. Pathol. Lab. Med 2008;132:1623 - 1629.
- Volpin E., Sauvanet A., Couvelard A., Belghiti J. Primary malignant melanoma of the esophagus: a case report and review of the literature. Dis. Esophagus 2002;15:244 - 249.
- Kransfelder M., Seidl S., Dobritz M. et al. Amelanotic esophageal malignant melanoma: case report and review of literature. Case Rep. Gastroenterol 2008;2:224 - 231.
- Stringa O., Valdez R., Beguerie J. R. et al. Primary amelanotic melanoma of the esophagus. Int. J. Dermatol 2006;45:1207 - 1210
- Koga N, Kubo N, Maehara Y. et al. Primary amelanotic malignant melanoma of the esophagus: a case report. Surg Case Rep 2019;5 (1):4.
- Baur E. H. Ein fall von primaerem melanoma de oesophagus. Arb. Geb. Pathol. Anat. Inst. Tuebingen 1906;5:343 - 354.
- Garfinkle JM, Cahan WG. Primary melanocarcinoma of the esophagus; fist histologically proved case. Cancer 1952;5:921 - 926.
- Morita F. H. A., Ribeiro U., Sallum R. A. A. et al. Primary malignant melanoma of the esophagus - a rare and aggressive disease. World. J. Surg. Oncol 2013;11:210 - 216.
- Krauthammer M. Unraveling the etiology of primary malignant melanoma of the esophagus. J Thorac Dis. 2018;9:1074 - 1075.
- Hashimoto T, Makino T, Doki Y. et al. Clinicopathological characteristics and survival of primary malignant melanoma of the esophagus. Oncol Lett. 2019;18 (2):1872 - 1880.
- Sim Y., Teo J. S., Iqbal J., Chan W. H. Primary melanoma of the esophagus, a diagnostic challenge. Asian J. Surg 2015;38 (4):236 - 238.
- Lee S. H., Park S. H., Kim H. G. et al. Primary malignant melanoma of the esophagus. Yonsei Med. J 1998;39:468 - 473.
- Naomoto Y., Perdomo J. A., Kamikawa Y. et al. Primary malignant melanoma of the esophagus: report of a case successfully treated with pre- and post-operative adjuvant hormone-chemotherapy. Jpn. J. Clin. Oncol 1998;28:758 - 761.
- Abdel Samie A., Stumpf M., Fayyazi A., Werle S., Theilmann L. Primary multifocal malignant melanoma of the esophagus. J. Gastrointest. Cancer 2014;45:228 - 30.
- Yamamoto S., Makuuchi H., Kumaki N., Ozawa S., Shimada H., Chino O., Kazuno A., Yasuda S., Tamayama T., Sakai I. A long surviving case of multiple early stage primary malignant melanoma of the esophagus and a review of the literature. Tokai J. Exp. Clin. Med. 2015;40 (3):90 - 95.
- Granel V. L., Moya S. M. A., Fortea S. C., Escrig S. V. J., Fortea S. C., Martínez L. C., Tornador G. N., Salvador S. J. L. Primary esophageal melanoma: Report of a case. Rev. Esp. Enferm. Dig 2016;108 (10):666 - 669.
- Makuuchi H., Takubo K., Yanagisawa A., Yamamoto S. Esophageal malignant melanoma: analysis of 134 cases collected by the Japan Esophageal Society. Dis. Esophagus 2015;12:158 - 169.
- Matsutani T., Onda M., Miyashita M. et al. Primary malignant melanoma of the esophagus treated by esophagectomy and systemic chemotherapy. Dis. Esophagus 2001;14:241 - 244
- Pfannenberg C., Schwenzer N. Whole-body staging of malignant melanoma: advantages, limitations and current importance of PET-CT, whole-body MRI and PET-MRI. Radiology 2015;55:120 - 126
- Vandewoude M., Cornelis A., Wyndaele D. et al. (18) FDG-PET-scan in staging of primary malignant melanoma of the oesophagus: a case report. Acta. Gastroenterol. Belg 2006;69:12 - 14.
- Ohnuma H, Ishikawa K, Kato J. et al. Cases of primary malignant melanoma and melanocytosis of the esophagus observed by magnifying endoscopy: Application to differential diagnosis: case series. Medicine (Baltimore) 2017;96 (17):e6701.
- Lasota, J., Kowalik, A., Miettinen, M. et al. Primary malignant melanoma of esophagus: clinicopathologic characterization of 20 cases including molecular genetic profiling of 15 tumors. Modern Pathology 2019;32:957 - 966.
- Wang X, Kong Y, Guo J. et al. Primary malignant melanoma of the esophagus: A retrospective analysis of clinical features, management, and survival of 76 patients. Thorac Cancer 2019;10 (4):950 - 956.
- Kobayashi J, Fujimoto D, Goi T. et al. A report of amelanotic malignant melanoma of the esophagus diagnosed appropriately with novel markers: A case report. Oncol Lett 2018;15 (6):9087 - 9092.
- Terada T. Amelanotic malignant melanoma of the esophagus: report of two cases with immunohistochemical and molecular genetic study of KIT and PDGFRA. World J. Gastroenterol 2009;15:2679 - 2683.
- Sanlorenzo M., Ribero S., Quaglino P. et. al. Genetic mutations in primary malignant melanoma of the esophagus: case report and literature review. G. Ital. Dermatol. Venerol 2015.
- Harada K, Mine S, Yamada K, et al. Long-term outcome of esophagectomy for primary malignant melanoma of the esophagus: a single-institute retrospective analysis. Dis Esophagus 2016;29:314 - 319.
- Gao S, Li J, Feng X, Shi S, He J. Characteristics and Surgical Outcomes for Primary Malignant Melanoma of the Esophagus. Sci Rep 2016;6:23804.
- Ling C, Feng J, Li J, Liu Q. Primary malignant melanoma of the esophagus. Turk J Gastroenterol 2018;6:711 - 713.
- Kuwabara S, Ebihara Y, Hirano S. Primary malignant melanoma of the esophagus treated with subtotal esophagectomy: a case report. BMC Surg 2017;17 (1):122.
- Imai, S., Suzuki, A., Yamamoto, Y., Clin J. et al. Primary malignant melanoma of esophagus following chemoradiotherapy for esophageal squamous cell carcinoma: report of a case. Gastroenterol 2017;10:336.
- Pauline Rochefort, Juliette Roussel, Christelle de la Fouchardière et al. Primary malignant melanoma of the esophagus, treated with immunotherapy: a case report. immunotherapy 2018;10:831 - 835.
- Tian Zhao, Feng-Wei Kong, Wen-Bin Wu. A long-term survivor with esophageal melanoma and pulmonary metastasis after single-stage esophagectomy and lobectomy. Medicine 2017; e7003.
- Abdo J, Agrawal DK, Mittal SK. "Targeted" Chemotherapy for Esophageal Cancer. Front Oncol 2017;7:63.
- Yoshio Naomoto, Kyoko Hara, Noriaki Tanaka. Primary Malignant Melanoma of the Esophagus: Report of a Case Successfully Treated with Pre- and Post-operative Adjuvant Hormone-Chemotherapy. Japanese Journal of Clinical Oncology 1998;28:758 - 761
- Eleftheriadis N., Inoue H., Ikeda H., Onimaru M., Yoshida A., Hosoya T. et al. Endoscopic submucosal dissection for primary malignant esophageal melanoma (with video). Gastrointest. Endosc. 2013;78:359.
- Tipirneni E., Gunaratnam N. T., Tworek J. A., Kodali S. Primary malignant melanoma of esophagus treated with endoscopic mucosal resection and esophagectomy. J. Gastrointest. Cancer 2011;42:266 - 268.
- Sabanathan S., Enj J., Pradhan G. Primary malignant melanoma of the esophagus. Am. J. Gastroenterol 1989;84:1475 - 1481.
- Navarro-Ballester A., De Lázaro-De Molina S., Gaona-Morales J. Primary Malignant Melanoma of the Esophagus: A Case Report and Review of the Literature. Am. J. Case Rep 2015;16:491 - 495.
- Raven R. W., Dawson A. Malignant melanoma of the esophagus. Br. J. Surg 1964;51:551 - 555.
- Sobin L. H., Gospodarowicz M. K., Wittekind Ch. TNM Classification of Malignant Tumors, 8th edition. Wiley- Blackwell 2016; p272.


