Первичная Т-клеточная экстранодальная лимфома, ассоциированная с энтеропатией, дебютировавшая с осложнений. Анализ двух собственных клинических наблюдений и причин их неблагоприятного исхода
Автор: Альмяшев Али Закирович, Ульянкина Регина Алиевна, Скопин Павел Игоревич, Ивашин Артм Александрович, Мохаммед Абдул-Азиз Ахмед
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 2 т.20, 2021 года.
Бесплатный доступ
Актуальность. Т-клеточные лимфомы с преимущественным поражением тонкой и/или толстой кишки относятся к категории редких и обычно крайне агрессивных по клиническому течению злокачественных неходжкинских лимфом. Выделяют два типа Т-клеточных лимфом с преимущественным поражением тонкой кишки: Т-клеточная лимфома, ассоциированная с аутоиммунной энтеропатией, и спорадическая мономорфная эпителиотропная интестинальная Т-клеточная лимфома. Описание. Представлены 2 истории болезни женщин 63 и 50 лет с редкой формой первичной периферической экстранодальной Т-клеточной лимфомы CD20- и CD30-негативной, ассоциированной с энтеропатией. Оба случая осложнялись перфорацией опухоли тонкой кишки и диагностированы при плановом послеоперационном гистологическом и иммуногистохимическом исследовании. Залючение. Поздняя диагностика, множественный характер поражения, осложнения и быстрое прогрессирование процесса привели к неблагоприятному исходу - гибели пациенток.
Т-клеточная лимфома, ассоциированная с аутоиммунной энтеропатией, диагностика, лечение, исход
Короткий адрес: https://sciup.org/140254065
IDR: 140254065 | УДК: 616-006.441-06:616.341 | DOI: 10.21294/1814-4861-2021-20-2-141-148
Текст научной статьи Первичная Т-клеточная экстранодальная лимфома, ассоциированная с энтеропатией, дебютировавшая с осложнений. Анализ двух собственных клинических наблюдений и причин их неблагоприятного исхода
Т-клеточные лимфомы с преимущественным поражением тонкой и/или толстой кишки относятся к категории редких и обычно крайне агрессивных по клиническому течению злокачественных неходжкинских лимфом (ЗНХЛ). Преимущественно поражаются лица старше 60–70 лет. По одним данным, чаще заболевают мужчины, по другим источникам, значительных гендерных отличий нет [1, 2]. В клинической картине преобладают симптомы хронической диареи, боли в животе, похудание, повышение температуры тела, кишечные кровотечения, реже наблюдаются пальпируемая в брюшной полости опухоль, лимфаденопатия, гепатоспленомегалия.
Частота ЗНХЛ составляет от 0,5 до 1 случая на 1 млн населения в год. Описаны дебюты заболевания в виде острой перфорации стенки тонкой кишки в зоне опухоли или желтухи, обусловленной множественными метастазами в печень [1, 2]. Классификация Т-клеточных лимфом с преимущественным поражением тонкой кишки претерпевала изменения (ВОЗ, 2008, 2017) [3]. На основании морфологии, иммуногистохимических особенностей и генетического профиля в качестве самостоятельных нозологических вариантов рассматриваются Т-клеточная лимфома, ассоциированная с аутоиммунной энтеропатией (ЭАТЛ), которая преобладает среди пациентов западных стран, преимущественно в европейской популяции и протекает с рефрактерной целиакией (глютеновая энтеропатия), встречается в 80–90 % случаев, и спорадическая мономорфная эпителиотропная интестинальная Т-клеточная лимфома (МЭИТЛ), характерная для азиатской популяции больных, при которой клинических проявлений целиакии (синдрома мальабсорбции) нет, встречается в 10–20 %.
Клинический пример № 1
Пациентка, 63 лет, обратилась 27.06.11 в ГБУЗ «Республиканский онкологический диспансер» Республики Мордовия (ГБУЗ РМ РОД) с жалобами на умеренные боли в животе. Обследована в плановом порядке в Лечебно-диагностическом центре, г. Пенза, где при МРТ брюшной полости и малого таза с внутривенным контрастированием (22.06.11) в пузырно-маточном пространстве справа была выявлена солидно-кистозная опухоль.
Поставлен диагноз опухоль правого яичника. 01.07.11 в гинекологическом отделении ГБУЗ РМ РОД в плановом порядке проведена лапаротомия. При ревизии брюшной полости выявлены множественные очаги: мягкотканые опухоли подвздошной кишки (дистальная – в 10–15 см от
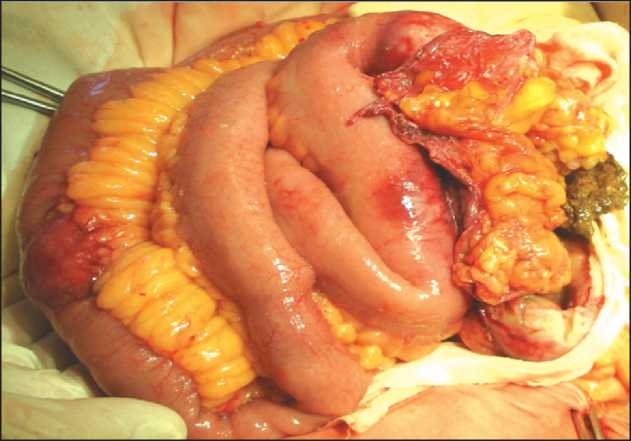
Рис. 1. Интрамуральные опухоли подвздошной кишки с инвазией серозной оболочки и перфорацией одной из петель кишки с образованием околокишечного абсцесса Fig. 1. Intramural ileum tumors with serosal involvement and perforation of one of them, and perienteric abscess баугиниевой заслонки), проксимальная опухоль (на 70 см выше) с распадом, прикрытой перфорацией (рис. 1) и образованием околокишечного абсцесса, фиксированного к дну и задней стенке мочевого пузыря. Произведена резекция сегмента подвздошной кишки, длиной 80–90 см, сформирован ручной однорядный илеотрансверзоанастомоз по типу «конец в бок», биопсия мезентериального лимфоузла, смыв с брюшной полости, полости мочевого пузыря на цитологию, дренирование брюшной полости.
При плановом морфологическом исследовании, по результатам светооптической микроскопии (препараты с окраской гематоксилином и эозином) больше данных за диффузную крупноклеточную В-клеточную лимфому (ДВККЛ) тонкой кишки. В лимфоузлах – явления реактивной гиперплазии. Блоки направлены на иммуногистохимическое исследование (ИГХ). Клинический диагноз: экс-транодальная ЗНХЛ (ДВККЛ с многоочаговым трансмуральным поражением тонкой кишки и перфорацией кишечной стенки) по Ann-Arbor IVB cт. и II ER ст. по Lugano.
При ИГХ-исследовании в ООД г. Пензы в стенке кишки выявлена диффузная инфильтрация (в боль- шей степени выраженная в слизистой оболочке) клетками среднего и крупного размера с округлым ядром и довольно обильной светлой цитоплазмой, опухолевые клетки проникают в эпителий крипт, на фоне клеток воспаления встречаются единичные фолликулярные структуры. В клетках видна диффузная экспрессия CD3, в большей части клеток – экспрессия CD43, в незначительной части – экспрессия bcl2, в единичных клетках – CD30, экспрессия цитокератинов в эпителии желез. Экспрессия Ki67 – 30 %. Заключение: периферическая Т-клеточная ЗНХЛ энтеропатического типа (ассоциированного с энтеропатией) тонкой кишки (рис. 2–8).
Послеоперационный период протекал без осложнений. С 19.08.11 по 1.11.11 проведено 4 курса полихимиотерапии по схеме CHOP (цикло-фосфан – 1,2 г, доксорубицин – 80 мг, винкристин – 2 мг). Через 6 мес после операции и через 3 мес после 4-го курса полихимиотерапии пациентка скончалась. Вскрытие не проводилось. Анализ медицинской документации показал, что предположительная причина смерти – полиорганная недостаточность.
Клинический пример № 2
Пациентка, 50 лет, поступила с жалобами на жидкий стул до 5 раз в сутки, тошноту, периодическую рвоту, схваткообразные боли в животе, отсутствие аппетита, потерю веса до 25 кг. Больной себя считает около полугода, амбулаторно лечилась у гастроэнтеролога по поводу синдрома раздраженной кишки. 25.10.19 госпитализирована в МРЦКБ с явлениями хронической тонкокишечной обтурационной непроходимости. 31.10.19 выполнена резекция тощей кишки по поводу стенозирующей опухоли на уровне 30 см от связки Трейца. С 13.12.19 получала симптоматическое лечение по месту жительства.
В ГБУЗ РМ РОД доставлена по экстренным показаниям через 2 мес после операции. По данным рентгенографии органов брюшной полости (13.12.19): петли толстой и тонкой кишки расширены, заполнены жидкостью с горизонтальными
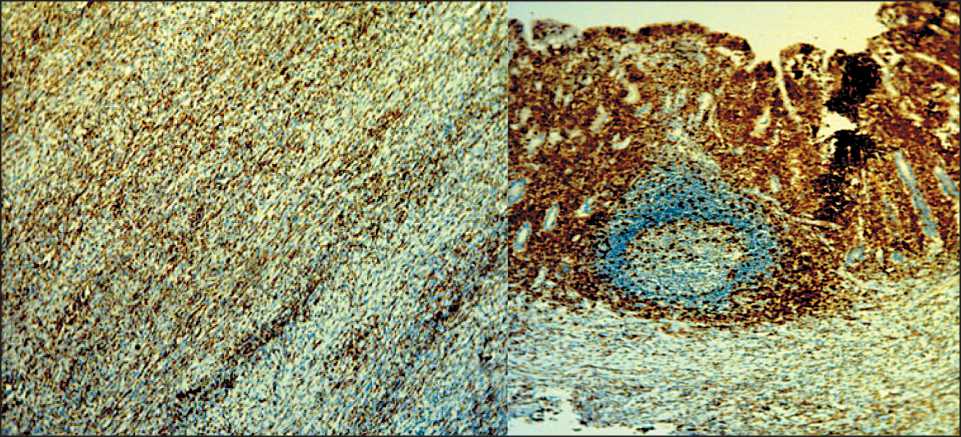
Рис. 2. Микрофото.
Иммуногистохимическое исследование.
CD3 «+», инфильтрация слизистой подвздошной кишки Т-лимфоцитами с атрофией ворсин. В центре препарата лимфоидный фолликул, ×10 Fig. 2. Microphoto. Immunohistochemical study. CD3 «+», Infiltration of the ileumT lymphocytes with villous atrophy. In the center of the drug is a lymphoid follicle, ×10
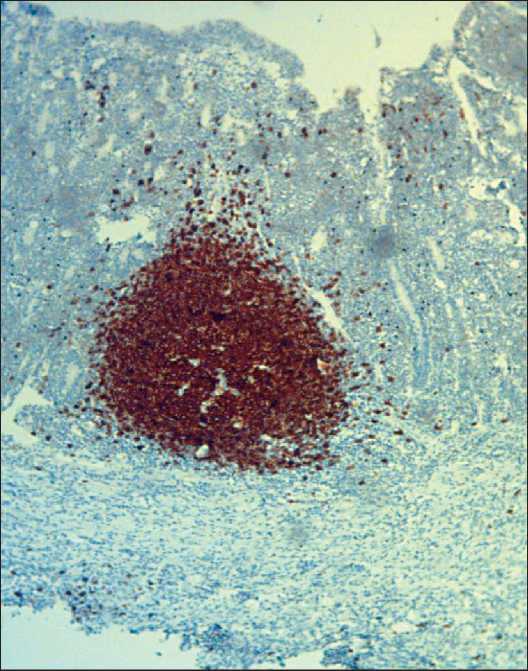
Рис. 4. Микрофото. Иммуногистохимическое исследование.
Слизистая подвздошной кишки: CD 20 – слабая экспрессия, в центре лимфоидный фолликул CD 20 «+»,×10
Fig. 4. Microphoto. Immunohistochemical study. Mucosal ileum:
CD 20 – weak expression, in the center of the lymphoid follicle
CD 20 «+», ×10
Рис. 3. Микрофото. Иммуногистохимическое исследование. Слизистая тонкой кишки: bcl2, слабая экспрессия в единичных клетках, ×10
Fig. 3. Microphoto. Immunohistochemical study. Mucosa of the small intestine: bcl2, weak expression in single cells, ×10
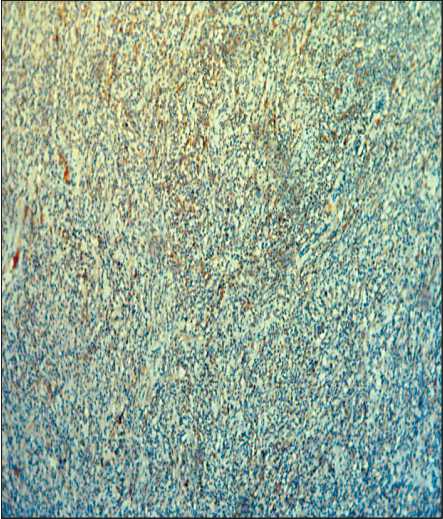
Рис. 5. Микрофото. Иммуногистохимическое исследование.
CD 30 «», незначительная часть клеток «+», ×10 Fig. 5. Microphoto. Immunohistochemical study. CD 30 «», a small part of the cells «+», ×10
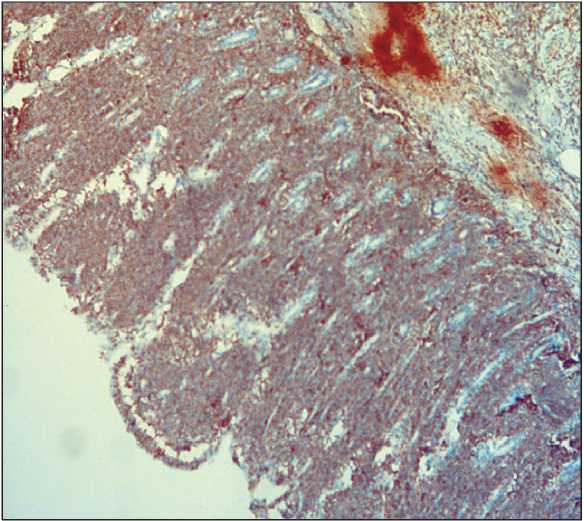
Рис. 6 . Микрофото. Иммуногистохимическое исследование.
CD 43 экспрессия в большей части клеток слизистой тонкой кишки, ×10
Fig. 6. Microphoto. Immunohistochemical study. CD 43 expression in most of the cells of the small intestine, ×10
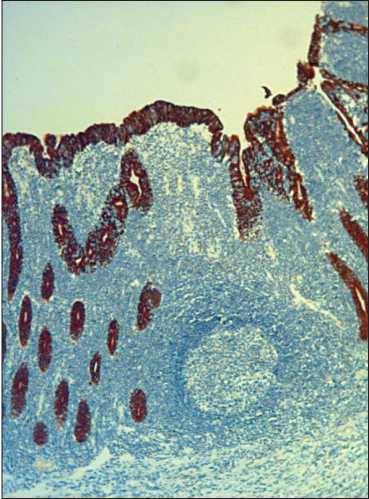
Рис. 7. Микрофото. Иммуногистохимическое исследование. Панцитокератины «». Экспрессия цитокератина в эпителии тонкокишечных желез, ×10
Fig. 7. Microphoto. Immunohistochemical study. Pancytokeratins «». Expression of cytokeratin in the epithelium of the small intestine, magnification ×10
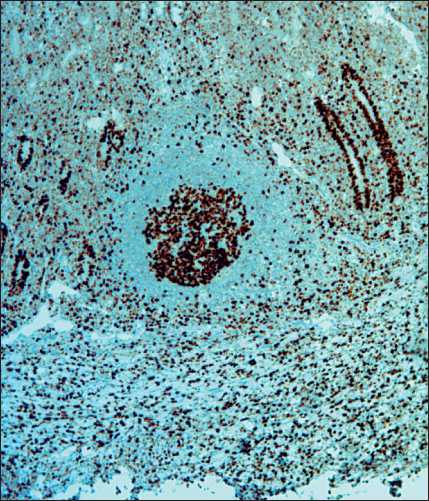
Рис. 8. Микрофото. Иммуногистохимическое исследование. Ki67 в опухолевых клетках – 30 %, ×10
Fig. 8. Microphoto. Immunohistochemical study. Ki67 in tumor cells – 30 %, ×10
уровнями в ободочной кишке. При рентгенографии грудной клетки признаки хронического бронхита, единичные кальцинаты легких, участки пневмосклероза. Запрошены и пересмотрены гистологические препараты резецированной тонкой кишки: больше данных за неходжкинскую лимфому. Препараты направлены в ГАУЗ «Республиканский клинический онкологический диспансер» Министерства здравоохранения Республики Татарстан для консультации и имунногистохимического исследования.
Консилиумом онкологов (№ 247, 20.12.19) выставлен предварительный диагноз: лимфома тонкой кишки II ER ст. Решено госпитализировать пациентку в хирургическое отделение и по жизненным показаниям начать курс ПХТ. 23.12.19 состояние больной резко ухудшилось, появилась клиника перфорации полого органа. По экстренным показаниям проведена лапаротомия, при которой выявлена перфорация купола слепой кишки у основания червеобразного отростка, выполнена резекция купола слепой кишки и участка терминального отдела подвздошной кишки, формирование концевых асцендо- и илеостомы, дренирование брюшной полости. В послеоперационном периоде проводилась комплексная антибактериальная и противовоспалительная интенсивная терапия, плазмотрансфу-зии и трансфузия тромбоконцентрата по поводу индуцированной панцитопении.
По результатам иммуногистохимического исследования (30.12.19): материал представлен многочисленными фрагментами опухоли, которые инфильтрируют всю толщину стенки кишки. Поверхность кишки некротизирована, слизистая оболочка не прослеживается. Инфильтрат имеет диффузный характер и образован клетками с плеоморфными гиперхромными ядрами, небольшими ядрышками и светлой цитоплазмой. Имеется примесь гистиоцитов и эозинофилов. В большинстве опухолевых клеток обнаружена экспрессия CD7, CD43 и CD5, экспрессия CD3, CD20, циклина D1, CD34, MPO, S100 отсутствует. СD30 маркирует лишь единичные опухолевые клетки. Заключение: Т-клеточная лимфома, ассоциированной с энтеропатией.
При плановом гистологическом исследовании операционного материала в ГБУЗ РМ РОД, г. Саранск (№ 13364–74): в области перфорации кишечной стенки – картина злокачественной неходжкинской лимфомы с диффузным инфильтративным ростом, вовлечением червеобразного отростка и регионарных лимфоузлов, слизистая оболочка с участками изъязвления и некроза, в отдельных полях зрения во всю толщу.
Несмотря на проводимую терапию, состояние прогрессивно ухудшалось, 06.01.20 при нарастающих явлениях полиорганной недостаточности наступила смерть больной. Заключительный диагноз: первичная экстранодальная Т-клеточная лимфома по Ann-Arbor IV B cт. и II 1 ER ст. по Lugano (многоочаговое трансмуральное поражение с перфорацией кишечной стенки купола слепой кишки), ассоциированная с энтеропатией, осложненная диффузным фибринозным перитонитом. Вскрытие не проводилось.
Обсуждение
Органы желудочно-кишечного тракта – наиболее частая (30–40 %) локализация экстранодальных ЗНХЛ, достигающая 4–20 % от всех лимфом у человека. При этом желудок является наиболее частой зоной поражения первичными экстранодальными лимфомами, составляя 50–60 % случаев [5]. Значительно реже поражаются другие органы. Критически важное значение при первичных Т-клеточных экстранодальных лимфомах с поражением тонкой кишки, ассоциированных с энтеропатией, имеет поздняя диагностика процесса, определяющая неудовлетворительные исходы лечения и высокую летальность. Ошибки связаны с редкостью данной патологии, отсутствием стандартизированных клинических протоколов и рекомендаций.
Впервые сочетание лимфомы и целиакии описано в 1937 г. N.H. Fairley, F.P. Mackie. Позже, P.G. Isaacson et al. установили их Т-клеточную природу (1983, 1985). Термин Т-клеточная лимфома, ассоциированная с энтеропатией, предложен в 1986 г. C. O´Farrelly [2]. В литературе встречаются единичные публикации, где представлено большое число пациентов с данной патологией. При анализе национальной базы данных Нидерландов с января 2000 г. по декабрь 2006 г., авторами выявлено 116 случаев Т-клеточной лимфомы, ассоциированной с энтеропатией. Преимущественно поражались проксимальные отделы тонкой кишки, средний возраст пациентов – 64 года. Заболеваемость составила 0,1 на 100 тыс. населения с повышением этого показателя до 2,08 в возрастном интервале старше 50 лет: 1,44 – в возрасте 50–59 лет, 2,92 – в возрасте 60–69 лет, 2,53 случая – в возрасте 70–79 лет. Преобладали мужчины – 64 % (р=0,004). Заболеваемость мужчин в возрасте старше 50 лет составила 2,95 на 100 тыс., женщин – 1,09 [6, 7].
Актуальность исследования связана с тем, что остается нерешенным вопрос о повышении эффективности диагностики и лечения экстранодальных ЗНХЛ. Отмечается низкий исходный клинический статус данных пациентов, обусловленный длительно и скрытно протекающим процессом, тошнотой, рвотой, хронической диареей, высокой нутритивной недостаточностью (мальабсорбцией), анемией, гипопротеинемией, электролитными нарушениями, нередко вплоть до кахексии, а также поздним обращением за медицинской помощью; врачебными ошибками, связанными с неспецифической клинической картиной и отсутствием достаточных знаний о данной патологии; неполным квалифицированным морфологическим исследованием биоптатов тонкой и/или ободочной кишки, что приводит к поздним верификации диагноза и началу специального лечения; быстрым прогрессирова- нием опухоли, что, в конечном итоге, определяет неблагоприятный исход заболевания. Чаще диагноз устанавливают после экстренного вмешательства, выполненного по поводу осложнений опухолевого процесса, при плановом морфологическом исследовании операционного материала.
При лекарственном лечении I линии ЗНХЛ преимущественно применяются антрациклин-содержащие схемы химиотерапии: СHOP и СНOP-подобные режимы (CHOEP), 4–8 курсов 1 раз в 3 нед. Возможно применение моноклонального-гуманизированного антитела антиCD-52 – алем-тузумаба, в монотерапии или в сочетании с гемцитабином [8, 9]. При II линии терапии применяют ифосфамид, этопозид, эпирубицин (ICE), схему DHAP, реже высокодозную химиотерапию с трансплантацией аутологичных стволовых клеток [3, 10].
Рефрактерное многомесячное течение диареи, резистентное к стандартной терапии, прогрессирующее похудание, неспецифическая эндоскопическая и клиническая картина, трудности дифференциальной диагностики между воспалительными заболеваниями кишечника (болезнь Крона), раком ободочной кишки и другими заболеваниями позволяют иногда заподозрить наличие целиакии (глютеновой энтеропатии). Время от появления клиники целиакии до формирования и выявления Т-клеточной лимфомы, ассоциированной с энтеропатией, может составлять от нескольких месяцев до десятилетий. Целиакия – это аутоиммунное заболевание, которое встречается менее чем у 1 % населения в западных странах и выявляется с частотой около 1 случая на почти 1000 недиагно-стированных пациентов. «Золотым» стандартом диагностики остается иммуногистохимическое исследование, выявляющее популяцию атипичных опухолевых интраэпителиальных Т-лимфоцитов: Т-клеточную лимфому, ассоциированную с энтеропатией, или нормальных поликлональных лимфоцитов, а также серологическая диагностика: выявление антител к тканевой трансглутаминазе и эндомизию при употреблении в пищу злаковых культур, генетическое тестирование. Терапия неосложненной целиакии – элиминационная строгая пожизненная безглютеновая диета, позволяющая предотвратить развитие осложнений. У таких пациентов повышен риск развития других аутоиммунных заболеваний: аутоиммунного тиреоидита, сахарного диабета I типа [2, 8].
Заключение
Первичные экстранодальные злокачественные неходжкинские лимфомы тонкой кишки – редкая патология, при которой не определены стандарты диагностики и лечения. Представлены 2 клинических наблюдения редкой формы первичной периферической экстранодальной Т-клеточной лимфомы CD20- и CD30-негативной, ассоцииро- ванной с энтеропатией. Оба случая, выявленные у женщин 63 и 50 лет, осложнились перфорацией опухоли тонкой кишки, были диагностированы в послеоперационном периоде, при плановом гистологическом и иммуногистохимическом исследова- нии операционного материала. Неблагоприятный исход заболевания был обусловлен поздней диагностикой, множественным характером поражения и осложненным течением опухолевого процесса.
Список литературы Первичная Т-клеточная экстранодальная лимфома, ассоциированная с энтеропатией, дебютировавшая с осложнений. Анализ двух собственных клинических наблюдений и причин их неблагоприятного исхода
- Felipe-Silva A., de Campos F.P.F., deMedeiros R.S.S., Lourengao R.M., Zerbini M.C.N. Enteropathy-associated T-cell lymphoma (type II): a Brazilian case report. Autops Case Rep. 2012; 2(2): 31-36. doi: 10.4322/ acr.2012.014.
- Zhang J.C., Wang Y., Wang X.F., Zhang F.X. Type I enteropathy-associated T-cell lymphoma in the colon of a 29-year-old patient and a brief literature review. Onco Targets Ther. 2016 Feb; 9: 863-8. doi: 10.2147/OTT.S96745.
- Российские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний. М., 2018. 324 с. [Russian clinical guidelines for the diagnosis and treatment of lymphoprolifera-tive diseases. Moscow, 2018. 324 p. (in Russian)].
- Sieniawski M.K., Lennard A.L. Enteropathy-associated T-cell lymphoma: epidemiology, clinical features, and current treatment strategies. Curr Hematol Malig Rep. 2011 Dec; 6(4): 231-40. doi: 10.1007/ s11899-011-0097-7.
- Виноградова Ю.Н., Чумаченко А.И.,Рябчикова В.В., Карягина Е.В., Медведева Н.В., Ходжибекова М.М., Орлова Р.В., Ильин Н.В. Оптимизация органосохраняющего лечения больных экстранодальной диффузной B-клеточной крупноклеточной лимфомой желудка. Злокачественные опухоли. 2019; 9(3s1): 3-8.
- Verbeek W.H., Van De Water J.M., Al-Toma A., Oudejans J.J., Mulder C.J., Coupe V.M. Incidence of enteropathy--associated T-cell lymphoma: a nation-wide study of a population-based registry in The Netherlands. Scand J Gastroenterol. 2008; 43(11): 1322-8. doi: 10.1080/00365520802240222.
- Al-Toma A., Verbeek W.H., Hadithi M., vonBlomberg B.M., Mulder C.J. Survival in refractory coeliac disease and enteropathy-associated T-cell lymphoma: retrospective evaluation of single-centre experience. Gut. 2007 Oct; 56(10): 1373-8. doi: 10.1136/gut.2006.114512.
- Gallamini A., Zaja F., Patti C., Billio A., Specchia M.R., Tucci A., Levis A., Manna A., Secondo V., Rigacci L., Pinto A., Iannitto E., Zoli V., Torchio P., Pileri S., Tarella C. Alemtuzumab (Campath-1H) and CHOP chemotherapy as first-line treatment of peripheral T-cell lymphoma: results of a GITIL (Gruppo Italiano Terapie Innovative nei Linfomi) prospective multicenter trial. Blood. 2007 Oct 1; 110(7): 2316-23. doi: 10.1182/ blood-2007-02-074641.
- Soldini D., Mora O., Cavalli F., Zucca E., Mazzucchelli L. Efficacy of alemtuzumab and gemcitabine in a patient with enteropathy-type T-cell lymphoma. Br J Haematol. 2008 Jul; 142(3): 484-6. doi: 10.1111/j.1365-2141.2008.07202.x.
- Rohatiner A., d'Amore F., Coiffier B., Crowther D., Gospodarowicz M., Isaacson P., Lister T.A., Norton A., Salem P., Shipp M. Report on a workshop convened to discuss the pathological and staging classifications of gastrointestinal tract lymphoma. Ann Oncol. 1994 May; 5(5): 397-400. doi: 10.1093/oxfordjournals.annonc.a058869.


