Первичный скрининг бактериальных штаммов антагонистов из коллекции лаборатории биометода ВНИИМК к возбудителю фомоза подсолнечника (часть 2)
Автор: Маслиенко Л.В., Воронкова А.Х., Даценко Л.А., Ефимцева Е.А., Пуногина Д.А., Гайдукова С.А., Казакова В.В., Ковалева С.Р.
Рубрика: Защита растений и иммунология
Статья в выпуске: 3 (183), 2020 года.
Бесплатный доступ
Приводятся данные по первичному скринингу бактериальных штаммов антагонистов из коллекции лаборатории биометода ФГБНУ ФНЦ ВНИИМК к агрессивному изоляту возбудителя фомоза подсолнечника Phoma macdonaldii Boerema методом двойных культур. Результаты оценки 27 коллекционных штаммов бактерий из рода Bacillus на трех питательных средах: картофельно-сахарозной (КСА), Тайлона-3 и овсяной (ОА), показали, что 21 из них обладали антагонистической активностью с типом механизма действия против возбудителя фомоза подсолнечника - антибиозом. У трех штаммов установлена конкуренция за площадь питания без образования стерильной зоны с патогеном. Максимальная стерильная зона к возбудителю фомоза установлена у штаммов: 11-3 Bacillus sp. (21,0 мм) на КСА; Б-4 B. circulans (19,0 мм) на среде Тайлона-3 и D 1-1 Bacillus sp. (17,0 мм) на ОА. Из девяти коллекционных штаммов бактерий рода Pseudomonas антагонистическую активность к возбудителю фомоза на средах КСА и Кинга В проявили восемь, а на ОА - семь штаммов с одним типом механизма действия -антибиозом. Максимальную стерильную зону сформировали штаммы: Oif 2-1, 16-2 и 12-2 Pseudomonas sp. (12,0-12,5 мм) - на КСА; 16-2 Pseudomonas sp. (16,5 мм) - на Кинга В; Oif 2-1 Pseudomonas sp. (18,0 мм) - на ОА.
Подсолнечник, фомоз, бактериальные штаммы антагонисты, скрининг, антагонистическая активность, конкуренция, антибиоз
Короткий адрес: https://sciup.org/142224954
IDR: 142224954 | УДК: 633.854.78: | DOI: 10.25230/2412-608X-2020-3-183-107-113
Текст научной статьи Первичный скрининг бактериальных штаммов антагонистов из коллекции лаборатории биометода ВНИИМК к возбудителю фомоза подсолнечника (часть 2)
Введение. Подсолнечнику, основной масличной культуре нашей страны, значительный ущерб наносит комплекс болезней. Все большую вредоносность на культуре в России показывает фомоз, или черная пятнистость ( Phoma macdonaldii Boerema) [1; 2].
В последние годы большое внимание уделяется разработке экологически безопасных мер борьбы с вредителями и болезнями. В связи с этим разработка биотехнологий получения и применения современных конкурентоспособных микробиологических препаратов для сельского хозяйства приобретает первостепенное значение. Одним из немногих в России разработчиков микробиопрепаратов для защиты растений от болезней является лаборатория биометода ФГБНУ ФНЦ ВНИИМК. В результате многолетних исследований создана коллекция перспективных штаммов грибов и бактерий антагонистов широкого круга патогенов, поражающих масличные и другие сельскохозяйственные культуры. Разработан ряд экологически безопасных микробиопрепаратов, полифункционального типа действия (Вермикулен, Хетомин, Бацил-лин, Веррукозин, Фуникулозум и др.), технологии производства разных препаративных форм и их применения против комплекса патогенов на подсолнечнике, сое, рапсе, а также яблоне, землянике, винограде и других сельскохозяйственных культурах [3; 4; 5; 6; 7; 8; 9]. В настоящее время проводятся исследования по разработке микробиологических средств снижения вредоносности фомоза подсолнечника.
В нашей стране зарегистрированных микробиопрепаратов против фомоза на подсолнечнике нет. Мы не обнаружили в литературе сведений о разработке биологических мер борьбы с Phoma macdonaldii , кроме испытаний биопрепаратов против фомоза на чае [10]. Поэтому целью наших исследований было проведение ступенчатого скрининга штаммов-антагонистов из коллекции лаборатории биометода ВНИИМК к возбудителю фо-моза подсолнечника.
В настоящей статье представлены результаты первичного скрининга коллекционных штаммов бактерий из родов Bacillus и Pseudomonas к Phoma macdonaldii на трех питательных средах.
Материалы и методы. Агрессивный изолят возбудителя фомоза Phoma macdonaldii выделен нами из стеблей пораженного подсолнечника на посевах ВНИИМК. Агрессивность изолятов возбудителя фомоза определяли методом «агаровых блоков», разработанным В.Ф. Зайчук (1983 г.) [11].
Первичный скрининг бактериальных штаммов антагонистов из коллекции лаборатории биометода к возбудителю фо-моза на подсолнечнике проводили к наиболее агрессивному изоляту методом двойных или встречных культур in vitro [12]. Культуры антагонистов и возбудителя болезни выращивали отдельно в течение пяти суток на агаризированной питательной среде. Стерильным сверлом вырезали блоки с мицелием антагониста и патогена и помещали в одну чашку Петри на расстоянии 6 см. Контролем служили культуры антагонистов и пато- гена, посеянные порознь. Контроль роста культур проводили ежедневно, учеты – на двадцатые сутки культивирования. Отмечали рост патогена и антагониста в процентах от площади чашки Петри (конкуренцию за площадь питания). Для этого измеряли площадь зарастания поверхности питательной среды в см2, а затем проводили перерасчет на процент по пропорции, имея ввиду площадь чашки Петри 81,0 см2. Кроме того, отмечали наличие или отсутствие зон задержки роста патогена в результате синтеза гидролитических ферментов или веществ антибиотической природы (диаметр стерильной зоны, мм), а также нарастание антагониста на колонию патогена (площадь гиперпаразитической зоны, см2). Антагонистов и патоген выращивали на агаризирован-ных средах: картофельно-сахарозной (КСА) [13], овсяной (ОА) [14], а также на специализированных средах: для бактерий из рода Bacillus – Тайлона-3 [13], из рода Pseudomonas – Кинга В [15].
Результаты и обсуждение. Результаты оценки антагонистической активности штаммов бактерий из рода Bacillus к возбудителю фомоза подсолнечника Phoma macdonaldii на трех питательных средах (КСА, Тайлона-3 и ОА) показали, что механизм действия представлен двумя типами:
-
- антагонист образует стерильную зону задержки роста мицелия патогена (антибиоз);
-
- антагонист занимает значительную поверхность питательной среды (до 50,0 %) и не образует стерильную зону задержки роста патогена (конкуренция за площадь питания).
На картофельно-сахарозном агаре в контроле за 20 суток культивирования изолят Phoma macdonaldii занял 100 % поверхности питательной среды. Из 27 коллекционных штаммов бактерий рода Bacillus антагонистическую активность к патогену через 20 суток совместного культивирования на КСА проявили 22 штамма. Из них только два штамма
(Б (2-1) B. licheniformis и 11-2 Bacillus sp.) показали зарастание поверхности пи-та°тельной среды до 50 %, без образования стерильной зоны (табл. 1).
Таблица 1
Антагонистическая активность штаммов бактерий из рода Bacillus к возбудителю фо-моза подсолнечника Phoma macdonaldii при температуре 25 °С на 20-е сутки культивирования на картофельно-сахарозном агаре г. Краснодар, ВНИИМК, 2020 г.
|
Штамм-антагонист |
Площадь зарастания поверхности питательной среды, % |
Размер стерильной зоны, мм |
|
|
антагонистом |
патогеном |
||
|
Phoma macdonaldii |
- |
100,0 |
- |
|
Б (2-1) B. licheniformis |
50,0 |
29,6 |
0 |
|
11-2 Bacillus sp. |
37,0 |
4,0 |
0 |
|
Far 8 Bacillus sp. |
37,9 |
30,0 |
4,0 |
|
Fa 4-2 Bacillus sp. |
36,1 |
55,3 |
4,0 |
|
D 7-3 Bacillus sp. |
32,9 |
56,3 |
5,0 |
|
D 7-1 B. subtilis |
30,9 |
38,2 |
5,0 |
|
D-10 Bacillus sp. |
16,9 |
46,3 |
4,5 |
|
5-3 Bacillus sp. |
14,9 |
52,9 |
3,5 |
|
01 кор f Bacillus sp. |
14,4 |
56,1 |
4,5 |
|
Fa 4-1 B. subtilis |
14,3 |
46,3 |
5,0 |
|
Б-12 B. licheniformis |
14,1 |
65,7 |
4,5 |
|
K 1-1 B. subtilis |
13,6 |
58,4 |
6,5 |
|
Fz 9 Bacillus sp. |
12,2 |
65,5 |
4,0 |
|
D 1-3 Bacillus sp . |
11,6 |
55,6 |
1,0 |
|
5Б-1 B. subtilis |
8,3 |
56,7 |
6,0 |
|
D 1-1 Bacillus sp. |
6,1 |
44,6 |
6,0 |
|
11-1 Bacillus sp. |
8,2 |
47,1 |
13,5 |
|
Б-5 B. licheniformis |
5,6 |
47,4 |
9,0 |
|
K 1-2 Bacillus sp. |
5,3 |
52,8 |
13,0 |
|
11-3 Bacillus sp. |
2,7 |
64,2 |
21,0 |
|
3-3 Bacillus sp. |
2,7 |
63,6 |
11,5 |
|
3-2 Bacillus sp. |
1,2 |
78,9 |
9,5 |
Остальные 20 штаммов бактерий при зарастании поверхности среды 1,2–37,9 % образовали стерильную зону 1,0–21,0 мм. Следует подчеркнуть, что с уменьшением площади зарастания поверхности питательной среды бактериальные штаммы образовывали большую стерильную зону. Максимальную антибиотическую активность к Phoma macdonaldii на КСА проявил штамм 11-3 Bacillus sp. , у которого стерильная зона составила 21,0 мм (рис 1.1).
На специализированной для бактерий рода Bacillus среде Тайлона-3 в контроле возбудитель фомоза за 20 суток культивирования занял 100 % поверхности питательной среды. Из 27 коллекционных бактерий рода Bacillus антагонистическую активность к возбудителю фомоза 109
через 20 суток совместного культивирования на среде Тайлона-3 проявили 20 штаммов (табл. 2).
Таблица 2
Антагонистическая активность штаммов бактерий из рода Bacillus к возбудителю фомоза подсолнечника Phoma macdonaldii при температуре 25 °С на 20-е сутки культивирования на среде Тайлона - 3
г. Краснодар, ВНИИМК, 2020 г.
|
Штамм-антагонист |
Площадь зарастания поверхности питательной среды, % |
Размер стерильной зоны, мм |
|
|
антагонистом |
патогеном |
||
|
Phoma macdonaldii |
- |
100,0 |
- |
|
Б-4 B. circulans |
3,3 |
38,2 |
17,0 |
|
1а B. polymyxa |
1,5 |
48,4 |
17,0 |
|
D 7-3 Bacillus sp. |
10,3 |
42,9 |
15,5 |
|
3-2 Bacillus sp. |
1,2 |
55,6 |
13,0 |
|
D-10 Bacillus sp. |
20,5 |
34,5 |
12,0 |
|
11-1 Bacillus sp. |
23,7 |
32,1 |
11,0 |
|
11-3 Bacillus sp. |
2,6 |
57,8 |
10,0 |
|
Б-12 B. licheniformis |
13,2 |
25,0 |
10,0 |
|
D 1-3 Bacillus sp. |
9,4 |
50,0 |
10,0 |
|
5-3 Bacillus sp . |
17,5 |
28,9 |
8,0 |
|
Б-5 B. licheniformis |
15,4 |
52,2 |
8,0 |
|
3-3 Bacillus sp. |
10,5 |
38,9 |
8,0 |
|
D 7-1 B. subtilis |
8,3 |
58,3 |
6,5 |
|
Б (2-1) B. licheniformis |
13,0 |
29,6 |
5,0 |
|
11-2 Bacillus sp. |
28,1 |
39,5 |
5,0 |
|
K 1-1 B. subtilis |
33,1 |
34,6 |
5,0 |
|
5Б-1 B. subtilis |
29,2 |
34,5 |
5,0 |
|
Fa 4-1 B. subtilis |
28,1 |
29,4 |
4,5 |
|
Fa 4-2 Bacillus sp. |
6,2 |
56,1 |
3,0 |
|
D 1-1 Bacillus sp. |
10,9 |
59,8 |
3,0 |
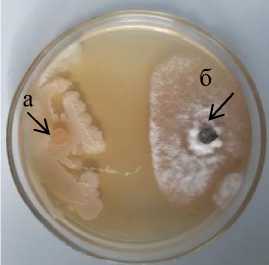
На среде Тайлона-3 прослеживается та же тенденция, что и на КСА, с уменьшением поверхности зарастания питательной среды бактериальные штаммы образовывали больший размер стерильной зоны. Максимальную стерильную зону (13,0–17,0 мм) образовали штаммы бактерий (3-2 и D 7-3 Bacillus sp., 1а B. polymyxa и Б-4 B. circulans ), занимавших в двойных культурах с возбудителем фо-моза небольшую поверхность питательной среды (1,2–10,3 %). Тогда как группа штаммов бактерий (Fa 4-1, 5Б-1, K 1-1 B. subtilis и 11-2 Bacillus sp.) , занимавшая более значительную поверхность зарастания среды (28,1–33,1 %), образовывала меньшую стерильную зону (4,5–5,0 мм). Максимальная антибиотическая активность к Phoma macdonaldii на среде Тай-лона-3 установлена у штаммов Б-4 B. 110
circulans и 1а B. polymyxa , у которых стерильная зона составила 17,0 мм (рис. 1.2).
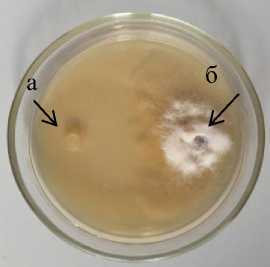
11-3 Bacillus sp. 1
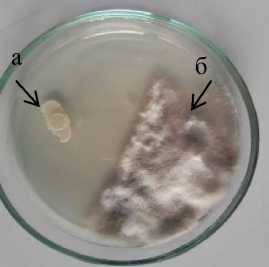
1а B. polymyxa 2
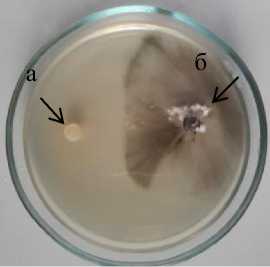
D 1-1 Bacillus sp.
а – антагонист; б – патоген
Рисунок 1 – Антибиотическая активность бактериальных штаммов из рода Bacillus к возбудителю фомоза подсолнечника Phoma macdonaldii через 20 суток культивирования, 2020 г. (ориг.) на питательных средах: 1 – КСА; 2 – Тайлона-3; 3 – ОА
На овсяном агаре в контроле возбудитель фомоза за 20 суток культивирования занял 83,0 % поверхности питательной среды.
Из 27 коллекционных бактерий рода Bacillus антагонистическую активность к Phoma macdonaldii через 20 суток совместного культивирования на ОА проявили 10 штаммов. Из них только один штамм 11-2 Bacillus sp показал зарастание поверхности питательной среды до 50 % без образования стерильной зоны (табл. 3).
Таблица 3
Антагонистическая активность штаммов бактерий из рода Bacillus к возбудителю фомоза подсолнечника Phoma macdonaldii при температуре 25 °С на 20-е сутки культивирования на овсяном агаре г. Краснодар, ВНИИМК, 2020 г.
|
Штамм-антагонист |
Площадь зарастания поверхности питательной среды, % |
Размер стерильной зоны, мм |
|
|
антагонистом |
патогеном |
||
|
Phoma macdonaldii |
- |
83,0 |
- |
|
11-2 Bacillus sp. |
33,0 |
1,2 |
0 |
|
D 1-1 Bacillus sp. |
0,6 |
54,3 |
17,0 |
|
3-3 Bacillus sp. |
2,4 |
58,0 |
17,0 |
|
K 1-1 B. subtilis |
1,2 |
57,7 |
15,0 |
|
D 1-3 Bacillus sp. |
2,5 |
57,8 |
14,0 |
|
D-10 Bacillus sp. |
1,2 |
55,6 |
10,0 |
|
D 7-1 B. subtilis |
2,3 |
52,5 |
10,0 |
|
Fa 4-2 Bacillus sp. |
27,0 |
46,3 |
10,0 |
|
11-1 Bacillus sp. |
1,2 |
43,2 |
1,8 |
|
Б (2-1) B. licheniformis |
3,7 |
58,8 |
1,0 |
У остальных штаммов, проявивших антагонистическую активность к Phoma macdonaldii на ОА, отмечена стерильная зона 1,0–17,0 мм. Максимальная антибиотическая активность на этой среде установлена у штаммов D 1-1 Bacillus sp. и 3-3 Bacillus sp., у которых стерильная зона составила 17,0 мм (рис. 1.3).
Результаты оценки антагонистической активности штаммов бактерий из рода Pseudomonas к Phoma macdonaldii на трех питательных средах КСА, Кинга В и ОА показали, что механизм действия представлен одним типом – антагонист образует стерильную зону задержки роста мицелия патогена (антибиоз).
Из девяти коллекционных штаммов бактерий рода Pseudomonas антагонистическую активность к возбудителю фомоза через 20 суток совместного культивирования на двух средах КСА и Кинга В проявили восемь, а на ОА – семь штаммов (табл. 4).
Таблица 4
Антагонистическая активность штаммов бактерий-антагонистов рода Pseudomonas к возбудителю фомоза Phoma macdonaldii при температуре 25 °С на 20-е сутки культивирования на агаризированных питательных средах г. Краснодар, ВНИИМК, 2020 г.
|
Штамм-антагонист |
Площадь зарастания поверхности питательной среды, % |
Размер стерильной зоны, мм |
|||
|
антагонистом |
патогеном |
||||
|
Картофельно-сахарозный агар |
|||||
|
Phoma macdonaldii |
- |
100,0 |
- |
||
|
Oif 2-1 Pseudomonas sp. |
11,5 |
50,2 |
12,5 |
||
|
16-2 Pseudomonas sp. |
7,1 |
61,1 |
12,0 |
||
|
12-2 Pseudomonas sp. |
7,4 |
59,6 |
12,0 |
||
|
15-1 Pseudomonas sp. |
8,5 |
50,6 |
9,5 |
||
|
13-2 Pseudomonas sp. |
9,3 |
58,3 |
9,0 |
||
|
14-3 P. chlororaphis |
4,9 |
56,8 |
9,0 |
||
|
Sgc-1 Pseudomonas sp. |
14,0 |
61,1 |
5,5 |
||
|
14-4 Pseudomonas sp. |
37,7 |
33,9 |
5,0 |
||
|
Кинга В |
|||||
|
Phoma macdonaldii |
- |
68,4 |
- |
||
|
16-2 Pseudomonas sp. |
23,4 |
40,7 |
16,5 |
||
|
Sgc-1 Pseudomonas sp. |
38,8 |
22,2 |
15,0 |
||
|
15-1 Pseudomonas sp. |
17,8 |
36,0 |
15,0 |
||
|
14-4 Pseudomonas sp. |
15,0 |
44,8 |
14,0 |
||
|
14-3 P. chlororaphis |
16,3 |
41,6 |
13,0 |
||
|
12-2 Pseudomonas sp. |
15,6 |
50,0 |
11,0 |
||
|
Oif 2-1 Pseudomonas sp. |
15,7 |
40,5 |
10,0 |
||
|
13-2 Pseudomonas sp. |
28,0 |
32,4 |
9,0 |
||
|
Овсяной агар |
|||||
|
Phoma macdonaldii |
- |
83,0 |
- |
||
|
Oif 2-1 Pseudomonas sp. |
1,5 |
43,2 |
18,0 |
||
|
12-2 Pseudomonas sp. |
1,0 |
57,7 |
17,0 |
||
|
16-2 Pseudomonas sp. |
3,3 |
49,3 |
16,0 |
||
|
14-3 P. chlororaphis |
1,9 |
55,5 |
16,0 |
||
|
Sgc-1 Pseudomonas sp. |
3,0 |
59,2 |
15,0 |
||
|
14-4 Pseudomonas sp. |
2,4 |
57,7 |
15,0 |
||
|
13-2 Pseudomonas sp. |
2,2 |
61,1 |
11,0 |
||
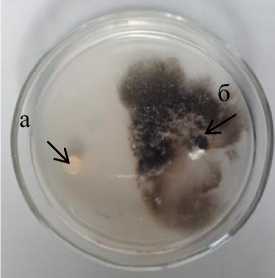
На КСА в контроле за 20 суток культивирования Phoma macdonaldii занял 100 % поверхности питательной среды. Максимальную антибиотическую активность показали три штамма Oif 2-1 Pseudomonas sp., 16-2 Pseudomonas sp. и 12-2 Pseudomonas sp. , стерильная зона у которых составила 12,0–12,5 мм (рис. 2.1) .
На специализированной для бактерий рода Pseudomonas среде Кинга В в контроле возбудитель фомоза подсолнечника за 20 суток культивирования занял 68,4 % поверхности питательной среды. На этой среде у большинства коллекционных штаммов псевдомонад зона ингибирования патогена была выше, чем на КСА. Максимальную антибиотическую активность показал штамм 16-2 Pseudomonas sp., стерильная зона у которого составила 16,5 мм (рис. 2.2).
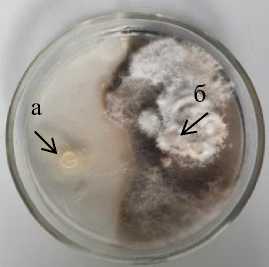
12-2 Pseudomonas sp. 1
16-2 Pseudomonas sp . 2
Oif 2-1 Pseudomonas sp .
а – антагонист; б – патоген
Рисунок 2 – Антибиотическая активность бактериальных штаммов из рода Pseudomonas к возбудителю фомоза подсолнечника Phoma macdonaldii через 20 суток культивирования, 2020 г. (ориг.), на питательных средах:
1 – КСА; 2 – Кинга В; 3 – ОА
На специализированной для фомоза среде ОА патоген за 20 суток культивирования занял 83,0 % поверхности пита- тельной среды. На этой среде большинство штаммов псевдомонад показали зону ингибирования патогена еще выше, чем на Кинга В. Максимальную антибиотическую активность к Phoma macdonaldii показал штамм Oif 2-1 Pseudomonas sp., у которого стерильная зона составила 18,0 мм (рис. 2.3).
Штаммы бактерий антагонистов, выделенные на первом этапе скрининга, будут оценены во вторичном скрининге, на фоне искусственного заражения возбудителем фомоза в лабораторных условиях во влажной камере и в грунте.
Выводы . В результате оценки 27 коллекционных штаммов бактерий рода Bacillus на трех питательных средах (КСА, Тайлона-3 и ОА) установлена антагонистическая активность у 24 штаммов. При этом у 21 штамма установлен один тип механизма действия против возбудителя фомоза подсолнечника – антибиоз. У трех штаммов ( Б (2-1) B. licheniformis, 11-2 Bacillus sp. – на КСА и 11-2 Bacillus sp. – на ОА) установлена конкуренция за площадь питания без образования стерильной зоны с патогеном. Максимальная стерильная зона к Phoma macdonaldii установлена у штаммов: 11-3 Bacillus sp. (21,0 мм) на КСА; Б-4 B. circulans (19,0 мм) на среде Тайлона-3; D 1-1 Bacillus sp. (17,0 мм) на ОА.
Из девяти коллекционных штаммов бактерий рода Pseudomonas антагонистическую активность к возбудителю фомоза на двух средах: КСА и Кинга В, проявили восемь, а на ОА – семь штаммов с одним типом механизма действия – антибиозом. Максимальную стерильную зону с Phoma macdonaldii сформировали штаммы: Oif 2-1 Pseudomonas sp. , 16-2 Pseudomonas sp . и 12-2 Pseudomonas sp. (12,0–12,5 мм) – на КСА; 16-2 Pseudomonas sp. (16,5 мм) – на Кинга В и Oif 2-1 Pseudomonas sp . (18,0 мм) – на ОА.
Работа выполнена при финансовой поддержке гранта РФФИ и администрации Краснодарского края р_ Наставник № 19416-235003.
Список литературы Первичный скрининг бактериальных штаммов антагонистов из коллекции лаборатории биометода ВНИИМК к возбудителю фомоза подсолнечника (часть 2)
- Саукова С.Л., Ивебор М.В., Антонова Т.С., Арасланова Н.М. Возбудитель фомоза на вегетирующих растениях подсолнечника в Краснодарском крае // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2014. -Вып. 2 (159-160). - С. 167-172.
- Арасланова Н.М., Саукова С.Л., Ивебор М.В., Антонова Т.С. Идентификация видовой принадлежности возбудителя фомоза подсолнечника в Краснодарском крае // Современная микология в России: материалы Международного микологического форума, Москва, 14-15 апреля 2015 г. - М.: Нац. акад. микол., 2015. - Т.5. - С. 61-62.
- Маслиенко Л.В. Обоснование и разработка микробиологического метода борьбы с болезнями подсолнечника: автореф. дис.. д-ра биол. наук / Любовь Васильевна Маслиенко. - Краснодар, 2005. - 48 с.
- Shternshis M., Tomilova O, Shpatova T., Soytong K., Maslienko L. Biological Fungicides Based on Chaetomium for Plant Protection // International Conference on Integration of Science and Technology for Sustainable Development, Bangkok, Thailand. 26 - 27 April, 2007. - Р. 304-307.
- Маслиенко Л.В. Шипиевская Е.Ю., Асатурова А.М. Биологические особенности перспективных штаммов грибов антагонистов возбудителя фомопсиса РV-3 Penicillium verrucosum Dierckx var. cyclopium Westling, Samson et al. и РF-1 Penicillium funiculosum Thom // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - Краснодар, 2007. - Вып. 2 (137). - С. 42-47.
- Маслиенко Л.В. Асатурова А.М. Оценка антифунгальной активности бактерий родов Bacillus и Pseudomonas в процессе периодического культивирования в отношении грибов рода Fusarium // Современное состояние и перспективы развития микробиологии и биотехнологии: материалы VII межд. науч. конф. (31 мая - 4 июня, 2010). - Минск, 2010. - С. 421-423.
- Маслиенко Л.В., Курилова Д.А. Разработка микробиологического метода снижения вредоносности фузариоза на сое // Масличные культуры. Науч. -тех. бюл. ВНИИМК. - 2012. - Вып. 2 (151-152) - С. 167-175.
- Якуба Г.В., Гусин Д.Н., Маслиенко Л.В. Перспективные микробиологические препараты для защиты яблони от парши // Плодоводство и виноградарство юга России [Электронный ресурс]. - Краснодар: СКЗНИИСиВ, 2013. № 22 (4). - Режим доступа: http://www.joumal.kubansad.ru/pdf/01.pdf.
- Холод Н.А., Маслиенко Л.В. Биологизированный контроль серой гнили земляники садовой в условиях усиления абиотического и антропогенного воздействий // Управление устойчивостью садовых агроценозов, обеспечивающих качество плодовой продукции. Научные труды СКФНЦСВВ. - Краснодар, 2018. - №. 14. - С. 179-183.
- Quiroz F.J., Edwards Molina J.P., Dosio G.A.A. Black stem by Phoma macdonaldii affected ecophysiological components that determine grain yield in sunflower (Helianthus annuus L.) // Field Crops Research. - 2014. - 160. -Р. 31-40.
- Зайчук В. Ф. Об устойчивости подсолнечника к гнилям // Маслич. культуры. - 1983. - № 1. - С. 16-17.
- Егоров Н.С. Выделение микробов-антагонистов и биологические методы учета их антибиотической активности. - М.: Изд-во Моск. ун-та, 1957. - 78 с.
- Билай В.И. Фузарии. - Киев: Изд-во: Наукова думка, 1977. - 440 с.
- Пименова М.Н., Гречушкина Н.Н., Азова Л.Г., Нетрусов А.И. [и др.]. Руководство к практическим занятиям по микробиологии. - [Для биол. фак. ун-тов.] / Под ред. Н.С. Егорова. - 2-е изд. - М.: Изд-во МГУ, 1983. - 221 с.
- King E.O., Two simple media for the demonstration of pyocyanin and fluorescing // J. Lab. Clin. Med. - 1954. -Vol. 44. - P. 301-307.


