Первичный скрининг коллекционных грибных штаммов антагонистов к возбудителю фомоза рапса озимого
Автор: Маслиенко Л.В., Дейнега Л.А., Заверюха Е.А., Кузнецова А.В.
Рубрика: Агрохимия, агропочвоведение, защита и карантин растений
Статья в выпуске: 4 (200), 2024 года.
Бесплатный доступ
В лаборатории биометода агро-технологического отдела ФГБНУ ФНЦ ВНИИМК с целью разработки микробиологического метода снижения вредоносности наиболее опасной болезни рапса озимого - фомоза (Leptosphaeria maculans (Desm.) Ces. et de Not, анаморфная стадия Phoma lingam (Tode) Desm.), в 2024 г. из рабочей коллекции проводили поиск перспективных штаммов-продуцентов микробиопрепаратов. В результате первичного скрининга выделено 26 перспективных грибных штаммов с разными типами антагонистической активности (конкуренция за площадь питания, гиперпаразитизм и антибиоз) против возбудителя фомоза: шесть штаммов из рода Trichoderma, семь - из рода Penicillium, четыре - из рода Chaetomium, три - из рода Aspergillus, два - из класса Basidiomycota, а также по одному из родов Sordaria, Metarhizium, Trichothecium и Talaromyces.
Фомоз, рапс озимый, первичный скрининг, грибные штаммы антагонисты, микробиологический метод
Короткий адрес: https://sciup.org/142243372
IDR: 142243372 | УДК: 633.853.494:632.937 | DOI: 10.25230/2412-608X-2024-4-200-107-113
Текст научной статьи Первичный скрининг коллекционных грибных штаммов антагонистов к возбудителю фомоза рапса озимого
Введение. Для снижения вредоносности одной из наиболее распространенных и опасных болезней рапса озимого – фо-моза (возбудитель Leptosphaeria maculans (Desm.) Ces. et de Not, анаморфная стадия Phoma lingam (Tode) Desm.) [1], актуальной задачей является разработка микробиологического метода. В условиях центральной зоны Краснодарского края, а в последние годы и в южных областях Нечерноземья, фомоз является одной из наиболее вредоносных болезней озимых культур семейства капустные, в том числе и рапса озимого, поражение которой может привести к снижению урожая до 40,0 %, а при раннем заражении – и к преждевременной гибели растений [2–5]. В качестве основных мер ее контроля рекомендуются: устойчивые сорта, уборка растительных остатков, соблюдение севооборота (срок возврата рапса на прежнее поле не ранее чем через 3–4 года), оптимальные сроки посева, пространственная изоляция, протравливание семян и применение фунгицидов во время вегетации культуры [6].
Зарегистрированных биопрепаратов от фомоза на рапсе в России нет. В лаборатории биометода агротехнологического отдела ФГБНУ ФНЦ ВНИИМК, одной из немногих в России, многие годы ведутся исследования по разработке микробиологических средств защиты масличных культур от болезней. В основе разработанной в лаборатории концепции целенаправленного создания микробиопрепаратов для защиты масличных и других сельскохозяйственных культур от болезней лежит поиск штаммов антагонистов, безопасных для человека, нефитотоксичных, проявляющих высокую активность в широко варьируемых погодных условиях против комплекса патогенов, обладающих полифунк-циональным типом действия [7]. Начальным этапом этих исследований является ступенчатый скрининг вновь выделенных или коллекционных штаммов в лабораторных условиях in vitro.
Настоящая работа посвящена первому этапу ступенчатого скрининга – первичному скринингу коллекционных грибных штаммов к агрессивному изоляту возбудителя фомоза рапса озимого Phoma lingam in vitro.
Материалы и методы. Исследования проводили в лаборатории биометода агро-технологического отдела ФГБНУ ФНЦ ВНИИМК в 2024 г. Объектом исследований служили: конидиальная стадия агрессивного изолята возбудителя фомоза рапса озимого Phoma lingam , выделенного в центральной зоне Краснодарского края; коллекционные штаммы грибных антагонистов возбудителей болезней масличных культур – 26 штаммов, представленных родами Trichoderma , Penicillium , Chaetomium , Sordaria , Metarhizium , Trichothecium, Talaromyces , Aspergillus , а также классом Basidiomycota.
Оценку антагонистической активности штаммов in vitro к агрессивному изоляту возбудителя фомоза рапса озимого проводили методом двойных или встречных культур [8]. Метод позволяет определить антагонистическую активность выделенных или коллекционных штаммов при совместном культивировании с возбудителем болезни (агрессивным изолятом) в одной чашке Петри.
Культуры грибных антагонистов и возбудителя болезни выращивали отдельно в течение пяти–семи суток на агаризирован-ной питательной среде. Стерильным сверлом размером 0,7 см вырезали блоки с мицелием антагониста и патогена и помещали в одну чашку Петри на расстоянии 6,0 см. Контролем служили культуры антагонистов и патогена, посеянные порознь. Антагонистов и патоген выращивали на картофельно-сахарозном агаре (КСА) [9] и на специализированной для грибов среде Рудакова [10]. Учёты взаимодействия патогена с антагонистами проводили на 20 сутки культивирования, отмечали:
-
- рост патогена и антагониста в % от площади чашки Петри (конкуренция за площадь питания);
-
- наличие или отсутствие зон задержки роста патогена в результате синтеза антагонистами гидролитических ферментов или веществ антибиотической природы (стерильная зона);
-
- нарастание антагониста на колонию патогена (гиперпаразитическая зона).
Результаты и обсуждения. Результаты первичной оценки коллекционных грибных штаммов к возбудителю фомоза рапса озимого Phoma lingam методом двойных или встречных культур на питательных средах КСА и Рудакова показали, что все штаммы проявили антагонистическую активность, при этом механизм антагонистического действия грибов представлен тремя типами: конкуренция за площадь питания, гиперпаразитизм и антибиоз.
Из 26 испытанных коллекционных штаммов грибов к возбудителю фомоза на среде КСА пять штаммов из рода Trichoderma (Т-1, Т-2, Т-3, Т-4 и Т-5 Trichoderma sp.) проявили тройной тип механизма антагонистической активности, заняв 100 % поверхности питательной среды, со стерильной зоной 4,5–5,5 мм и с гиперпаразитической зоной 0,5–3,7 см2 (табл. 1, рис. 1).
Таблица 1
Антагонистическая активность грибных штаммов к возбудителю фомоза рапса озимого Phoma lingam при температуре 25 °С на 20-е сутки культивирования на среде КСА
ФГБНУ ФНЦ ВНИИМК, 2024 г.
|
Штамм антагонист |
Площадь зарастания поверхности питательной среды |
Размер стерильной зоны, мм |
Размер гиперпаразитической зоны, см2 |
|||
|
антагонистом |
патогеном |
|||||
|
% |
см2 |
% |
см2 |
|||
|
Phoma lingam |
- |
- |
27,6 |
17,5 ± 1,3 |
- |
- |
|
конкуренция за площадь питания + антибиоз + гиперпаразитизм |
||||||
|
T-1 Trichoderma sp . |
100 |
63,6 ± 0 |
5,8 |
3,7 ± 0,1 |
4,5 ± 0,5 |
3,7 ± 0,1 |
|
T-2 Trichoderma sp . |
100 |
63,6 ± 0 |
1,3 |
0,8 ± 0,2 |
5,0 ± 0 |
0,8 ± 0,2 |
|
T-3 Trichoderma sp . |
100 |
63,6 ± 0 |
2,1 |
1,4 ± 0,2 |
5,5 ± 0,5 |
1,4 ± 0,2 |
|
T-4 Trichoderma sp . |
100 |
63,6 ± 0 |
0,8 |
0,5 ± 0,3 |
5,0 ± 0 |
0,5 ± 0,3 |
|
T-5 Trichoderma sp . |
100 |
63,6 ± 0 |
1,2 |
0,8 ± 0 |
5,5 ± 0,5 |
0,8 ± 0 |
|
конкуренция за площадь питания + антибиоз |
||||||
|
Pv-3 Penicillium verrucosum |
53,7 |
34,2 ± 1,8 |
18,5 |
11,8 ± 2,0 |
10,0 ± 0 |
0 |
|
Pk-1 Penicillium vermiculatum |
56,1 |
35,7 ± 5,3 |
27,2 |
17,3 ± 2,0 |
8,0 ± 1,0 |
0 |
|
Pbc-1 Penicillium brevi-compactum |
46,7 |
29,7 ± 0,7 |
35,2 |
22,4 ± 0,5 |
7,5 ± 0,5 |
0 |
|
Pp-1 Penicillium purpurescens |
69,5 |
44,2 ± 3,9 |
12,4 |
7,9 ± 1,2 |
7,5 ± 2,5 |
0 |
|
Av-1 Aspergillus versicolor |
64,8 |
41,3 ± 5,9 |
15,6 |
9,9 ± 1,1 |
7,5 ± 0,5 |
0 |
|
An-1 Aspergillus niger |
66,3 |
41,2 ± 4,9 |
12,7 |
8,1 ± 4,0 |
7,5 ± 0,5 |
0 |
|
Af-1 Aspergillus flavus |
53,9 |
34,3 ± 1,1 |
17,7 |
11,2 ± 1,9 |
6,5 ± 0,5 |
0 |
|
М-1 Metarhizium sp . |
53,4 |
33,9 ± 1,5 |
15,2 |
9,7 ± 1,1 |
6,5 ± 0,5 |
0 |
|
Xk-1 Chaetomium olivaceum |
61,6 |
39,3 ± 0,5 |
23,7 |
15,1 ± 1,5 |
6,0 ± 0 |
0 |
|
Pr-1 Penicillium rugulosum |
25,8 |
16,5 ± 1,8 |
16,4 |
10,4 ± 0,6 |
5,5 ± 0,5 |
0 |
|
Xk-2 Chaetomium globosum |
66,1 |
42,1 ± 3,2 |
18,7 |
11,8 ± 1,9 |
5,5 ± 0,5 |
0 |
|
Tt-1 Talaramyces trachispermus |
25,8 |
16,4 ± 0,2 |
40,0 |
25,5 ± 0,3 |
5,5 ± 2,5 |
0 |
|
Хk-4 Chaetomium sp . |
65,8 |
41,9 ± 1,3 |
21,3 |
13,5 ± 2,2 |
5,0 ± 0 |
0 |
|
Sm-1 Sordaria macrospora |
80,3 |
51,1 ± 6,3 |
7,0 |
4,4 ± 2,4 |
5,0 ± 0 |
0 |
|
Pf-1 Penicillium funiculosum |
58,7 |
37,4 ± 1,5 |
11,6 |
7,5 ± 0,2 |
4,5 ± 0,5 |
0 |
|
Tr-1 Trichothecium roseum |
82,7 |
53,6 ± 0 |
10,4 |
6,6 ± 1,7 |
4,0 ± 1,0 |
0 |
|
A-1 Basidiomycota |
86,9 |
55,3 ± 2,1 |
11,1 |
7,1 ± 1,8 |
3,5 ± 0,5 |
0 |
|
Хk-3 Chaetomium globosum |
63,5 |
44,4 ± 0,2 |
16,4 |
10,4 ± 0,2 |
2,5 ± 0,5 |
0 |
|
M-24 Penicillium vermiculatum |
53,7 |
34,2 ± 0,1 |
9,9 |
6,3 ± 4,7 |
1,5 ± 0,5 |
0 |
|
конкуренция за площадь питания + гиперпаразитизм |
||||||
|
Tk-1 Trichoderma koningii |
87,4 |
55,6 ± 0 |
25,2 |
16,0 ± 2,0 |
0 |
8,1 ± 3,5 |
|
И-3 Basidiomycota |
53,5 |
34,0 ± 2,9 |
31,1 |
19,8 ± 2,7 |
0 |
3,1 ± 1,2 |
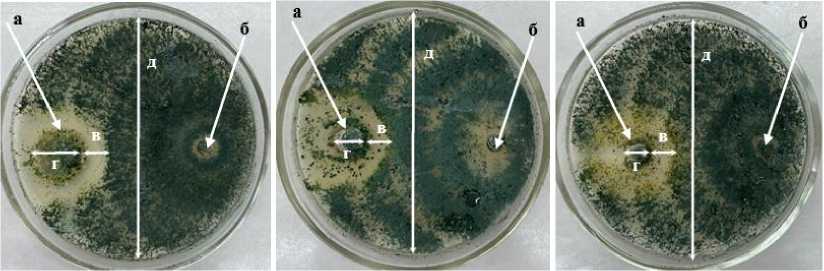
T-1 Trichoderma sp . T-3 Trichoderma sp . T-4 Trichoderma sp .
Рисунок 1 – Антагонистическая активность грибов рода Trichoderma к возбудителю фомоза рапса озимого Phoma lingam через 20 суток совместного культивирования на среде КСА при температуре 25 °С (ориг.) (ФГБНУ ФНЦ ВНИИМК, 2024 г.): а – колония патогена; б – колония антагониста; в – стерильная зона; г – гиперпаразитизм; д – конкуренция за площадь питания
Двойной тип механизма антагонистической активности (конкуренция за площадь питания и антибиоз) проявили семь штаммов из рода Penicillium (Pv-3 Penicillium verrucosum , Pk-1 Penicillium vermiculatum , Pbc-1 Penicillium brevi-compactum , Pp-1 Penicillium purpurescens , Pr-1 Penicillium rugulosum , Pf-1 Penicillium funiculosum и M-24 Penicillium vermiculatum ), четыре из рода Chaetomium (Xk-1 Chaetomium oliva-ceum , Xk-2 и Хk-3 Chaetomium globosum и Хk-4 Chaetomium sp . ), три из рода Aspergillus (Av-1 Aspergillus versicolor , An-1 Aspergillus niger и Af-1 Aspergillus flavus ), а также штаммы М-1 Metarhizium sp . , Tt-1
Talaramyces trachispermus , Sm-1 Sordaria macrospora , Tr-1 Trichothecium roseum и A-1 Basidiomycota . Вышеуказанные штаммы на 20 сутки заняли от 25,8 до 86,9 % площади поверхности питательной среды при таковой у патогена 7,0–40,0 %, а также образовали стерильную зону задержки роста патогена размером от 1,5 до 10,0 мм. Максимальная стерильная зона установлена у штаммов Pv-3 Penicillium verrucosum , Pk-1 Penicillium vermiculatum , Pbc-1 Penicillium brevi-compactum , Pp-1 Penicillium pur-purescens , Av-1 Aspergillus versicolor и An-1 Aspergillus niger – 7,5–10,0 мм (рис. 2).
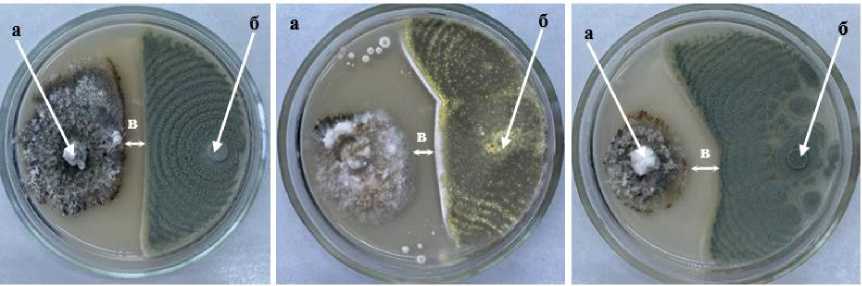
Pv-3 Penicillium
Pk-1 Penicillium
Pbc-1 Penicillium
verrucosum vermiculatum brevi-compactum
Pp-1 Penicillium Av-1 Aspergillus An-1 Aspergillus purpurescens versicolor niger
Рисунок 2 – Антибиотическая активность грибных штаммов к возбудителю фомоза рапса озимого Phoma lingam через 20 суток совместного культивирования на среде КСА при температуре 25 °С (ориг.) (ФГБНУ ФНЦ ВНИИМК, 2024 г.): а – колония патогена; б – колония антагониста; в – стерильная зона
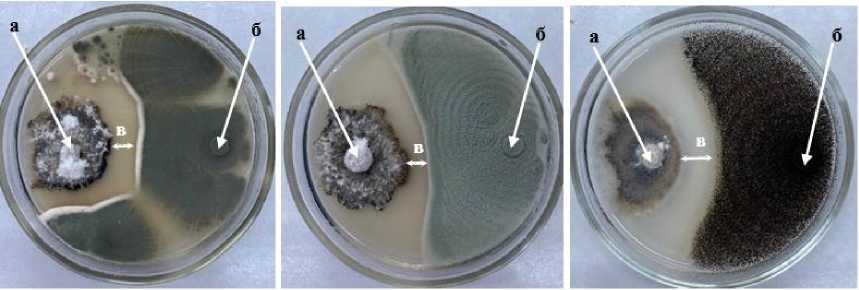
Штаммы И-3 Basidiomycota и Tk-1 Trichoderma koningii на среде КСА проявили двойной тип механизма антагонистической активности (конкуренция за площадь питания и гиперпаразитизм), заняв 53,5–87,4 % поверхности питательной среды при гиперпаразитической зоне 3,1– 8,1 см2 соответственно.
На специализированной для грибов питательной среде Рудакова у 12 штаммов (Т-1, Т-2, Т-3, Т-4 и Т-5 Trichoderma sp., Xk-1 Chaetomium olivaceum, Xk-2 и Хk-3 Chae-tomium globosum, и Хk-4 Chaetomium sp., И-3 и А-1 Basidiomycota и Tr-1 Trichothe-cium roseum) выявлен двойной тип антагонистической активности к возбудителю фо-моза рапса озимого Phoma lingam – конку- ренция за площадь питания и гиперпаразитизм (табл. 2). При этом максимальную конкуренцию за площадь питания проявили штаммы из рода Trichoderma (Т-1, Т-2, Т-3, Т-4 и Т-5), заняв 100 % поверхности питательной среды, а максимальная гиперпаразитическая зона выявлена у штаммов Xk-2 и Хk-3 Chaetomium glo-bosum, Tr-1 Trichothecium roseum и И-3 Ba-sidiomycota – 8,2–12,1 см2.
Таблица 2
Антагонистическая активность грибных штаммов к возбудителю фомоза рапса озимого Phoma lingam при температуре 25 °С на 20-е сутки культивирования на среде Рудакова
ФГБНУ ФНЦ ВНИИМК, 2024 г.
|
Штамм антагонист |
Площадь зарастания поверхности питательной среды |
Размер стерильной зоны, мм |
Размер гиперпаразитической зоны, см2 |
|||
|
антагонистом |
патогеном |
|||||
|
% |
см2 |
% |
см2 |
|||
|
Phoma lingam |
- |
- |
78,0 |
49,1 ± 0,6 |
- |
- |
|
конкуренция за площадь питания + гиперпаразитизм |
||||||
|
T-1 Trichoderma sp . |
100 |
63,6 ± 0 |
2,7 |
1,7 ± 0,2 |
0 |
1,7 ± 0,2 |
|
T-2 Trichoderma sp . |
100 |
63,6 ± 0 |
2,0 |
1,2 ± 0,5 |
0 |
1,2 ± 0,5 |
|
T-3 Trichoderma sp . |
100 |
63,6 ± 0 |
4,2 |
2,6 ± 0,2 |
0 |
2,6 ± 0,2 |
|
T-4 Trichoderma sp . |
100 |
63,6 ± 0 |
2,9 |
1,8 ± 0,1 |
0 |
1,8 ± 0,1 |
|
T-5 Trichoderma sp . |
100 |
63,6 ± 0 |
6,0 |
2,1 ± 1,0 |
0 |
2,1 ± 1,0 |
|
Tr-1 Trichothecium roseum |
100 |
63,6 ± 0 |
13,4 |
8,5 ± 1,7 |
0 |
8,5 ± 1,7 |
|
A-1 Basidiomycota |
90,7 |
57,7 ± 2,9 |
14,3 |
9,1 ± 1,1 |
0 |
7,1 ± 0,9 |
|
Xk-2 Chaetomium globosum |
81,4 |
51,7 ± 1,5 |
16,5 |
10,5 ± 2,1 |
0 |
8,2 ± 1,7 |
|
Xk-1 Chaetomium olivaceum |
77,9 |
49,6 ± 2,2 |
17,7 |
11,3 ± 1,2 |
0 |
1,9 ± 0,3 |
|
Хk-4 Chaetomium sp . |
75,3 |
47,9 ± 0 |
13,8 |
8,7 ± 0 |
0 |
6,8 ± 0 |
|
Хk-3 Chaetomium globosum |
71,8 |
45,6 ± 1,0 |
16,8 |
10,6 ± 0,7 |
0 |
8,3 ± 0,5 |
|
И-3 Basidiomycota |
58,9 |
37,4 ± 0,8 |
23,5 |
15,5 ± 0,5 |
0 |
12,1 ± 0,4 |
|
конкуренция за площадь питания + антибиоз |
||||||
|
Av-1 Aspergillus versicolor |
56,1 |
35,7 ± 0,4 |
33,1 |
21,0 ± 5,5 |
5,0 ± 1,0 |
0 |
|
Pr-1 Penicillium rugulosum |
36,3 |
23,0 ± 1,6 |
46,6 |
29,6 ± 2,2 |
3,5 ± 0,5 |
0 |
|
Tk-1 Trichoderma koningii |
100 |
63,6 ± 0 |
6,0 |
2,1 ± 0,7 |
2,5 ± 0,5 |
0 |
|
Pk-1 Penicillium vermiculatum |
59,5 |
37,8 ± 5,4 |
33,2 |
21,1 ± 1,9 |
2,5 ± 0,5 |
0 |
|
Pbc-1 Penicillium brevi-compactum |
54,9 |
34,9 ± 0,4 |
37,9 |
24,1 ± 0,6 |
2,5 ± 0,5 |
0 |
|
Pp-1 Penicillium purpurescens |
52,8 |
33,5 ± 0,4 |
29,6 |
18,8 ± 0,7 |
2,5 ± 0,5 |
0 |
|
Af-1 Aspergillus flavus |
58,3 |
37,1 ± 1,1 |
21,8 |
13,8 ± 0,7 |
2,5 ± 0,5 |
0 |
|
An-1 Aspergillus niger |
87,4 |
55,5 ± 4,9 |
10,6 |
6,7 ± 3,6 |
2,0 ± 1,0 |
0 |
|
M-24 Penicillium vermiculatum |
55,7 |
35,4 ± 0,1 |
35,0 |
22,2 ± 1,4 |
1,0 ± 0 |
0 |
|
Pv-3 Penicillium verrucosum |
58,3 |
37,2 ± 1,7 |
39,5 |
25,1 ± 3,2 |
1,0 ± 0 |
0 |
|
конкуренция за площадь питания |
||||||
|
Sm-1 Sordaria macrospora |
97,8 |
62,2 ± 0,1 |
2,1 |
1,3 ± 0,1 |
0 |
0 |
|
Pf-1 Penicillium funiculosum |
51,5 |
32,8 ± 1,0 |
47,8 |
30,4 ± 1,4 |
0 |
0 |
|
М-1 Metarhizium sp . |
42,0 |
26,7 ± 0,3 |
43,9 |
27,9 ± 1,6 |
0 |
0 |
Конкуренцию за площадь питания и антибиоз проявили три штамма из рода Aspergillus (Av-1 Aspergillus versicolor , An-1 Aspergillus niger и Af-1 Aspergillus flavus ), шесть – из рода Penicillium (Pv-3 Penicillium verrucosum , Pk-1 Penicillium vermiculatum , Pbc-1 Penicillium brevi-compactum , Pp-1 Penicillium purpurescens , Pr-1 Penicillium rugulosum и M-24 Penicillium vermicula-tum ), а также штамм Tk-1 Trichoderma kon-ingii . При этом максимальную конкуренцию за площадь питания показал штамм Tk-1 Trichoderma koningii , заняв 100 % площади среды, а максимальный антибиоз – штаммы Pr-1 Penicillium rugulosum и Av-1 Aspergillus versicolor при стерильной зоне 3,5 и 5,0 мм соответственно. Только конкуренция за площадь питания выявлена у штаммов SM-1 Sordaria macrospora , Pf-1 Penicillium funiculosum и М-1 Metarhizium sp . , которые заняли от 42,0 до 97,8 % поверхности питательной среды, когда патоген при этом зарос всего на 2,1–47,8 %.
Таким образом, на двух питательных средах: КСА и Рудакова, выделено 26 перспективных грибных штаммов, проявивших антагонистическую активность к возбудителю фомоза рапса озимого с разными типами действия, для проведения вторичного скрининга на фоне искусственного заражения в лабораторных условиях во влажной камере.
Заключение. В результате первичного скрининга грибных штаммов антагонистов из рабочей коллекции лаборатории биометода агротехнологического отдела ФГБНУ ФНЦ ВНИИМК в 2024 г. на средах КСА и Рудакова выделены перспективные штаммы грибов с разными типами антагонистической активности к возбудителю фомоза рапса озимого: конкуренция за площадь питания, гиперпаразитизм и антибиоз. При этом пять штаммов из рода Trichoderma (Т-1, Т-2, Т-3, Т-4 и Т-5 Trichoderma sp.) проявили тройной тип механизма антагонистической активности. Максимальный антибиоз установлен у штаммов Pv-3 Penicillium verrucosum, Pk-1 Penicillium vermiculatum, Pbc-1 Penicillium brevi-compactum, Pp-1 Penicillium pur-purescens, Av-1 Aspergillus versicolor, An-1 Aspergillus niger и Pr-1 Penicillium rugu-losum, максимальная гиперпаразитическая зона – у штаммов Xk-2 и Хk-3 Chaetomium globosum, Tr-1 Trichothecium roseum и И-3 Basidiomycota, а максимальная конкуренция за площадь питания – у штамма Tk-1 Trichoderma koningii. Только конкуренция за площадь питания выявлена у штаммов Sm-1 Sordaria macrospora, Pf-1 Penicillium funiculosum и М-1 Metarhizium sp. В дальнейшем выделенные штаммы будут оценены во вторичном скрининге на фоне искусственного заражения возбудителем фо-моза рапса озимого в лабораторных условиях во влажной камере и в грунте.
Список литературы Первичный скрининг коллекционных грибных штаммов антагонистов к возбудителю фомоза рапса озимого
- Index Fungorum Data Bases: [Электронный ресурс]. - Режим доступа: https://www.indexfungorum.org/names/Names_Record.asp?RecordID=230154 (дата обращения: 29.10.2024).
- Бочкарев Н.И., Пивень В.Т., Тишков Н.М. [и др.]. Защита рапса // Защита и карантин растений. - 2017. - № S1. - С. 3776. EDN: XQQWJV
- Сердюк О.А., Трубина В.С., Горлова Л.А. Влияние внутренней инфекции на всхожесть и масличность семян масличных культур семейства капустные // Масличные культуры. - 2019. - Вып. 3 (179). -С.119-123.
- Gomzhina M.M., Gasich E.L. Plenodomus species infecting oilseed rape in Russia // Plant Protection News. - 2022. -No. 105 (3). - P. 135-147.
- Костин Н.К., Кузнецова А.А., Дудченко И.П. [и др.]. Видовой состав микромицетов, ассоциированных с растениями рапса озимого некоторых регионов России // Сб. тезисов докладов конф. "Генетические технологии в микробиологии и микробное разнообразие", Пущино, 06-08 декабря 2022 г. - С. 56-59. EDN: HSIUQG
- Гасич Е.Д. Фомоз рапса (обзор литературы) // Вестник защиты растений. -2004. - № 1. - С. 11-24. EDN: YKUWZV
- Маслиенко Л.В. Лаборатория биологических средств защиты растений (вчера, сегодня, завтра) // История научных исследований во ВНИИМКе за 90 лет. - Краснодар, 2002. - С. 191-197.
- Егоров Н.С. Выделение микробов антагонистов и биологические методы учета их антибиотической активности. - М.: Изд-во Моск. ун-та, 1957. - 78 с.
- Лысак В.В., Желдакова Р.А., Фомина О.В. Микробиология. Практикум: пособие. - Минск: БГУ, 2015. - 115 с.
- Рудаков О.Л. Микофильные грибы, их биология и практическое значение. -М.: Наука, 1981. - 160 с. EDN: UAJMLR


