Первый клинический опыт применения холодноплазменного стернотома
Автор: Козлов Б.Н., Кузнецов М.С., Насрашвили Г.Г., Панфилов Д.С., Шипулин В.М., Николаев А.Г., Гуляев В.М.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: В помощь практическому врачу
Статья в выпуске: 2 т.27, 2012 года.
Бесплатный доступ
Цель исследования: анализ эффективности применения в клинической практике стернотома с холодноплазменным наконечником в сравнении со стандартной методикой стернотомии электромеханической пилой. Исследование включало 36 пациентов, поступивших в стационар для планового оперативного лечения заболеваний сердца. Средний возраст - 58,0±6,2 года. Согласно применявшемуся способу стернотомии - с использованием стернотома с холодноплазменным наконечником (ХПН) либо электромеханической пилой - пациентов разделили на две группы: основную (n=20) и контрольную (n=19). У всех пациентов исследовали исходное состояние костной ткани грудины (гистологически), влияние коблации на рассекаемые ткани, объем кровопотери (гравиметрическим методом) на этапе стернотомии; в период после оперативного вмешательства - показатели костного ремоделирования. Кроме того, оценивали индивидуальную переносимость обоих способов (сроки активизации пациентов, интенсивность болевого синдрома), сроки заживления раны и частоту послеоперационных осложнений. При использовании стернотома с ХПН уменьшалось время осуществления хирургического доступа более чем на 90%; в среднем в 7 раз снижался объем кровопотери на этапе стернотомии; уменьшалась глубина и степень повреждения тканей; на 45,5% снижалась интенсивность болевого синдрома в послеоперационном периоде (оценка по шкале от 1 до 10 баллов). Стернотом с холодноплазменным наконечником, благодаря низкотермическому воздействию и малой глубине повреждения рассекаемых тканей в сравнении со стандартной методикой, обладает меньшей травматичностью, сокращает продолжительность этапа стернотомии и кровопотерю. Эти характеристики способствуют более быстрому заживлению костной ткани грудины, снижению частоты послеоперационных осложнений, поэтому его использование можно считать более предпочтительным.
Грудина, стернотом, холодная плазма
Короткий адрес: https://sciup.org/14919750
IDR: 14919750 | УДК: 617-7
Текст научной статьи Первый клинический опыт применения холодноплазменного стернотома
Несмотря на постоянное совершенствование методик консервативного лечения заболеваний сердечно-сосудистой системы, по-прежнему очевидна огромная роль хирургического подхода. О востребованности хирургического лечения говорит и ежегодное повышение оперативной активности в хирургии сердца по всему миру. По данным Минздравсоцразвития, только в России ежегодно выполняется более 59 тыс. операций на сердце с применением широкого доступа к сердцу – срединной стернотомии [1]. Неоспоримым преимуществом данного доступа является наибольшая свобода действий, предоставляемая хирургу при операциях на органах средостения.
Впервые полная продольная срединная стернотомия произведена Milton в 1897 г. у больного с медиастинальным туберкулезом [2]. С тех пор данный доступ нашел широкое применение в торакальной хирургии и в том числе в сердечно-сосудистой хирургии. Известно много методов для выполнения стернотомии с использованием различных инструментов: гильотинный стернотом, дисковая пила, пила Джигли, листовая пила, стернотом-долото Долиотти [7]. Однако в силу сложности, длительности выполнения стернотомии и высокого риска ятрогенных повреждений органов средостения данные способы утратили актуальность, уступив место современным электромеханическим стернотомам. Тем не менее, рассечение грудины даже с использованием более совершенных, удобных и безопасных медицинских инструментов не лишено недостатков. Так, непосредственно после рассечения грудины пилой возникает необходимость в остановке кровотечения из надкостницы и губчатого вещества кости. С этой целью на сегодняшний день используются различные электрохирургические инструменты в сочетании с медицинским воском. Такой подход создает препятствия для благоприятной репарации кости, поскольку сопровождается дополнительной травматизаци-ей надкостницы (важнейшей ростковой зоны) и образованием прослойки из чужеродного вещества (воска), создающей механический барьер для пролиферации клеток. Кроме того, данные манипуляции удлиняют время этапа стернотомии и операции в целом. В связи с этим возникает необходимость в аппаратах, которые позволяли бы рассекать костные ткани с мгновенным коагулированием сосудов и идеальным асептическим эффектом при минимальном повреждающем воздействии. В литературе встречаются сообщения о клиническом опыте плазменного рассечения тканей [3], однако данных о применении методик, позволяющих проводить рассечение и гемостаз костных тканей одномоментно, мы не обнаружили.
Цель исследования: апробация в клинической практике комбинированного холодноплазменного стерното-ма и определение его эффективности, безопасности и степени повреждения тканей при выполнении стернотомии как этапа оперативного вмешательства.
Материал и методы
В структуре заболеваемости у 39 пациентов (79,5%) – 20 человек из основной и 19 человек из контрольной группы – преобладал диагноз ишемической болезни сердца (ИБС). По тяжести проявлений стенокардии у большинства больных преобладали II–III функциональные классы (ФК): в контрольной группе – у 11 человек, в основной – у 13. По 3 человека в каждой группе имели I ФК.
В основной группе имелся 1 пациент с IV ФК. Кроме того, среди включенных в исследование пациентов с основным диагнозом ИБС у 2 человек (5%) диагностирована дилатационная кардиомиопатия. Остальные 8 пациентов (20,5%) в качестве основного заболевания имели порок аортального клапана. Фоновой патологией у всех обследованных была гипертоническая болезнь III ст., риск 4.
В спектре сопутствующих заболеваний наиболее часто диагностировали хронический гастрит в фазе ремиссии: в основной группе – у 12 (60%) пациентов, в контрольной – у 11 (58%) больных. Сахарный диабет либо нарушение толерантности к углеводам в основной группе выявлен у 4 (20%) пациентов, в контрольной – у 5 (26%) человек. Остеохондроз позвоночника диагностирован у 13 пациентов, из них 8 (40%) больных основной группы и 5 (26%) человек – в контрольной. Также достаточно часто выявлялась МКБ: основная группа – у 3 (15%) пациентов, контрольная – у 2 (10%). Частота других сопутствующих заболеваний, встречавшихся у пациентов в обеих группах, не превышала 5%.
В рамках исследования всем пациентам выполнялось комплексное обследование состояния костной системы, в частности, грудины. Оценивали ее состояние исходно, после интраоперационного повреждающего воздействия, а также в раннем и отдаленном послеоперационных периодах.
Показатели метаболизма костной ткани определяли иммуноферментным анализом (ИФА) по уровню остеоб-ластической активности в сыворотке крови (остеокальцин, общая и специфическая костная щелочная фосфатаза, ионизированный кальций и фосфор) и показателям резорбции в моче (кальций и дезоксипиридинолин). Кроме того, всех пациентов тестировали опросником IOF (International Osteoporosis Foundation) по 10-балльной шкале для оценки риска заболевания остеопорозом. Полученные при скрининге данные позволяли косвенно судить о костной регенераторной способности, степени остеопороза и вероятности развития послеоперационных осложнений.
Подсчет объема кровопотери из надкостницы и костной ткани грудины проводился гравиметрическим методом (подсчет разности массы пропитанных кровью и сухих салфеток).
Степень повреждения надкостницы в процессе операции и скорость регенерации костной ткани тела грудины в послеоперационном периоде оценивали морфологическими исследованиями фрагментов тканей.
В качестве метода контроля эффективности репаративной регенерации клеток костной ткани использовали трехфазную динамическую сцинтиграфию и однофотонную эмиссионную компьютерную томографию (ОЭКТ) грудины с 99mТс-пирофосфатом или 99mТс-мети-лендифосфатом [8]. Данный метод основан на концепции подсчета поглощения фосфатов тканью грудины по отношению к условно интактной костной ткани позвоночника и позволяет избежать дополнительной лучевой нагрузки, отказавшись от исследования на дооперацион-ном этапе.
Холодноплазменный стернотом – аппарат, разработанный на базе НИИ сильноточной электроники СО РАН
(Томск) совместно с отделом сердечно-сосудистой хирургии ФГБУ “НИИ кардиологии” СО РАМН (Томск), сохранивший эффективность и скорость электромеханической пилы, но при этом позволивший отказаться от использования диатермокоагуляции и медицинского воска, благодаря применению методики коблации [6]. Основой изобретения является модифицированный наконечник электромеханической сагиттальной пилы c двумя электродами (рис. 1).
Благодаря расположению электродов, во время стернотомии возникает разность потенциалов между полотном пилы и коагуляционным электродом наконечника посредством подключения его к биполярному холодноплазменному аппарату “Atlas” (ArthroCare Corp., USA), рисунок 2.
Аппарат обеспечивает ионизацию электропроводящей жидкостной среды (физиологический раствор, кровь) с образованием низкотемпературной плазмы. Таким образом, при продвижении пилы вдоль грудины за рассекающим полотном возникает облако холодной плазмы, которое мгновенно коагулирует сосуды надкостницы и губчатое вещество кости.
Эффект коблации, благодаря более низкому в сравнении с диатермокоагуляцией термическому воздействию, меньше повреждает ткани, не вызывает ожога, а
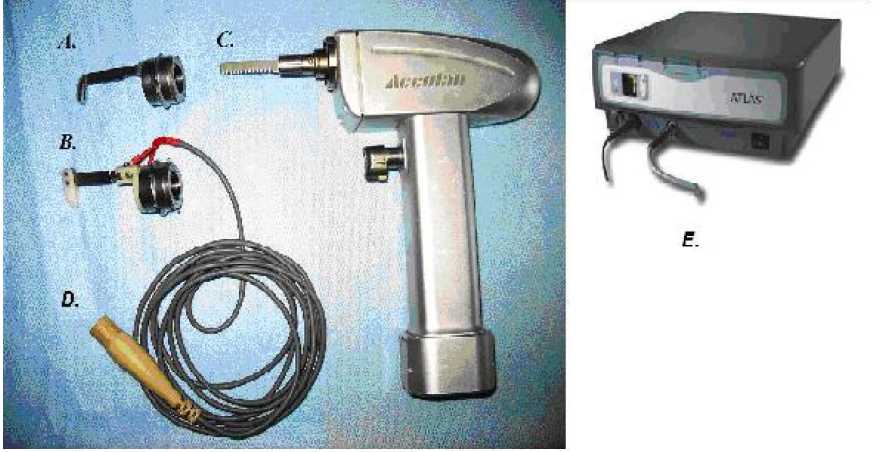
Рис. 2. Устройство холодноплазменного стернотома: А – стандартный наконечник пилы, В – модифицированный наконечник пилы, С – электромеханическая пила для стернотомии, D – разъем для подключения к холодноплазменному аппарату “Atlas”, Е – биполярный холодноплазменный аппарат “Atlas”
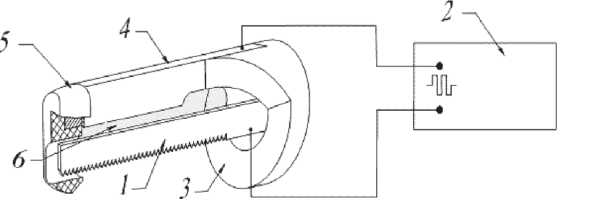
Рис. 1. Схематичное изображение модифицированного наконечника стернотома, где 1 – полотно пилы, 2 – источник питания, 3 – диэлектрическое основание, 4 – коагуляционный электрод, 5 – диэлектрическая ограничительная лапка, 6 – область формирования облака плазмы также лишен эффекта прилипания ткани (ArthroCare Corp., USA). Эффективность и безопасность разработанного аппарата подтверждена серией экспериментов на беспородных собаках. Полученные результаты показали снижение объема интраоперационной кровопотери и послеоперационных инфекционных осложнений у животных [4].
На первом (дооперационном) этапе у пациентов обеих групп анализировали показатели метаболизма костной ткани, что позволяло оценить ее состояние, установить скорость обменных процессов в кости, прогнозировать риск послеоперационных осложнений, а также осуществлять в дальнейшем оценку влияния стернотомии на состояние грудины.
На втором этапе (интраоперационно) проводился сравнительный анализ результатов стернотомии и получаемого эффекта от использования стернотома с ХПН у больных 1-й группы. Для этого под внутривенным наркозом, в условиях искусственной вентиляции легких, после обработки операционного поля раствором антисептика и ограничения одноразовым стерильным бельем, рассекали кожу и подкожную жировую клетчатку строго по средней линии примерно на 1,5 см выше рукоятки грудины и на 2–3 см ниже мечевидного отростка. Далее тупым путем освобождали ретростернальное пространство. Затем непосредственно рассекали грудину модифицированным стернотомом с ХПН. В момент рассечения грудины проводили коагулирование надкостницы и губчатого вещества кости облаком холодной плазмы с температурой в зоне воздействия 40–70 °С. Какие-либо другие методы гемостаза не применяли. После выполнения основного этапа все операции завершались стабилизацией распиленных частей грудины с помощью медицинской металлической проволоки “Ethicon 7”. Интраоперационно – на этапе стернотомии – подсчитывали объем кровопотери из надкостницы и костной ткани грудины вышеуказанным методом. Для проведения сравнительного анализа влияния коблации непосредственно перед выполнением распила, а также сразу после стернотомии забирали фрагменты надкостницы и костной ткани из тела грудины для морфологического исследования. Дополнительно фиксировали время, затрачиваемое для выполнения стернотомии в обеих группах.
На третьем этапе (ранний послеоперационный) исследовали остеобластическую и остеокластическую активность, аналогично исследованиям, проведенным на доопе-рационном этапе (уровни остеокальцина, общей и специфической костной щелочной фосфатазы, ионизированного кальция и фосфора), оценивали послеоперационные осложнения. Интенсивность бо- левого синдрома в зоне вмешательства – от 0 до 10 баллов – оценивали по шкале NRS (Numeric Rating Scale).
В сроки от 10 до 14 сут после проведенного хирургического лечения (период репаративной регенерации с наиболее интенсивной пролиферацией и дифференцировкой клеток костной ткани) пациентам проводилась трехфазная динамическая сцинтиграфия и ОЭКТ грудины с 99mТс-пирофосфатом или 99mТс-метилен дифосфатом [8]. Также в этом периоде для проведения морфологического исследования выполняли пункционную биопсию костной мозоли грудины, результаты которой давали представление о степени завершенности формирования костной мозоли и ее структурных характеристиках. Использование модифицированного стернотома с ХПН согласовано с локальным этическим комитетом. Все пациенты давали письменное согласие на выполнение операций.
На четвертом (поздний послеоперационный) этапе (в период от 6 до 12 мес. после проведенного вмешательства) планируется провести анализ отделенных результатов с контролем качества репаративных процессов костной ткани (динамической сцинтиграфией и ОЭКТ), а также отслеживанием поздних послеоперационных осложнений.
Полученные числовые данные подвергались статистической обработке при помощи программы STATISTICA 6.0 for Windows. Для показателей, характеризующих качественные признаки, указывалось абсолютное число и относительная величина (%). Малый и неравный объем исследуемых выборок данных послужил основанием выбора непараметричеких критериев для проверки статистической значимости межгрупповых различий показателей, которые проверяли при помощи ϕ *-критерия (угловое преобразование Фишера), Q-критерия Розенбаума. Различия считали статистически значимыми при уровне p<0,05.
Результаты и обсуждение
Настоящая работа содержит первые результаты апробации стернотома с ХПН в клинической практике у пациентов, поступивших в стационар для планового оперативного лечения различных сердечно-сосудистых заболеваний (атеросклеротического поражения коронарных артерий, ишемической кардиомиопатии, аневризм восходящего отдела и дуги аорты, патологий клапанного аппарата сердца).
Полученные по результатам исследования данные по- зволяют говорить о том, что время, затраченное на проведение стернотомии с использованием модифицированного наконечника, оказалось несколько большим, чем при использовании стандартного стернотома, и составило 14±3 против 7±2 с. Мы предполагаем, что это может быть связано с недостаточно оптимальной формой лапки для диссекции тканей ретростернального пространства. Однако, учитывая тот факт, что после выполнения стернотомии с использованием эффекта коблации не было необходимости в дополнительном гемостазе электрохирургическим инструментом (диатермокоагуляция) и медицинским воском, суммарное время выполнения данного этапа значительно сокращалось и составляло всего 14±3 против 160±15 с в группе контроля (рис. 3).
Кроме того, использование комбинированного стер-нотома существенно (в среднем в 7 раз) снижало объем интраоперационной кровопотери на этапе стернотомии (табл. 1).
На рисунках 4 и 5 представлены изображения грудины, рассеченной с использованием холодноплазменного стернотома и стандартной электромеханической пилы, позволяющие оценить степень травматизации тканей и качество гемостаза при использовании обеих методик.
Использование комбинированного стернотома, благодаря значительно меньшей глубине повреждения и температуре в зоне распила костной ткани и надкостницы, уменьшало зону асептического некроза по сравнению со стандартным стернотомом и диатермокоагуляцией. По данным литературы, получаемый пучок холодной плазы, образующийся в процессе распила, обладает как антисеп-
Таблица 1
Сравнительные показатели стернотомии с холодноплазменным и стандартным наконечником
|
СтернотомПоказатели |
Холодноплазменный |
Стандартный в сочетании с электрокоагуляцией |
|
Время выполнения этапа стернотомии, с |
14±3** |
160±15** |
|
Объем кровопотери на этапе стернотомии, гр. |
21±5** |
145±20** |
|
Интенсивность болевого синдрома в баллах |
12±3 |
22±4 |
|
Глубина воздействия на рассекаемые ткани, мм |
0,35–0,8 |
до 20 |
|
Температура в зоне воздействия, С# |
40–70 |
Более 100 |
Примечание: # – использованы технические данные аппаратов; ** – р <0,05 — уровень статистической значимости различий между показателями у больных в зависимости от методики стернотомии.
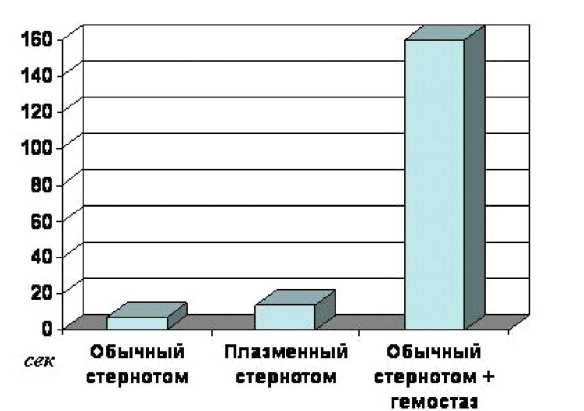
Рис. 3. Продолжительность стернотомии при использовании различных методик
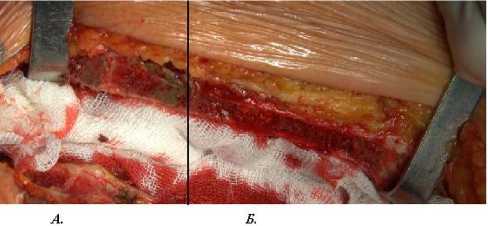
Рис. 4. Раздельная стернотомия с использованием плазменного стернотома и электромеханической пилы. Грудина рассечена с использованием холодноплазменного наконечника (А) и без него (Б). Линией обозначена граница применения методик
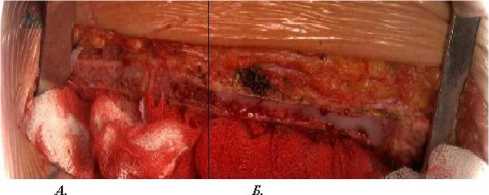
Рис. 5. Раздельная стернотомия с использованием плазменного стернотома и электромеханической пилы. Грудина рассечена с использованием холодноплазменного наконечника (А) и без него (Б). Линией обозначена граница применения методик. Справа – состояние грудины после проведения гемостаза электрокоагуляцией и медицинским воском
Таблица 2
Течение раннего послеоперационного периода
|
Группы пациентов |
Госпитализация |
Осложнения |
|
|
Инфицирование раны в области грудины |
Несостоятельность грудины |
||
|
Основная Контрольная |
16,9 суток** 26,5 суток** |
0 2 |
0 1 |
Примечание: ** – уровень статистической значимости различий между показателями у больных в различных группах, р < 0,05.
тическим, так и асептическим эффектом [5]. Благодаря таким особенностям действия стернотома с ХПН, в дальнейшем снижалось время репаративной регенерации грудины и риск развития инфекционных осложнений.
Как следствие, более низкий повреждающий эффект новой методики обуславливал меньшую интенсивность болевого синдрома в послеоперационном периоде. А отсутствие такого чужеродного вещества в области распила как медицинский воск, снижало время репаративной регенерации грудины и риск нестабильности грудины [9, 10].
Таким образом, результаты исследования позволяют говорить о том, что методика холодноплазменной стернотомии, благодаря сокращению продолжительности хирургического доступа, уменьшению объема кровопотери и травматизации тканей, снижает риск развития послеоперационных осложнений. Данное утверждение также основано на анализе течения послеоперационного периода у пациентов в обеих группах (табл. 2).
Продолжительность пребывания в отделении пациентов основной группы в послеоперационном периоде оказалась статистически значимо ниже, чем в контрольной, составив 16,9 сут против 26,5. У больных из основной группы не отмечено осложнений в послеоперационном периоде, тогда как в контрольной группе имели место 3 случая осложненного течения, один из которых потребовал проведения хирургической операции металлоостеосинтеза грудины.
Заключение
Таким образом, использование комбинированного стернотома, состоящего из холодноплазменного наконечника и электромеханической пилы возможно, эффективно и безопасно. Более того, по результатам исследования данный способ стернотомии представляется ме- тодом выбора, в частности, для пациентов с высоким риском послеоперационных осложнений – пожилых и больных с хроническими сопутствующими заболеваниями (сахарный диабет, остеопороз и др.).
Работа выполнена при поддержке гранта РФФИ № 11-08-98009-р Cибирь а от 15 декабря 2011 г.
Список литературы Первый клинический опыт применения холодноплазменного стернотома
- Бокерия Л.А., Гудкова Р.Г. Сердечно-сосудистоя хирургия. 2010 год. Болезни и врожденные аномалии системы кровообращения. -Научный совет по сердечно-сосудистой хирургии РАМН. -М.: Научный центр сердечно-сосудистой хирургии им. А.Н. Бакулева РАМН, 2010. -С. 1-37.
- Вишневский А.А., Рудаков С.С., Миланов Н.О. Хирургия грудной стенки: руководство -М.: Видар, 2005. -С. 273-276.
- Жуликов А.Л., Маланин Д.А. Применение метода холодноплазменной аблации в травматологии и других областях хирургии//Бюллетень Волгоградского научного центра РАМН. -2008. -№ 1. -С. 59-61.
- Козлов Б.Н., Кузнецов М.С., Казаков В.А. и др. Первый экспериментальный опыт стернотомии плазменным скальпелем//Сибирский медицинский журнал (Томск). -2010. -Т. 25, № 4, вып. 1. -С. 123-126.
- Мисюн Ф.А., Беседин Э.В., Гостев В.А. и др. Экспериментальное изучение бактерицидных свойств холодной плазмы//Материалы конф. "Диагностика и лечение инфекционных заболеваний". -Петрозаводск: Изд-во ПетрГУ, 2000. -С. 171-180.
- Николаев А.Г., Окс Е.М., Юшков Г.Ю. и др. Стернотом-коагулятор: пат. №114267 Рос. Федерации//Официальный Бюлл. Российского агентства по патентам и товарным знакам "Изобретения. Полезные модели". -2012. -№ 8. -2 с.
- Семенов Г.М. СЗО Современные хирургические инструменты. -СПб.: Питер, 2006. -Серия "Краткое руководство". -352 с.
- Тепляков А.Т., Мамчур С.Е., Вечерский Ю.Ю. Коронарное шунтирование. Оптимизация восстановительного лечения. Томск: Изд"во Том. ун-та, 2006 -362 с.
- Alberius P., Klinge B., Sjogren S. Effects of bone wax on rabbit cranial bone lesions//J. Craniomaxillofac. Surg. -1985. -Vol. 15 (2). -P. 63-67.
- Ibarrola J.L., Bjorenson J.E., Austin B.P. et al. Osseous reactions to three hemostatic agents//J. Endod. -1985. -Vol. 11 (2). -P. 75-83.


