Первый опыт хирургического лечения хронической тромбоэмболической легочной гипертензии
Автор: Чупин Андрей Валерьевич, Аверьянов Александр Вячеславович, Черняк Борис Борисович, Кемеж Юлия Владимировна, Ситников Александр Владимирович, Прокофьева Н.В., Касьянова Наталья Юрьевна, Бубнов В.А.
Журнал: Клиническая практика @clinpractice
Рубрика: Случай из практики
Статья в выпуске: 3 (7), 2011 года.
Бесплатный доступ
Описан клинический случай успешной тромбэндартерэктомии легочной артерии у 34-летней пациентки, в течение 9 лет страдавшей хронической тромбоэмболической легочной гипертензией и тяжелой дыхательной недостаточностью.
Тромбоэмболическая легочная гипертензия, тромбэндартерэктомия
Короткий адрес: https://sciup.org/14338395
IDR: 14338395
Текст научной статьи Первый опыт хирургического лечения хронической тромбоэмболической легочной гипертензии
Исходом острой тромбоэмболии легочной артерии может быть как полное ее разрешение, так и разрешение с остаточными явлениями, среди которых у небольшой части пациентов формируется хроническая тромбоэмболическая легочная гипертензия (ХТЭЛГ) [1-6]. Настоящая заболеваемость ХТЭЛГ неизвестна, но эксперты полагают, что это не более 0,5% перенесших эмболию [7].
По данным Национального центра статистики здоровья США, ежегодно в США происходит около 600 000 случаев острой тромбоэмболии легочной артерии (ТЭЛА). Прижизненно диагноз острой ТЭЛА устанавливается только у 20-30% пациентов. Летальность составляет около 10%. Острая ТЭЛА занимает третью позицию в структуре сердечно-сосудистых заболеваний после инфарктов и инсультов [8]. Из числа пациентов, переживших острый эпизод, приблизительно у 540-1080 больных в год формируется ХТЭЛГ.
В России нет четких данных по изучению эпидемиологии ХТЭЛГ, однако цифры в пересчете на душу населения должны быть примерно сходными или даже более высокими с уче- том ограниченного применения тромболизиса при острой ТЭЛА в отечественной практике.
Прогноз заболевания без лечения – неблагоприятный и зависит от степени легочной гипертензии. При среднем давлении в легочной артерии более 50 мм рт. ст. пятилетняя выживаемость при естественном течении заболевания составляет около 10% [9]. Консервативное лечение ХТЭЛГ включает пожизненный прием антикоагулянтов, антагонистов кальция или более эффективных, но весьма дорогостоящих силденафила, ингаляционного простациклина и босентана, длительную кислородотерапию.
Единственным на сегодняшний день методом, позволяющим значительно продлить жизнь пациентам с ХТЭЛГ, является операция тромбэндартерэтомии (ТЭАЭ) легочной артерии. В мире накоплен опыт около 3000 операций по поводу ХТЭЛГ. Послеоперационная летальность колеблется от 4,4 до 21%. После ТЭАЭ из легочной артерии в течение 10 лет выживает 80% оперированных больных. Необходимо сказать, что летальность зависит от опыта выполнения данных операций. Так, наименьшая летальность 4,4% имеет место в Ме- дицинском центре Сан-Диего, где выполнено более 2000 ТЭАЭ. Единственной хирургической альтернативой ТЭАЭ из легочной артерии является трансплантация легких, однако пятилетняя выживаемость после такого вмешательства составляет около 40% [8].
Решение о выполнении ТЭАЭ из легочной артерии у пациентов, страдающих ХТЭЛГ, основывается на объективных и субъективных факторах, которые тщательно определяются на предоперационном этапе [3, 4, 10].
Первый и наиболее важный критерий для потенциального хирургического вмешательства – доступность тромбов, которая определяется при помощи ангиографии, ангиоскопии. Существующая хирургическая техника дает возможность удаления хронических тромбов, которые локализованы в основной, долевой, сегментарной артериях. Тромбы, распространяющиеся более дистально, не являются субстратом эндартерэктомии. Неудачная попытка удаления достаточного количества материала приводит к повышению легочного сосудистого сопротивления, в особенности у пациентов с выраженной легочной гипертензией и правожелудочковой недостаточностью, ассоциированными с негативным прогнозом [11].
Второй критерий отбора для оперативного вмешательства касается тщательной оценки показателей центральной гемодинамики как результата хронической тромбоэмболической обструкции легочной артерии [7]. Показанием для ТЭАЭ является степень периферического сосудистого сопротивления выше 300 дин/с·см-5 и наличие клинических признаков сердечной недостаточности III-IV ф.к. по NYHA.
Главными противопоказаниями для ТЭАЭ считается наличие функционально значимых заболеваний легких и тяжелая сопутствующая патология. Кроме того, высокие цифры периферического сопротивления > 1100 дин/с·см-5 и систолического давления в легочной артерии > 100 мм рт. ст. резко увеличивают риск послеоперационной летальности.
В данной статье мы хотим поделиться первым собственным опытом ТЭАЭ при ХТЭЛГ.
В январе 2010 г. в отделение реанимации Клинической больницы № 83 поступила пациентка К., 34 лет, с жалобами на кровохарканье до 20 раз в день алой кровью, одышку при минимальной физической нагрузке, слабость.
В декабре 2002 г. у пациентки К. впервые по- явилась клиника ТЭЛА. По поводу восходящего тромбофлебита большой подкожной вены слева выполнена операция Троянова-Тренде-ленбурга. В 2007 г. появилось кровохарканье, вероятнее всего, уже на фоне легочной гипертензии. При первом поступлении в нашу клинику в январе 2010 г. выполнена эмболизация нижних бронхиальных артерий.
В январе 2011 г. – очередной эпизод легочного кровотечения, которое было остановлено консервативными методами в нашей клинике. У больной практически отсутствовала толерантность к физической нагрузке, одышка возникала при малейшем движении (поворотах, вставании с кровати). Кожные покровы были диффузно цианотичны. Наблюдалась пастозность стоп и голеней. Детальное обследование дало следующие результаты.
Ультразвуковое дуплексное сканирование (УЗДС) вен нижних конечностей, таза – состояние после операции Троянова-Тренделенбур-га слева; вены нижних конечностей, подвздошные вены проходимы.
ЭхоКГ – правый желудочек дилатирован до 4,45 см. Гипертрофия правого желудочка (передняя стенка – 1,0 см). Значительное увеличение объема правого предсердия – 138,0 мл. Расширение ствола легочной артерии до 3,2 см. Легочная гипертензия 3-й степени. Систолическое давление в легочной артерии 114 мм рт. ст. Зон нарушения локальной сократимости не выявлено. Фракция выброса 50-52%.
Сцинтиграфия легких – нарушение перфузии правого легкого 2 ст., левого – 4 ст. (рис. 1).
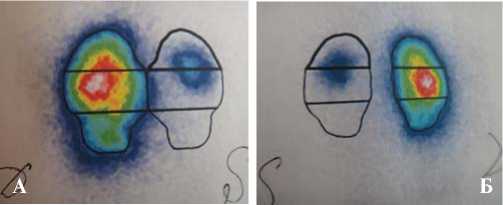
Рис. 1. Сцинтиграфия легких (А – передняя поверхность, Б – задняя поверхность)
Спиральная компьютерная томография (СКТ) сосудов грудной клетки – субокклюзия левой легочной артерии, признаки перенесенной инфарктной пневмонии с обеих сторон (рис. 2).
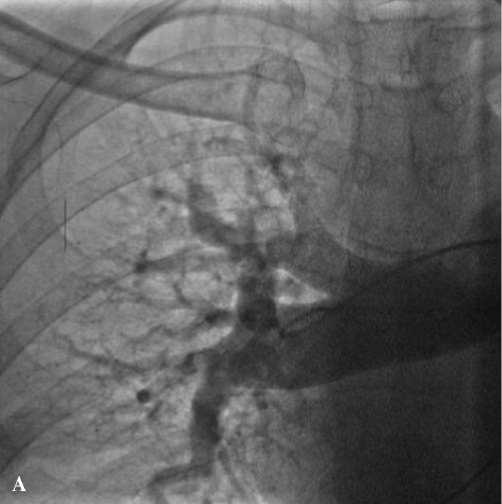
Ангиопульмонография – признаки субокклюзии левой легочной артерии, деформации правой легочной артерии (рис. 3).
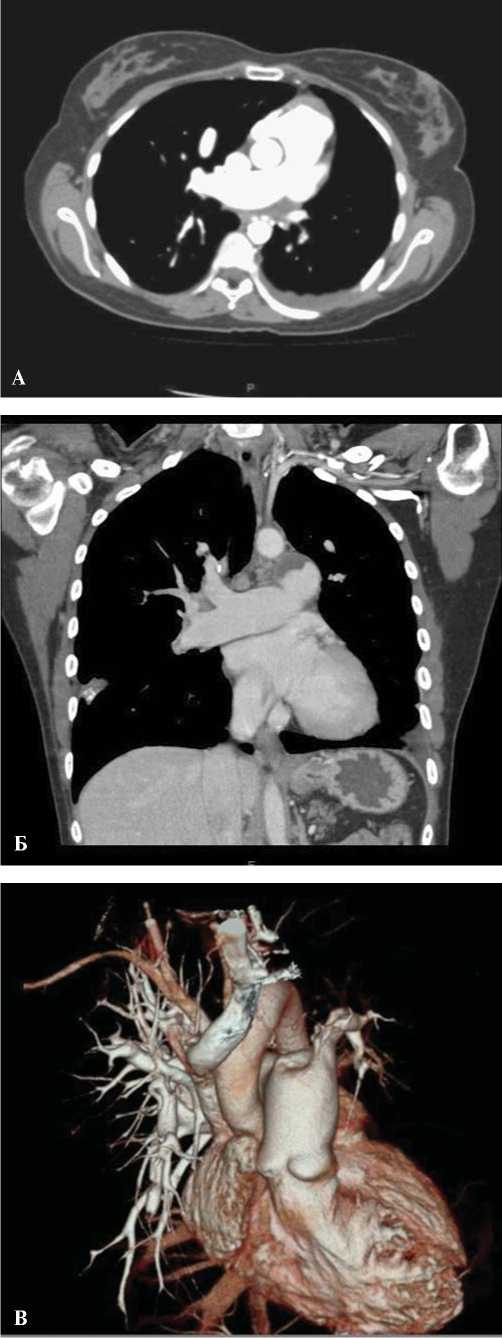
Рис. 2. СКТ сосудов грудной клетки до операции (А – сагиттальный срез, Б – фронтальный срез, В – 3-х мерное изображение)
Б
Рис. 3. Ангиопульмонография (А – правое легкое, Б – левое легкое)
Клинический диагноз: хроническая тромбоэмболическая болезнь, хроническая тромбоэмболическая легочная гипертензия, хроническое легочное сердце. Недостаточность кровообращения IV ф.к по NYHA. Рецидивирующая ТЭЛА. Рецидивирующие легочные кровотечения. Эмболизация нижних бронхиальных артерий (январь 2010 г.). Постэмболический субтотальный стеноз левой легочной артерии. Аневризматическое расширение легочного ствола.
Определены следующие показания к операции: высокая легочная гипертензия, рецидиви- рующие легочные кровотечения, проксимальная окклюзия ствола легочной артерии.
Предоперационная подготовка включала прием блокатора фосфодиэстеразы-5 силденафила (Виагра) 50 мг х 2 раза в день в течение 2 мес., который привел к снижению систолического давления в легочной артерии до 78 мм рт. ст.
25.04.2011: проведена операция ТЭАЭ из ствола и левых ветвей легочной артерии в условиях искусственного кровообращения и гипотермии 27 С, кардиоплегия с использованием препарата Кустодиол.
Используемый доступ – продольная стернотомия. Аппарат искусственного кровообращения подключали по стандартной схеме. Во избежание выраженного ретроградного кровотока, создающего помехи в работе, выполняли дренирование левого желудочка в условиях искусственного кровообращения (рис. 4).
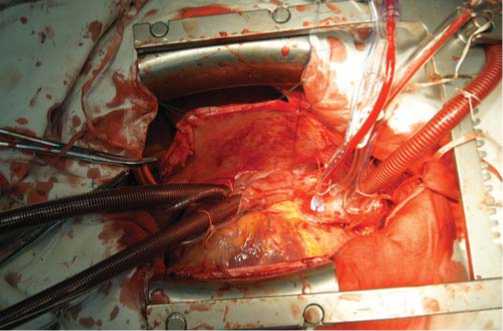
Рис.4. Продольная стернотомия. Аппарат искусственного кровообращения подключался по стандартной схеме. Во избежание выраженного ретроградного кровотока, создающего помехи в работе, выполнялось дренирование левого желудочка в условиях искусственного кровообращения.
Выполняли продольную артериотомию ствола легочной артерии с переходом на левую легочную артерию. В просвете артерии обнаружен плотный организованный тромб, субок-клюзирующий устье левой легочной артерии (рис. 5, 6).
На рис. 7. представлены тромботические массы, извлеченные из ствола легочной артерии, левой легочной артерии и ее ветвей первого порядка.
После выполненной ТЭАЭ получен удовлетворительный ретроградный кровоток из левой легочной артерии (рис. 8). Легочная артерия ушита двойным обвивным швом с использованием клея "Биоглю" (рис. 9).
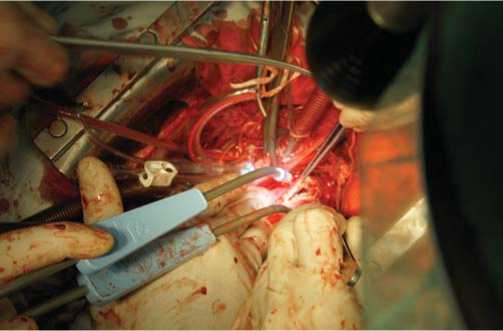
Рис. 5. Продольная артериотомия ствола легочной артерии с переходом на левую легочную артерию.
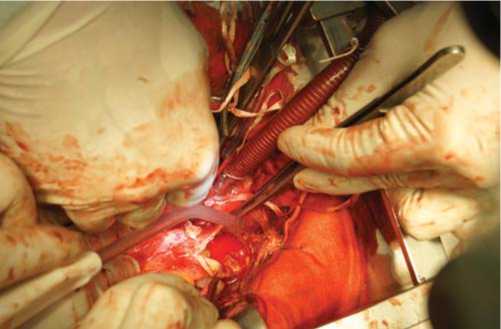
Рис. 6. В просвете артерии – плотный организованный тромб, субокклюзирующий устье левой легочной артерии.
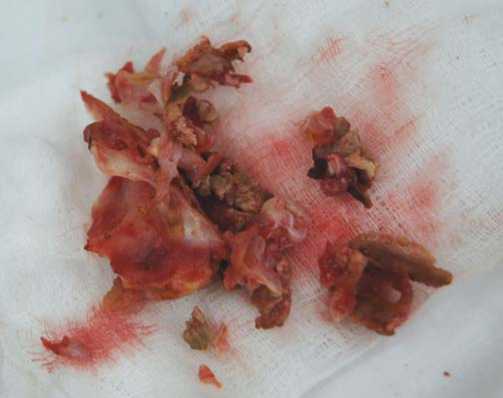
Рис. 7. Извлеченные тромботические массы из легочной артерии
Длительность операции составила 6 ч 5 мин. Время пережатия аорты – 58 мин. Длительность искусственного кровообращения – 1 ч 51 мин. Кровопотеря составила 2000 мл. Возвращено при помощи аппарата Cell sever 400 мл.
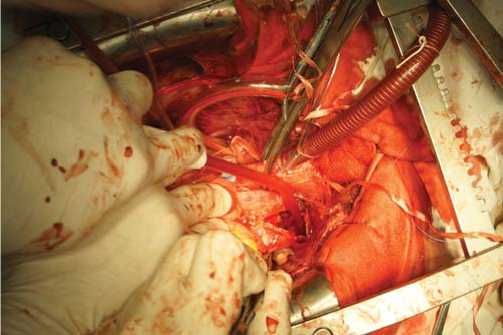
Рис. 8. Получение удовлетворительного ретроградного кровотока из левой легочной артерии после тромбэндартерэктомии из ствола легочной артерии, левой легочной артерии и ее ветвей первого порядка.
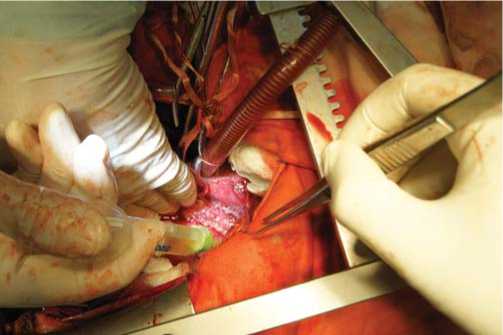
Рис. 9. Ушивание легочной артерии двойным обвивным швом с использованием клея "Биоглю".
Пациентка экстубирована на следующие сутки после операции. Удаление дренажей из плевральных полостей, из полости перикарда -на 4-е сут. Перевод в профильное отделение из отделения реанимации, активизация пациентки – на 4-е сут после операции.
Консервативная терапия послеоперационного периода: антикоагулянты (первые 3 дня – прямые, затем – перевод на непрямые), блокаторы Са-каналов (верапамил 80 мг х 3 раза в день), мочегонные (верошпирон 50 мг в сутки), блокаторы 5-ФДЭ (силденафил 50 мг х 2 раза в день), антибактериальная терапия, обезболивающая терапия, ингаляции лазолвана, ингаляции увлажненного кислорода.
В послеоперационном периоде при контрольной ЭхоКГ – уменьшение размеров дилатированного правого желудочка до 3,1 см, гипертрофия правого желудочка (передняя стенка – 0,6 см), уменьшение объема правого предсердия – 90,0 мл, диаметр легочной артерии – 3,0 см, легочная гипертензия 1-й степени, систолическое давление в легочной артерии 48 мм рт. ст., зон нарушения локальной сократимости не выявлено. Фракция выброса – 58% (табл.)
СКТ сосудов грудной клетки в послеоперационном периоде – полная проходимость левой легочной артерии, контрастирование легочных артерий до сегментарного уровня (рис. 10, 11).
Выписана пациентка в удовлетворительном
Динамика изменений показателей ЭхоКГ
Таблица
|
Время выполнения ЭхоКГ |
2 мес. до операции |
5 дней до операции |
2-е сутки после операции |
4-е сутки после операции |
5-е сутки после операции |
8-е сутки после операции |
16-е сутки после операции |
36-е сутки после операции |
|
Размер правого желудочка, см |
4,45 |
4,8 |
- |
4,0 |
4,1 |
4,1 |
3,8 |
3,1 |
|
Толщина передней стенки правого предсердия, см |
1,0 |
0,6 |
- |
- |
- |
- |
0,72 |
0,6 |
|
Объем правого предсердия, мл |
138,0 |
120,0 |
86,0 |
98,0 |
81 |
92 |
81 |
90,0 |
|
Диаметр ствола легочной артерии, см |
3,2 |
3,1 |
- |
- |
- |
- |
2,8 |
3,0 |
|
Систолическоедавление в легочной артерии, мм.рт.ст. |
114 |
71 |
95 |
78 |
85 |
83 |
71 |
48 |
|
Фракция выброса, % |
52 |
64 |
56 |
54 |
58 |
56 |
64 |
58 |
состоянии на 16-е сут после операции.
Заживление послеоперационной раны первичным натяжением без признаков воспаления.
Жалоб, в том числе, на одышку при физической нагрузке, на момент выписки не предъявляла. В настоящее время пациентка работает, ведет активный образ жизни.
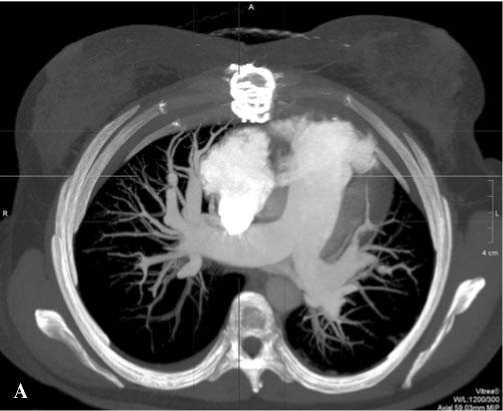
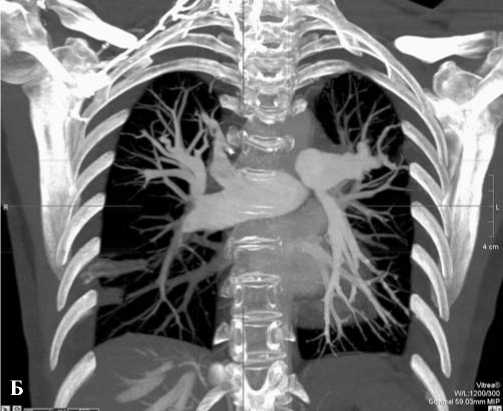
Рис. 10. СКТ сосудов грудной клетки после операции (А – сагиттальный срез, Б – фронтальный срез)
Необходимо отметить, что 9-летний период высокой легочной гипертензии привел к ремоделированию периферического сосудистого русла обоих легких, утолщению стенок и сужению просвета артериол и капилляров, поэтому
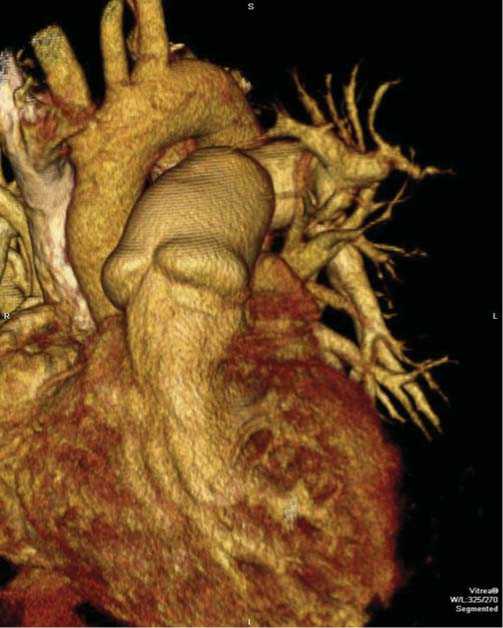
Рис. 11. СКТ сосудов грудной клетки после операции, 3-х мерная конструкция.
в таких случаях невозможно рассчитывать на нормализацию легочного АД.
В заключение следует отметить, что успешное выполнение подобного высокотехнологичного вмешательства возможно только при условии преемственности и содружественного ведения больных врачами разных специальностей – пульмонологами, кардиологами, сосудистыми и кардиохирургами, анестезиологами-реаниматологами в рамках четкого внутреннего протокола.
Проведение операций в таком объеме возможно в рамках федеральных квот по высокотехнологичной медицинской помощи (ВТМП), однако пред- и послеоперационное ведение больных с применением современных эффективных препаратов (силденафил, босентан) до последнего времени не регламентировано федеральными стандартами и порядками оказания медицинской помощи, что значительно ограничивает их назначение из-за высокой стоимости.
Список литературы Первый опыт хирургического лечения хронической тромбоэмболической легочной гипертензии
- Dartevelle P., Fadel E., Mussot S. et al. Chronic thromboembolic pulmonary hypertension//Eur. Respir. J. 2004. Vol. 23 (4). P. 637-648.
- Fedullo P.F., Auger W.R., Kerr K.M., Rubin L.J. Chronic thromboembolic pulmonary hypertension//N. Engl. J. Med. 2001. Vol. 345 (20). P. 1465-1472.
- Moser K.M., Auger W.R., Fedullo P.F. Chronic major-vessel thromboembolic pulmonary hypertension//Circulation. 1990. Vol. 81 (6). P. 1735-1743.
- Moser K.M., Auger W.R., Fedullo P.F., Jamieson S.W. Chronic thromboembolic pulmonary hypertension: clinical picture and surgical treatment//Eur. Respir. J. 1992. Vol. 5 (3). P. 334-342.
- Kearon C. Natural history of venous thromboembolism//Circulation. 2003. Vol. 107 (23 Suppl. 1). P. I22-I30.
- Fedullo P.F., Auger W.R., Channick R.N. et al. Chronic thromboembolic pulmonary hypertension//Clin. Chest Med. 2001. Vol. 22 (3). P. 561-581.
- Fedullo P., Kerr K.M., Kim N.H., Auger W.R. Chronic thromboembolic pulmonary hypertension//Am. J. Respir. Crit. Care Med. 2011. Vol. 183 (12). P. 1605-1613.
- Сб. "Новые технологии в сердечно-сосудистой хирургии и интервенционной кардиологии". VI научные чтения, посвященные памяти академика РАМН Е.Н. Мешалкина
- Lewczuk J., Piszko P., Jagas J. et al. Prognostic factors in medically treated patients with chronic pumonary embolism//Chest. 2001. Vol. 119 (3). P. 818-823).
- Dunning J., McNeil K. Pulmonary thromboendarterectomy for chronic thromboembolic pulmonary hypertension//Thorax. 1999. Vol. 54 (9). P. 755-756.
- Bergin C.J., Sirlin C., Deutsch R. et al. Predictors of patient response to pulmonary thromboendarterectomy//AJR Am. J. Roentgenol. 2000. Vol. 174 (2). P. 509-515.


