Первый опыт этапного лечения ребенка грудного возраста с синдромом гетеротаксии и тотальным аномальным дренажем легочных вен в сочетании с единственным желудочком сердца и атрезией легочной артерии: клинический случай
Автор: К.Н. Куатбеков, А.В. Мишин, А.Д. Сепбаева, Г.С. Нигай, Д.М. Канжигалин
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Случаи из клинической практики
Статья в выпуске: 2 т.26, 2022 года.
Бесплатный доступ
Сочетание врожденных пороков сердца моножелудочкового типа кровообращения с тотальным аномальным дренажем легочных вен и атрезией легочной артерии — редкая патология с крайне тяжелым течением и самой высокой летальностью среди всех врожденных пороков сердца. В работе описан клинический случай успешного первого опыта двухэтапного лечения ребенка грудного возраста с тотальным аномальным дренажем, единственным желудочком сердца и атрезией легочной артерии в Республике Казахстан. Для коррекции тотального аномального дренажа применили технику первичной бесшовной пластики (англ. primary sutureless repair), которую в Национальном научном медицинском центре используют в качестве первичной. Ввиду тяжелой анатомии порока при первичной операции использовали необычную область наложения дистального конца центрального системно-легочного анастомоза, ассоциированную с высокими хирургическими рисками: устье отсеченного открытого артериального протока в области бифуркации легочной артерии. Из-за дополнительного препятствия к легочному кровотоку в виде устьевого стеноза левой ветви легочной артерии выполнили одномоментную расширяющую пластику бифуркации ветвей легочной артерии аутоперикардом. При повторной операции впервые столкнулись с грозным осложнением в виде повреждения аорты, благодаря экстренным действиям оно не стало фатальным. При формировании анастомоза по Гленну выполнили наиболее предпочтительное расширение гипоплазированных ветвей легочной артерии пластикой собственными тканями верхней полой вены.
Атрезия легочной артерии, единственный желудочек, клинический случай, тотальный аномальный дренаж легочных вен
Короткий адрес: https://sciup.org/142232026
IDR: 142232026 | DOI: 10.21688/1681-3472-2022-2-73-78
Текст научной статьи Первый опыт этапного лечения ребенка грудного возраста с синдромом гетеротаксии и тотальным аномальным дренажем легочных вен в сочетании с единственным желудочком сердца и атрезией легочной артерии: клинический случай
Цитировать: Куатбеков К.Н., Мишин А.В., Сепбаева А.Д., Нигай Г.С., Канжигалин Д.М. Первый опыт этапного лечения ребенка грудного возраста с синдромом гетеротаксии и тотально-аномальным дренажем легочных вен в сочетании с единственным желудочком сердца и атрезией легочной артерии: клинический случай. Патология кровообращения и кардиохирургия. 2022;26(2):73-78. https:// org/10.21688/1681-3472-2022-2-73-78
К.Н. Куатбеков, А.В. Мишин, А.Д. Сепбаева, Д.М. Канжигалин,
Сочетание тотального аномального дренажа легочных вен (ТАДЛВ) и врожденных пороков сердца с уменьшенным легочным кровотоком — исключительно редкая патология с крайне тяжелым течением. Летальность при хирургической коррекции ТАДЛВ пациентов с гетеротаксией и моножелудоч-ковым кровообращением самая высокая среди всех коррекций единственного желудочка сердца: до 54 % [1; 2]. По данным центра Mount Fuji Shizuoka Children’s Hospital, с 1998 по 2015 г. среди 48 прооперированных пациентов с ТАДЛВ и единственным желудочком сердца в 50 % случаев (n = 24) у больных была атрезия легочной артерии [3]. По данным M. Sugano и соавт., для паллиативной коррекции чаще всего формируют подключично-легочный шунт или анастомоз из единственного желудочка в легочную артерию. Мы представляем клинический случай лечения пациента с редким сочетанным пороком сердца: ТАДЛВ с единственным желудочком сердца и атрезией легочной артерии с выраженной гипоплазией легочного русла, — которому поэтапно выполнили коррекцию ТАДЛВ бесшовным методом с центральным анастомозом в устье артериального протока и анастомоз по Гленну с пластикой легочной артерии [3].
Цель — описать первый опыт двухэтапного лечения ребенка грудного возраста с ТАДЛВ в сочетании с единственным желудочком сердца и атрезией легочной артерии на базе трех медицинских центров Республики Казахстан.
Клинический случай
Девочка, вес при рождении 2,3 кг. Порок сердца диагностирован с рождения. В возрасте 2 недель госпитализирована в Национальный научный медицинский центр (ННМЦ) (Нур-Султан, Республика Казахстан) с диагнозом: situs inversus. Праворасположенное левосформированное сердце. ТАДЛВ, супракардиальная форма. Атриовентрикулярный септальный дефект, полная форма, несбалансированный тип по типу единственного желудочка сердца. Атрезия легочной артерии 1-го типа. Устьевой стеноз левой легочной артерии. Открытый артериальный проток. Легочная гипертензия. Синдром ге-теротаксии, аспления. Выписали под наблюдение кардиолога, через месяц в связи со снижением сатурации до 55 % экстренно выполнили оперативный первый этап: коррекцию ТАДЛВ, расширяющую пластику бифуркации легочной артерии, наложение центрального системно-легочного анастомоза.
Грудину закрыли. Общая продолжительность искусственного кровообращения составила 231 мин, ишемии миокарда 53 мин, циркуляторного ареста 2 мин.
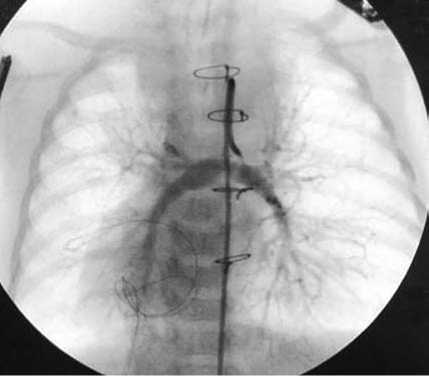
Рис. 2. Контрольное зондирование через 7 дней после первичной операции: центральный системно-легочный анастомоз функционирует, ветви легочной артерии расширены адекватно
По данным эхокардиографии в первые послеоперационные сутки, анастомоз в левое предсердие впадает без обструкций с градиентом 5 мм рт. ст. Сосудистый анастомоз в легочную артерию впадает диаметром 4,5 мм со скоростью 1,2 м/с, градиент давления 10 мм рт. ст. Через неделю выполнили катетеризацию полостей сердца (рис. 2): аорто-легочный анастомоз функционирует. Отметили замедленное контрастирование верхней правой легочной артерии. В фазе левограммы легочные вены впадают в полость левого предсердия, данных о стенозе коллектора нет.
Через месяц после операции ребенка выписали в удовлетворительном состоянии. По прошествии 9 мес. приняли на плановую госпитализацию. По данным эхокардиографии, системно-легочный анастомоз функционирует. Легочные вены впадают без обструкции с градиентом 5 мм рт. ст. Компьютерная томография (рис. 3) показала впадение легочных вен в полость инверсированного левого предсердия. Функционирующий сосудистый шунт от восходящей аорты к легочной артерии. Признаков обтурационных, стенотических изменений, аномалий со стороны коронарных артерий не определили.
Для определения показаний ко второму этапу гемодинамической коррекции выполнили катетеризацию сердца: стеноз устья левой ветви легочной артерии. Давление в мм рт. ст.: рудимент ствола и проксимальный сегмент легочной артерии 33/12, среднее 21; средний сегмент 21/10, среднее 12; левый желудочек 80/3; грудная аорта 80/52.
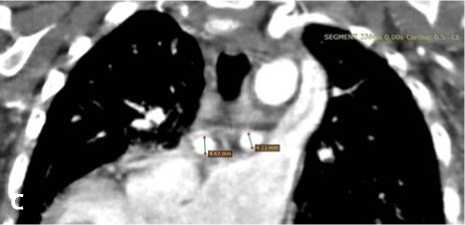
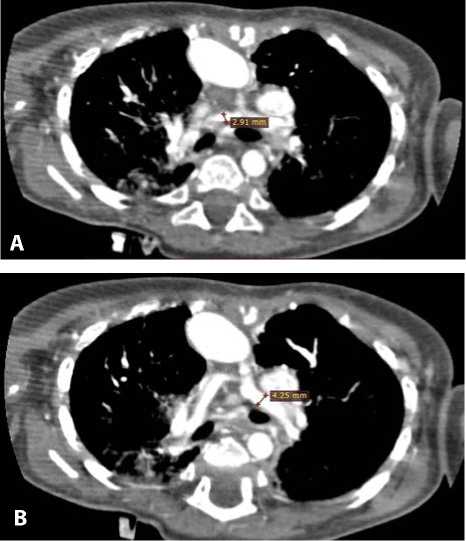
Рис. 3. Компьютерная ангиография: левая ветвь легочной артерии с сужением до 2,9 мм (Z-score 3,75) в аксиальной проекции (A); правая ветвь легочной артерии диаметром 4,25 мм (Z-score 1,99) в аксиальной проекции (B); максимальные участки за бифуркацией легочных ветвей (правая 4,67 мм, левая 4,11 мм) во фронтальной проекции (C)
Совместно со специалистами двух клиник на базе Центра перинатологии и детской кардиохирургии 22.09.2021 г. выполнили операцию Гленна. При рестернотомии, когда оставалась нерас-сеченной только рукоятка грудины, повредили аорту. С таким грозным осложнением столкнулись впервые, благодаря экстренным действиям оно не стало фатальным. Учитывая тяжелое осложнение, полученное при рестернотомии, и необходимость при этом экстренного входа в искусственное кровообращение, практически всю операцию выполняли на параллельном искусственном кровообращении, включая кардиолиз, который обычно проводят до канюляций, что увеличило время искусственного кровообращения до 407 мин, а общее время операции до 9 ч и утяжелило ранний послеоперационный период. При формировании анастомоза по Гленну выполнили наиболее предпочтительное расширение гипоплазированных ветвей легочной артерии пластикой собственными тканями верхней полой вены. Завершили операцию оставлением открытой грудины и установкой перитонеального дренажа. На 2-е послеоперационные сутки грудину закрыли, на 12-е сутки ребенка экстубировали. В раннем послеоперационном периоде наблюдалась клиника релаксации левого купола диафрагмы, не потребовавшая ее пликации. По данным электрофизиологического исследования глаз через 2 недели после экстубации отметили гипоксически-ишемическое поражение зрительного анализатора на уровне центрального нейрона затылочной доли головного мозга. Характер регистраций электрофизиологического исследования позволяет прогнозировать положительную динамику, ребенок видит. На 33-е сут. после операции пациента перевели в профильное отделение с сатурацией 73 %, на 51-е сут. выписали под наблюдение кардиолога по месту жительства с сатурацией 70–80 %. В будущем планируется 3-й этап оперативного лечения — операция Фонтена.
Обсуждение
Высокая смертность лечения ТАДЛВ с гетеротак-сией и моножелудочковым кровообращением может быть связана с более сложными физиологическими и анатомическими аномалиями, ранним возрастом детей при хирургическом вмешательстве и повышенным риском послеоперационной обструкции легочных вен с сопутствующей аспленией [4]. M.S. Khan и соавт. [5] продемонстрировали раннюю смертность 43 % (из 167 пациентов). M. Yong и соавт. [1] сообщили о столь же высокой ранней смертности (42 %) у новорожденных с мо-ножелудочковым кровообращением, подвергшихся коррекции ТАДЛВ. В среднем даже в крупном кардиохирургическом центре встречаемость этого контингента пациентов составляет не более 1–2 в год, что в среднем соответствует 0,2 % от всех операций.
Первый этап оперативного вмешательства после коррекции ТАДЛВ осуществили одномоментной аутопластикой дополнительного (помимо легочной атрезии) препятствия к легочному кровотоку: устьевого стеноза левой ветви легочной артерии. С учетом сложной топографической архитектони- ки порока выбрали редко применяемый в таких случаях тип центрального анастомозирования: восходящая аорта – расширенная бифуркация легочной артерии, а также опасный участок наложения его дистального соединения: устье иссеченного открытого артериального протока. С учетом необычной анатомии с относительно глубоким ходом брахиоцефальных сосудов, отходящих от задней стенки дуги аорты, широкой поперечной веной прикрывавшей их сверху, посчитали, что наложение классического анастомоза по Блелок – Тауссиг будет иметь высокий риск перегиба со сдавлением последнего. Вектор созданного шунта приходился в точную позицию легочного устья отсеченного протока, который является неблагоприятным участком ввиду ненадежности каркаса сосудистой стенки, однако анатомо-топографически идеально подходящим местом равномерно распределяющего потока по обеим ветвям легочной артерии. Прямой высокообъемный центрально-легочный анастомоз с удобным вектором дистального анастомозирования в неблагоприятную зону иссеченного Ботал-лова протока позволил изолированно выполнить расширяющую пластику легочной артерии с равномерным распределением легочного кровотока без развития легочной гипертензии. Максимальное удаление некомпетентных сосудистых тканей ложа дистального анастомоза, наложение более дистальных швов на надежных участках способствовало гарантированной состоятельности соединения.
При подготовке ко второму этапу операции провели компьютерную томографическую ангиографию, видели необычно близко расположенную восходящую аорту, интимно спаянную с грудиной, однако решили идти обычным доступом без предварительной периферической канюляции с началом искусственного кровообращения до стернотомии, посчитав, что увеличение продолжительности искусственного кровообращения при такой тактике приведет к нежелательным эффектам. Это стало тактической ошибкой. После остановки кровотечения при основном этапе удалось субтотально, практически до долевых бифуркаций, добиться рерасширения системы легочных артерий собственными тканями верхней полой вены, что приоритетно для обеспечения благоприятного роста анастомозированного участка с меньшим риском рестенозирования, а также более широкой площади наложения будущего анастомоза по Фонтену. Слаженная и своевременная работа команды при фатальном осложнении в виде разрыва аорты привела к успешному результату.
ТАДЛВ корригировали методом первичной бесшовной пластики. По ряду преимуществ многие центры используют его для первичной коррекции практически любой формы ТАДЛВ [6]. Техника позволила существенно сократить время ишемии миокарда и минимизировать неблагоприятную общую продолжительность искусственного кровообращения при тяжелом пороке. В ННМЦ всем пациентам с ТАДЛВ помимо эхокардиографии назначают компьютерную томографию, которая позволяет провести полноценную диагностику с преимуществами перед зондированием полостей сердца, особенно в неонатальном периоде [7; 8].
С учетом небольшого объема операций по коррекции врожденных пороков сердца, выполняемых в ННМЦ (не более 200 с искусственным кровообращением), за последние 10 лет мы впервые столкнулись с таким уникальным пороком и выполнили две его хирургические коррекции на базе трех медицинских центров.
Заключение
В связи с анатомической сложностью порока неординарные хирургические приемы выбора типа центрально-легочного анастомоза и топики его наложения гемодинамически доказали эффективность и адекватность кровоснабжения пульмо-нарного ангиорусла без развития легочной гипертензии. Максимальное применение тканей верхней полой вены in situ при формировании анастомоза по Гленну создало благоприятные условия для третьего хирургического этапа моножелудочковой коррекции.
Список литературы Первый опыт этапного лечения ребенка грудного возраста с синдромом гетеротаксии и тотальным аномальным дренажем легочных вен в сочетании с единственным желудочком сердца и атрезией легочной артерии: клинический случай
- Yong M.S., Zhu M.Z.L., d’Udekem Y., Konstantinov I.E. Outcomes of total anomalous pulmonary venous drainage repair in neonates with univentricular circulation. Interact Cardiovasc Thorac Surg. 2018;27(5):756-760. PMID: 29757371. https://doi.org/10.1093/icvts/ivy159
- Okamoto T., Nakano T., Goda M., Oda S., Kado H. Outcomes of systemic-to-pulmonary artery shunt for single ventricular heart with extracardiac total anomalous pulmonary venous connection. Gen Thorac Cardiovasc Surg. 2021;69(4):646-653. PMID: 32886275. https://doi.org/10.1007/s11748-020-01474-4
- Sugano M., Murata M., Ide Y., Ito H., Kanno K., Imai K., Ishidou M., Fukuba R., Sakamoto K. Midterm results and risk factors of functional single ventricles with extracardiac total anomalous pulmonary venous connection. Gen Thorac Cardiovasc Surg. 2019;67(11):941-948. PMID: 31134530. https://doi.org/10.1007/s11748-019-01141-3
- Alsoufi B., McCracken C., Schlosser B., Sachdeva R., Well A., Kogon B., Border W., Kanter K. Outcomes of multistage palliation of infants with functional single ventricle and heterotaxy syndrome. J Thorac Cardiovasc Surg. 2016;151(5):1369-1377.e2. PMID: 27085618. https://doi.org/10.1016/j.jtcvs.2016.01.054
- Khan M.S., Bryant R. 3rd, Kim S.H., Hill K.D., Jacobs J.P., Jacobs M.L., Pasquali S.K., Morales D.L.S. Contemporary outcomes of surgical repair of total anomalous pulmonary venous connection in patients with heterotaxy syndrome. Ann Thorac Surg. 2015;99(6):2134-2139; discussion 2139-2140. PMID: 25912749. https://doi.org/10.1016/j.athoracsur.2015.02.035
- Теплов П.В., Титов А.М., Миллер А.Ю., Сакович В.А., Дробот Д.Б., Морозов А.А. Сравнение прямого анастомоза и «бесшовной техники» при радикальной коррекции тотального аномального дренажа легочных вен. Клиническая и экспериментальная хирургия. Журнал имени академика Б.В. Петровского. 2021;9(3 Suppl):33-36. https://doi.org/10.33029/2308-1198-2021-9-3suppl-33-36
- Teplov P.V., Titov A.M., Miller A.Yu., Sakovich V.A., Drobot D.B., Morozov A.A. Comparison of direct anastomosis and "sutureless" technique for radical correction of total anomaly drainage of pulmonary veins. Clinical and Experimental Surgery. Petrovsky Journal. 2021;9(3 Suppl):33-36. (In Russ.) https://doi.org/10.33029/2308-1198-2021-9-3suppl-33-36
- Gözgeç E., Kantarci M., Guven F., Ogul H., Ceviz N., Eren S. Determination of anomalous pulmonary venous return with high-pitch low-dose computed tomography in paediatric patients. Folia Morphol (Warsz). 2021;80(2):336-343. PMID: 32459365. https://doi.org/10.5603/FM.a2020.0054
- Xiong L., Patel M.D., Biliciler-Denktas G., Dodge-Khatami A., Salazar J., Adebo D.A. Perioperative anomalous pulmonary venous return evaluation with low-dose cardiac computed tomography. World J Pediatr Congenit Heart Surg. 2021;12(4):529-534. PMID: 34278867. https://doi.org/10.1177/21501351211010115


