Первый опыт применения метода структурно-резонансной терапии в комплексном лечении больных острым панкреатитом
Автор: Дятчина Галина Владимировна, Алехнович Алексей Владимирович, Иванов Юрий Викторович
Журнал: Хирургическая практика @spractice
Рубрика: Клинические исследования
Статья в выпуске: 4, 2012 года.
Бесплатный доступ
Впервые в комплексном лечении больных острым панкреатитом (ОП) использован новый метод - структурно-резонансной терапии (СРТ). Метод основан на использовании электромагнитного излучения и электрического тока в определенном частотном ритме функционирования живой ткани, что способствует оптимизации деятельности биообъекта на субклеточном, клеточном, тканевом, органном, системном и организменном уровнях. Применение СРТ позволило уменьшить сроки купирования основных клинических симптомов ОП и быстрее нормализовать лабораторные показатели, что привело к сокращению сроков госпитализации и расходов на медикаментозное лечение. Метод СРТ патогенетически обоснован, прост в исполнении и не требует больших финансовых затрат, что делает возможным его широкое применение в клинической практике у больных ОП.
Острый панкреатит, структурно-резонансная терапия, поджелудочная железа, биоритм, аппарат "рематерп", спонтанная биопотен- циальная активность, частота сигнала, болевой синдром
Короткий адрес: https://sciup.org/142211489
IDR: 142211489
Текст научной статьи Первый опыт применения метода структурно-резонансной терапии в комплексном лечении больных острым панкреатитом
В настоящее время проблема лечения острого панкреатита (ОП) продолжает оставаться одной из наиболее сложных и дискутабельных вопросов ургентной хирургии [1, 3, 8, 11, 12, 18]. Это обусловлено значительным ростом заболеваемости ОП и сохраняющейся одной из самых высоких послеоперационной летальностью (12–87%) среди всех ургентных хирургических заболеваний [1, 11].
В России ОП прочно занимает 2-е место в общей структуре ургентной абдоминальной патологии, уступая лишь острому аппендициту [3, 11, 12]. В 60–90% случаях развивается отечная форма ОП, требующая лишь минимальной поддерживающей терапии [8, 9, 14]. Однако у 10–40% больных наблюдается деструктивный ОП – панкреонекроз, характеризующийся развитием системных или местных осложнений, в результате которых летальность может достигать 40–70% [1, 9, 10, 11, 17].

Такой разброс статистических данных развития деструктивных форм ОП обусловлен не только особенностью заболеваемости населения в том или ином регионе страны, возможностью клиник своевременно диагностировать данное заболевание и оказывать специализированную помощь, но и эффективностью комплексной консервативной терапии ОП на начальных стадиях заболевания.
Увеличение заболеваемости ОП обусловлено многообразием причин, приводящих к развитию данной патологии, а так же ростом употребления алкоголя среди населения и низкой эффективностью консервативной терапии. По данным отечественных и зарубежных исследователей, имеется около 140 разнообразных факторов, которые могут явиться причиной ОП [12, 14, 18]. Предложен целый ряд теорий патогенеза, объясняющих механизм этого заболевания, однако до настоящего времени не существует единой общепризнанной патогенетической концепции развития ОП [8, 10, 11].
В настоящее время, помимо разработки и совершенствования хирургических методик лечения, продолжается непрерывный поиск методов и средств медикаментозного и физического воздействия на патологические процессы, происходящие в организме при ОП с целью профилактики возникновения тяжелых форм заболевания.
В 40–42% случаев воспалительно-дегенеративный процесс в поджелудочной железе (ПЖ) переходит в хроническую форму [12, 16]. Если учитывать, что в России 70% больных ОП – лица активного трудоспособного возраста, то становится очевидной огромная социально-экономическая значимость этой проблемы, а неудовлетворительные результаты лечения требуют критической оценки его методов.
Поэтому проблема успешного лечения данного заболевания является приоритетным направлением научных изысканий многих клиник, где оказывается экстренная хирургическая помощь.
В первое десятилетие ХХI века за рубежом, а затем и в России в комплексном лечении многих острых хирургических заболеваний стали активно использовать и новые методики физического воздействия на основные звенья патогенеза заболеваний. Большой интерес представляет научное обоснование применения немедикаментозных технологий, среди них важное значение имеют методы физиотерапии, устраняющие вегетативный, метаболический и электролитный дисбаланс, которые являются определяющими при многих заболеваниях, в том числе и при ОП.
Однако до настоящего времени ни один из видов информационно-волновых воздействий не применялся при данном заболевании с учетом частотной характеристики функционирования того или иного органа.
В России одной из успешных отечественных разработок в данном направлении явился предложенный новый метод лечения, основанный на синхронизации ритмов действующего фактора и соответствующей функциональной системы – структурно-резонансная терапия (СРТ) [4, 6]. Интересным в этом плане представляется СРТ, основанная на использовании электромагнитного излучения и электрического тока в определенном частотном ритме функционирования живой материи, что способствует оптимизации деятельности биообъекта на субклеточном, клеточном, тканевом, органном, системном и организменном уровнях.
В экспериментах доказаны обезболивающий, противовоспалительный, противоотечный, репаративный, иммуномодулирующий и трофический эффекты магнитотерапии [7]. Учеными-биофизиками установлено наличие определенных колебательных движений клеток различных органов человека, которые возможно зарегистрировать с помощью прибора – биопотенциалографа. При дальнейшем анализе была получена интегральная частота автоколебаний 0,0108 Гц (период 93 секунды) и доказано, что каждый орган сокращается относительно данной частоты определенное количество раз, кратное 2 или 3. Этим процессам, происходящим в организме, был присвоен термин спонтанная биопотенциальная активность (СБА) [5]. Основываясь на свойствах колебательных процессов в нелинейных системах, где реализация на выходе собственной частоты Fω колебаний нелинейной системы возникает при воздействии близких к ней индуцированных экзогенных частот F [4], были разработаны аппараты для проведения сеансов СРТ. Исследователи предполагают, что во время работы аппарата СРТ подаваемый сигнал строго определенной частоты на тело человека создает строго определенное магнитное поле, резонансное СБА, восстанавливая, таким образом, нормальное функционирование органов и тканей, согласно свойствам колебательных систем. Режимы работы таких аппаратов, необходимые для достижения требующегося лечебного эффекта при различных заболеваниях, были отработаны и установлены экспериментально [2, 13].
В клинической практике метод СРТ уже доказал свою эффективность в комплексном лечении пациентов с гинекологическими, неврологическими и ревматологическими заболеваниями [2, 4, 6, 13]. По мнению ряда авторов [4, 6], в условиях стационара наиболее простым и удобным в применении является аппарат «Рематерп» (рис. 1). В отличие от других аппаратов данного класса, «Рематерп» обладает возможностью автоматического (по специальной программе) изменения частоты подаваемого сигнала с целью создания резонанса с СБА различных органов и структур организма [13].
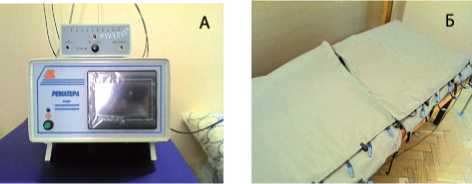
Рис. 1. Аппарат «Рематерп» для проведения СРТ. А – электронный блок аппарата, подающий сигнал определенной частоты; Б – материал, проводящий сигнал и непосредственно соприкасающийся с пациентом

В клинике при использовании метода СРТ в комплексном лечении ряда заболеваний были достигнуты следующие эффекты [2, 7]:
-
- быстрое купирование местных симптомов воспаления;
-
- уменьшение экссудативных явлений, отечности мягких тканей;
-
- купирование болевого синдрома;
-
- улучшение микроциркуляции тканей;
-
- нормализация сосудистого тонуса;
-
- физическое заживление дефектов, без грубых рубцовых изменений;
-
- достижение стойкой ремиссии заболеваний.
Учитывая основные звенья патогенеза и фаз течения ОП, а также принимая во внимание возможности метода СРТ в купировании отека, улучшении микроцикуляции, нормализации тонуса и работы кишечника, восстановлении нормального (генетически обусловленного) функционирования вегетативной нервной системы, можно было предположить получение положительного клинического эффекта при использовании данного метода в комплексном лечении пациентов с ОП. Результаты, полученные при физикобиологических исследованиях, послужили теоретическим обоснованием для использования этого метода в клинической практике.
Целью исследования явилась оценка возможности и эффективности применения в комплексном лечении больных ОП нового метода – структурно-резонансной терапии.
Материал и методы
В настоящее рандомизированное сравнительное проспективное плацебо-контролированное исследование были включены 144 пациента, проходивших лечение в отделении хирургии ФНКЦ ФМБА России в период с 2010 по 2012 гг. с клиническим диагнозом ОП.
Основную группу составили 84 больных, которым впервые в комплексном лечении заболевания использовали метод СРТ. В группу сравнения включены 60 больных, в комплексной терапии которых применяли плацебо имитацию метода СРТ без включения активного режима. Обе исследуемые группы были репрезентативны и сопоставимы по полу, возрасту, сроку заболевания и основным клинико-лабораторным показателям.
В основной группе были 51 мужчина (60,7%) и 33 женщины, средний возраст – 51,2±4,7 лет. Группу сравнения составили 36 мужчин (60%) и 24 женщины, средний возраст – 53,1±5,2 лет.
Распределение пациентов по тяжести ОП представлено в табл. 1.
Средние сроки заболевания до момента госпитализации в стационар в основной группе составили 2,4±1,2 сут., в группе сравнения – 2,5±0,9 сут. На догоспитальном этапе 68% пациентов основной группы и 62% больных из группы сравнения принимали лекарственные препараты (спазмолитические, антиферментные, анальгетические и др. препараты).
Этиологическими факторами, вызвавшими ОП, были: алиментарный (погрешность в диете, употребление алкоголя) и билиарный (патология желчных путей) (табл. 2).
Таблица 1
Распределение больных обеих групп по тяжести заболевания
|
Группы больных |
Тяжесть заболевания |
Всего больных |
|
|
легкая |
средняя |
||
|
Основная группа |
62 (73,8%) |
22 (26,2%) |
84 |
|
Группа сравнения |
42 (70%) |
18 (30%) |
60 |
Таблица 2
Этиологические факторы развития ОП в исследуемых группах
|
Этиологический фактор |
Основная группа (n=84) |
Группа сравнения (n=60) |
||
|
абс. |
% |
абс. |
% |
|
|
Алиментарный |
55 |
65,5 |
38 |
63,3 |
|
Билиарный |
29 |
34,5 |
22 |
36,7 |
Клинический диагноз ОП устанавливали на основании анамнеза, клинической картины заболевания, данных клинических, инструментальных и лабораторных обследований, а также диагностической лапароскопии.
Из инструментальных методов диагностики у всех больных обеих групп использовали рентгенографию органов грудной клетки и обзорную рентгенографию органов брюшной полости, ультразвуковое исследование (УЗИ) органов брюшной полости и забрюшинного пространства, компьютерную томографию (КТ) с болюсным контрастным усилением, электрокардиографию. По показаниям выполняли эзофагогастродуоденоскопию (ЭГДС) и эндоскопические вмешательства на большом дуоденальном сосочке и общем желчном протоке (папиллос-финктеротомия, эндоскопическая литэкстракция, назобили-арное дренирование). В основной группе ЭГДС выполнено 36 больным (42,9%), а эндоскопические вмешательства у 22 пациентах (26,2%), тогда как в группе сравнения соответственно у 25 (41,7%) и 16 (26,7%) больных.
Во всех наблюдениях из лабораторных методов исследования, помимо общих анализов крови и мочи, биохимического анализа крови, развернутой коагулограммы, наибольшее внимание уделяли изучению и анализу в динамике следующих показателей: уровню лейкоцитов в крови и состав лейкоцитарной формулы, уровню панкреатической амилазы в крови и диастазы в моче, уровням общего и прямого билирубина, мочевины и креатинина, глюкозы, аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ) и щелочной фосфатазы (ЩФ). По показаниям, у части больных (13 пациентов основной группы и 6 больных группы сравнения) определяли уровень С-реактивного белка и выполняли прокальцитонино-вый тест в динамике.
Диагностическая лапароскопия выполнена 28 пациентам основной группы (33,3%) и 12 больным из группы сравнения (20%). Показанием к лапароскопии являлись: 1) сомнения в диагнозе ОП; 2) исключение другой или сопутствующей острой патологии органов брюшной полости, требующей оперативно-
го лечения; 3) верификация формы и стадии заболевания. Помимо диагностического фактора лапароскопия в большинстве случаев носила и лечебный характер. Так, у 16 из 28 больных основной группы и у 7 из 12 пациентов группы сравнения лапароскопия включала в себя: санацию и удаление токсического выпота из брюшной полости и сальниковой сумки, установку дренажей в брюшную полость, катетеризацию круглой связки печени и последующим введением анальгетических растворов. Кроме того, у 6 больных во время лапароскопии было произведено чрескожное чреспеченочное дренирование желчного пузыря с целью ликвидации билиарной гипертензии (рис. 2).
Оценку тяжести ОП при поступлении в стационар проводили с помощью интегральной шкалы тяжести физиологического состояния (ТФС) [12], а также по данным компьютерной томографии в системе Balhtasar (табл. 3).
Для исследования были отобраны пациенты только с легкой или средней степенью
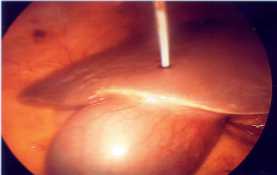
Рис. 2. Интраоперационный вид выполненной при лапароскопии чрескожной чреспеченочной холецистостомии
тяжести ОП с целью более точного определения лечебного эффекта метода СРТ, так как при лечении пациентов с тяжелыми формами ОП, перенесших традиционные операции (лапаротомию), оценить эффективность данного метода среди прочих довольно трудно.
Критерии включения пациентов с ОП в исследование были следующими:
-
1 Мужчины и женщины в возрасте 18–70 лет.
-
2. Установленный при поступлении и подтвержденный инструментальными и лабораторными исследованиями диагноз острого панкреатита легкой или средней степени тяжести.
-
3. Тяжесть заболевания по шкале Balhtasar В, С, D, по шкале ТФС от 2 до 4 баллов при легкой, и от 5 до 8 баллов – при средней тяжести ОП.
-
4. Возможность проведения комплексного лечения без выполнения открытых хирургических операций.
-
5. Наличие письменного информированного добровольного согласия пациента на применение метода СРТ в комплексном лечении.
Таблица 3
Распределение пациентов обеих групп по тяжести ОП в системе Balhtasar
Группа
Степень тяжести ОП
A
B
C
D
E
Основная (n=84)
0
49 (58,3%)
23 (27.4%)
12 (14,3%)
0
Сравнения (n=60)
0
38 (63,3%)
15 (25%)
7 (11,7%)
0
К критериям исключения пациентов с ОП из исследования относили:
-
1. Отсутствие любого из критериев включения.
-
2. Необходимость выполнения открытой хирургической операции.
-
3. Беременность, кормление грудью.
-
4. Тяжелые сопутствующие заболевания: иммунодефицит, диабет, декомпенсированная печеночная и почечная недостаточность.
-
5. Злокачественные опухоли любой локализации и стадии или обоснованное подозрении на онкопатологию.
Комплексное лечение в обеих группах включало в себя: индивидуальную тактику лечения ОП в зависимости от его этиологии (автономный или билиарный), создание физиологического покоя ПЖ, купирование болевого синдрома (эпидуральная анестезия), зондирование и аспирацию желудочного содержимого, интенсивную терапию (направленную на восстановление гемодинамики, регидратацию, коррекцию нарушений КОС, поддержание оптимального уровня доставки кислорода), блокаду секреторной функции ПЖ (октреотид), противоязвенную терапию.
Октреотид (сандостатин) вводили подкожно из расчета 100 мкг 3 раза в день при легкой тяжести заболевания и по 200 мкг 3 раза в день – при средней тяжести, в течение 3–7 суток от момента поступления.
По показаниям проводили антибактериальную и нутритивную терапию, кишечный лаваж, экстракорпоральную детоксикацию (метод низкопоточной гемофильрации), а также лечебную лапароскопию или пункцию жидкостных образований в брюшной полости под контролем УЗИ или КТ.
Нутритивную поддержку осуществляли через назо-еюнальный зонд, установленный дистальнее связки Трейца эндоскопическим способом или во время операции. Питательные смеси – стандартные: берламин, нутризон, нутрилан, ну-тридринк и др. Режим энтерального питания – стартовый по темпу и объему, с постепенным переходом от глюкозо-солевых растворов и химусоподобных смесей к олигомерным питательным смесям в возрастающих концентрациях 5–10–20%. Нутритивную поддержку обычно начинали на 3 сутки пребывания в стационаре, по мере разрешения пареза желудочнокишечного тракта (ЖКТ), при восстановлении перистальтики и отсутствии гастростаза.
В основной группе больным дополнительно проводились сеансы СРТ с помощью аппарата «Рематерп» в режиме №43 с экспозицией 43 минуты, курсом от 7 до 10 дней (1 раз в сутки). По данным предварительных клинических исследований нами было установлено, что наиболее эффективным является использование режима №43 (аппарат «Рематерп»). Режим №43 аппарата «Рематерп» представляет собой последовательное использование части диапазона лечебных воздействий №7-42. При патологических состояниях, наряду с общим воздействием вышеуказанными параметрами, может осуществляться локальное воздействие

на область проекции патологического очага или сегментарно с использованием электродов из углеродсодержащей ткани разной площади (большой размер - электроды 21 x 29 см, средний размер - 12 x 21 см, малый размер - 7 x 11 см). Воздействие импульсным током осуществляется сканирующим режимом (от 1-го до 9-го) или с использованием одного из режимов этого диапазона.
В группе сравнения применяли плацебо имитацию метода СРТ без включения активного режима. Оценку эффективности лечения пациентов ОП в основной группе проводили путем сравнения длительности клинических проявлений, динамики лабораторно-инструментальных показателей относительно таковых в группе сравнения.
Весь цифровой материал обработан статистически по общепринятым методикам, описанным в работе С. Гланца (1999) с использованием пакета программ “STATISTICA 6.0” (Stat-Soft, 2001). Результаты считались достоверными при p<0,05.
Результаты исследования
На момент госпитализации в стационар у пациентов с ОП обеих групп наблюдали следующие основные клинические симптомы: боль, интоксикация, нарушение функции других органов и систем, симптомы раздражения брюшины (табл. 4).
Клинически лечебный эффект при использовании в комплексном лечении метода СРТ оценивали по быстроте купирования болевого симптома, интоксикации, пареза ЖКТ у больных обеих групп. При анализе выявлено, что данные симптомы достоверно быстрее проходили у больных основной группы, где использовали методику СРТ (табл. 5).
Интенсивность болевого симптома в основной группе уменьшалась к концу 3-х суток лечения, тогда как в группе сравнения – сохранялась до 5-х суток заболевания. Аналогичная динамика прослеживается и по другим симптомам: тошно-та/рвота, парез ЖКТ, гипертермия, напряжение мышц передней брюшной стенки (р<0,05) (табл. 5).
Из особенностей клинической картины заболевания следует отметить, что 15 (17,6%) пациентов из основной группы отметили незначительное и кратковременное (до 1,5–2 ч) усиление болей при первой процедуре СРТ, которые во всех наблюдениях были купированы дополнительным однократным введением ненаркотических анальгетиков (кетонал). При втором и последующих сеансах СРТ подобных явлений не было. Ни в одном из приведенных наблюдений не потребовалось прекращения процедуры.
Различия по срокам купирования других симптомов ОП у больных сравниваемых групп были статистически недостоверны (p>0,05).
К 5-м суткам заболевания у пациентов в основной группе происходило быстрее снижение уровня амилазы крови с 790,8±78,9 до 80,1±23,2 Ед/л относительно такового в группе сравнения (745,4±98,3 до 270,2±38,9 Ед/л, р<0,05) (рис. 3). У 17 (20,2%) пациентов основной группы и у 7 (11,7%) больных в группе сравнения произошло
Таблица 4
Частота симптомов у больных обеих групп при поступлении в стационар
Динамика изменений уровня других биохимических показателей крови больных ОП не отличалась (р>0,05) в исследуемых группах (табл. 6).
Таблица 5
Сроки купирования основных клинических проявлений ОП
|
Симптом |
Основная группа (n=84) |
Группа сравнения (n=60) |
Р |
|
Болевой |
68,1±3,4 ч. |
84,6±5,02 ч. |
<0,05 |
|
Тошнота/рвота |
57,4±3,2 ч. |
73,6±3,2 ч. |
<0,05 |
|
Парез ЖКТ |
47,3±4,2 ч. |
69,4±2,2 ч. |
<0,05 |
|
Гипертермия (> 37 гр.) |
76,7±4,1 ч. |
103,8±3,9 ч. |
<0,05 |
|
Напряжение мышц передней брюшной стенки |
52,4±2,9 ч. |
79,3±3,1 ч. |
<0,05 |
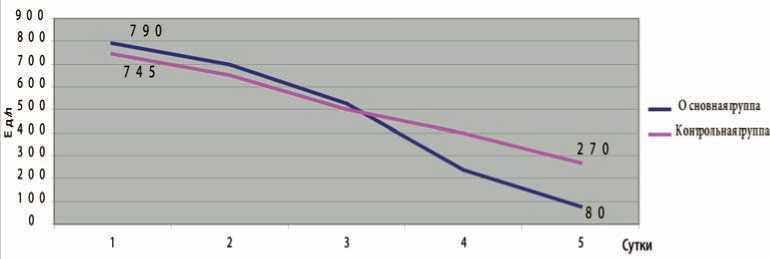
Рис. 3. Динамика изменения уровня панкреатической амилазы крови у пациентов с ОП
В основной группе больных на фоне лечения к 10-м суткам происходила нормализация уровня С-реактивного белка в крови с 47,4±8,7 г/л до 4,9±2,1 г/л, тогда как у пациентов из группы сравнения данный показатель оставался повышенным (42,8±10,1 г/л и 9,8±1,4 г/л соответственно) (рис. 4).
Анализ основных показателей инструментальных методов исследования (УЗИ, КТ) в динамике не выявил достоверных различий (р>0,05) межу пациентами двух групп.
Результаты лечения больных ОП, которым в комплексную терапию включен метод СРТ, отличались от таковых в группе сравнения. Так, средний койко-день в основной группе составил 12,1±1,2 суток, а в группе сравнения – 16,8±1,4 (р<0,05). Побочных отрицательных эффектов при использовании СРТ не наблюдали. Летальных исходов в обеих группах не было.
Обсуждение
Улучшение результатов лечения у пациентов в основной группе с использованием СРТ можно объяснить за счет следующих эффектов:
-
- нормализация биоритмов и восстановление нормаль-
- ной работы сфинктера Одди (уменьшение протоковой гипертензии ПЖ и как следствие – снижение повреждающего воздействие панкреатического секрета);
- противовоспалительный, противоотечный эффект и улучшение микроциркуляции (уменьшение объема повреждения ткани ПЖ, что способствует более быстрому купированию болевого синдрома и улучшению лабораторных показателей);
-
- синхронизация работы сим
патической и парасимпатической системы.
Симпатическая система регулирует внутриорганное кровообращение ПЖ, а парасимпатическая воздействует на ее секрецию. При заболевании нарушение динамического равновесия в их функционировании ведет к расстройству кровообращения (ангиоспазм и гипоксия) и усилению экзокринной секреции. Указанные изменения в сочетании с нарушением проходимости панкреатических протоков могут привести к очаговому повреждению ацинарной ткани.
Экспериментально было подтверждено, что нарушения микроциркуляции в сочетании с активацией иммунопатологических реакций в ПЖ создают благоприятные условия для развития дисбактериоза, активации условно-патогенной микрофлоры кишечника, что усугубляется на фоне пареза кишечника, сопровождающего ОП. В результате, с одной стороны, возрастает риск осложнений OП, вследствие присоединения вторичной инфекции, что усиливает воспаление ПЖ, с другой – усугубляется иммунная агрессия против нее и других органов, за счет микробных антигенов Форсмана, сходных с ор-
Таблица 6
Динамика ряда биохимических показателей крови у больных ОП
|
Показатель |
Сутки лечения |
|||
|
1-е |
3-и |
7-е |
10-е |
|
|
Общий белок (65–85 г/л) |
72,1±3,2 |
68,2±2,7 |
71,6±3,5 |
77,4±2,8 |
|
Мочевина (1,7–8,3 ммоль/л) |
8,0±1,6 |
5,8±1,4 |
4,4±0,8 |
1,9±0,3 |
|
Глюкоза (4,2–6,1 ммоль/л) |
6,0±1,3 |
5,4±1,2 |
4,8±0,6 |
5,1±0,2 |
|
АлАТ (5–35 ед./л) |
92,2±6,3 |
73,5±4,3 |
41,9±5,2 |
18,2±3,1 |
|
АсАТ (5–40 ед./л) |
107,4±9,2 |
76,7±4,1 |
44,7±5,1 |
15,1±2,3 |
|
ЩФ (50–120 ед./л) |
151,2±5,1 |
147,2±6,3 |
98,3±5,4 |
65,7±3,4 |
|
ГГТП (5–50 ед./л) |
85,3±5,4 |
64,5±4,1 |
50,1±4,2 |
25,7±2,3 |
|
ЛДГ (80–140 ед./л) |
475,7±12,2 |
360,7±10,2 |
245,4±8,7 |
150,8±4,3 |
|
Холинэстераза (140–200 ед.) |
174,9±4,2 |
166,8±3,9 |
171,3±2,9 |
192,9±3,1 |
|
Общий билирубин (7–21ммоль/л) |
23,1±2,3 |
21,4±2,4 |
15,4±3,2 |
11,2±2,1 |
|
Калий (3,5–5,0 ммоль/л) |
4,7±0,3 |
4,8±0,2 |
4,7±0,3 |
3,7±0,2 |
|
Натрий (135–145 ммоль/л) |
143,8±0,2 |
142,3±0,3 |
138,5±0,3 |
141,4±0,2 |
ганными антигенами человека. Прямым следствием этого является трансформация отечной формы ОП в панкреоне-кроз, в основе которого лежит феномен Санарелли–Шварцмана [15, 16].
Возможность воздействия с помощью СРТ на микроцикуляцию в ПЖ и восстановление нормальных биоритмов кишечника, способствуют более раннему разрешению пареза кишечника и уменьшает патологическое воздействие микрофлоры кишечника на ПЖ.
Таким образом, применение метода СРТ в комплексном лечении больных ОП позволяет добиться повышения эффективности консервативной терапии, а именно: быстрее купировать основные клинические и лабораторные проявления заболевания, что дает возможность завершить лечение в более ранние сроки. Также представляет ин-
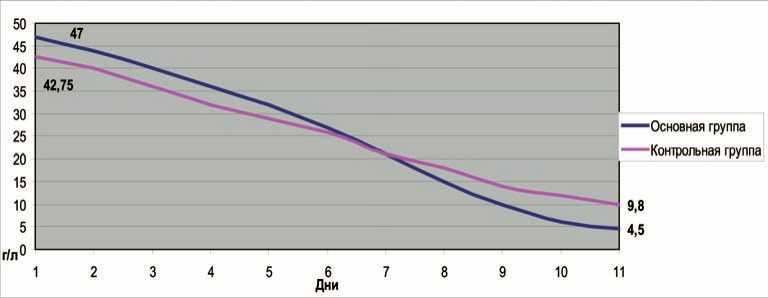
Рис. 4. Динамика изменения уровня С-реактивного белка в крови у пациентов с ОП
терес изучение возможности применение СРТ у пациентов с тяжелыми формами панкреонекроза и способности метода уменьшить число переходов отечной формы ОП в панкреоне-кроз. Положительные эффекты СРТ могут оказать благоприятное воздействие на лечение пациентов с хроническим панкреатитом с возможностью достижения более стойкой ремиссии и проведением противорецидивных курсов амбулаторно, что в свою очередь может значительно уменьшить число госпитализаций таких пациентов в стационар для подбора терапии.
Полученные предварительные результаты применения в комплексной терапии больных ОП метода СРТ диктуют необходимость проведения дальнейших рандомизированных плацебо-контролируемых исследований, способных помочь улучшить результаты лечения данного заболевания.
Выводы
-
1. Методика СРТ патогенетически обоснована при ОП, проста в исполнении и не требует больших финансовых затрат.
-
2. Применение метода СРТ в комплексном лечении больных ОП позволяет уменьшить сроки купирования основных клинических симптомов заболевания и быстрее нормализовать лабораторные показатели, что ведет к сокращению сроков госпитализации и соответственно расходов на медикаментозное лечение.
-
3. Первый опыт использования метода СРТ показал отсутствие каких-либо отрицательных побочных эффектов, что делает возможным его широкое применение в клинической практике у больных с ОП.
Список литературы Первый опыт применения метода структурно-резонансной терапии в комплексном лечении больных острым панкреатитом
- Ачкасов Е.Е., Гараев Ю.А., Пугаев А.В., Набиева Ж.Г., Заполь-ский А.Г. Выбор тактики лечения острого панкреатита в фазе гнойнонекротических поражений//Хирург. 2010. №2. С. 6-13.
- Безбах И.В., Кузовлев О.П., Цахилова С.Г. Применение структурно-резонансной терапии в восстановительном лечении больных хроническим сальпингоофоритом//Журн. Российского общества акушеров-гинекологов. 2006. №3. С. 26-29.
- Гальперин Э.И., Дюжева Т.Г., Докучаев К.В., Погосян Г.С., Чевокин А.Ю., Ахаладзе Г.Г., Абдель-Галил Р. Диагностика и хирургическое лечение панкреонекроза//ирургия. Журнал им. Н.И. Пирогова. 2003. №3. С. 50-54.
- Губарева В.В., Кузовлев О.П., Котенко К.В., Лактионова Л.В. Применение структурно-резонансной терапии для лечения гипоменструального синдрома у женщин с нейроэндокринными нарушениями//Журн. физиотерапия, бальнеология и реабилитация. 2007. №1. С. 50-61.
- Коган А.Б. Биологическая кибернетика. М., 1977. 408 с.
- Кузовлев О.П., Хазина, Л.В., Блинников И.Л. Новая перспективная методика -структурно-резонансная электромагнитная терапия//Журн. перспективы традиционной медицины. 2003. №2. С. 44-50.
- Кузовлев О.П., Блинков И.Л., Мейзеров Е.Е. и др. Структурнорезонансная (электро-и электромагнитная) терапия. Пособие для врачей. М., 2004. 243 с.
- Набиева Ж.Г., Гараев Ю.А., Ачкасов Е.Е., Волков В.С., Посуд-невский В.И. Современные аспекты подавления панкреатической секреции при остром панкреатите//Хирург. 2011. №7. С. 42-47.
- Нестеренко Ю.А. Лаптев В.В., Михайлусов С.В. Диагностика и лечение деструктивного панкреатита. М.: БИНОМ, 2004. 304 с.
- Пугаев А.В., Ачкасов Е.Е. Классификация острого воспаления поджелудочной железы//Хирургия. 2008. №1. С. 43-46.
- Пугаев А.В., Ачкасов. Е.Е. Острый панкреатит. М.: ПРОФИЛЬ, 2007. 336 с.
- Савельев В.С., Филимонов М.И., Бурневич С.З. М.: МИА, 2008. 259 с.
- Хазина Л.В., Корчажкина Н.Б. Структурно-резонансная терапия больных с пояснично-крестцовой радикулопатией//Журн. физиотерапия, бальнеология и реабилитация. 2010. №6. С. 39-42.
- Cruickhank A.H. Non-infective acute pancreatitis//Pathology of Pancreas. 1995. P. 12.


