Первый опыт расширенной миоэктомии при хирургическом лечении обструктивной гипертрофической кардиомиопатии: непосредственные и промежуточные результаты
Автор: Богачев-Прокофьев Александр Владимирович, Железнев Сергей Мванович, Фоменко Михаил Сергеевич, Афанасьев Александр Владимирович, Шарифулин Равиль Махарамович, Пивкин Алексей Николаевич -, Демидов Денис Петрович, Караськов Александр Михайлович
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Приобретенные пороки сердца
Статья в выпуске: 2 т.19, 2015 года.
Бесплатный доступ
Цель Изучить безопасность, клиническую и гемодинамическую эффективность внедренной методики расчета объема иссечения миокарда у пациентов с обструктивной гипертрофической кардиомиопатией (ГКМП). Материал В период с ноября 2011 г. по июнь 2013 г. выполнено 53 процедуры расширенной миоэктомии у пациентов и методы с обструктивной ГКМП. Средний возраст составил 51,9±14,2 года (от 22 до 74 лет). Фракция выброса левого желудочка перед операцией - 72,8±7,9%, пиковый градиент на уровне выходного отдела левого желудочка - 89,9±27,2 мм рт. ст. при толщине межжелудочковой перегородки 25,8±4,1 мм. Переднесистолическое движение передней створки митрального клапана (SAM- синдром) наблюдалось у 100% пациентов, при этом умеренная и выраженная митральная регургитация - у 73,5% (39 пациентов). Расчет объема резекции миокарда выполняли по данным ЧП ЭхоКГ. Для оценки результатов операций использовали ЧП ЭхоКГ и прямую тензиометрию. результаты Все процедуры выполнялись в условиях искусственного кровообращения при гипотермии (34-32 °С). Среднее время искусственного кровообращения составило 119±40 мин, окклюзии аорты - 88±34 мин. В 52 (98,2%) случаях удалось выполнить расширенную миоэктомию на основании использованной методики расчета объема резекции. В одном случае (1,8%) потребовалось дополнительно резецировать среднюю часть межжелудочковой перегородки для получения ЭхоКГ и гемодинамического результата. После операции SAM-синдром отсутствовал во всей группе пациентов. Госпитальная летальность отсутствовала. Градиент на уровне выходного отдела левого желудочка составил 16,8±7,4, по данным ЭхоКГ, и 9,3±3,5 мм рт. ст., по данным прямой тензиометрии. Среди осложнений в одном (1,8%) случае выполнено закрытие дефекта межжелудочковой перегородки, 5 пациентам (9,4%) имплантирован постоянный электрокардиостимулятор в связи с полной АВ-блокадой. Заключение Технология расширенной миоэктомии может безопасно и эффективно выполняться у пациентов с обструктивной ГКМП. Предложенная методика расчета зоны и объема иссечения миокарда межжелудочковой перегородки позволяет определить длину и толщину иссекаемого миокарда межжелудочковой перегородки - ключевые критерии для успешного устранения обструкции выходного отдела левого желудочка.
Гипертрофическая кардиомиопатия, миоэктомия, сердечная недостаточность
Короткий адрес: https://sciup.org/142140665
IDR: 142140665 | УДК: 616.127-007.61-089.168
Текст научной статьи Первый опыт расширенной миоэктомии при хирургическом лечении обструктивной гипертрофической кардиомиопатии: непосредственные и промежуточные результаты
Выраженная гипертрофия миокарда левого желудочка (ЛЖ) – основной фактор риска внезапной смерти у пациентов с гипертрофической кардиомиопатией
(ГКМП) [1, 2]. Тяжелая обструкция выходного отдела левого желудочка (ВОЛЖ) с высоким градиентом и выраженные клинические проявления на фоне адекватной
Таблица 1 Клинико-демографическая характеристика пациентов
|
Показатель |
Среднее ± отклонение, % |
|
Всего пациентов |
53 |
|
Возраст, лет |
51,9±14,2 |
|
Пол (женщины), n (%) |
33 (62) |
|
Класс сердечной недостаточности по NYHA, n (%) |
|
|
II |
10 (18,9) |
|
III |
43 (81,1) |
|
Пиковый градиент ВОЛЖ, мм рт. ст. |
89,9±27,2 |
|
Толщина МЖП, мм |
25,8±4,1 |
|
Уровень обструкции, n (%) |
|
|
базальный |
25 (47,2) |
|
средневентрикулярный |
9 (16,9) |
|
базальный + средневентрикулярный |
19 (35,9) |
|
Митральная недостаточность |
|
|
умеренная |
20 (37,7) |
|
выраженная |
19 (35,8) |
|
SAM-синдром |
|
|
I степень, n (%) |
8 (15,2) |
|
II степень, n (%) |
24 (45,2) |
|
III степень, n (%) |
21 (39,6) |
|
ФВ ЛЖ, % |
72,8±7,9 |
|
ФП, n (%) |
10 (18,8) |
|
Предшествующая спиртовая редукция, n (%) |
7 (13,2) |
ФВ ЛЖ – фракция выброса левого желудочка; ФП – фибрилляция предсердий медикаментозной терапии являются общепринятыми показаниями к хирургическому лечению больных с обструктивной ГКМП [3]. Миоэктомия по Morrow на данный момент считается золотым стандартом в лечении пациентов с ГКМП [3, 4]. Однако до сих пор отсутствуют методики расчета корректного иссечения миокарда межжелудочковой перегородки (МЖП), нет описания характера вмешательства на подклапанных структурах [3, 5]. В проведенном исследовании на основании анализа результатов внедрения методики расчета объема иссечения миокарда мы изучили клиническую и гемодинамическую эффективность операций расширенной миоэктомии у пациентов с обструктивной ГКМП.
Материал и методы
В период с ноября 2011 г. по июнь 2013 г. в институте выполнено 53 процедуры расширенной миоэктомии у пациентов с обструктивной ГКМП. Основные демографические характеристики пациентов представлены в табл. 1. Переднесистолическое движение передней створки митрального клапана (МК) (SAM-синдром) наблюдалось у всех пациентов, при этом регургитация с умеренным и выраженным объемом сброса отмечена у 39 (73,5%) пациентов (табл. 1). Пациентам с це- лью определения показаний к оперативному лечению, уточнения объема митральной недостаточности (МН) и механизмов ее развития, а также оценки внутрисердечной анатомии выполнялась контрастная МРТ и трансторакальная ЭхоКГ с различными функциональными пробами (тест с физической нагрузкой, проба Вальсальвы). Для детальной оценки внутрисердечной анатомии проводили контрастную магнитно-резонансную томографию.
Расчет объема резекции МЖП
Для проведения расчета планируемого объема и зоны резекции интраоперационно до основного этапа операции выполнялась чреспищеводная эхокардиография (ЧП ЭхоКГ). По длинной оси сердца (с четкой визуализацией левого предсердия, левого желудочка и аорты) на срезе проводились две схематичные линии для формирования зоны иссечения миокарда. Первая линия – с отступом от фиброзного кольца аортального клапана на 4–5 мм и продолжалась по направлению к верхушке на протяжении выступающей части гипертрофированной МЖП (определение глубины резекции), вторая линия начиналась от эндокардиальной поверхности гипертрофированной МЖП перпендику-
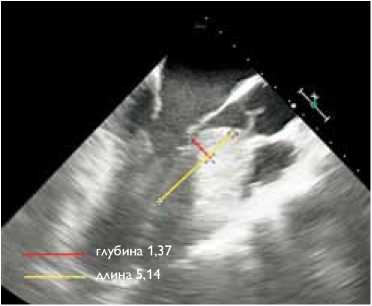
Рис. 1. Эхографическая картина сердца – визуализация и определение объема иссечения миокарда: а – ЭхоКГ-расчет глубины и толщины резекции миокарда; б – ЭхоКГ-картина миоэктомии. Красным отмечена зона резекции
б
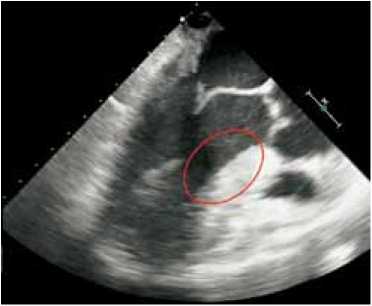
лярно к первой линии в зоне наибольшего утолщения (определение толщины резекции) (рис. 1, а ). В отличие от классической тоннелеобразной методики, предложенной Morrow, миокард МЖП иссекался в форме трапеции. Боковыми границами трапециевидной зоны резекции являлись анатомические ориентиры: справа – середина правой коронарной створки (расположение проводящих путей), слева – свободная стенка левого желудочка. Граница резекции имела расширение вправо от 1,5 до 3,0 см по МЖП – 2 см вниз от основания правой коронарной створки (зона проводящих путей). Графический результат миоэктомии представлен на рис. 1, б .
Интраоперационно, после основного этапа операции, выполнялась ЧП ЭхоКГ с целью оценки адекватности проведения резекции, объема резидуальной МН и отсутствия SAM-феномена. Дополнительно для выявления эффективности процедуры проводили прямую тензиометрию в левом желудочке.
Все процедуры выполняли в условиях искусственного кровообращения (ИК) при нормо- и гипотермии (33–34 °С). В качестве кардиоплегии использовался кристаллоидный раствор Custodiol® (Dr Kohler Pharma, Alsbach-Hahnlein, Germany) в объеме 2 000 мл. Всем пациентам перед выпиской проведено ультразвуковое исследование сердца.
Статистический анализ
Статистическая обработка полученных данных осуществлялась с помощью программы «Statistica 6.0». Результаты представлены как среднее и стандартное отклонение (М± δ ).
Результаты
Среднее время искусственного кровообращения составило 119±40 мин, окклюзии аорты – 88±34 мин, повторное возобновление ИК потребовалось 3 пациентам со средней продолжительностью 71±10 и 61±7,0 мин соответственно. В 52 (98,2%) случаях удалось выполнить расширенную миоэктомию на основании использованной методики расчета объема резекции. Средняя масса иссеченного миокарда составила 6,8±3,8 г (рис. 2).
В одном случае (1,8%) потребовалось повторное вмешательство в связи с сохранившимся SAM-синдромом на фоне остаточной обструкции. Дополнительно резецирована средняя часть МЖП с адекватной ЭхоКГ и гемодинамическим результатом. В двух (3,7%) случаях, несмотря на эффективное выполнение миоэктомии, потребовалось повторное подключение ИК в связи с выраженной МН без SAM-феномена. При ревизии МК обнаружены выраженные дегенеративные изменения, потребовавшие его замены механическим протезом. По данным прямой тензиометрии пиковый градиент составил 9,3±3,5 мм рт. ст.
По поводу сопутствующей кардиальной патологии выполнены дополнительные вмешательства: протезирование аортального клапана у 2 (3,7%) пациентов, коронарное шунтирование – 2 (3,7%) случая, 3 (5,6%) случая аблации фибрилляции предсердий. Госпитальная летальность отсутствовала. Наиболее частыми осложнениями в наблюдаемой группе пациентов были нарушение ритма и полная АВ-блокада.
Характеристика осложнений представлена ниже.
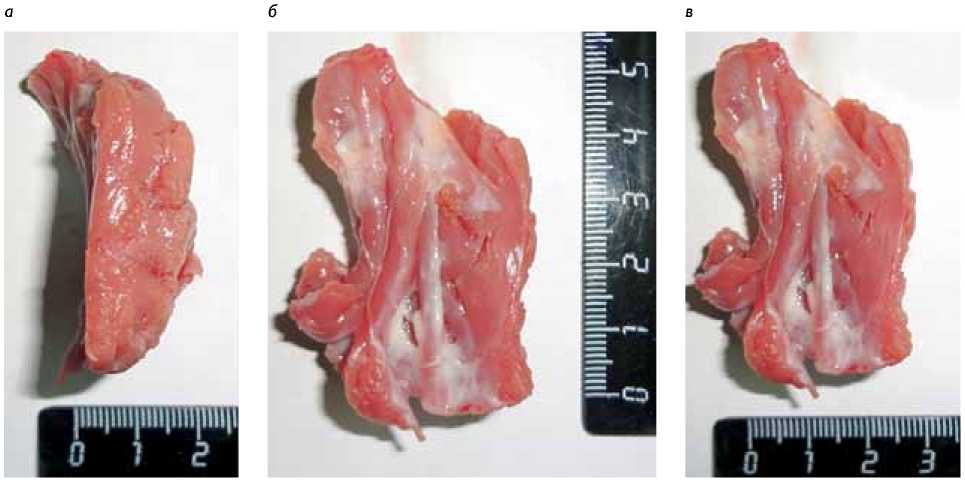
Рис. 2. Иссеченный фрагмент миокарда: а – толщина, б – длина, в – ширина
Показатель
Полная АВ-блокада с имплантацией постоянного кардиостимулятора Пароксизм фибрилляции предсердий n (%)
5 (9,4)
5 (9,4)
Дефект межжелудочковой перегородки 1 (1,8)
Время пребывания пациентов в палате реанимации составило 2,2±2,0 (1–5) сут. Уже в раннем послеоперационном периоде отмечены выраженное снижение градиента в выходном отделе и ремоделирование полости ЛЖ. Наблюдалось достоверное увеличение конечного диастолического объема левого желудочка (КДО ЛЖ) с 72,6±23,4 до 81,9±32,1 мл. Среднее время пребывания пациента в клинике составило 13,8±4,4 сут.
Средний срок наблюдения после операции составил 13,3±5,2 мес. На этапе отдаленного периода в клинике обследовано 37 (69,8%) пациентов, оставшаяся часть пациентов опрошена методом анкетирования. Отдаленной летальности не выявлено. Рецидивов обструкции ВОЛЖ, нарастания резидуальной МН в отдаленном периоде также не отмечено. При анализе результатов тансторакальной ЭхоКГ выявлены статистически значимая регрессия массы миокарда, а также позитивная динамика линейно-объемных показателей левого желудочка (табл. 2). Зафиксирована достоверная положительная динамика функционального ста- туса пациентов: к III функциональному классу (ФК) относились 43 (81,1%) пациента до операции и только 2 (3,7%) пациента – на отдаленном этапе после операции (p = 0,039); в I ФК в отдаленном послеоперационном периоде отмечен 51 (96,2%) пациент, при этом ни один из пациентов до операции не имел данный ФК.
Обсуждение
На сегодняшний день для хирургического лечения обструктивной ГКМП применяются два основных метода. Спиртовая редукция миокарда позволяет получить положительные непосредственные результаты (Berghoefer, 1989), однако высокий процент рецидива обструкции ограничивает показания к применению этого метода [2]. Более адекватный метод хирургического лечения обструктивной ГКМП – миоэктомия по Morrow, предусматривающая тунелевидное иссечение миокарда МЖП [3–5]. В классическом варианте миоэктомии возможно не только тунелевидное, но и неглубокое (до 3 см) продольное иссечение миокарда МЖП. К сожалению, данная методика иссечения МЖП не всегда позволяет полностью устранить обструкцию ВОЛЖ и SAM-синдром [6, 7], поскольку отсутствуют методики расчета зоны и объема резекции. При этом большинство хирургов выполняют данную технологию, руководствуясь собственным опытом.
Таблица 2 Динамика ЭхоКГ-показателей в отдаленном периоде
|
Показатель |
Выписка |
Отдаленное наблюдение |
p |
|
ФВ ЛЖ, % |
76,1±4,6 |
69,7±9,1 |
0,235 |
|
КДО ЛЖ, мл |
56,2±13,7 |
81,9±32,1 |
0,012 |
|
Градиент ВОЛЖ, мм рт. ст. |
89,1±26,4 |
16,8±7,4 |
0,001 |
|
Масса миокарда ЛЖ, г |
199,7±67,6 |
174,6±56,4 |
0,04 |
Наша работа построена на объективном предоперационном расчете зоны резекции миокарда МЖП по данным ЧП ЭхоКГ. На основании проведенного расчета в большинстве удалось успешно устранить обструкции ВОЛЖ и SAM-синдром.
Следует отметить, что обструктивная ГКМП имеет сложную патологическую взаимосвязь с передним систолическим движением передней створки МК [8–10], которая в большинстве случаев вызывает гемодинамически значимую МН [11–13]. Однако в ряде случаев значимая регургитация на МК связана с дегенеративными и фиброзными изменениями передней створки вследствие травмирующего контакта с выступающей частью МЖП и воздействия турбулентного тока крови в ВОЛЖ. Таким образом, для эффективной коррекции обструкции необходимы пластика либо протезирование митрального клапана [14–16].
Остаточная обструкция ВОЛЖ сохраняется при недостаточном иссечении гипертрофированной МЖП, которое часто встречается при протяженной обструкции базальной и средней частей перегородки и небольшом опыте выполнения миоэктомии. Наиболее простой способ устранения обструкции в данной ситуации – протезирование МК низкопрофильным механическим протезом, поскольку устраняется один из компонентов, участвующий в формировании обструкции ВОЛЖ – передняя створка МК [13]. Однако выбор такой тактики нивелирует положительный эффект от операции у пациентов с обструктивной ГКМП [17]. Внедрение технологии расчета объема иссечения миокарда позволяет эффективно и безопасно выполнить расширенную миоэктомию даже у пациентов со среднежелудочковой обструкцией при этом сохранить нативный МК.
Заключение
В исследовании продемонстрировано, что выполнение технологии расширенной миоэктомии безопасно и эффективно у пациентов с обструктивной ГКМП. Предложенная методика расчета зоны и объема иссечения миокарда межжелудочковой перегородки позволяет определить длину и толщину иссекаемого миокарда МЖП – ключевые критерии для успешного устранения обструкции ВОЛЖ. Коррекция сопутствующей кардиальной патологии не влияла на течение послеоперационного периода. Средеотдаленные результаты свидетельствуют об улучшение функционального статуса пациентов, отсутствии рецидива обструкции ВОЛЖ и митральной регургитации, а также демонстрируют положительные изменения в ремоделировании левого желудочка.
Список литературы Первый опыт расширенной миоэктомии при хирургическом лечении обструктивной гипертрофической кардиомиопатии: непосредственные и промежуточные результаты
- Rick A. Nishimura, Steve R. Ommen. Septal Reduction Therapy for Obstructive Hypertrophic Cardiomyopathy and Sudden Death: What Statistics Cannot Tell You//Circ. Cardiovasc. Interv. 2010. Vol. 3. P. 91-93.
- Robert A. Leonardi, Evan P. Kransdorf, David L. Simel and Andrew Wang. Meta-Analyses of Septal Reduction Therapies for Obstructive Hypertrophic Cardiomyopathy Comparative Rates of Overall Mortality and Sudden Cardiac Death After Treatment//Circ. Cardiovasc. Interv. 2010. Vol. 3. P. 97-104.
- A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy//J. Thorac. Cardiovasc. Surg. 2011. Vol. 142. P. 153-203.
- Morrow A.F. Hypertrophic subaortic stenosis. Operative methods utilized to relieve left ventricular outflow obstruction//J. Thorac. Cardiovasc. Surg. 1978. Vol. 76. P. 423-30.
- Balaram S.K., Sherrid M.V., Derose J.J. Jr., Hillel Z., Winson G, Swistel D.G. Beyond extended myectomy for hypertrophic cardiomyopathy: resection-plication-release (RPR) repair//Ann. Thorac. Surg. 2005. Vol. 80. P. 217-23.
- Cooley D.A. Surgical technique for hypertrophic left ventricular obstructive myopathy including mitral valve plication//J. Cardiac. Surg. 1991. Vol. 6. P. 29-33.
- Maslow A.D., Regan M.M., Haering J.M., Johnson R.G., Levine R.A. Echocardiographic predictors of left ventricular outflow tract obstruction and systolic anterior motion of the mitral valve after mitral valve reconstruction for myxomatous valve disease//J. Am. Coll. Cardiol. 1999. Vol. 34. P. 2096-104.
- Lee K.S., Stewart W.J., Lever H.M., Underwood P.L., Cosgrove D.M. Mechanism of outflow tract obstruction causing failed mitral valve repair. Anterior displacement of leaflet coaptation//Circulation. 1993. Vol. 88. P. II24-9.
- Kaple R.K., Murphy R.T., DiPaola L.M., et al. Mitral valve abnormalities in hypertrophic cardiomyopathy: echocardiographic features and surgical outcomes//Ann. Thorac. Surg. 2008. Vol. 85. P. 1527-35, 1535.e1-2.
- Balaram S.K., Tyrie L., Sherrid M.V., et al. Resection-plicationrelease for hypertrophic cardiomyopathy: clinical and echocardiographic follow-up//Ann. Thorac. Surg. 2008. Vol. 86. P. 1539^4.
- Schaff H.V., Suri R.M., Enriquez-Sarano M. Indications for surgery in degenerative mitral valve disease//Semin. Thorac. Cardiovasc. Surg. 2007. Vol. 19. P. 97-102.
- Enriquez-Sarano M., Avierinos J.F., Messika-Zeitoun D., et al. Quantitative determinants of the outcome of asymptomatic mitral regurgitation//N. Engl. J. Med. 2005. Vol. 352. P. 875-83.
- Calvin K.N. Wan, Joseph A. Dearani, Thoralf M. Sundt, et al. What Is the Best Surgical Treatment for Obstructive Hypertrophic Cardiomyopathy and Degenerative Mitral Regurgitation?//Ann. Thorac. Surg. 2009. Vol. 88. P. 727-32.
- Minakata K., Dearani J.A., Nishimura R.A., et al. Extended septal myectomy for hypertrophic obstructive cardiomyopathy with anomalous mitral papillary muscles or chordae//J. Thorac. Cardiovasc. Surg. 2004. Vol. 127. P. 481-9
- Железнев С.И., Богачев-Прокофьев А.В., Емешкин М.И., Караськов А.М. Отдаленные результаты хирургического лечения фибрилляции предсердий у больных с приобретенными пороками митрального клапана//Патология кровообращения и кардиохирургия. 2014. № 1. С. 5-10.
- Тулеутаев Р.М., Богачев-Прокофьев А.В., Железнев С.И., Афанасьев А.В., Караськов А.М. Обратное ремоделирование левых камер сердца после реконструкции митрального клапана при мезенхимальной дисплазии//Патология кровообращения и кардиохирургия. 2015. Т. 19, № 1. С. 66-71.
- Sandhya K. Balaram, Ronald E. Ross, Mark V. Sherrid, Gary S. Schwartz, Zak Hillel, Glenda Winson, and Daniel G. Swistel. Role of Mitral Valve Plication in the Surgical Management of Hypertrophic Cardiomyopathy//Ann. Thorac. Surg. 2012. Vol. 94. P. 1990-1998.


